|

Jonathan Hartwell (1906-1991). Χημικός του NCI. Aπό τους
πρωτεργάτες της αναζήτησης φαρμάκων για τον καρκίνο στα φυσικά
προϊόντα. |
Φυσικά προϊόντα ως
αντικαρκινικές ουσίες - Ιστορική αναδρομή
Με πρωτοβουλία του
Εθνικού
Ινστιτούτου Καρκίνου των ΗΠΑ (National
Cancer Institute,
NCI) ιδρύθηκε το 1955 το Εθνικό Κέντρο για τη Χημειοθεραπεία του Καρκίνου (Cancer
Chemotherapy National Service Center, CCNSC).
Από τότε, το
CCNSC
είναι ο κεντρικός φορέας συλλογής και μελέτης αντικαρκινικών φαρμάκων
(συνθετικά και φυσικά). Στις δραστηριότητές του περιλαμβάνεται το πρόγραμμα ελέγχου
(screening) νέων φυτικών εκχυλισμάτων (από φυτά, δένδρα, φύλλα, φλοιός κορμού, κ.λπ.)
για πιθανές
αντικαρκινικές ιδιότητες. Τα εκχυλίσματα αυτά στέλνονται για
αντικαρκινικό έλεγχο σε εξωτερικά ινστιτούτα, πανεπιστήμια, ερευνητές και
εταιρίες φαρμάκων [Αναφ. 2].
Αν και οι περισσότερες
ουσίες που μελετήθηκαν ήταν συνθετικές, ο χημικός
Jonathan Hartwell
του NCI, ο
οποίος είχε μεγάλη εμπειρία με φυσικά εκχυλίσματα φυτικών προϊόντων, άρχισε να συλλέγει
μεγάλο αριθμό φυτικών δειγμάτων και να τα ελέγχει για αντικαρκινική δράση.
Οι μελέτες αυτές διεξάγονταν στο παρελθόν με τη χρήση πειραματοζώων (in
vivo)
(μύες και επίμυες), στα οποία είχαν χορηγηθεί υψηλές δόσεις καρκινογόνων ουσιών
(ενέσιμα, με την τροφή, λήψη από το στόμα) και στη συνέχεια ελάμβαναν τα "αντικαρκινικά" σκευάσματα με τη διατροφή τους.
Προφανώς η όλη διαδικασία ήταν αργή και δαπανηρή.
Αργότερα,
στις έρευνες για νέες αντικαρκινικές ουσίες άρχισαν να χρησιμοποιούνται καλλιέργειες καρκινικών κυττάρων (όπως
L1210,
P388,
κυτταρικές σειρές λευχαιμίας). Στις
καλλιέργειες καρκινικών
κυττάρων προσέθεταν σταδιακά αυξανόμενες συγκεντρώσεις των πιθανών αντικαρκινικών ουσιών. Εάν τα
προκαταρκτικά αυτά
πειράματα έδειχναν, αυξημένη αντικαρκινική δράση (θάνατο κυττάρων, αναστολή
πολλαπλασιασμού, απόπτωση, μίτωση, παρεμπόδιση μετάστασης κ.λπ.) τότε
συνεχίζονταν οι μελέτες και σε πειραματόζωα.
Με αυτό το πρωτόκολλο
εξετάσθηκαν χιλιάδες φυσικές ουσίες
(εκτιμούνται σε περισσότερες από 50.000), εκχυλίσματα φυτικών προϊόντων, αλλά και
ουσίες που ελήφθησαν από
μικροοργανισμούς, θαλάσσια είδη κ.λπ. Αν αυτά τα πειράματα έδιναν κάποια
ενθαρρυντικά αποτελέσματα, ακολουθούσαν οι μελέτες τριών σταδίων (Φάσεις Ι-ΙΙΙ,
βλ. παρακάτω) σε
ασθενείς με διάφορα είδη κακόηθων νεοπλασιών.
Συνήθως, για ένα αντικαρκινικό
φάρμακο χρειάζονται 10-15 χρόνια από το έτος της ανακάλυψής του, για να
εγκριθεί και να αρχίσει η διάθεσή του στη φαρμακοθεραπευτική αγορά. Στις ΗΠΑ η
υπεύθυνη υπηρεσία για την έγκριση φαρμάκων είναι η Υπηρεσία Τροφίμων και
Φαρμάκων (Food and Drug
Administration,
FDA) και
στην Ευρώπη ο Ευρωπαϊκός Οργανισμός Φαρμάκων (European Medicines Agency,
EMA)
με έδρα το Λονδίνο.
|

Το
έλατο Taxus ήταν από παλιά γνωστό για τα
εξαιρετικής ποιότητας τόξα που μπορούσαν να κατασκευαστούν από το
ξύλο του [Αναφ. 3γ]. |
Ανακάλυψη της ταξόλης.
Από το 1960 οι βοτανολόγοι
των ΗΠΑ άρχισαν να συλλέγουν 1000 περίπου φυτά τον χρόνο για μελέτη της
αντικαρκινικής δράσης των εκχυλισμάτων τους. Το 1962, ο βοτανολόγος
Arthur
S.
Barclay,
συγκέντρωσε 200 δείγματα φυτών σε μια μεγάλη περιοδεία του. Μεταξύ αυτών
υπήρχαν και
δείγματα φλοιού του κορμού ενός ήμερου ελάτου, του Ελάτου του Ειρηνικού
(Pacific
yew tree), με
τη συστηματική ονομασίαTaxus brevifolia
Nutt.
(: Τάξος ο μικρόφυλλος)
από ένας δάσος στην περιοχή της πόλης
Packwood,
της Βορειοδυτικής Πολιτείας των ΗΠΑ Washington
[Αναφ. 4θ].
Τον Μάιο του 1964 πραγματοποιήθηκε η
μελέτη της αντικαρκινικής δράσης του δείγματος σε κυτταρικές καλλιέργειες (cellular
assay) και
βρέθηκε ότι το εκχύλισμα από τον φλοιό τουTaxus
παρουσίαζε ισχυρή αντικαρκινική δράση. Το 1965, με φρέσκο δείγμα
του φλοιού
Taxus
και με καθαρό
κλάσμα του εκχυλίσματος πραγματοποιήθηκε νέος έλεγχος σε ένα άλλο εργαστήριο (Monroe
E.
Wall,
Research Triangle Park,
North Carolina).
|
Dr.
Susan B. Horwitz:
Μοριακή Φαρμακολόγος,
Albert Einstein College of Medicine,
Bronx, Νέα Υόρκη |
Τα νέα πειράματα
επιβεβαίωσαν την παρουσία μιας άγνωστης μέχρι τότε ουσίας, που ονομάστηκε ταξόλη, με ισχυρή αντικαρκινική δράση
στο εκχύλισμα και οι επιστήμονες ανακοίνωσαν
τα αποτελέσματα σε συνέδριο της
American
Chemical Society
(Miami
Beach,
April,
1967).
Το NCI αποφάσισε τη διεύρυνση της έρευνας για την ταξόλη και τη συλλογή
ακόμη μεγαλύτερων ποσοτήτων φλοιού του ελάτου. Έτσι, το 1969, από 1200 kg φλοιού ελήφθησαν
28 kg μη καθαρού εκχυλίσματος, από τα οποία μετά
από επίπονες διαδικασίες διαχωρισμών απομονώθηκαν 10 g
καθαρής ταξόλης. Ο προσδιορισμός της δομής της μέχρι τότε άγνωστης ένωσης δημοσιεύτηκε στο περιοδικό Journal of American Chemical Society (JACS) το 1971
[Αναφ. 4γ].
Ωστόσο, η έρευνα δεν προχώρησε για αρκετά χρόνια, παρά το γεγονός ότι μια νέα έρευνα του
1975 επιβεβαίωνε για μια ακόμη φορά την εξαιρετική αντικαρκινική δράση της
ένωσης.
Πέρασαν άλλα δύο
χρόνια μέχρι να γίνει επανεξέταση των αποτελεσμάτων και τελικά προτάθηκε να
εντατικοποιηθούν τα πειράματα με μεγαλύτερες ποσότητες. Πράγματι, το 1977
παρασκευάσθηκαν 600 g ταξόλης από περίπου 3,5
τόνους φλοιού ελάτου. Το 1978 νέες έρευνες έδειξαν
ότι η ταξόλη παρουσίαζε αντικαρκινική δράση σε ποντίκια με λευχαιμία
[Αναφ. 4α].
|
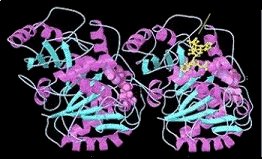
Απεικόνιση του
συμπλέγματος του ετεροδιμερούς των α- και β-τουμπουλινών και
της ταξόλης (κίτρινο μόριο, δεξιά) [Αναφ. 8δ]. |
Μηχανισμός δράσης.
H ταξόλη έγινε
ευρύτερα γνωστή το 1979 μετά τη δημοσίευση των ερευνητικών αποτελεσμάτων της ερευνήτριας
Susan B.
Horwitz (Albert Einstein College of Medicine).
Η Horwitz ήταν γνωστή για τις
έρευνές της πάνω στα αντικαρκινικά φάρμακα που βασίζονταν στη σύνδεσή με το
DNA και διέκοπταν τον κύκλο πολλαπλασιασμού των
καρκινικών κυττάρων. Το 1977, που η ταξόλη ήταν
ακόμη σχετικά άγνωστη, το NCI προσέγγισε την Horwitz
και της ζήτησε να εξετάσει τον μηχανισμό δράσης της ταξόλης,
προσφέροντάς της μια ποσότητα 10 mg του φαρμάκου
για διευρευνητικά πειράματα. Η Horwitz βρήκε
εξαιρετικά ενδιαφέρουσα την πρόταση και μετά από ορισμένα θετικά
προκαταρκτικά πειράματα διάρκειας ενός μηνός, ανέλαβε την έρευνα.
Οι έρευνες της ομάδας της Horwitz απέδειξαν ότι η ταξόλη δρα με ένα άγνωστο μέχρι τότε μηχανισμό:
προκαλούσε ένα είδος υπερβολικής σταθεροποίησης των κυτταρικών μικροσωληνίσκων (hyperstabilization
of microtubules)
[Αναφ. 5].
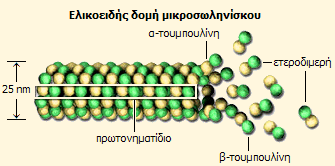
Οι μικροσωληνίσκοι είναι σωληνοειδείς διατάξεις από ετεροδιμερή των
πρωτεΐνων α- και β-τουμπουλίνης. Αποτελούν μία από τις κύριες δομές του κυτταροσκελετού και
διαδραματίζουν σημαντικό οργανωτικό και λειτουργικό ρόλο σε όλα τα
ευκαρυωτικά κύτταρα.
Η ταξόλη είχε τη ασυνήθιστη ικανότητα να προκαλεί πολυμερισμό των
τουμπουλινών, χωρίς να απαιτείται η δράση της τριφωσφορικής γουανοσίνης
(GTP), που υπεισέρχεται στον φυσιολογικό μηχανισμό
πολυμερισμού.
Η υπερσταθεροποίηση των μικροσωληνίσκων οφείλεται στην
πρόσδεση της ταξόλης με τη β-τουμπουλίνη. Αυτή η ανεπιθύμητη σταθεροποίηση των μικροσωληνίσκων καθιστά αδύνατο το "κόψιμό" τους
κατά τη
μίτωση (mitosis)
και ειδικά
κατά τη φάση διαχωρισμού των χρωμοσωμάτων (μπλοκάρισμα στα στάδια
μετάφασης και ανάφασης).
'Ετσι,
το κύτταρο δεν μπορεί να διαιρεθεί και
πεθαίνει.
Πέρα από τη σταθεροποίηση των μικροσωληνίσκων, η ταξόλη δρα ως "μοριακή σκούπα"
δεσμεύοντας την ελεύθερη β-τουμπουλίνη, με αποτέλεσμα να μειώνει την παροχή μονομερών και
διμερών τουμπουλίνης στο κύτταρο ανακόπτοντας την ανανέωση των
μικροσωληνίσκων.
Νεότερες έρευνες έδειξαν
ότι εκτός από τον προηγούμενο τρόπο δράσης, η ταξόλη επάγει την απόπτωση, δηλ. τον προγραμματισμένο
(φυσιολογικό) θάνατο
του κυττάρου, στα καρκινικά κύτταρα. Αυτό οφείλεται στη σύνδεσή της με την πρωτεΐνη Bcl-2 (B-cell
lymphoma 2) και την αχρήστευσή της. Η πρωτεΐνη Bcl-2 ευθύνεται για τη διακοπή του μηχανισμού απόπτωσης
και η παρουσία της ευνοεί την ανεπιθύμητη "αθανασία" των
καρκινικών κυττάρων
[Αναφ. 5στ].
Επιπλέον,
έχει αναφερθεί μηχανισμός δράσης της ταξόλης μέσω δέσμευσης της τουμπουλίνης πάνω σε
μικροκρυστάλλους της [Αναφ. 5ζ].
Η ταξόλη είναι καλό αντικαρκινικό φάρμακο
για τους "επιθετικούς
καρκίνους" (aggressive cancers),
που απαιτούν διαίρεση κυττάρων και αναδιαμόρφωση του κυτταροσκελετού τους. Αν και
επηρεάζει συγχρόνως και τα φυσιολογικά κύτταρα, τα καρκινικά κύτταρα, επειδή
διαιρούνται ταχύτερα, καταστρέφονται σε μεγαλύτερο βαθμό από την πακλιταξέλη.
Δομή και ρόλος των
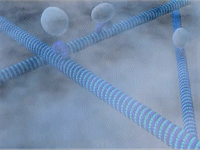
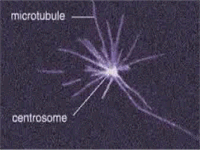
μικροσωληνίσκων [Αναφ. 6]
Μικροσωληνίσκοι (microtubules) είναι μικροί
κύλινδροι με κενό εσωτερικό κοίλωμα και με διάμετρο περίπου 25 nm.
Το μήκος τους κυμαίνεται από 0,2 έως 25 μm, ανάλογα με το ρόλο του
δεδομένου μικροσωληνίσκου και το στάδιο ζωής του κυττάρου.
Bρίσκονται
διάσπαρτοι στο κυτταρόπλασμα των ευκαρυωτικών (μόνο) κυττάρων
και ο ρόλος τους είναι πολλαπλός. Δρουν ως μεταφορείς των
οργανιδίων του κυττάρου μέσα στο κυτταρόπλασμα (περίπου σαν ιμάντες
μεταφοράς), αλλά και ως στηρικτικά της δομής του κυττάρου,
αποτελώντας μέρους του κυτταρικού σκελετού που δίνει στο κύτταρο το
σχήμα του.
Οι μικροσωληνίσκοι είναι τα κύρια συστατικά των βλεφαρίδων
(cilia)και των
μαστιγίων (flagella) και
μετέχουν στον μηχανισμό διαίρεσης του κυττάρου (μίτωση).
Η πρώτη φάση σχηματισμού
ενός μικροσωληνίσκου είναι η δημιουργία ενός "αρχικού πυρήνα" (nucleation),
ενός ετεροδιμερούς των δύο πρωτεϊνών α- και β-τουμπουλίνη.
Για τη διαδικασία αυτή απαιτείται η παρουσία ιόντων Mg(ΙΙ) και
τριφωσφορικής γουανοσίνης (GTP) και αυτή είναι η πιο αργή
φάση. Ακολουθεί η φάση της "επιμήκυνσης" (elongation) που είναι
ταχύτερη. Κατά τη φάση αυτή ετεροδιμερή (με προσκολημμένα σ' αυτά
μόρια GTP) προστίθενται το ένα πάνω στο άλλο αυξάνοντας το μήκος του
μικροσωληνίσκου. Καθώς προστίθεται μια μονάδα ετεροδιμερούς, η GTP
υδρολύεται προς διφωσφορική γουανοσίνη (GDP).
Έτσι, στην ουσία οι μικροσωληνίσκοι
είναι πολυμερείς δομές που αποτελούνται (περιφερειακά) από 13 παράλληλα πρωτονηματίδια τα οποία
σχηματίζονται από εναλλασσόμενα μόρια δύο πρωτεΐνων της α-
και της β-τουμπουλίνης. Οι δομές αυτές είναι πολωμένες, δηλ. τα άκρα τους
διαφέρουν (άκρα - και +).
Πέραν της
"στηρικτικής" λειτουργίας τους, οι μικροσωληνίσκοι δρουν και ως
"οδικό δίκτυο" μέσω του οποίου μεταφέρονται τα διάφορα κυτταρικά οργανίδια και κυστίδια (που περιέχουν ουσίες, όπως
νευροδιαβιβαστές). Η μεταφορά πραγματοποιείται με τη
μεσολάβηση ορισμένων πρωτεϊνών, που δρουν σαν "μεταφορικά μέσα" (motor
proteins). Κατά τον ένα άκρο τους "συνδέονται" με τους
μικροσωληνίσκους και κατά το άλλο "δένονται" με το υπό μεταφορά
οργανίδιο ή κυστίδιο,
το οποίο μεταφέρουν στην επιθυμητή περιοχή του κυττάρου
(σαν "τελεφερίκ") καταναλώνοντας μόρια ATP ως "καύσιμο". Μια από τις πρωτεΐνες αυτές,
η κινεσίνη, εκτελεί τη μεταφορά από από το - προς το + άκρο,
ενώ μια άλλη, η δυνεΐνη, εκτελεί την αντίστροφη διαδρομή.
Τα ευκαρυωτικά
κύτταρα εξαρτώνται από τους μικροσωληνίσκους για να διατηρήσουν τη
δομή τους και τη λειτουργία τους. Για τον λόγο αυτό, πολλά φυτά
για την άμυνά τους παράγουν φυσικές τοξίνες που καταστρέφουν
το δικτύωμα μικροσωληνίσκων των κυττάρων-"εισβολέων". Σε
φυσιολογικές συνθήκες οι μικροσωληνίσκοι βρίσκονται σε μια δυναμική
κατάσταση συνεχούς ανανέωσης της δομής τους, η οποία περιλαμβάνει το στάδια
ανάπτυξης (πολυμερισμού) - σταθεροποίησης και λειτουργίας τους -
καταστροφής (αποπολυμερισμός). Η ταξόλη αποτελεί παράδειγμα
τοξίνης, που προσδένεται στα νηματίδια προκαλώντας ένα είδος
υπερσταθεροποίησης της πολυμερούς δομής τους, ενώ άλλες, όπως η
κολχικίνη, κάνουν το ακριβώς αντίθετο, τις αποπολυμερίζουν.
Προφανώς, και
στις δύο περιπτώσεις το κύτταρο καταστρέφεται.
|
Κλινικές
έρευνες - Περιβαλλοντικά και πολιτικά προβλήματα - Εμπορική εκμετάλλευση
|

Η ανακάλυψη της
ταξόλης ενέπνευσε το σενάριο της κινηματογραφικής
ταινίας "Medicine
Man" (1992): Ένας γιατρός (στο ρόλο του ο Sean Connery)
αναζητεί το θαυματουργό φάρμακο κατά του καρκίνου στη χλωρίδα
μιας περιοχής του Αμαζονίου, όπου οι ιθαγενείς δεν προσβάλλονται
ποτέ από αυτήν την ασθένεια. |
Το
1982 ολοκληρώθηκαν οι μελέτες
αντικαρκινικής δράσης της ταξόλης σε πειραματόζωα (ποντίκια). Τον ίδιο χρόνο το
NCI
υπέβαλε αίτηση για κλινικές μελέτες σε ανθρώπους. Το 1984 ξεκίνησε η Φάση Ι των κλινικών
ερευνών και αργότερα το ίδιο έτος αποφασίστηκε η έναρξη
της Φάσης ΙΙ.
Οι έρευνες αυτές απαιτούσαν μεγάλες ποσότητες φλοιού του ελάτου. Μέχρι το
τέλος του 1986 χρειάστηκαν σχεδόν 6 τόνοι για τις δοκιμές, αλλά για την ολοκλήρωση της Φάσης ΙΙ θα
χρειάζονταν ακόμη τουλάχιστον 30 τόνους φλοιού. Οι τεράστιες αυτές ποσότητες
απαιτούσαν την κοπή μεγάλου αριθμού ελάτων. Το γεγονός αυτό προκάλεσε διαμαρτυρίες των
δασικών υπηρεσιών, των πολιτικών και των κατοίκων των περιοχών και το θέμα της ταξόλης έγινε
πλέον πολιτικό και περιβαλλοντικό θέμα
[Αναφ. 7].
Τα αποτελέσματα της Φάσης
ΙΙ (Μάιος 1988) έδειξαν ικανοποιητική δράση σε περιπτώσεις μελανωμάτων και
εξαιρετικά αποτελέσματα σε περιπτώσεις καρκίνου των ωοθηκών. Ωστόσο, το
κόστος των ερευνών ήταν τεράστιο, εξαιτίας των απαιτούμενων μεγάλων
ποσοτήτων φλοιού Taxus. Οι υπεύθυνοι του
NCI
σκέφθηκαν ότι θα έπρεπε το ινστιτούτο να συνεργασθεί με κάποια μεγάλη φαρμακευτική εταιρεία για
να συμβάλλει οικονομικά και να λύσει το πρόβλημα του ανεφοδιασμού με φλοιό
του ελάτου. Σε αντάλλαγμα, το NCI θα εκχωρούσε στην εταιρεία όλα τα ερευνητικά αποτελέσματα
που είχε συλλέξει μέχρι εκείνη την εποχή. Η μεγάλη φαρμακευτική εταιρεία
Bristol-Myers
Squibb
(BMS) ήταν μία από τις 4 εταιρείες που έδειξαν ενδιαφέρον.
|

Απόξεση και
παραλαβή φλοιού Taxus για την
απομόνωση της ταξόλης. |
Αντιρρήσεις. Ήταν αναμενόμενο να
υπάρξουν πολλές αντιρρήσεις από διάφορους επιστήμονες για τους όρους του
συμβολαίου και τις διαπραγματεύσεις. Το NCI έγινε
στόχος επικρίσεων. Το θέμα της
ταξόλης έγινε αφορμή για ομιλίες στο Κογκρέσο των ΗΠΑ κατά
το 1991 και 1992 λόγω
των αμφισβητήσεων ως προς τη σκοπιμότητα ή και τη νομιμότητα της συμφωνίας με την πολυεθνική φαρμακευτική εταιρεία
BMS.
Τελικά, το 1992 η εταιρεία
BMS υπέβαλε αίτηση για νέο αντικαρκινικό φάρμακο και
το FDA της έδωσε την απαραίτητη έγκριση
για τη συνέχιση των κλινικών μελετών. Αν και δεν
υπήρξε κάποιο δίπλωμα ευρεσιτεχνίας για τα δικαιώματα στο φάρμακο ταξόλη
(επειδή πρόκειται για φυσική ουσία), η
εταιρεία
BMS
απόκτησε αποκλειστικά δικαιώματα 5 ετών.
Τo
1993, η BMS άρχισε τη διάθεση της ταξόλης
στην αγορά, ως
ισχυρότατου χημειοθεραπευτικού φαρμάκου κατά του καρκίνου. Θα πρέπει
εδώ να σημειωθεί ότι σε μια ετήσια αναφορά (του 2000) της
BMS, η εταιρεία ανακοίνωσε πωλήσεις του
φαρμάκου 1.592 εκατομμυρίων δολαρίων (ημερήσιες πωλήσεις 4,3
εκατομμυρίων δολαρίων)
[Αναφ. 7δ]. Το
παρασκήνιο της εμπορικής διάθεσης υπήρξε ιδιαίτερα έντονο και επιπλέον
πληροφορίες σχετικές με το θέμα, όσο και για το εκτιμούμενο κόστος των
σχετικών μελετών μπορούν να αναζητηθούν σε πολλές πηγές
[Αναφ. 7στ].
Το πρόβλημα με
την ονομασία. Θα πρέπει να
σημειωθεί ότι πρόβλημα προέκυψε ακόμη και με το όνομα της ουσίας. Η μέχρι
τότε χρησιμοποιούμενη επιστημονική ονομασία ταξόλη (Taxol), "ξαφνικά" κατοχυρώθηκε
ως εμπορική ονομασία από την BMS.
Η επιστημονική κοινότητα αναστατώθηκε θεωρώντας αυτήν την κατοχύρωση σαν ένα
ακόμη σκάνδαλο. Το
περιοδικό
Nature
διαμαρτυρήθηκε για αυτήν τη "δέσμευση" του ονόματος,
αφού αυτό το όνομα είχε ήδη χρησιμοποιηθεί ως "επιστημονική ονομασία" της
ουσίας σε περισσότερα από
600 επιστημονικά άρθρα. Η BMS επιχειρηματολόγησε στα δικαστήρια ότι
ενδεχόμενη αλλαγή του ονόματος θα
προκαλούσε σύγχυση στους γιατρούς ογκολόγους και θα οδηγούσε σε εμπορική
αποτυχία του παρασκευάσματος. Έτσι σήμερα η ονομασία
Taxol είναι πλέον κατοχυρωμένη εμπορική ονομασία, ενώ η γένια (generic)
ονομασία της χημικής ένωσης είναι Paclitaxel
[Αναφ.
4α, 7].
|
 Φάσεις
δοκιμών ενός νέου φαρμάκου [Αναφ. 8] Φάσεις
δοκιμών ενός νέου φαρμάκου [Αναφ. 8]
Φάση Ι: Αρχικές
μελέτες για την εξακρίβωση του μεταβολισμού και της φαρμακολογικής
δράσης του φαρμάκου στους ανθρώπους, των παρενεργειών που συνδέονται
με την αύξηση των δόσεων, όπως και για πρώιμες ενδείξεις επί της
αποτελεσματικότητάς του. Στη φάση αυτή μπορούν να συμμετέχουν υγιή
και ασθενή άτομα.
Φάση ΙΙ:
Διεξάγονται ελεγχόμενες κλινικές μελέτες,
δηλ. με ομάδες ασθενών που λαμβάνουν το φάρμακο και με ομάδες
που λαμβάνουν εικονικό φάρμακο (placebo).
Έτσι εκτιμάται η αποτελεσματικότητα του φαρμάκου επί ορισμένης
ένδειξης (ή ενδείξεων) σε ασθενών, με την υπό εξέταση ασθένεια ή
κατάσταση. Στη φάση αυτή διαπιστώνονται οι βραχυπρόθεσμες
παρενέργειες και κίνδυνοι.
Φάση ΙΙΙ:
Επεκταμένες ελεγχόμενες και μη δοκιμές, μετά τη λήψη
προκαταρκτικών ενδείξεων αποτελεσματικότητας του φαρμάκου. Σκοπός
είναι η συλλογή επιπλέον πληροφοριών για τη εκτίμηση της
σχέσης
κινδύνου/οφέλους
(risk-benefit
relationship) και τη σωστές ιατρικές οδηγίες.
Φάση
IV: Μελέτες μετά τη διάθεση του
φαρμάκου στο εμπόριο με σκοπό τη συλλογή επιπλέον πληροφοριών,
περιλαμβανόμενων των κινδύνων, οφελών και τον άριστο τρόπο χρήσης.
|
|
 |
 |
|
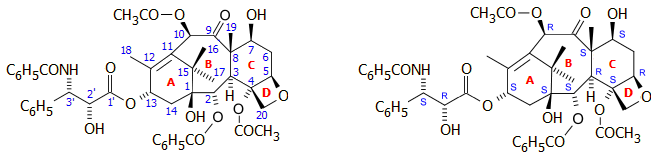
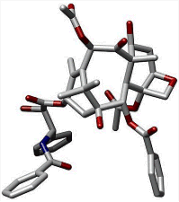
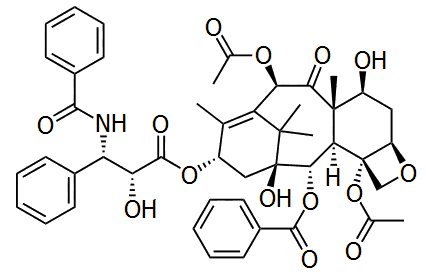
Αρίθμηση των ατόμων
άνθρακα της ταξόλης, στερεοχημεία
των 11 ασύμμετρων ανθράκων του μορίου της και το τρισδιάστατο μοντέλο
του. Η ταξόλη είναι ένα διτερπένιο. Το
κεντρικό τμήμα του μορίου είναι ένα ταξάνιο, δηλ. ένα
σύστημα δύο εξαμελών δακτυλίων (Α, C), σχεδόν σχεδόν κάθετα
τοποθετημένων σε ένα οκταμελή δακτύλιο (B). Eπιπλέον, ένας ακόμη
δακτύλιος, ο D (οξετάνιο) είναι προσκολλημένος στον δακτύλιο D. Η ταξόλη αναφέρεται
και ως παράγωγο του κυκλοδεκανίου (συνδυασμός των
δακτυλίων Α και B). Η κατά IUPAC ονομασία της ταξόλης είναι: βενζοϊκό
(2α,4α,5β,
7β,
10β,13α)-4,10-δις(ακετυλοξυ)-13-{[2'R,3'S)-3'-(βενζοϋλαμινο)-2'-υδροξυ-3'-φαινυλοπροπανοϋλο]οξυ-1,7-διυδροξυ-9-οξο-5,20-εποξυταξ-11-εν-2-ύλιο
|
Ημισυνθετική οδός παρασκευής ταξόλης και νέες φυσικές πηγές
Μετά από τα
επιτυχή πειράματα των κλινικών φάσεων, η ταξόλη αναγνωρίστηκε οριστικά ως ένα επιτυχημένο
αντικαρκινικό φάρμακο.
Ωστόσο, παρέμενε το πρόβλημα των τεράστιων ποσοτήτων φλοιού του Taxus που χρειάζονταν
[Αναφ. 9].
H
περιεκτικότητα σε ταξόλη του ξηρού εσωτερικού φλοιού του Taxus brevifolia, όπου κυρίως
βρίσκεται η ουσία, είναι πολύ μικρή (0,01-0,03%). Αυτό σήμαινε πως για την
απομόνωση 1 kg ταξόλης χρειάζονταν σχεδόν 10 τόνοι φλοιού, που θα
λαμβάνονταν από 2 έως 3 χιλιάδες
δέντρα τα οποία έτσι θα καταστρέφονταν.
|
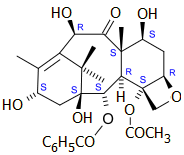
10-δεακετυλομπακατίνη III (10-DAB) |
Για μια πλήρη θεραπευτική αγωγή με ταξόλη χρειάζονται μέχρι και 2 g
ταξόλης (σε 4 έως 6 ενέσεις). Έτσι,
υπολογίσθηκε ότι κάθε χρόνο θα έπρεπε να κόβονται 360 χιλιάδες δέντρα. Ο Taxus
αναπτύσσεται πολύ αργά, είναι ένα σχετικά σπάνιο δέντρο που βρίσκεται σε
απόμακρες περιοχές, δεν σχηματίζει μεγάλες συστάδες και έτσι δεν είναι
εύκολη η δημιουργία φυτειών του. Όλα αυτά καθιστούσαν το πρόβλημα
μη αντιμετωπίσιμο
[Αναφ. 9β].
Τότε ξεκίνησε μια άλλη αναζήτηση: Η
συνθετική
και
η
ημισυνθετική παρασκευή του φαρμάκου.
Από
τα τέλη της
δεκαετίας του
1970 Γάλλοι και Αμερικανοί επιστήμονες άρχισαν να ενδιαφέρονται για τη
συνθετική παρασκευή της ταξόλης. Ο Αμερικανός χημικός
Robert A.
Holton
(Florida
State University)
ξεκίνησε την ολική σύνθεση της ταξόλης από απλές χημικές ουσίες (βλ.
παρακάτω), θέλοντας να
δοκιμάσει τα επιμέρους στάδια της σύνθεσης και τις σχετικές τεχνικές και όχι για πρακτική
εφαρμογή σε μεγάλη κλίμακα. Αντίθετα, ο Γάλλος χημικός
Potier Pierre
(CNRS
Centre de la Reserche Scientific)
εξαρχής σκόπευσε στην καλή απόδοση, ώστε η σύνθεση αυτή να είναι εφαρμόσιμη στη
φαρμακευτική βιομηχανία.
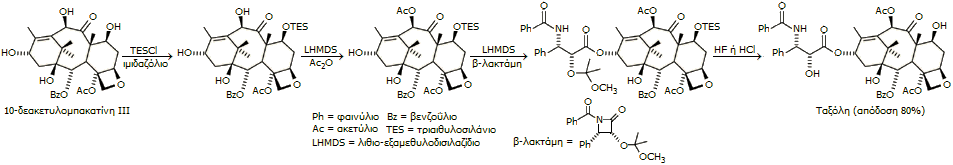
Ημισυνθετική πορεία. Η ομάδα του
Holton, έχοντας την εμπειρία της ολικής σύνθεσης,
παρουσίασε μια σχετικά εύχρηστη ημισυνθετική μέθοδο. Χρησιμοποίησε ως
πρώτη ύλη τη φυσική ουσία
10-δεακετυλομπακατίνη (10-deacetylbaccatin,
10-DAB),
η οποία βρίσκεται σε αρκετή ποσότητα στο Ευρωπαϊκό έλατο
Taxus baccata.
Η 10-DAB εμπεριέχει το
κύριο ("συνθετικά δύσκολο") τμήμα της δομικής πολυπλοκότητας της ταξόλης (τους 9
ασύμμετρους άνθρακες
από τους 11 της ταξόλης).
Τα βελονοειδή
φύλλα και τα κλαδιά
του ελάτου περιείχαν αρκετή ποσότητα (περίπου 0,1%
σε ξηρά βάση) της 10-DAB. Το έλατο δεν χρειαζόταν
πλέον να κοπεί και επομένως η πηγή της 10-DAB ήταν ανανεώσιμη και δεν υπήρχε
κάποια βλάβη για το οικοσύστημα.
Το τμήμα
των ανθράκων 1', 2' και 3' (N-βενζοϋλο-2'R,3'S-3-φαινυλο-ισοσερίνη), που συνδέεται με τον
άνθρακα 13 του συγκροτήματος των δακτυλίων, συχνά αναφέρεται απλά ως "ουρά" του
μορίου. Για το τμήμα αυτό, παρασκευάζεται χωριστά μια β-λακτάμη, γνωστή ως
λακτάμη Ojima,
η οποία στη συνέχεια συνδέεται με την 10-DAB,
αφού προηγουμένως "προστατευθούν" ορισμένες ομάδες της
τελευταίας.
Η σειρά των αντιδράσεων (δεν
περιλαμβάνεται η σύνθεση της β-λακτάμης) είναι η ακόλουθη:
Κρισιμότητα των επιμέρους
ομάδων του μορίου. Η επίδραση και η
χρησιμότητα των διάφορων χαρακτηριστικών ομάδων του μορίου στη
βιοδραστικότητα της ταξόλης εξετάσθηκε με τη σύνθεση διάφορων τροποποιημένων
μορφών της. Ορισμένα από τα
συμπεράσματα στα οποία οι έρευνες αυτές κατέληξαν έχουν ως εξής
[Αναφ.
4η]:
Σε ό,τι αφορά την "ουρά", την ομάδα δηλαδή που
είναι συνδεμένη με τον C13 του κεντρικού
συγκροτήματος των δακτυλίων:
- Προστασία του υδροξυλίου του
C2' με εστεροποίηση, απενεργοποιεί τη δραστικότητα
ως προς τη σταθεροποίηση των κυτταροσκελετικών μικροσωληνίσκων, όχι όμως την
κυτταροτοξικότητα της ένωσης.
- Η αμιδική-ακυλική ομάδα του
C3' είναι απαραίτητη, ωστόσο δεν έχει σημασία αν
έχει
αρωματική ομάδα ή αλκύλιο.
- Το άζωτο που συνδέεται με τον
C3' μπορεί να αντικατασταθεί με οξυγόνο χωρίς
απώλεια της βιοδραστικότητας.
- Το αρύλιο που συνδέεται με τον
C3' είναι απαραίτητο. Αντικατάστασή του με μεθύλιο
μειώνει τη βιοδραστικότητα κατά 19 φορές.
Σε ό,τι αφορά το σύστημα των τεσσάρων
δακτυλίων:
- Ο οξετανικός δακτύλιος D
είναι ιδιαίτερα κρίσιμος. Διάνοιξή του παρέχει ένωση με δραματικά μειωμένη βιοδραστικότητα.
- "Στένεμα" του 8-μελούς δακτυλίου Β σε 7-μελή
παρέχει ένωση με την ίδια βιοδραστικότητα ως προς τη σταθεροποίηση των μικροσωληνίσκων.
- Απομάκρυνση της ακετυλικής ομάδας από τον
C10 παρέχει ένωση με την ίδια βιοδραστικότητα.
- Απομάκρυνση της Ο-βενζοϋλικής ομάδας από τον
C2 παρέχει ένωση με εξαιρετικά μειωμένη βιοδραστικότητα.
Ολικές συνθέσεις της
ταξόλης [Αναφ. 10]
Η αδυναμία της εξασφάλισης
των απαραίτητων ποσοτήτων ταξόλης εξαρχής έθεσε το ερώτημα του κατά πόσο
είναι δυνατή μια ολική σύνθεση της ένωσης. Δηλαδή μιας σύνθεσης, όπου θα
γινόταν χρήση απλών (μικρομοριακών) και εμπορικώς διαθέσιμων χημικών ουσιών,
ως πρώτων υλών.
Εξαρχής οι επιστήμονες που
ασχολήθηκαν με την ολική σύνθεση της ταξόλης δεν έτρεφαν αυταπάτες. Σε καμιά
περίπτωση οποιοδήποτε σχήμα ολικής σύνθεσης δεν θα μπορούσε να οδηγήσει σε μια "οικονομικώς
βιώσιμη"
παρασκευή
της ουσίας σε μεγάλες ποσότητες. Η ολική σύνθεση ήταν περισσότερο ένα είδος
"επιστημονικής πρόκλησης" και ένα πεδίο δοκιμών, βελτίωσης των
υπαρχουσών τεχνικών οργανικής
σύνθεσης και εισαγωγής νέων, αλλά και ένα πεδίο ανταγωνισμού των μεγαλύτερων
συνθετικών οργανικών χημικών της εποχής μας.
Θα πρέπει να
τονιστεί ότι η ολική σύνθεση της ίδιας της ταξόλης δεν έχει μόνο θεωρητικό
ενδιαφέρον ("σύνθεση για τη σύνθεση"). Οι συνθέσεις αυτές, εύκολα μπορούν να
τροποποιηθούν σε κάποια στάδιά τους και να οδηγήσουν σε τροποποιημένες
μορφές ταξόλης, που συλλογικά αναφέρονται ως ταξοειδή (taxoids).
Πολλά ταξοειδή θα μπορούσαν να αποδειχθούν κατά πολύ δραστικότερες από την
ίδια.
Κατά τη δεκαετία του 1990,
ασχολήθηκαν με την ολική σύνθεση της ταξόλης περίπου 30 ερευνητικές ομάδες
σε όλο τον κόσμο. Αυτές οι συνθέσεις της
ταξόλης περιλαμβάνονται πλέον στις αριστουργηματικές και μνημειώδεις
οργανικές συνθέσεις.
Εδώ περιγράφονται μόνο οι αρχές των συνθετικών οδών που
ακολούθησαν ανεξάρτητα μεταξύ τους οι ερευνητικές ομάδες των καθηγητών Holton,
Nicolaou και
Danishefsky,
με βάση την αντίστοιχη περιγραφή που γίνεται στην
[Αναφ. 4στ].
Η παρουσίαση είναι εκ των πραγμάτων εξαιρετικά συνοπτική λόγω των πολλών σταδίων (δεκάδες
ενδιάμεσα στάδια) και των
απαιτούμενων εξαιρετικά εξειδικευμένων γνώσεων σε θέματα σύγχρονης οργανικής σύνθεσης και
των ιδιοτήτων πλήθους σύγχρονων ειδικών αντιδραστηρίων εναντιοεκλεκτικής σύνθεσης.
Σύνθεση κατά
Holton. Το 1994, η ομάδα του Holton
χρησιμοποίησε μια γραμμική (linear) συνθετική οδό, δηλαδή σταδιακές
αλλαγές και προσθήκες σε ένα αρχικό μόριο. Χρησιμοποιεί τη φυσική
ουσία (-)βορνεόλη ως πρώτη ύλη, την οποία μετατρέπει στην ακόρεστη κετόνη
1 σε 13 χημικά στάδια. Στην
1
πραγματοποιείται εισαγωγή της εποξειδικής ομάδας για να ληφθεί η ένωση
2,
το
οξείδιο του β-πατσουλενίου (β-patsoulene), μια εμπορικώς διαθέσιμη φυσική
ένωση, παράγωγο της πατσουλόλης, συστατικού του
αρωματικού αιθέριου ελαίου πατσουλί. Η 2 ήδη περιέχει τα 15
από τα 20 άτομα άνθρακα του συστήματος των δακτυλίων ABCD. Η 2 μετά από σκελετική
αντιμετάθεση παρέχει την τριτοταγή αλκοόλη 3. Η
3 με νέα
εποξείδωση και θραυσματοποίηση οδηγεί στην ένωση 4 που περιλαμβάνει
πλέον το χαρακτηριστικό σύστημα των δακτυλίων
Α και Β της ταξόλης. Ακολουθεί εισαγωγή του δακτυλίου C με τη μεθοδολογία
σχηματισμού δακτυλίου (annulation)
Robinson-Stock.
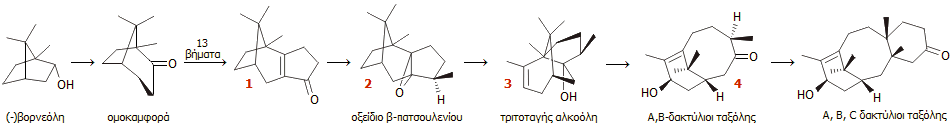
Άλλα αντιδραστήρια που χρησιμοποιήθηκαν ως
"πρώτες ύλες" ήταν: η 4-πεντενάλη, το m-χλωροϋπερβενζοϊκό οξύ, το
μεθυλομαγνησιοβρωμίδιο και το φωσγένιο. Περισσότερες λεπτομέρειες θα
πρέπει να αναζητηθούν στις αρχικές δημοσιεύσεις
[Αναφ. 11α και β].
Σύνθεση κατά Nicolaou.
Το 1994, η ομάδα του Nicolaou χρησιμοποίησε μια συγκλίνουσα (convergent)
συνθετική οδό. Οι δακτύλιοι Α και C παρασκευάστηκαν χωριστά (συνθόνες) και
στη συνέχεια συνδέθηκαν μεταξύ τους μέσω μιας
αντίδρασης Shapiro
(μετατροπή κετόνης ή αλδεΰδης σε αλκένιο, μέσω ενδιάμεσου σχηματισμού
υδραζόνης). Ακολούθησε μια
σύζευξη McMurray
(σύζευξη δύο καρβονυλικών ενώσεων προς σχηματισμό αλκενίου, γνωστή και "πινακολινική
σύζευξη") για να "κλείσει" ο οκταμελής δακτύλιος Β.
Στη συνέχεια πραγματοποιήθηκε η
εισαγωγή του οξετανικού δακτυλίου D και η συνθόνη της "ουράς" (λακτάμη
Ojima) του άνθρακα 13.
Περισσότερες λεπτομέρειες θα πρέπει να αναζητηθούν στις αρχικές δημοσιεύσεις
[Αναφ. 12].
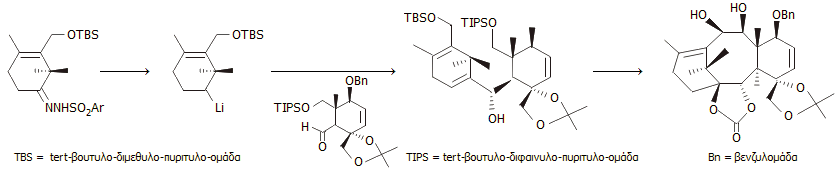
Χρησιμοποιήθηκε ένα πλήθος αντιδραστηρίων ως
πρώτες ύλες, ως προστατευτικά μέσα ομάδων κ.α. Μεταξύ αυτών περιλαμβάνονται
τα: βλενικό οξύ (mucic acid), 2-χλωροακρυλονιτρίλιο, υδρίδιο αργιλίου-λιθίου, φωσγένιο, γλυκολικό οξύ, βενζαλδεΰδη, εξαμεθυλοφωσφοραμίδιο
(HMPA), προπιονικός αιθυλεστέρας, αλλυλική αλκοόλη, ακετόνη, ακετυλακετόνη,
μεθυλοβρωμίδιο, οξικό οξύ, φαινυλολίθιο και χλωροχρωμικό πυριδίνιο.
Σύνθεση κατά Danishefsky.
Tο 1996, η ομάδα του Danishefsky χρησιμοποίησε μια επίσης συγκλίνουσα
συνθετική οδό με πολλές ομοιότητες με εκείνη της σύνθεσης της ομάδας Nicolaou. Μία από τις αρχικές ενώσεις ήταν η
κετόνη Wieland-Miescher,
μια εξαιρετικά χρήσιμη και εμπορικώς διαθέσιμη συνθόνη, η οποία έχει χρησιμοποιηθεί σε μεγάλο αριθμό
ολικών συνθέσεων φυσικών προϊόντων. Μια επιπλέον διαφορά της συνθετικής
πορείας -σε σχέση με τη σύνθεση
της ομάδας Nicolaou- είναι η
προηγούμενη εισαγωγή του οξετανικού δακτυλίου D
στον κυκλοεξανολικό δακτύλιο C,
πριν από το "κλείσιμο" του κεντρικού οκταμελούς δακτυλίου
B.
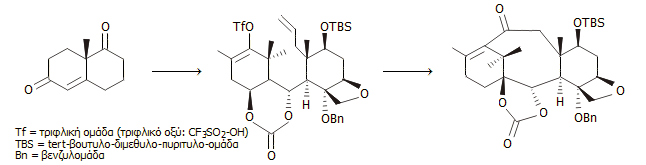
Και στη σύνθεση αυτή χρησιμοποιήθηκε ένα πλήθος αντιδραστηρίων ως
πρώτες ύλες, ως προστατευτικά μέσα ομάδων κ.α., όπως τα:
κετόνη
Wieland-Miescher, 2-μεθυλο-3-πεντανόνη, υδρίδιο
αργιλίου-λιθίου, τετροξείδιο του οσμίου, φαινυλολίθιο, ακρυλοϋλοχλωρίδιο και χλωροχρωμικό πυριδίνιο.
Κύριες αντιδράσεις μετασχηματισμών ήσαν η αντίδραση
Johnson-Corey-Chaykovsky (μετατροπή
καρβονυλικής ομάδας σε εποξειδική) και η
αντίδραση
Heck (εισαγωγή ομάδων σε αλκένια).
Περισσότερες λεπτομέρειες θα πρέπει να
αναζητηθούν στις αρχικές δημοσιεύσεις
[Αναφ. 13].
|
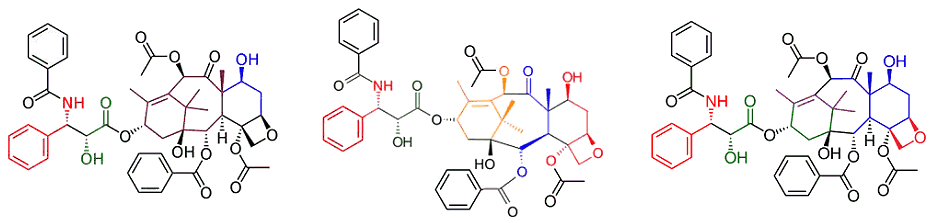
Συνοπτική
παρουσίαση των ολικών συνθέσεων ταξόλης από τις ομάδες (από αριστερά προς τα
δεξιά) Holton - Nicolaou -
Danishefsky από άποψη
"πρώτων υλών":
Τα διάφορα χρώματα υποδεικνύουν
τα τμήματα του μορίου της ταξόλης, που προέρχονται από διαφορετικές "πρώτες
ύλες". Οι χημικοί τύποι ελήφθησαν από τις
αναφορές
[Αναφ. 11δ, 12ζ και
13γ], που παρέχουν
μια πολύ καλή πρώτη παρουσίαση των επιμέρους σταδίων των συνθέσεων για κάθε
ενδιαφερόμενο. |
Παραγωγή της ταξόλης από
την
BMS
μέσω φυτικών κυττάρων
|

Αντιδραστήρες
ζύμωσης φυτικών κυττάρων σε μια από τις εγκαταστάσεις της Phyton
Biotech Inc. |
Η ημισυνθετική μέθοδος της
ομάδας Holton κάλυψε τις ανάγκες σε ταξόλη για πολλά χρόνια (από το 1993). Ωστόσο, και
αυτή ήταν πολύπλοκη.
Χρειάζονταν 11 χημικές μετατροπές και 7 απομονώσεις. Ακόμη απαιτούσε τη χρήση 13 διαλυτών και 13 οργανικών αντιδραστηρίων και πολλά άλλα υλικά
απαραίτητα για τους διαχωρισμούς και τους καθαρισμούς
[Αναφ. 9γ,δ].
Τελικά,
η εταιρεία
Bristol-Myers
Squibb
προτίμησε μια βιοτεχνολογική μέθοδο ζύμωσης με κύτταρα φυτών (Plant
Cell Fermentation Technology, PCF),
που ανέπτυξε η βιοτεχνολογική εταιρεία
Phyton Biotech Inc
και εφάρμοσε στο εργοστάσιό της στη Γερμανία
[Αναφ. 14].
Η μέθοδος αυτή
ξεκινάει με μάζες αδιαφοροποίητων κυττάρων (calluses) του ελάτου
taxus,
τα οποία
πολλαπλασιάζονται σε υδατικό διάλυμα σε μεγάλους αντιδραστήρες ζύμωσης με
προσθήκη θρεπτικών συστατικών (σάκχαρα, αμινοξέα, βιταμίνες, ιχνοστοιχεία)
και υπό ελεγχόμενες συνθήκες. Η ταξόλη
εκχυλίζεται άμεσα, καθαρίζεται με χρωματογραφία και απομονώνεται με
κρυστάλλωση.
Σε σύγκριση με την ημι-συνθετική, η βιοτεχνολογική μέθοδος είναι
πολύ καλύτερη, δεν χρησιμοποιεί τοξικές χημικές ουσίες και διαλύτες και
καταναλώνει ελάχιστη ενέργεια. Στην ουσία η μέθοδος είναι μια τυπική μέθοδος
"πράσινης
χημείας" (green
chemistry) και
αποδίδει τα ίδια προϊόντα με λιγότερα προβλήματα από περιβαλλοντική άποψη. Η
BMS
βραβεύθηκε το 2004 με το
βραβείο Πράσινης Χημείας στις ΗΠΑ και είναι η μόνη πλέον μέθοδος που
χρησιμοποιείται σήμερα για την παραγωγή ταξόλης
[Αναφ. 9γ].
Το 1993 ανακαλύφθηκε ότι η ταξόλη
παράγεται στο έλατο από μύκητες που ζουν στο φλοιό του ελάτου, αλλά βρέθηκε
ότι και άλλοι ενδοφυτικοί μύκητες (όπως ο
Nodulisporium
sylviforme)
μπορούν να παράγουν την ταξόλη [Αναφ. 9β,
14γ].
 Κλινικές
εφαρμογές - Χορήγηση
[Αναφ. 15]
Κλινικές
εφαρμογές - Χορήγηση
[Αναφ. 15]
Η ταξόλη έχει εγκριθεί ως αντικαρκινικό
φάρμακο για τους καρκίνους των ωοθηκών, του μαστού και των πνευμόνων. Επίσης
έχει χρησιμοποιηθεί για τη θεραπεία του σαρκώματος Kaposi. Έχει εκτιμηθεί
ότι το κόστος της θεραπείας ασθενούς με έγκαιρα διαγνωσμένο καρκίνο του
μαστού (για 4 κύκλους θεραπείας) είναι περίπου 6000 δολάρια ΗΠΑ, ενώ το
κόστος της καθαρής (99,5%) ουσίας είναι περίπου 235 δολάρια ΗΠΑ για ποσότητα
1 g (τιμή Αυγούστου 2009).
Η ταξόλη χορηγείται
ενδοφλεβίως πάντοτε υπό ιατρική επίβλεψη.
Ένα από τα
μειονεκτήματα του φαρμάκου είναι η χαμηλή διαλυτότητά του στο νερό αλλά και
στους περισσότερους φαρμακευτικώς αποδεκτούς διαλύτες.
Στο εμπόριο διατίθεται σε φιαλίδια
ως διάλυμα σε μίγμα (1:1) αιθανόλης και μιας υγρής μη-ιοντικής επιφανειακώς ενεργού ουσίας, με την εμπορική
ονομασία
Cremophor L (προϊόν της BASF). Το Cremophor L είναι ένα υδατοδιαλυτό, πολυοξυαιθυλιωμένο
παράγωγο του καστορέλαιου. Παρασκευάζεται με αντίδραση του καστορέλαιου με αιθυλενοξείδιο σε γραμμομοριακή αναλογία 1 προς 35.
Το Cremophor L δρα ως γαλακτωματοποιητής (emulsifier), είναι ικανοποιητικά
ανεκτός από τον οργανισμό. Πριν από την ενδοφλέβια χορήγηση, το διάλυμα αυτό
αραιώνεται με φυσιολογικό
ορό (διάλυμα NaCl 0,9%) ή διάλυμα γλυκόζης 5%, οπότε δημιουργείται ένα εναιώρημα ταξόλης.
Έχουν προταθεί αρκετοί άλλοι
βελτιωμένοι τρόποι
χορήγησης της ταξόλης (περισσότερο ανεκτοί από τους ασθενείς, ταχύτερη
διαδικασία χορήγησης), όπως υπό τη μορφή λιποσωμάτων ή νανοσωματιδίων. Υδατοδιαλυτά
είναι και ορισμένα συμπλέγματα ταξόλης με δεξτράνες και κυκλοδεξτρίνες. 'Ενα
σκεύασμα με την εμπορική ονομασία Abraxane είναι σύζευγμα ταξόλης-αλβουμίνης
και διατίθεται σε μορφή σκόνης μετά από λυοφιλίωση. Το Abraxane υπόκειται σε
ανασύσταση με νερό και παρέχει ενέσιμο εναιώρημα λίγο πριν από τη χορήγηση σε ασθενείς.
 Η ταξόλη, ως δραστικότατο
αντικαρκινικό χημειοθεραπευτικό φάρμακο, προκαλεί σοβαρές και δυσάρεστες
παρενέργειες παροδικού χαρακτήρα. Σε αυτές περιλαμβάνονται: πλήρης απώλεια τριχοφυίας, αναιμία, αιμορραγίες, πόνοι στους μυς και στις
αρθρώσεις, διάρροια, εμετοί, βραδυκαρδία, υπόταση, αλλά και υπέρταση. Η
σοβαρότητα των παρενεργειών δεν επιτρέπει τη χρήση της ταξόλης σε
περιπτώσεις παιδικών καρκίνων [Αναφ. 15ε,στ].
Η ταξόλη, ως δραστικότατο
αντικαρκινικό χημειοθεραπευτικό φάρμακο, προκαλεί σοβαρές και δυσάρεστες
παρενέργειες παροδικού χαρακτήρα. Σε αυτές περιλαμβάνονται: πλήρης απώλεια τριχοφυίας, αναιμία, αιμορραγίες, πόνοι στους μυς και στις
αρθρώσεις, διάρροια, εμετοί, βραδυκαρδία, υπόταση, αλλά και υπέρταση. Η
σοβαρότητα των παρενεργειών δεν επιτρέπει τη χρήση της ταξόλης σε
περιπτώσεις παιδικών καρκίνων [Αναφ. 15ε,στ].
Ορισμένα φαρμακοκινητικά δεδομένα: Βιοδιαθεσιμότητα (από το
στόμα): 6,5%, δέσμευση πρωτεΐνης: 89-98%, μεταβολισμός: ηπατικός (CYP28,
CYP3A4), ημιζωή: 5,8 ώρες, απέκκριση: κόπρανα, ούρα.
Αντικαρκινικά φάρμακα παρόμοιας δομής - Ταξάνια
[Αναφ. 16]
Τα τελευταία χρόνια έχουν
εγκριθεί παρόμοια αντικαρκινικά φάρμακα παρόμοιας δομής και δράσης με εκείνη
της ταξόλης. Τυπικό παράδειγμα αποτελεί το φάρμακο ντοκοταξέλη (docotaxel)
με την εμπορική ονομασία Taxotere (της φαρμακευτικής εταιρείας
Sanofi-Aventis).
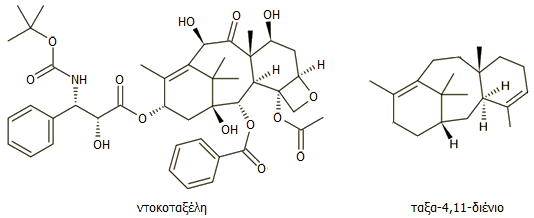
Η ντοκοταξέλη διαφέρει
δομικά από την ταξόλη σε δύο μόνο σημεία που την καθιστά περισσότερο υδατοδιαλυτή σε σχέση με την
ταξόλη: Το υδροξείδιο του C-10 είναι ελεύθερο και στην "ουρά" του C-13 υπάρχει μια ομάδα καρβαμιδικού
εστέρα της t-βουτυλικής αλκοόλης αντί της ομάδας του βενζυλαμιδίου.
Η ομάδα των φαρμάκων αυτών
ονομάζονται συλλογικά
ταξάνια (taxanes) και η φυσιολογική τους δράση
είναι παρόμοια.
Όλα τα ταξάνια
περιλαμβάνουν ως κύριο δομικό στοιχείο το διτερπένιο ταξαδιένιο, το
οποίο παράγεται από τα έλατα του γένους Taxus. Η βιοσύνθεση του ταξαδιενίου
και της ταξόλης έχει αποτελέσει αντικείμενο έντονης έρευνας και τα κύρια
στάδιά της έχουν διευκρινισθεί.
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1. (α) US National Institute of Health: "National
Cancer Institute". (β) National Cancer Institute: "Milestone
(1955): Creation of CCNSC". (γ) Wikipedia: "History
of cancer chemotherapy". (δ) NCI: "Milestowns
1955:
Creation of CCNSC". (ε)
www.encognitive.com: "Dr
Jonathan L. Hartwell".
2. (α) Kardinal CG: "Cancer chemotherapy. Historical
aspects and future considerations", Postgrad Med. 77(6):165-174, 1985
(Abstract). (β) Newman DJ, Cragg GM, Snader KM: "The
influence of natural products upon drug discovery", Nat. Prod. Rep.
17:215-234, 2000 (αρχείο
PDF, 2,97 MB). (γ) Efferth T: "EDITORIAL Part I:
Pharmacognosy and Molecular Pharmacology of Small Molecules of Natural
Origin for Cancer Therapy and Chemoprevention", Current Drug Targets
7(3):237-238, 2006 (αρχείο
PDF, 60 KB). (δ) Efferth T: "Editorial
(Hot Topic):
Small
molecules of natural origin for cancer chemotherapy and chemoprevention
Part II: Pharmacogenomics and Biotechnological Applications of Small
Molecules of Natural Origin for Cancer Therapy and Chemoprevention", Current
Drug Targets 7(4):385-386, 2006 (Abstract).
3. (α) Wikipedia: "Taxus
brevifolia". (β) USDA Forest Service:"Taxus
Brevifollia: Pacific Yew". (γ) Pacific Yew, Inc. "Pacific
Yew Longbows".
4. (α)
Goodman
J,
Walsh V:
"The Story of Taxol.
Nature and Politics
in the
Pursuit of An Anti-Cancer Drug", Cambridge University Press,
Cambridge, 2001 (Google
e-book). (β)
Wikipedia: "Paclitaxel".
(γ)
Wani M, Taylor H, Wall M, Coggon P, McPhail A: "Plant antitumor agents. VI. The isolation and structure of taxol, a novel
antileukemic and antitumor agent from Taxus brevifolia", J Am Chem
Soc 93(9): 2325-2327,
1971 (Αρχείο
PDF, 365 ΚΒ).
(δ)
Fuchs, David A and Johnson, Randall K "Cytologic evidence
that taxol, an antineoplastic agent from Taxus brevifolia, acts as a
mitotic spindle poison", Cancer Treatment Reports 62(8):
1219-1222, 1978.
(ε) Wall ME, Wani MC: "Camptothecin and
taxol: discovery to clinic--Thirteenth Bruce F. Cain Memorial Award
Lecture", Cancer Res. 55(4): 753-760, 1995 (Abstract).
(στ) Edwards N (Bristol University): "Molecule
of the Month: Taxol". (ζ) National Cancer Institute: "Success
Story:
Taxol (TM) (NSC 125973)".
(η)
Harrison K (www.3dchem.com, Molecule of
the Month): "Taxol
@ 3Dchem.com".
(θ) Stephenson F (Florida State University): "A
tale of Taxol".
5. (α)
Schiff PB,
Fant J, Horwitz SB:
"Promotion of microtubule assembly in vitro by taxol", Nature 277:665-667,
1979 (Abstract).
Kumar N: "Taxol-induced Polymerization of Purified
Tubulin",
Journal of Biological Chemistry
256(20):10435-10441,
1981 (αρχείο
PDF, 819 KB).
(γ) Horwitz SB: "Taxol (paclitaxel):
mechanism of action (review)", Ann Oncol 6:S3-S6, 1994 (Abstract).
(δ) Horwitz
SB: "Personal recollections on the early development of taxol", J Nat
Prod 67:136-138, 2004 (Αρχείο
PDF, 436
KB).
(ε) National Foundation for Cancer Research: "Susan
B. Horwitz, Ph.D.".
(στ) Haldart S, Jena N, Croce
CM: "Inactivation
of Bcl-2 by phosphorylation",
Proc. Natl. Acad. Sci. USA 92:4507-4511, 1995.
(ζ) Margit Foss M,
Wilcox BWL,
Bradley Alsop
G, Zhang
D: "Taxol
Crystals Can Masquerade as Stabilized Microtubules", PLoS ONE 3(1): e1476, 2008.
6. (α) Molecular
Expressions (Florida State University): "Microtubules".
(β) Cytochemistry.net: "Microtubule
Structure". (γ) Wikipedia: "Microtubule".
(δ) Παναγιωτίδης Χ (Πανεπιστήμιο Θεσσαλονίκης, Τμήμα Φαρμακευτικής):
"Διάλεξη 7: Κυτταροσκελετός (Ενδιάμεσα ινίδια, μικροσωληνίσκοι, ακτίνη & και
λειτουργίες της", (αρχείο
PDF, 1,8 MB).
7.
(α)
Wikipedia: "Paclitaxel".
(β) Report to the Honorable Ron Wyden,
U.S. Senate
:
"TECHNOLOGY
TRANSFER NIH-Private Sector
Partnership in the Development of Taxol",
United
States General Accounting Office
(GAO), June
2003 (αρχείο
PDF, 390 KB).
(γ) Morrissey SR:
"MAXIMIZING
RETURNS:
A driving force in getting Taxol to market quickly, NIH is being asked to
evaluate the way it deals with the private-sector partnerships",
Chemical & Engineering News 81(37):17-20, 2003.
(δ) Chou T (About.com):
"An
Analysis on Waxman-Hatch Act: The Effect of Generic Entry on Pharmaceutical
Prices". (ε) www.21cecpharm.com:
"Paclitaxel
(Taxol): The No. 1 Anti-Cancer Drug - A "Billion
Dollar Molecule". (στ) "Names for hi-jacking",
Nature 373(6513):370,
1995.
(ζ) Nader R, Love
J:"Looting the medicine chest: how
Bristol-Myers Squibb made off with the public's cancer research",
The Progressive,
February, 1993. (η)
Consumer Project on Technology: "Disputes
involving Paclitaxel, a cancer drug sold under different brand names,
including Taxol". (θ) Vidensek
N, Lim P, Cambell A, Carlson C: "Taxol content in bark, wood, root, leaf,
twig, and seedling from several Taxus species", J Nat Prod
53(6):1609-1610, 1990 (Abstract).
8.
(α)
ClinicalTrials.gov: "Glossary
of Clinical Trials Terms".
(β)
ClinicalTrials.gov: "Understanding
Clinical Trials".
9. (α)
Mangatal L, Adeline MT, Guenard D,
Potier P:
"Application of the vicinal oxyamination reaction with asymmetric
induction to the hemisynthesis of taxol and analogues", Tetrahedron
45(13):4177-4190, 1989
(Abstract).
(β)
Stierle A, Strobel G,
Stierle D: "Taxol and taxane production by
taxomyces-andreanae, an endophytic fungus of Paciific yew", Science
260(5105):214-216, 1993 (PubMed,
αρχείο Word, 42 KB).
(γ) Environmental Protection Agency (EPA): "2004
Greener Synthetic Pathways Award: Development of a Green Synthesis
for Taxol(ΤΜ) Manufacture via Plant Cell Fermentation and Extraction".
(δ) Jacoby M: "Taxol",
Chemical & Engineering News, 2005.
10. (α) Sato K (www.org-chem.org): "Taxol
- The Drama behind Total Synthesis". (β) Wikipedia: "Plaxicatel
total synthesis".
11.
(α) Holton RA, Somoza C, Kim HB, Liang F, Biediger RJ, Boatman PD, Shindo M,
Smith CC, Kim S: "First total synthesis of taxol. 1. Functionalization of
the B ring", J. Am. Chem. Soc. 116(4):1597-1598, 1994 (Abstract).
(β) Holton RA, Kim HB, Somoza C, Liang F, Biediger RJ, Boatman PD, Shindo M,
Smith CC, Kim S: "First total synthesis of taxol. 2. Completion of the C and
D rings", J. Am. Chem. Soc. 116 (4), pp 1599-1600, 1994 (Abstract).
(γ) Wikipedia: "Holton
Taxol total synthesis". (δ)
Wapedia: "Holton
Taxol total synthesis".
12. (α)
Nicolaou KC, Yang Z,
Liu JJ, Ueno H, Nantermet PG, Guy RK, Claiborne CF, Renaud
J, Couladouros EA, Paulvannan K, Sorensen EJ: "Total
synthesis of taxol",
Nature 367, 630-634, 1994
(Abstract
(β)
Nicolaou KC, Nantermet H, Ueno R, Guy RK:
"Novel chemistry of taxol.
Retrosynthetic and synthetic studies", J Chem Soc, Chem Commun
(3):295-296,
1994
(Abstract).
(γ)
Nicolaou KC, Nantermet PG, Ueno H,
Guy RK, Couladouros EA, Sorensen EJ: "Total synthesis of taxol. 1.
Retrosynthesis, degradation, and reconstruction", J Am Chem Soc
117:624-633,
1995
(αρχείο
PDF, 2,1 MB). (δ)
Nicolaou KC,
Guy RK:
"The Conquest of Taxol", Angew Chem Int Edition
34:2079-2090, 1995 (Abstract).
(ε) "RSC
Centenary Lecturer: Professor K. C. Nicolaou",
J. Chem. Soc., Perkin Trans. 1:
vii-x, 2002 (αρχείο
PDF, 335 KB).
(στ) worldlingo.com: "Nicolaou
Taxol total synthesis". (ζ) Wapedia: "Nicolaou
Taxol total synthesis".
13.
(α) Danishefsky SJ,
Masters JJ, Young WB,
Link JT, Snyder LB,
Magee TV, Jung DK,
Isaacs RCA, Bornmann WB,
Alaimo CA, Coburn CA, Di
Grandi MJ: "Total Synthesis of Baccatin III and
Taxol", J. Am. Chem. Soc. 118(12):
2843-2859,
1996
(Abstract).
(β) Wikipedia: "Danishefsky
Taxol total synthesis".
(γ) Wapedia: "Danishefsky
Taxol total synthesis".
14. (α) Phyton Biotech Inc.: "How
it started". (β) Phyton Biotech Inc.: "Upstream/Downstream capabilities"
(αρχείο
PDF, 342 KB). (γ)
Zhao K, Zhou D, Ping W, Ge J: "Study on
the Preparation and Regeneration of Protoplast from Taxol-producing Fungus
Nodulisporium sylviforme",
Nature and Science, 2(2):52-59, 2004 (αρχείο
PDF, 111 KB).
15. (α) BASF: "Cremophor L (technical
leaflet)", July 1997 (αρχείο
PDF, 65 KB).
(β) Shieh M-F, Chu I-M, Lee
C-J, Pei Kan P, Hau D-M, Shieh J-J: "Liposomal
delivery system for taxol", Journal of Fermentation
and Bioengineering, 83(1):87-90, 1997 (Abstract).
(γ) Qu G, Yao Z, Zhang C, Wu X,
Ping Q: "PEG conjugated N-octyl-O-sulfate chitosan micelles for delivery of
paclitaxel: in vitro characterization and in vivo evaluation", Eur J Pharm
Sci. 37(2):98-105, 2009 (Pubmed).
(δ) Castor TP: "Phospholipid Nanosome", Current Drug Delivery, 2(4):329-340,
2005, (PubMed,
αρχείο PDF, 468 KB). (ε) emedtv.com: "Taxol
Side Effects".
(στ) Flexyx.com: "Flexyx
drugs: Taxol". (ζ) LC
Laboratories: "P-9600
Paclitaxel, >99.5%"
(August 2009). (η) drugs.com: "Abraxane".
16.
(α) Wikipedia: "Docetaxel".
(β) Lamb HM, Wiseman LR: "Docetaxel. A pharmacoeconomic review of its use in
the treatment of metastatic breast cancer", Pharmacoeconomics 14(4):447-459
1998 (PubMed).
(γ) Clarke SJ,
Rivory LP: "Clinical pharmacokinetics of docetaxel", Clin. Pharmacokinet. 36(2):99-114,
1999 (PubMed).
(δ) Chemler JA, Yajun Yan
Y, Koffas M-AG: "Biosynthesis
of isoprenoids, polyunsaturated fatty acids and flavonoids in
Saccharomyces cerevisiae", Microbial
Cell Factories 5:20,
2006. (ε)
School of Biological & Chemical Sciences at
Queen Mary, University of London:
"Taxadiene
biosynthesis".












 Φάσεις
δοκιμών ενός νέου φαρμάκου [
Φάσεις
δοκιμών ενός νέου φαρμάκου [












 Η ταξόλη, ως δραστικότατο
αντικαρκινικό χημειοθεραπευτικό φάρμακο, προκαλεί σοβαρές και δυσάρεστες
παρενέργειες παροδικού χαρακτήρα. Σε αυτές περιλαμβάνονται: πλήρης απώλεια τριχοφυίας, αναιμία, αιμορραγίες, πόνοι στους μυς και στις
αρθρώσεις, διάρροια, εμετοί, βραδυκαρδία, υπόταση, αλλά και υπέρταση. Η
σοβαρότητα των παρενεργειών δεν επιτρέπει τη χρήση της ταξόλης σε
περιπτώσεις παιδικών καρκίνων [
Η ταξόλη, ως δραστικότατο
αντικαρκινικό χημειοθεραπευτικό φάρμακο, προκαλεί σοβαρές και δυσάρεστες
παρενέργειες παροδικού χαρακτήρα. Σε αυτές περιλαμβάνονται: πλήρης απώλεια τριχοφυίας, αναιμία, αιμορραγίες, πόνοι στους μυς και στις
αρθρώσεις, διάρροια, εμετοί, βραδυκαρδία, υπόταση, αλλά και υπέρταση. Η
σοβαρότητα των παρενεργειών δεν επιτρέπει τη χρήση της ταξόλης σε
περιπτώσεις παιδικών καρκίνων [





