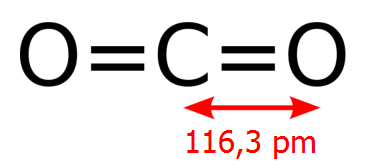 Ιστορικά δεδομένα για την ανακάλυψη και
μελέτη του διοξειδίου του άνθρακα
[Αναφ. 1]
Ιστορικά δεδομένα για την ανακάλυψη και
μελέτη του διοξειδίου του άνθρακα
[Αναφ. 1]
Το διοξείδιο του άνθρακα (CO2) είναι αέριο με εξαιρετική σημασία για την προβιοτική σύνθεση των οργανικών ενώσεων, υπεύθυνο για το ήπιο ατμοσφαιρικό κλίμα και την ανάπτυξη της ζωής στον πλανήτη Γη. Αποτελεί κοινό προϊόν καύσης όλων των οργανικών, όπως προϊόν καταβολισμού κάθε αερόβιου οργανισμού. Είναι ένα σταθερό, άχρωμο και άοσμο αέριο και κανονικό συστατικό της γήινης ατμόσφαιρας. Το CO2 στη στερεά μορφή (ξηρός πάγος) είναι ένα ιδιαίτερα χρήσιμο υλικό για την επίτευξη χαμηλών θερμοκρασιών (μέχρι τους -78ºC) και ως αέριο χρησιμοποιείται ευρύτατα ως μέσο πυρόσβεσης.
 |
 |
|
Οι πρώτοι που μελέτησαν τις χημικές και φυσιολογικές ιδιότητες του διοξειδίου του άνθρακα: Αριστερά: ο Φλαμανδός χημικός Baptist van Helmont (1579-1644). Δεξιά: Ο Σκωτσέζος φυσιολόγος Joseph Black (1728-1799) |
|
Το CO2 αποτέλεσε αντικείμενο έρευνας αρκετών φυσιοδιφών και χημικών ήδη από τους χρόνους του μεσαίωνα και υπήρξε το πρώτο αέριο το οποίο μελετήθηκε ως κανονικό συστατικό του αέρα.
Τον 17ο αιώνα, ο Φλαμανδός ιατρός και χημικός Baptist van Helmont (1579-1644) παρατήρησε ότι όταν καιγόταν ο άνθρακας (κάρβουνο, ξύλο) σε κλειστό δοχείο, η μάζα της στάχτης που προέκυπτε ήταν κατά πολύ μικρότερη από εκείνη του αρχικού ανθρακούχου υλικού. Η ερμηνεία που έδωσε ήταν ότι ένα τμήμα του άνθρακα μετατράπηκε σε κάποιο είδος "αόρατου" αερίου, το οποίο ονόμασε gas ή "άγριο πνεύμα" (wild spirit), αφού δεν μπόρεσε να διαπιστώσει επακριβώς τι ήταν. Στις σημειώσεις που κρατούσε στη λατινική γλώσσα ο van Helmont είχε γράψει:
"Hunc spiritum, incognitum hactenus, novo nomine gas voco. In nominis egestate, halitum illud gas vocavi, non longe a chao veterum" (Αυτό το πνεύμα, το μέχρι στιγμής άγνωστο, το ονομάζω με ένα νέο όνομα, gas. Ελλείψει άλλου ονόματος, αυτή την αναθυμίαση την ονόμασα gas, που δεν διαφέρει και πολύ από το αρχαίο χάος).
Κατά τη δεκαετία 1750-1760, ο Σκωτσέζος φυσιολόγος Joseph Black (1728-1799) μελέτησε διεξοδικά τις ιδιότητες του αερίου CO2. Ο Black πρόσεξε ότι το ανθρακικό ασβέστιο (ασβεστόλιθος, CaCO3) κατά την ισχυρά θέρμανσή του ή κατά την κατεργασία του με οξέα παράγει ένα αέριο, το οποίο ονόμασε σταθεροποιημένο αέρα (fixed air) (άλλες αποδόσεις: δεσμευμένος, καθηλωμένος, παγιδευμένος αέρας). Διαπίστωσε ότι το αέριο αυτό ήταν πυκνότερο από τον αέρα και δεν συντηρούσε ούτε την καύση, ούτε τις ζωικές λειτουργίες οργανισμών. Ο Black χρησιμοποίησε τη διαπίστωση αυτή για να αποδείξει ότι το CO2 παράγεται κατά την αναπνοή των ζώων και τη μικροβιακή ζύμωση, δηλαδή διαδραματίζει σημαντικό ρόλο αποτελώντας σημαντικό προϊόν της καταβολικής πορείας του ζωικού μεταβολισμού.
Το 1772, ο 'Αγγλος χημικός Joseph Priestley (1733-1804) μετά από πειράματα, δημοσίευσε επιστημονική εργασία με τίτλο "Εμπλουτισμός του ύδατος με σταθεροποιημένο αέρα" (Impregnating Water with Fixed Air). Ήταν ο πρώτος που παρασκεύασε υπέρκορο υδατικό διάλυμα CO2 (οξυανθρακούχο ύδωρ), διαπιστώνοντας την ευχάριστη όξινη γεύση του (pH: 3 έως 4) και τις "δροσιστικές" ιδιότητές του. Από τις αρχές του 19ου αιώνα άρχισε η βιομηχανική παρασκευή και εμπορική διάθεση του οξυανθρακούχου ύδατος, το οποίο αργότερα ονομάστηκε soda water (νατριούχο ύδωρ), λόγω της μεγάλης περιεκτικότητας σε νάτριο ορισμένων φυσικών οξυανθρακούχων υδάτων.
Το 1823, το CO2 υγροποιήθηκε για πρώτη φορά (σε υψηλές πιέσεις) από τον Humphry Davy (1778-1829) και τον μαθητή του Michael Faraday (1791-1867), ενώ το 1834 δόθηκε η πρώτη αναφορά και περιγραφή του στερεού CO2 (ξηρός πάγος) από τον Γάλλο χημικό Adrien-Jean-Pierre Thilorier (1790-1844) το 1834.
|
|
||||||||
|
|||||||||||||||||||||||||||||||
Το διοξείδιο του άνθρακα στην ατμόσφαιρα της Γης [Αναφ. 2]
Το CO2 υπήρξε το κύριο αέριο της αρχέγονης ατμόσφαιρας κατά την πρωταρχική περίοδο αμέσως μετά τον σχηματισμό της Γης, πριν 4,7 δισεκατ. χρόνια. Οι επιστήμονες υποθέτουν ότι οι συνθήκες και τα υλικά της πρωταρχικής Γης δημιούργησαν σημαντικές συγκεντρώσεις CO2, CO, H2, He, N2, Η2S και CH4 στην αρχέγονη ατμόσφαιρα, μια σύνθεση που της προσέδιδε από χημική άποψη αναγωγικό χαρακτήρα.
Στην πρώτη περίοδο σχηματισμού της Γης, υπολογίζεται ότι υπήρχαν, περίπου, 1023 g άνθρακα με τη μορφή διάφορων χημικών μορίων, όπως διοξείδιο του άνθρακα (CO2), μονοξείδιο του άνθρακα στην ατμόσφαιρα (CO) και μεθάνιο (CH4) ως αέρια στην ατμόσφαιρα, όπως επίσης και υπό τη μορφή ανθρακικών αλάτων (CO32-) και όξινων ανθρακικών αλάτων (HCO3-) στο έδαφος και τους ωκεανούς. Σημαντικές ποσότητες των αερίων αυτών ήταν αποτέλεσμα εκπομπών από ηφαίστεια και θερμές πηγές του εσωτερικού του πλανήτη. Και σήμερα ακόμη, σύμφωνα με τις εκτιμήσεις του Γεωλογικού Ινστιτούτου των ΗΠΑ, τα ηφαίστεια παράγουν σε παγκόσμιο επίπεδο 200 εκατομ. τόνους CO2 ετησίως.
'Ερευνες έδειξαν η συγκέντρωση του CO2 στην ατμόσφαιρα μειώθηκε δραστικά και πριν 500 εκατομμύρια χρόνια ήταν περίπου 7500 ppm, δηλ. περίπου 20 φορές υψηλότερη από ό,τι είναι στις σημερινές εποχές. Πριν 300 εκατομμύρια χρόνια η συγκέντρωση έφθασε τα 370 ppm, πριν 43 εκατομμύρια χρόνια ήταν 385 ppm και πριν 25 έως 9 εκατομ. χρόνια μειώθηκε ακόμη περισσότερο στα επίπεδα των 180-290 ppm.
[Διευκρίνηση: Οι μονάδες μέτρησης της περιεκτικότητας του CO2 -αλλά και άλλων αερίων- στην ατμόσφαιρα είναι τα μέρη στο εκατομμύριο (parts per million, ppm) και ισοδυναμούν με τον αριθμό των μορίων του αερίου σε ένα εκατομμύριο -συνολικά- μόρια αερίων].
Στις ατμόσφαιρες της Αφροδίτης και του 'Αρη επικρατεί το CO2. Στην επιφάνεια της αρχέγονης Γης οι επιστήμονες πιστεύουν ότι επικράτησαν το άζωτο και το οξυγόνο και τεράστιες ποσότητες ύδατος (ωκεανοί), που συγκρατήθηκαν από την έλξη του πλανήτη και την ψυχρότερη επιφάνεια, λόγω της κατάλληλης για τις συνθήκες αυτές απόστασή της από τον Ήλιο. Αντίθετα, τα ελαφρότερα αέρια υδρογόνο και ήλιο εξαφανίσθηκαν γιατί δεν μπόρεσαν να συγκρατηθούν από το ελκτικό πεδίο της Γης. Στην Αφροδίτη οι επικρατούσες συγκεντρώσεις CO2 στην ατμόσφαιρα έχουν προκαλέσει εντονότατο φαινόμενο θερμοκηπίου με αποτέλεσμα τις εξαιρετικά υψηλές θερμοκρασίες (467°C) επιφανείας, που θα ήταν πολύ μικρότερες αν η ατμόσφαιρά της ήταν παρόμοια με εκείνη της Γης.
 |
 |
 |
|
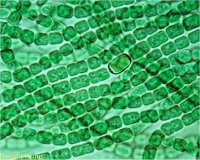
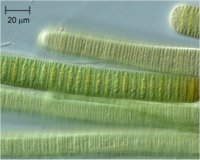
Αριστερά: Σύγχρονα κυανοβακτήρια (κυανοφύκη) επιπλέοντα σe επιφάνεια λίμνης. Μέσον και Δεξιά: Κυανοβακτήρια στο μικροσκόπιο. Αρχέγονες μορφές ζωής που δημιούργησαν τις προϋποθέσεις δημιουργίας ανώτερων μορφών ζωής στη Γη, με τη μετατροπή του άφθονου ατμοσφαιρικού CO2 σε O2 με τη βοήθεια της ηλιακής ακτινοβολίας. |
||
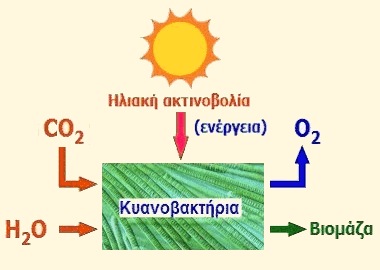
Ο ρόλος των κυανοβακτηρίων και του CO2 στην παραγωγή οξυγόνου. Το CO2 της αρχέγονης ατμόσφαιρας υπήρξε η βασική πρώτη ύλη για τη σύνθεση οργανικής βιομάζας και οξυγόνο. Οι πλέον αρχαίοι οργανισμοί, σύμφωνα με τους παλαιοντολόγους-γεωχημικούς είναι τα κυανοβακτήρια (κυανοφύκη) τα οποία συνέβαλαν στην εξελικτική ιστορία της Γης. Απολιθώματά τους, μαρτυρούν την ύπαρξή τους πριν από 3,5 δισεκατομμύρια χρόνια, ενώ ακόμη και σήμερα είναι άφθονη η παρουσία διαφόρων μορφών τους.
Τα κυανοβακτήρια, ένα είδος νηματοειδών πρωτόγονων μορφών φωτοσυνθετικών φυκών, θεωρούνται ως οι πρώτοι οργανισμοί που δημιουργήθηκαν στη Γη, οι οποίοι αφομοίωναν CO2 και παρήγαγαν οξυγόνο με φωτοσύνθεση. Η πλούσια σε οξυγόνο ατμόσφαιρα ουσιαστικά μπορεί να θεωρηθεί ως δημιούργημά τους και πετυχημένα τα κυανοβακτήρια έχουν χαρακτηρισθεί ως "οι αρχιτέκτονες της γήινης ατμόσφαιρας" [Αναφ. 2θ].
Η αρχική τους ονομασία "κυανoφύκη" (στη διεθνή ορολογία: blue-green algae ) οφείλεται κυρίως στο χρώμα το οποίο παρουσίαζαν πολλά από αυτά τα είδη, χρώμα προερχόμενο από την παρουσία χρωστικών, τόσο στους οργανισμούς αυτούς όσο και στα ερυθρά φύκη (red algae) ή ροδόφυτα (rhodophytes), και ειδικότερα των φυκοκυανινών. Οι χρωστικές αυτές αποτελούσαν το μέσο "σύλληψης" ενέργειας από την ηλιακή ακτινοβολία.
Οι διάσημοι επιστήμονες Schopf και Walter (1982) έχουν χαρακτηρίσει την προτεροζωική περίοδο ως "εποχή των κυανοβακτηρίων", επειδή έχουν βρεθεί άφθονα κυανοβακτήρια εκείνης της εποχής σε απολιθωμένη μορφή. Επίσης, μερικές νηματοειδείς δομές που έχουν βρεθεί σε πρωτοζωικά απολιθώματα έχουν εντυπωσιακή ομοιότητα με τα σύγχρονα νηματοειδή κυανοβακτήρια, όπως τα πολύ γνωστά κυανοφύκη στο Shark Bay της Δυτικής Αυστραλίας.
Σήμερα, το έργο των κυανοβακτηρίων συνεχίζεται. 'Ολα τα φυτά της Γης περιλαμβάνουν συμβιωτικά κυανοβακτήρια, γνωστά ως χλωροπλάστες (chloroplasts), που συνεχίζουν τη φωτοσυνθετική διαδικασία.
 |
 |
|
Πριν 3,5 περίπου δισεκατομμύρια χρόνια οι πρώτοι πρωτόγονοι οργανισμοί, τα κυανοβακτήρια άρχισαν τη σταδιακή μετατροπή του άφθονου διοξειδίου του άνθρακα της τότε αρχέγονης γήινης ατμόσφαιρας σε οξυγόνο και βιομάζα. |
|
Σύνθεση διοξειδίου του άνθρακα
Βιομηχανική παρασκευή CO2: Το διοξείδιο του άνθρακα αποτελεί το κύριο προϊόν καύσης του άνθρακα και των οργανικών ουσιών γενικά. Αποτελεί το κύριο παραπροϊόν πλήθους αντιδράσεων βιομηχανικής σημασίας που πραγματοποιούνται σε μεγάλη κλίμακα, έτσι π.χ. αποτελεί κύριο παραπροϊόν της παραγωγής υδρογόνου και αμμωνίας (βλ. Χημική ένωση του μήνα: Αμμωνία). Ως εκ τούτου οι αντιδράσεις μεγάλης βιομηχανικής σημασίας από τις οποίες προέρχεται το εμπορικώς διαθέσιμο CO2 σχεδόν στο σύνολό του είναι οι:
| Αντίδραση αναμόρφωσης με ατμό (steam reforming reaction): | CH4
+ 2H2O
|
|
Αντίδραση μετατόπισης (shift reaction): |
CO + H2O
|
 |
 |
|
Τυπική συσκευή Kipp. Συσκευή ευρύτατης χρήσης κατά το παρελθόν χρησιμο-ποιούμενη για την ελεγχόμενη παραγωγή αερίων (κυρίως: CO2, H2 και H2S). Εφευρέθηκε από τον Ολλανδό φαρμακοποιό Petrus Jacobus Kipp (1808-1864) γύρω στο 1844. Σήμερα αποτελεί πλέον μουσειακό είδος. Με το κλείσιμο της στρόφιγγας, η αναπτυσσόμενη πίεση του παραγόμενου αερίου εκτόπιζε το οξύ από το κάτω διαμέρισμα στο επάνω και η αντίδραση σταματούσε. |
|
Συνεπώς, από βιομηχανική άποψη, δεν καταβάλλεται κάποια ιδιαίτερη προσπάθεια παρασκευής του. Απλά συλλέγεται (ως εύκολα υγροποιούμενο αέριο υπό πίεση) ως παραπροϊόν άλλων διαδικασιών, υπόκειται σε διάφορα στάδια καθαρισμού -ανάλογα με τον απαιτούμενο βαθμό καθαρότητας- και διατίθεται στο εμπόριο ως υγρό σε κυλίνδρους υπό πίεση ή ως στερεό στη μορφή "ξηρού πάγου".
Διοξείδιο του άνθρακα παράγεται κατά την πλήρη καύση του άνθρακα, κατά την πύρωση ανθρακικών ορυκτών, κατά την καύση υδρογονανθράκων, κατά την αναγωγή μεταλλικών οξειδίων με άνθρακα, όπως επίσης και κατά τη ζύμωση σακχάρων (π.χ. κατά την αλκοολική ζύμωση), αλλά και από πλήθος βιοχημικών αντιδράσεων ως προϊόν αποκαρβοξυλιώσεων:
C + O2
![]() CO2 CaCO3
CO2 CaCO3
![]() CaO + CO2 CxHy + (x + y/4)O2
CaO + CO2 CxHy + (x + y/4)O2
![]() xCO2 + y/2H2O
xCO2 + y/2H2O
2Fe2O3 +
3C
![]() 4Fe
+ 3CO2
C6H12O6
4Fe
+ 3CO2
C6H12O6
![]() 2CO2 +
2C2H5OH
2CO2 +
2C2H5OH
Εργαστηριακή παρασκευή CO2: Σε εργαστηριακή κλίμακα μικρές ποσότητες CO2 παρασκευάζονται εύκολα με αντίδραση ισχυρού οξέος (συνήθως HCl) με ανθρακικά ορυκτά (συνήθως μάρμαρο, ασβεστόλιθος). Αυτή είναι μια από τις πρώτες χημικές αντιδράσεις που διδάσκονται και επάνω στην οποία συχνά πειραματίζονται οι μαθητές στη δευτεροβάθμια εκπαίδευση. Επίσης, μικρές ποσότητες μπορούν να παρασκευασθούν με σχετικώς ελαφριά θέρμανση στερεών όξινων ανθρακικών αλάτων, όπως της μαγειρικής σόδας (όξινο ανθρακικό νάτριο):
CaCO3 + 2 HCl
![]() CaCl2 + H2O + CO2
2 NaHCO3
CaCl2 + H2O + CO2
2 NaHCO3
![]() Na2CO3 + H2O +
CO2
Na2CO3 + H2O +
CO2
Η ελεγχόμενη παροχή CO2 με αντίδραση οξέων/ανθρακικών αλάτων στα χημικά εργαστήρια παλαιότερα γινόταν με την περίφημη συσκευή Kipp, που σήμερα αποτελεί πλέον χημικό σκεύος μουσειακής αξίας. Στα χημικά εργαστήρια, σπάνια πλέον πραγματοποιείται η χημική παρασκευή CO2, αφού το αέριο αυτό διατίθεται σε υγροποιημένη μορφή υπό πίεση σε φιάλες διαφόρων μεγεθών με χαμηλό κόστος.
Φυσικές ιδιότητες του διοξειδίου του άνθρακα [Αναφ. 3]
Το CO2 είναι αέριο άχρωμο και άγευστο σε χαμηλές συγκεντρώσεις, ενώ σε μεγάλες συγκεντρώσεις έχει μια οξεία, όξινη οσμή. Σε συνήθεις θερμοκρασίες έχει ειδικό βάρος 1,98 kg/m3 και είναι 1,67 φορές ειδικώς βαρύτερο σε σχέση με τον αέρα. Για τον λόγο αυτό, σε χώρους όπου δεν υπάρχουν αέρια ρεύματα, κατά την παραγωγή του (π.χ. σε υπόγεια με βαρέλια όπου γίνεται ζύμωση του γλεύκους) ή την έκλυσή του από ρωγμές του εδάφους (σε σπήλαια ή ανθρακωρυχεία), σωρεύεται σε χαμηλά ύψη. Το γεγονός αυτό έχει προκαλέσει πολλούς θανάτους από ασφυξία σε όσους επιχείρησαν να ξαπλώσουν ή να συρθούν στο έδαφος τέτοιων χώρων (υψηλές συγκεντρώσεις CO2 έχουν ναρκωτικές ιδιότητες). Πολύ γνωστή είναι μια σπηλιά κοντά στη Νεάπολη της Ιταλίας, γνωστή ως Grotta del Cane (Σπηλιά των Σκύλων), όπου το εκλυόμενο από σχισμές του εδάφους διοξείδιο του άνθρακα σχηματίζει ένα στρώμα ύψους περίπου 1 μέτρου. Το στρώμα αυτό είναι φονικό για κάθε τετράποδο, όχι όμως για τους ανθρώπους που τυχόν τα συνοδεύουν.
|
|
|
|
|
|
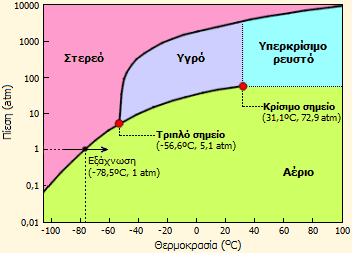
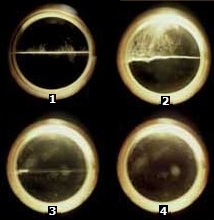
Αριστερά: Διάγραμμα φάσεων CO2. Μέσον: Αμπούλα με υγρό CO2. Σε θερμοκρασίες δωματίου υγρό CO2 μπορεί να υπάρξει μόνο υπό πίεση (περί τις 50 atm σε θερμοκρασία δωματίου). Αν σπάσει η αμπούλα, μέρος του CO2 θα εξατμιστεί υποβιβάζοντας τη θερμοκρασία του υπολοίπου, το οποίο θα στερεοποιηθεί σχεδόν ακαριαία [πηγή]. Δεξιά: Σταδιακή μετατροπή με θέρμανση υγρού CO2 (1) σε υπερκρίσιμο ρευστό CO2 (4) (παρατήρηση σε υάλινη κυψελίδα υψηλής πιεσης, >75 atm) [πηγή]. |
|||
Το διάγραμμα φάσεων του CO2 δείχνεται παρακάτω. Το διάγραμμα φάσεων μιας ουσίας (που είναι σταθερή και στις τρεις φάσεις) δείχνει την κατάσταση, στην οποία βρίσκεται η ουσία αυτή κάτω από δεδομένες συνθήκες πίεσης και θερμοκρασίας. Χαρακτηριστικά σημεία ενός διαγράμματος φάσεων είναι: Το τριπλό σημείο και το κρίσιμο σημείο, τα οποία στην περίπτωση του CO2 είναι -56,6ºC, 5,1 atm και 31,1ºC, 72,9 atm, αντιστοίχως.
Στο τριπλό σημείο ενός αερίου συνυπάρχουν και τρεις φάσεις (αέριο, υγρό, στερεό). 'Οπως φαίνεται από το διάγραμμα φάσεών του, σε θερμοκρασίες και πιέσεις μικρότερες και από εκείνες του τριπλού σημείου, το CO2 δεν μπορεί να υπάρξει σε υγρή φάση. 'Ετσι, σε πίεση 1 atm, με ψύξη στους -78,5ºC στερεοποιείται προς στερεό (ξηρός πάγος), το οποίο με αύξηση της θερμοκρασίας μεταβαίνει απ' ευθείας στην αέρια φάση (εξαχνώνεται). Από το διάγραμμα φαίνεται ότι σε κανονική πίεση δωματίου (1 atm) είναι αδύνατη η συντήρηση του CO2 στην υγρή μορφή, η οποία μπορεί να υπάρξει μόνο σε πιέσεις μεγαλύτερες από 5,1 atm (περί τις 60-70 atm στις συνήθεις θερμοκρασίες). Στις φιάλες αερίων (οβίδες, κυλίνδρους), το CO2 βρίσκεται σε υγρή μορφή, επειδή πληρούται αυτή η προϋπόθεση.
Υπερκρίσιμη κατάσταση. Σε θερμοκρασίες και πιέσεις μεγαλύτερες από τις κρίσιμες, ένα αέριο περιέρχεται σε κατάσταση υπερκρίσιμου ρευστού (supercritical fluid), μια κατάσταση με χαρακτηριστικά παρόμοια με εκείνα της υγρής φάσης (τα μόρια συγκρατούνται μεταξύ τους, αλλά χαλαρά), ενώ διαθέτει ρευστότητα (π.χ. διαχυσιμότητα, ιξώδες) παραπλήσια της αέριας φάσης.
Η υπερκρίσιμη κατάσταση διαφόρων ουσιών παρατηρήθηκε για πρώτη φορά το 1822 από τον Γάλλο μηχανικό και φυσικό Charles Cagniard de la Tour (1777-1859), ο οποίος παρατήρησε ότι η διαχωριστική επιφάνεια αέριας-υγρής φάσης μιας ουσίας (η πρώτη ουσία που δοκίμασε ήταν η αιθανόλη) που βρίσκεται σε ένα κλειστό χώρο, από μια θερμοκρασία και πάνω εξαφανίζεται και δημιουργείται ένα νέο είδος ομοιόμορφης φάσης (υπερκρίσιμη κατάσταση).
|
Ένα υπερκρίσιμο ρευστό διαθέτει τις ιδιότητες ροής ενός αερίου και τις διαλυτικές ιδιότητες ενός υγρού. |
|
Τα κατώτερα στρώματα της ατμόσφαιρας της Αφροδίτης (CO2 96,5%, σε πίεση 92 atm και θερμοκρασία 462ºC), ουσιαστικά συνιστούν έναν ωκεανό υπερκρίσιμου CO2. |
Αν μια κλειστή αμπούλα με υγρό CO2 σε πίεση μεγαλύτερη από την κρίσιμη θερμανθεί από θερμοκρασίες μικρότερες της κρίσιμης προς θερμοκρασίες μεγαλύτερές της, το υγρό CO2 μετατρέπεται σε υπερκρίσιμο ρευστό με σταδιακή εξαφάνιση της διαχωριστικής επιφάνειας μεταξύ υγρής και αέριας φάσης (βλ. φωτογραφία). Αξίζει στο σημείο αυτό να αναφερθεί ότι οι συνθήκες πίεσης και θερμοκρασίας που επικρατούν στην επιφάνεια της Αφροδίτης (92 atm, 462ºC), καθιστούν τα κατώτερα στρώματα της ατμόσφαιράς της (CO2 96,5%), από τεχνική άποψη, έναν "ωκεανό" υπερκρίσιμου ρευστού.
Να σημειωθεί ότι το αντίστοιχο κρίσιμο σημείο στο διάγραμμα φάσεων του ύδατος βρίσκεται σε θερμοκρασία 374ºC και την πίεση 218 atm. Η απαιτούμενη υψηλή θερμοκρασία για τη διατήρηση της υπερκρίσιμης κατάστασης του ύδατος (>374ºC) το καθιστά ακατάλληλο ως υπερκρίσιμο ρευστό στις διάφορες εφαρμογές χημικού χαρακτήρα. Αντίθετα, το υπερκρίσιμο ύδωρ έχει αποδειχθεί κατάλληλο για τη μεταφορά θερμότητας στους πυρηνικούς σταθμούς παραγωγής ηλεκτρικής ενέργειας.
Τα υπερκρίσιμα "ρευστά" (και όχι "υγρά") διαθέτουν κάποιες παράδοξες και αξιοθαύμαστες ιδιότητες. 'Ενα υπερκρίσιμο ρευστό τείνει να καταλάβει τον συνολικό όγκο του περιέκτη του, μια συμπεριφορά που σαφώς χαρακτηρίζει τα αέρια. Ωστόσο, ένα υπερκρίσιμο ρευστό έχει και τις ιδιότητες ενός υγρού διαλύτη, δηλ. μπορεί να διαλύει ουσίες, μια ιδιότητα που μόνο τα υγρά διαθέτουν και δεν τη διαθέτει κανένα αέριο σε οποιαδήποτε πίεση. Ακόμη, χαρακτηριστικό των υπερκρίσιμων ρευστών είναι η έντονη εξάρτηση της πυκνότητάς τους από την πίεση: όσο αυξάνει η πίεση, αυξάνει και η πυκνότητά τους. Είναι γνωστό ότι αυτό δεν ισχύει στην περίπτωση των υγρών. Χαρακτηριστικά, η πυκνότητα (σε g/mL) του υπερκρίσιμου CO2 είναι 0,225, 0,403 και 0,662 σε πιέσεις και θερμοκρασίες 80 bar/50ºC, 100 bar/50ºC και 120 bar/40ºC, αντιστοίχως (1 bar = 10.000 pascal = 0,98692 atm = 750,0616 Torr) [Αναφ. 3γ].
Ανάλογη είναι η εντονότατη εξάρτηση της διαλυτότητας διαφόρων ουσιών σε υπερκρίσιμα ρευστά από την πίεση. 'Οσο αυξάνει η πίεσή τους, τόσο αυξάνει και η διαλυτική τους ικανότητα. Είναι εκπληκτική και εξαιρετικά χρήσιμη η ιδιότητα αυτή: μετά τη διάλυση σχεδόν μέχρι κορεσμού μιας ουσίας σε ένα υπερκρίσιμο ρευστό (π.χ. καφεΐνης σε υπερκρίσιμο CO2), με μείωση της ασκούμενης στο σύστημα πίεσης επέρχεται καθίζηση της διαλυμένης ουσίας !!! [Αναφ. 3ζ].
Κατά την πρώτη περιγραφή του φαινομένου από τους Hannay και Hogarth ενώπιον της Royal Society (Λονδίνο, 1879), χαρακτηριστικά αναφέρθηκε ότι με μείωση της πίεσης του "αερίου" (ακόμη πίστευαν ότι η υπερκρίσιμη φάση είναι αέριο υπό υψηλή πίεση) η διαλυμένη ουσία εμφανίζεται να "πέφτει σαν χιόνι" [Αναφ. 3η].
|
Διαλυτότητα του CO2 στο ύδωρ ως συνάρτηση της πίεσης και της θερμοκρασίας. |
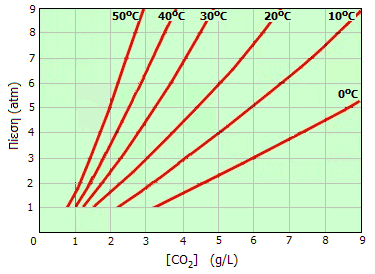
Διαλυτότητα του CO2 στο νερό. Το CO2 παρουσιάζει σχετικά μεγάλη διαλυτότητα στο νερό, που (όπως ισχύει για όλα τα διαλυόμενα αέρια) μειώνεται με αύξηση της θερμοκρασίας και αυξάνει με αύξηση της πίεσης.
Υπολογίζεται ότι το 50% του CO2 στην επιφάνεια της Γης βρίσκεται διαλυμένο στους ωκεανούς και τα άλλα υδάτινα συστήματα. Η διαλυτότητα του CO2 στο νερό εξαρτάται από πολλούς παράγοντες πέραν από την πίεση και τη θερμοκρασία. Για χημικούς λόγους εξαρτάται από το pH (η διαλυτότητα του CO2 αυξάνεται με την αύξηση του pH) και την παρουσία άλλων ουσιών, έτσι η διαλυτότητά του μειώνεται από την παρουσία ενώσεων όπως το χλωριούχο νάτριο, αλλά μπορεί και να αυξηθεί ή να μειωθεί με την αύξηση της συγκέντρωσης των οργανικών ενώσεων.
Σε πίεση 1 atm και στους 25ºC η διαλυτότητά του CO2 είναι 1,45 g/L (0,033 Μ) ή περίπου 0,8 L αερίου/L, η οποία υπερδιπλασίαζεται στους 0ºC. Χαρακτηριστική είναι η ιδιότητα του CO2 να σχηματίζει υπέρκορα υδατικά διαλύματα, τα οποία χάνουν το επιπλέον CO2 με έντονη ανάδευση. Αποτελεί κοινή εμπειρία το τι συμβαίνει όταν αναταραχθεί μια φιάλη με οξυανθρακούχο ποτό ή αναψυκτικό.
Χημικές ιδιότητες διοξειδίου του άνθρακα [Αναφ. 4]
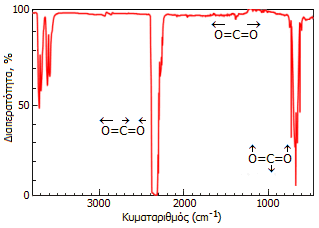
Το μόριο του διοξειδίου του άνθρακα είναι γραμμικό και κεντροσυμμετρικό, γεγονός το οποίο ερμηνεύει τη μηδενική διπολική ροπή του μορίου. Οι αποστάσεις μεταξύ C και Ο είναι 116,3 pm, τυπικές αποστάσεις διπλού δεσμού (Ο=C=O).
 |
 |
|
Καύση μαγνησίου Αριστερά: Σε ατμόσφαιρα CO2 [πηγή]. Δεξιά: Σε κοίλωμα μπλοκ στερεού CO2 (ξηρού πάγου) [πηγή]. |
|
Το διοξείδιο του άνθρακα είναι εξαιρετικά σταθερό οξείδιο. Δεν παρέχει εύκολα το οξυγόνο του και για τον λόγο αυτό χρησιμοποιείται ως πυροσβεστικό μέσο, που δρα μέσω της εκτόπισης του ατμοσφαιρικού οξυγόνου από την εστία της φωτιάς. Ωστόσο, σε υψηλές θερμοκρασίες μπορεί να αναχθεί από άνθρακα προς CO. Επίσης, μπορεί να αναχθεί πλήρως προς άνθρακα από δραστικά μέταλλα, γεγονός που το καθιστά ακατάλληλο για την πυρόσβεση πυρκαγιών οφειλόμενων στην ανάφλεξη δραστικών μετάλλων (αλκαλίων, γαιαλκαλίων). Για παράδειγμα, έλασμα μαγνησίου καιόμενο στην ατμόσφαιρα, θα συνεχίσει να καίγεται και σε ατμόσφαιρα CO2 παράγοντας αιθάλη, ένα συνηθισμένο και εντυπωσιακό πείραμα επίδειξης της αναγωγικής δραστικότητας του μαγνησίου, ενώ το αργίλιο αντιδρά με το CO2 σε υψηλή θερμοκρασία παρέχοντας καρβίδιο:
CO2 + C
![]() 2 CO
CO2 + 2Mg
2 CO
CO2 + 2Mg
![]() MgO + C 3CO2
+ 8Al
MgO + C 3CO2
+ 8Al
![]() Al4C3 + 2Al2O3
Al4C3 + 2Al2O3
To CO2
ως ανυδρίτης του ανθρακικού οξέος.
Το διοξείδιο του άνθρακα είναι όξινο οξείδιο, ανυδρίτης του ανθρακικού
οξέος (CO2
+ H2O
![]() Η2CΟ3),
ενός οξέος το οποίο "παραδοσιακά" θεωρείται ως τυπικό παράδειγμα ασθενούς διβασικού ανόργανου οξέος. Ωστόσο, στην πραγματικότητα το ανθρακικό οξύ είναι
πολύ ισχυρότερο απ' όσο παλαιότερα πίστευαν. Η πραγματική ισχύς του το
κατατάσσει στα μετρίως ισχυρά οξέα, αφού είναι ισχυρότερο από το οξικό οξύ
κατά περίπου μία τάξη μεγέθους.
Η2CΟ3),
ενός οξέος το οποίο "παραδοσιακά" θεωρείται ως τυπικό παράδειγμα ασθενούς διβασικού ανόργανου οξέος. Ωστόσο, στην πραγματικότητα το ανθρακικό οξύ είναι
πολύ ισχυρότερο απ' όσο παλαιότερα πίστευαν. Η πραγματική ισχύς του το
κατατάσσει στα μετρίως ισχυρά οξέα, αφού είναι ισχυρότερο από το οξικό οξύ
κατά περίπου μία τάξη μεγέθους.
Το ανθρακικό οξύ κατατασσόταν στα ασθενή οξέα, επειδή, για τον υπολογισμό της ισχύος του, θεωρείτο ότι η συνολική ποσότητα του διαλυμένου στο ύδωρ CO2 μετατρεπόταν σε H2CO3, το οποίο στη συνέχεια υφίστατο μερική διάσταση. Ωστόσο, στην πραγματικότητα, όπως καταφαίνεται από την ισορροπία εφυδάτωσής του, μικρό μόνο κλάσμα του CO2 εφυδατώνεται προς H2CO3 (περίπου το 1/600), επομένως η έστω και ασθενής οξύτητα υδατικών διαλυμάτων CO2 οφείλεται σε ένα κατά πολύ αραιότερο διάλυμα ανθρακικού οξέος.
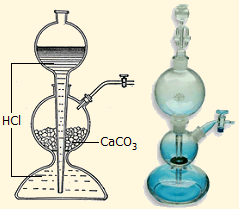
Οι ισορροπίες που υφίστανται σε υδατικό διάλυμα CΟ2 είναι η ισορροπία εφυδάτωσής του προς ανθρακικό οξύ (1) και οι δύο διαστάσεις του ανθρακικού οξέος (2, 3):
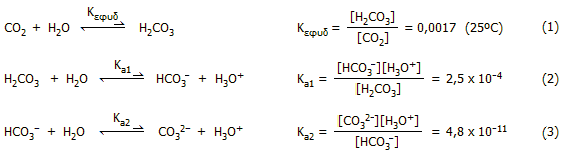
Αν προστεθεί η ισορροπία (1) στην (2) προκύπτει η ολική ισορροπία (4) η σταθερά της οποίας υπολογίζεται από το γινόμενο των εκφράσεων ισορροπίας των (1) και (2):
![]()
Με βάση τις προηγούμενες εξισώσεις, είναι δυνατόν να εξαχθούν εκφράσεις που αποδίδουν τα κλάσματα [''συναρτήσεις άλφα, (α = φ(pH)''] της συγκέντρωσης κάθε σωματιδίου ανθρακικού οξέος/CO2 ως προς την ολική συγκέντρωση του CO2 (σε κάθε του μορφή), που αντιστοιχούν στην καθεμία από τις τέσσερις μορφές, ως συναρτήσεις του pH, δηλ. οι λόγοι:
![]()
Τα διαγράμματα των "συναρτήσεων α" στη γραμμική και λογαριθμική μορφή τους (Bjerrum plots) δίνονται παρακάτω.
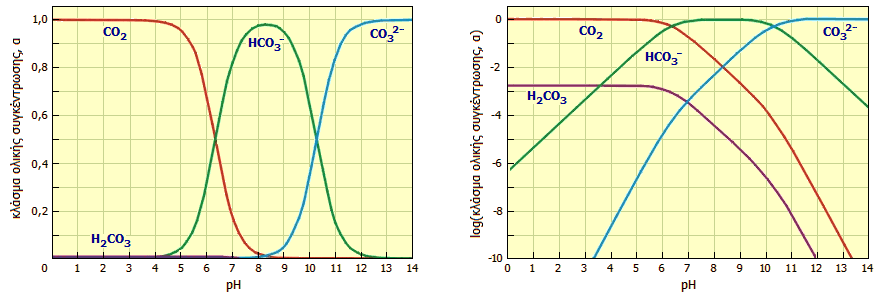
|
Σωματιδιακή κατανομή των διαφόρων μορφών που αποκτά το CO2 σε υδατικά διαλύματα, ως συνάρτηση του pH. Αριστερά: Γραμμικό διάγραμμα. Δεξιά: Λογαριθμικό διάγραμμα. Από το αριστερό διάγραμμα φαίνεται ότι το κλάσμα α, που αντιστοιχεί στο αδιάστατο Η2CO3 είναι αμελητέο και οι τιμές του μπορούν εκτιμηθούν καλύτερα από το λογαριθμικό διάγραμμα δεξιά. Από τα διαγράμματα αυτά φαίνεται ότι σε pH 7,3-7,4 (pH του πλάσματος του αίματος), περίπου το 90% του ολικού διοξειδίου του άνθρακος βρίσκεται στη μορφή όξινων ανθρακικών ιόντων και το 10% στη μορφή CO2. |
Θα πρέπει να σημειωθεί ότι η αποκατάσταση της ισορροπίας εφυδάτωσης του CO2 προς ανθρακικό οξύ (εξίσωση 1) είναι σχετικώς βραδεία (απαιτούνται αρκετά δευτερόλεπτα για να σχηματισθεί ανθρακικό οξύ από το CO2). Συγκεκριμένα, στους 25ºC, οι σταθερές ταχύτητας της ορθής και της αντίστροφης φοράς στους είναι:
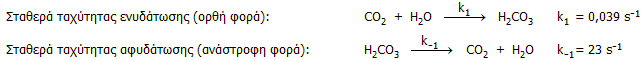
Η ταχεία αποκατάσταση της ισορροπίας ενυδάτωσης/εφυδάτωσης έχει ιδιαίτερη βιοχημική σημασία (οξεοβασική ισορροπία και αποβολή CO2 από τον ζωικό οργανισμό) και καταλύεται από μια οικογένεια ψευδαργυρούχων ενζύμων, γνωστών ως ανθρακικές ανυδράσες (carbonic anhydrases), που βρίσκονται κυρίως στα ερυθρά αιμοσφαίρια.
|
|
 |
|
|
Αριστερά: Θόλωση διαυγούς αρχικά διαλύματος Ca(OH)2 μετά από εμφύσηση εκπνεόμενου αέρα (πλούσιου σε CO2) λόγω σχηματισμού δυσδιάλυτου CaCO3. Μέσον: Σταλακτίτες και σταλαγμίτες. Το κλασικό παράδειγμα φυσικού αποτελέσματος της αντιστρεπτής αντίδρασης ανθρακικού ασβεστίου με πλούσια σε CO2 υπόγεια ύδατα. Το ελαφρά κοκκινωπό χρώμα τους οφείλεται σε μικροποσότητες σιδήρου που ακολουθούν την ίδια πορεία με εκείνη του ασβεστίου. Δεξιά: Σωλήνας ύδρευσης σχεδόν αποφραγμένος από αποθέσεις (scales) ανθρακικού ασβεστίου. Ο σχηματισμός τους είναι ανάλογος με εκείνο του σχηματισμού σταλακτιτών. Σταδιακή απόθεση CaCO3 λόγω διάσπασης του διαλυτού Ca(HCO3)2, κανονικού συστατικού του φυσικού ύδατος. |
||
'Αλατα ανθρακικού οξέος. Ως όξινο οξείδιο, το CO2 αντιδρά με βάσεις ή ανυδρίτες βάσεων σχηματίζοντας ανθρακικά άλατα. 'Ολα τα ουδέτερα άλατα του ανθρακικού οξέος είναι δυσδιάλυτα με εξαίρεση τα ανθρακικά άλατα των αλκαλιμετάλλων, από τα οποία το Li2CO3 είναι το λιγότερο διαλυτό με διαλυτότητα 1,3 g/100 mL στους 20ºC. Πολλά ανθρακικά άλατα (ιδιαίτερα των πολυσθενών μετάλλων) δεν είναι απομονώσιμα και λαμβάνονται μόνο υπό τη μορφή βασικών μικτών αλάτων ποικίλης σύνθεσης.
Σε κάποιες περιπτώσεις τα ανθρακικά ιόντα δρουν ως υποκαταστάτης και σχηματίζουν ανθρακικά σύμπλοκα, από τα οποία τα πιο γνωστά είναι τα ανθρακικά ανιοντικά σύμπλοκα του ουρανίου (και συγκεκριμένα του οξοκατιόντος ουρανυλίου), όπως π.χ. τα UO2(CO3)22-, UO2(CO3)34-. Η ιδιότητα του ουρανίου να σχηματίζει αυτά τα ανιοντικά σύμπλοκα αξιοποιείται κατά τη διαδικασία παραλαβής του ουρανίου από τα ορυκτά του και καθαρισμού του [Αναφ. 4ιβ]. Επίσης, το όξινο ανθρακικό νάτριο (NaHCO3) έχει προταθεί ως αντίδοτο σε περιπτώσεις οξείας δηλητηρίασης από ενώσεις ουρανίου [Αναφ. 4ιγ].
Κατά τη διοχέτευση περίσσειας CO2 μέσω διαλυμάτων βάσεων ή διαλυτών ανθρακικών αλάτων, αλλά ακόμη και μέσω αιωρημάτων δυσδιάλυτων ανθρακικών αλάτων σχηματίζονται όξινα ανθρακικά άλατα.
Σε αντίθεση με τα ουδέτερα ανθρακικά άλατα, τα όξινα ανθρακικά άλατα είναι στο σύνολό τους ευδιάλυτα, αλλά δεν είναι απομονώσιμα σε στερεά κατάσταση με εξαίρεση τα όξινα ανθρακικά άλατα των αλκαλιμετάλλων, επειδή χάνουν εύκολα CO2 μεταπίπτοντας στα δυσδιάλυτα ουδέτερα.
2NaOH + CO2
![]() Na2CO3 + CO2 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 Na2CO3 + CO2 + H2O
![]() 2NaHCO3 + H2O
2NaHCO3 + H2O
Ca(OH)2
+ CO2
![]() CaCO3 + H2O
CaCO3 + H2O
Ο σχηματισμός σταλακτιτών και σταλαγμιτών σε σπήλαια, αποτελεί κλασικό παράδειγμα της αντιστρεπτότητας της ισορροπίας ανθρακικών/όξινων ανθρακικών αλάτων. Τα πλούσια σε CO2 υπόγεια ύδατα προκαλούν μια βραδεία διαλυτοποίηση (διάβρωση) των ασβεστολιθικών πετρωμάτων, μετατρέποντας το αδιάλυτο ανθρακικό ασβέστιο (και μικρότερων ποσοτήτων ανθρακικών αλάτων άλλων μετάλλων) σε ευδιάλυτο όξινο ανθρακικό άλας σύμφωνα με την αντίδραση:
CaCO3
+ CO2
+ H2O
![]() Ca(HCO3)2
Ca(HCO3)2
Τα πλούσια σε CO2 υδατικά διαλύματα όξινου ανθρακικού ασβεστίου κατά την εκροή τους στις οροφές των σπηλαίων ερχόμενα σε επαφή με την ατμόσφαιρα χάνουν το περισσότερο CO2 και η προηγούμενη αντίδραση αντιστρέφεται με αποτέλεσμα τον σταδιακό επανασχηματισμό ανθρακικού ασβεστίου στη συνεκτική μορφή των σταλακτιτών και σταλαγμιτών:
Ca(HCO3)2
![]() CaCO3
+ CO2
+ H2O
CaCO3
+ CO2
+ H2O
|
Συστήματα δέσμευσης του CO2 [Αναφ. 5]
Ιδιαίτερη σημασία σε πολλούς τομείς της επιστήμης, της ιατρικής και της τεχνολογίας έχει η δέσμευση του CO2 (CO2 scrubbing). Η ευκολία με την οποία δεσμεύεται το CO2 από τις βάσεις αξιοποιείται στα εργαστήρια για τη δέσμευση του CO2 από μίγματα αερίων, για την απαλλαγή από CO2 της ατμόσφαιρα περιορισμένων χώρων (π.χ. υποβρυχίων, καταδυτικών κωδώνων, διαστημικών οχημάτων), όπως και για τη δέσμευση του CO2 της εκπνοής των χειρουργούμενων στα επανακυκλοφορούντα αέρια νάρκωσης κατά τη διάρκεια χειρουργικών επεμβάσεων. Το κυριότερο υλικό για τη δέσμευση του CO2 είναι ένα κοκκώδες υλικό γνωστό ως νατράσβεστος (soda lime) με τυπική σύνθεση: Ca(OH)2 75%, NaOH 3%, KOH 1% (το υπόλοιπο: Η2Ο), το οποίο διατίθεται στο εμπόριο σε διάφορες ποιότητες (μέγεθος κόκκου, με δείκτη ή χωρίς δείκτη κ.α.). Στη διαστημική τεχνολογία ως δεσμευτικό σε πολλές περιπτώσεις χρησιμοποιείται το LiOH, το οποίο λόγω του μικρού μοριακού βάρους του διαθέτει μεγαλύτερη δεσμευτική ικανότητα CO2 ανά μονάδα βάρους, χαρακτηριστικό ιδιαίτερα επιθυμητό για τις διαστημικές αποστολές. Στις αποστολές Soyuz χρησιμοποιήθηκε με επιτυχία το σουπεροξείδιο του καλίου (ΚΟ2), το οποίο δεσμεύει το CO2 αποδίδοντας οξυγόνο σύμφωνα με την αντίδραση:
4 KO2
+ 4 CO2
+ 2 H2O
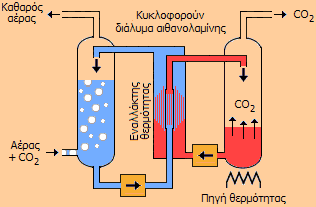
'Ενα αναγεννούμενο σύστημα δέσμευσης CO2 (regenerative CO2 scrubber) βασίζεται στην αντίδραση του CO2 με σχετικώς πυκνά διαλύματα μη πτητικών ασθενών οργανικών βάσεων (κυρίως χρησιμοποιείται αιθανολαμίνη). Στη συνέχεια το διάλυμα αυτό μεταφέρεται σε ξεχωριστό χώρο εκτός θαλάμου, όπου θερμαίνεται και αποβάλει το δεσμευμένο CO2. Στη συνέχεια το ίδιο διάλυμα ξαναχρησιμοποιείται. Η διαδικασία μπορεί να είναι συνεχής με κατάλληλο σύστημα κυκλοφορητών:
Το ίδιο αναγεννούμενο σύστημα χρησιμοποιείται σε μεγάλη κλίμακα σε βιομηχανικές εγκαταστάσεις για τη δέσμευση CO2, αλλά και άλλων ανεπιθύμητων αερίων, όπως το H2S και το SO2 που σχηματίζουν διαλυόμενα στο νερό ασθενή οξέα. Παρόμοιο σύστημα χρησιμοποιείται για την "εξυγίανση" του αέρα κλειστών χώρων, όπου εργάζονται πολλοί άνθρωποι και η ανανέωση του αέρα με εξωτερικό δεν ενδείκνυται για ενεργειακούς λόγους (π.χ. σε εξαιρετικώς ψυχρά κλίματα). |
Το CO2 στην οργανική σύνθεση. To CO2 έχει εξαιρετικά περιορισμένες εφαρμογές ως συνθετικό αντιδραστήριο στην οργανική σύνθεση. Πρόκειται για μόριο ενεργειακά "τακτοποιημένο" (σταθερότατο) και απαιτείται πολλή ενέργεια για να "ανοίξουν" οι ισχυροί δεσμοί C=O. Μια από τις λίγες συνθέσεις, όπου χρησιμοποιείται ως αντιδρών είναι η βιομηχανική σύνθεση του σαλικυλικού οξέος, η οποία βασίζεται στην αντίδραση φαινολικού νατρίου με CO2 στους 125ºC και πίεση 100 atm (αντίδραση Kolbe-Shmidt):
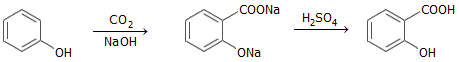
Επίσης, μεγάλες ποσότητες CO2 χρησιμοποιούνται για τη σύνθεση ουρίας μέσω καρβαμιδικού αμμωνίου. Η σύνθεση αυτή πραγματοποιείται παράλληλα με τη σύνθεση αμμωνίας από φυσικό αέριο, όπου το CO2 αποτελεί ούτως ή άλλως το κύριο παραπροϊόν (βλ. Χημική ένωση του μήνα: Αμμωνία). Η ουρία είναι προϊόν που χρησιμοποιείται σε λιπάσματα, όπως και στη σύνθεση πλαστικών:
![]()
Μια άλλη κλασική αντίδραση του CO2 είναι η πυρηνόφιλη προσθήκη οργανομεταλλικών ενώσεων στο CO2 με σχηματισμό καρβοξυλικών οξέων, όπου το CO2 συμπεριφέρεται ως δικαρβονυλική ένωση (Ο=C=O). Τυπικά παραδείγματα αποτελούν οι αντιδράσεις του με οργανομαγνησιακές ενώσεις (αντιδραστήρια Grignard) και οργανολιθιακές ενώσεις σε αιθερικά (διαιθυλαιθέρας, τετραϋδροφούρανιο) και τελείως άνυδρα διαλύματα, π.χ.
CH3MgI + CO2
![]() CH3COOMgI
CH3COOMgI
![]() CH3COOH
κ-C4Η9Li + CO2
CH3COOH
κ-C4Η9Li + CO2
![]() κ-C4Η9COOLi
κ-C4Η9COOLi
![]() κ-C4Η9COOH
κ-C4Η9COOH
Οι παραπάνω αντιδράσεις έχουν πρακτική σημασία περισσότερο στην παρασκευή ραδιοεπισημασμένων καρβοξυλικών οξέων (με χρήση 14CO2) με 14C στην καρβοξυλική ομάδα τους.
Το 14CO2
παρασκευάζεται με σχετική
ευκολία με βομβαρδισμό νιτρικών αλάτων με νετρόνια σε πυρηνικό
αντιδραστήρα: 14Ν + n
![]() 14C + p. Παραλαμβάνεται με ρεύμα αδρανούς
αερίου και
διέρχεται μέσω διαλύματος Ba(OH)2,
οπότε παρέχει απομονώσιμο ίζημα Ba14CO3.
Αυτό το ραδιοεπισημασμένο ανθρακικό άλας του βαρίου αποτελεί την "πρώτη ύλη" για τη σύνθεση όλων των ραδιοεπισημασμένων
με 14-C
οργανικών ενώσεων με
αντιδράσεις όπως οι παρακάτω, από τα προϊόντα
των οποίων
μπορεί να προκύψει ακόμη μεγαλύτερος αριθμός ραδιοεπισημασμένων ενώσεων
[Αναφ.
1δ, 4θ]:
14C + p. Παραλαμβάνεται με ρεύμα αδρανούς
αερίου και
διέρχεται μέσω διαλύματος Ba(OH)2,
οπότε παρέχει απομονώσιμο ίζημα Ba14CO3.
Αυτό το ραδιοεπισημασμένο ανθρακικό άλας του βαρίου αποτελεί την "πρώτη ύλη" για τη σύνθεση όλων των ραδιοεπισημασμένων
με 14-C
οργανικών ενώσεων με
αντιδράσεις όπως οι παρακάτω, από τα προϊόντα
των οποίων
μπορεί να προκύψει ακόμη μεγαλύτερος αριθμός ραδιοεπισημασμένων ενώσεων
[Αναφ.
1δ, 4θ]:
NaH14CO3
+ H2/Pd/C
![]() H14COOH
14CO2 + LiAlH4
H14COOH
14CO2 + LiAlH4
![]() 14CH3OH
Ba14CO3 + Ba
14CH3OH
Ba14CO3 + Ba
![]() Ba14C2
Ba14C2
![]() 14C2H2
14C2H2
Ηλεκτροχημική αναγωγή του CO2. Το πρόβλημα της δέσμευσης (sequestration) του CO2 (συζητείται εκτενέστερα παρακάτω) έχει στρέψει κατά τα τελευταία 20-30 χρόνια πολλές ερευνητικές ομάδες στην αναζήτηση τρόπων αναγωγής του CO2 προς άλλες χρήσιμες ενώσεις, όπως μεθανόλη, μυρμηκικό και οξαλικό οξύ, αλλά και άλλες ενώσεις με βάση τις συνολικές ηλεκτροδιακές αντιδράσεις:
CO2 + 6H+ + 6e-
![]() CH3OH + H2O
CO2 + 2H+ + 2e-
CH3OH + H2O
CO2 + 2H+ + 2e-
![]() HCOOH 2CO2 + 2H+ + 2e-
HCOOH 2CO2 + 2H+ + 2e-
![]() (COOH)2
(COOH)2
Τα μέχρι σήμερα αποτελέσματα είναι μάλλον πενιχρά, οι αποδόσεις που έχουν επιτευχθεί είναι μικρές και η έρευνα συνεχίζεται προς αναζήτηση αποτελεσματικότερων υλικών ηλεκτροδίων και καταλυτών [Αναφ. 4ι, 4ια]. Το ενδιαφέρον στρέφεται ιδιαίτερα στα συστήματα εκείνα, όπου η ηλιακή ακτινοβολία αξιοποιείται ως πηγή ενέργειας.
|
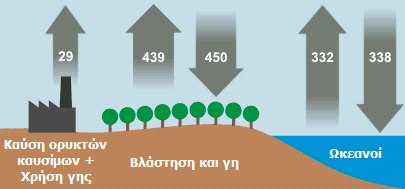
Οι αριθμοί αντιπροσωπεύουν τους γιγατόνους (1 Gt = 1012 kg) CO2 που διακινούνται ετησίως κατά τον κύκλο του άνθρακα. 'Οπως φαίνεται η συνεισφορά των ανθρωπογενών πηγών (καύσεις ορυκτών καυσίμων/χρήση γης) αποτελεί μικρό κλάσμα [πηγή]. |
Ο βιογεωχημικός κύκλος του άνθρακα
Ο κύκλος του άνθρακα (carbon cycle) έχει ως κεντρικό σημείο του τη δέσμευση του CO2 από τους χερσαίους και υδάτινους φωτοσυνθετικούς οργανισμούς. Στη συνέχεια, αφού επιτελείται η μετατροπή του σε διάφορες οργανικές ενώσεις, από κει και πέρα διακινείται μέσα στα τροφικά δίκτυα και επανεκλύεται ως CO2 μέσω της αναπνοής ζώων, φυτών και μικροοργανισμών (κάποιοι οργανισμοί αποσυνθέτουν νεκρούς ζωικούς και φυτικούς ιστούς και κλείνουν τον κύκλο).
Ο κύκλος του άνθρακα χαρακτηρίζεται ως ο "τελειότερος" από τους βιογεωχημικούς κύκλους, λόγω της μεγάλης ταχύτητας με την οποία μεταπίπτει ο άνθρακας από την ανόργανη κατάστασή του (CO2) σε οργανική ύλη και σε βιομόρια ζωντανών οργανισμών, διακινούμενος σε ολόκληρη τη βιόσφαιρα της Γης.
Όπως φαίνεται από το παραπλεύρως σχήμα υπάρχει μια ευαίσθητη ισορροπία μεταξύ πηγών και αποδεκτών CO2 (Οι αριθμητικές εκτιμήσεις ποικίλουν και οι αναφερόμενες στο σχήμα έχουν περισσότερο ενδεικτική σημασία και αφορούν τη συγκεκριμένη πηγή πληροφορίας). Αν και οι 29 γιγατόνοι ανθρωπογενούς CO2 αποτελούν μικρό μόλις κλάσμα στο σύνολο των παραγόμενων 800 γιγατόνων CO2 (κατ' εκτίμηση πάντοτε), είναι αυτοί που δημιουργούν ένα πλεόνασμα 12 γιγατόνων, που δεν απορροφάται από τους αποδέκτες και είναι υπεύθυνο για τη σταδιακή αύξηση του ατμοσφαιρικού CO2.
To ατμοσφαιρικό διοξείδιο του άνθρακα κατά τα τελευταία 250 χρόνια - Φαινόμενο θερμοκηπίου
Από την εποχή της βιομηχανικής επανάστασης (έναρξη: μέσα 18ου αιώνα με επίκεντρο την Αγγλία), οι άνθρωποι ξεκίνησαν να χρησιμοποιούν ενεργειακά ορυκτά καύσιμα σε τεράστιες ποσότητες στα εργοστάσια, για την παραγωγή ενέργειας, για την κίνηση οχημάτων και για τη θέρμανση των κατοικιών τους. Ωστόσο, η καύση των ορυκτών καυσίμων απελευθερώνει CO2 και άλλα αέρια με αποτέλεσμα τη συσσώρευσή τους στην ατμόσφαιρα της Γης. Ταυτόχρονα, λόγω της συνεχιζόμενης αποψίλωσης των δασών, μειώνεται η δυνατότητα δέσμευσης του CO2 μέσω της φωτοσυνθετικής πορείας.
Από το: Χημική ένωση του μήνα: Εξαφθοριούχο θείο. |
||||||||||||||||||||||||
Η αύξηση της συγκέντρωσης του CO2 στην ατμόσφαιρα περιορίζει τη δυνατότητα ανάκλασης της θερμότητας της ηλιακής ακτινοβολίας υπό τη μορφή υπέρυθρης ακτινοβολίας, αφού μέρος της δεσμεύεται από τα μόρια του CO2 με αποτέλεσμα τη θέρμανση της ατμόσφαιρας, φαινόμενο που είναι γνωστό ως φαινομένο του θερμοκηπίου (greenhouse effect). Με άλλα λόγια το CO2 δρα όπως τα υάλινα τοιχώματα του θερμοκηπίου. Η αύξηση της μέσης θερμοκρασίας της ατμόσφαιρας της Γης οδηγεί στην κλιματική αλλαγή και στην επιδείνωση μετεωρολογικών φαινομένων, όπως αλλοπρόσαλλες θερμοκρασιακές μεταβολές, τυφώνες, πλημμύρες και τήξη των πάγων στους πόλους. Η τελευταία επιφέρει επιπλέον μείωση της ανακλαστικής ικανότητας της Γης και επομένως περαιτέρω επιδείνωση των φαινομένων.
Το CO2 είναι το σημαντικότερο από τα ανθρωπογενή αέρια που προκαλούν την υπερθέρμανση του πλανήτη και προέρχεται από την ανεξέλεγκτη καύση των ορυκτών καυσίμων. 'Αλλα αέρια είναι το μεθάνιο (CH4), το υποξείδιο του αζώτου (N2O) τα οποία προέρχονται κυρίως από γεωργικές, αλλά και από βιομηχανικές δραστηριότητες (βλέπε χημικές ενώσεις του μήνα: Μεθάνιο, Υποξείδιο του αζώτου). Επιπλέον, τρία συνθετικά χημικά αέρια: οι φθοριωμένοι υδρογονάνθρακες (HFCs), οι υπερφθοράνθρακες (PFCs) και το εξαφθοριούχο θείο (SF6), τα οποία ουσιαστικά στο σύνολό τους παράγονται από βιομηχανικές διεργασίες, συμβάλλουν σε μικρότερο βαθμό στο φαινόμενο του θερμοκηπίου.
Ο έλεγχος αυτών των έξι αερίων του θερμοκηπίου είναι το αντικείμενο της συμφωνίας του πρωτοκόλλου, που υπογράφηκε στο Kyoto της Ιαπωνίας στις 11 Δεκεμβρίου 1997 και άρχισε να εφαρμόζεται στις 16 Φεβρουαρίου 2005.
 |
 |
|
|
Svante Arrhenius (1859-1927). Ο διάσημος Σουηδός χημικός που τιμήθηκε με το Nobel Χημείας του 1903 για τη θεωρία του περί ηλεκτρολυτικής διάστασης, ήταν ο πρώτος που υπολόγισε τις επιπτώσεις του ανθρωπογενούς CO2 στην αύξηση της θερμοκρασίας της ατμόσφαιρας. |
To φάσμα υπερύθρου του CO2. Στις δονήσεις ασύμμετρης τάσης και της ψαλιδοειδούς κάμψης οφείλεται η ικανότητα απορρόφησης υπέρυθρης ακτινοβολίας από το CO2 και (σε τελική ανάλυση) η συμβολή του CO2 στο φαινόμενο του θερμοκηπίου. Η δόνηση συμμετρικής τάσης δεν απορροφά δεδομένου ότι δεν επιφέρει μεταβολή της διπολικής ροπής του μορίου, που αποτελεί απαραίτητη προϋπόθεση για να υπάρξει απορρόφηση στην περιοχή υπερύθρου. |
Τα κράτη που έχουν συνυπογράψει το Πρωτόκολλο του Kyoto δεσμεύονται να ελαττώσουν τις εκπομπές αερίων του θερμοκηπίου την πρώτη περίοδο ανάληψης υποχρεώσεων (2008-2012) κατά ένα συγκεκριμένο στόχο σε σχέση με τις εκπομπές του 1990.
Για περισσότερες πληροφορίες πάνω στο φαινόμενο θερμοκηπίου, όπως και τη συνεισφορά του κάθε αερίου στο φαινόμενο της υπερθέρμανσης της ατμόσφαιρας, βλέπε Χημική ένωση του μήνα: Εξαφθοριούχο θείο.
Περιεκτικότητα της ατμόσφαιρας σε CO2. Συνολικά, η συγκέντρωση του CO2 στην ατμόσφαιρα έχει αυξηθεί κατά 31% και πλέον από το 1750, δηλαδή από την έναρξη της Βιομηχανικής Επανάστασης. Οι εκπομπές του CO2 είναι περίπου 12 φορές υψηλότερες σε σχέση με εκείνες του 1900, καθώς οι ανθρώπινες κοινωνίες ανά την υφήλιο καίνε συνεχώς αυξανόμενες ποσότητες γαιάνθρακα, πετρελαίου και φυσικού αερίου για την παραγωγή ενέργειας.
Δεδομένα από το World Resources Institute δείχνουν ότι οι ανθρώπινες δραστηριότητες έχουν προσθέσει στην ατμόσφαιρα 2,3 τρισεκατομμύρια τόνους CO2 τα τελευταία 200 χρόνια. Η μεγαλύτερη αύξηση στις εκπομπές του CO2 παρουσιάστηκε το 2004 (προστέθηκαν στην ατμόσφαιρα πάνω από 28 εκατομμύρια τόνοι CO2).
Το CO2 στη γήινη ατμόσφαιρα θεωρείται "ιχνοσυστατικό", με μέση συγκέντρωση που έφθασε πλέον τα 400 ppm. Η συνολική μάζα των ατμοσφαιρικών εκπομπών CO2 έχει εκτιμηθεί στην ποσότητα των περίπου 3×1015 kg (3000 γιγατόνοι).
Η συγκέντρωση CO2 κυμαίνεται εποχικά ως αποτέλεσμα της ασύμμετρης εποχικής ανάπτυξης των φυτών μεταξύ Βορείου (μεγαλύτερες εκτάσεις βλάστησης) και Νοτίου Ημισφαίριου (μικρότερες εκτάσεις βλάστησης). Στις αστικές περιοχές οι συγκεντρώσεις είναι γενικά υψηλότερες, μπορεί και κατά 50% σε σχέση με εκείνες της υπαίθρου.
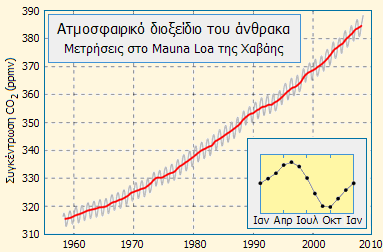
Η Εθνική Υπηρεσία Ωκεανών και Ατμόσφαιρας (National Oceanic and Atmospheric Administration, NOAA) των ΗΠΑ έχει εγκαταστήσει από το 1958 στο όρος Mauna Loa της Χαβάης (σε υψόμετρο 3400 m) διάταξη ακριβέστατων μετρήσεων των συγκεντρώσεων του ατμοσφαιρικού CO2. Οι μετρήσεις αυτές πραγματοποιούνται με βάση μετρήσεις απορρόφησης υπέρυθρης ακτινοβολίας, αποτελούν εδώ και πέντε δεκαετίες τον αρχαιότερο και το πλέον αξιόπιστο "οδηγό" σε παγκόσμιο επίπεδο ως προς τη συγκέντρωση του CO2 στην ατμόσφαιρα. Οι μετρήσεις στο ύψος αυτό παρέχουν αξιόπιστες τιμές του "υποβάθρου" CO2, αφού είναι απαλλαγμένες από διακυμάνσεις και εξάρσεις οφειλόμενες σε διάφορες δραστηριότητες ανθρωπογενούς προέλευσης (π.χ. βιομηχανικές εκπομπές, καυσαέρια).
Ο ρυθμός αύξησης των συγκεντρώσεων CO2 συνεχώς αυξάνει, καθώς η μέση ετήσια αύξηση των 0,7 ppm της δεκαετίας του 1960, έχει φτάσει (2012) σε στην τιμή των 2,1 ppm. Οι μετρήσεις του Μαΐου 2013 έδειξαν ότι η συγκέντρωση του CO2 στην ατμόσφαιρα αγγίζει πλέον τα 400 ppm: στις 9 Μαΐου ήταν 399,89 ppm, ενώ στις 11 Μαΐου 399,46 ppm. Σύμφωνα με τα στελέχη της ΝΟΑΑ πρόκειται για τις υψηλότερες συγκεντρώσεις CO2 στην ατμόσφαιρα εδώ και 3 εκατομμύρια έτη. Στις 12 Μαρτίου 2014 η συγκέντρωση του CO2 υπερέβη για πρώτη φορά το "ψυχολογικό όριο των 400 ppm" για πρώτη φορά εδώ και χιλιάδες χρόνια [Αναφ. 7δ].
 |
 |
 |
|
Αριστερά: Το αστεροσκοπείο του όρους Mauna Loa της Χαβάης (υψόμετρο 3400 m), όπου λαμβάνονται σε καθημερινή και ωριαία βάση ακριβέστατες μετρήσεις του ατμοσφαιρικού CO2. Μέσον: Η καμπύλη της συγκέντρωσης του ατμοσφαιρικού CO2 με βάση τις μετρήσεις στο Mauna Loa, όπου φαίνεται η εποχιακή διακύμανση λόγω του κύκλου βλάστησης στο Βόρειο ημισφαίριο, που δεν αντισταθμίζεται από τον αντίστοιχο κύκλο βλάστησης του Νοτίου Ημισφαιρίου (μεγαλύτερες εκτάσεις βλάστησης στο Βόρειο Ημισφαίριο, αλλά και περιορισμένη αναμιξιμότητα των ατμοσφαιρών των δύο ημισφαιρίων). Αξίζει να σημειωθεί ότι αυτή η εποχιακή διακύμανση είναι κατά πολύ εντονότερη στο Βόρειο Ημισφαίριο παρά στο Νότιο ημισφαίριο [Αναφ. 7ε]. Η καμπύλη αυτή είναι γνωστή πλέον ως καμπύλη Keeling προς τιμή του Αμερικανού Charles David Keeling (1928-2005) (δεξιά) του επιστήμονα, που αφιέρωσε τη ζωή του στην παρακολούθηση της αυξητικής τάσης του CO2 και επισήμανε τους κινδύνους για την ανθρωπότητα από τις επερχόμενες κλιματικές μεταβολές. Περισσότερες πληροφορίες για το θέμα της παρακολούθησης του ατμοσφαιρικού CO2 μπορούν να αναζητηθούν εδώ. Λεπτομέρειες για τον τρόπο μέτρησης του CO2 στο Mauna Loa (με μετρήσεις απορρόφησης στο υπέρυθρο) μπορούν να αναζητηθούν εδώ. Οι καθημερινές μετρήσεις του CO2 μπορούν να αναζητηθούν εδώ (π.χ. 1ης Μαΐου 2014: 401,44 ppm). Σήμερα, το CO2 της ατμόσφαιρας παρακολουθείται από σχεδόν 100 σταθμούς σε όλον τον κόσμο [Αναφ. 7στ]. |
||
|
Πειράματα Tyndall - Απορρόφηση της υπέρυθρης ακτινοβολίας από το CO2 [Αναφ. 6]
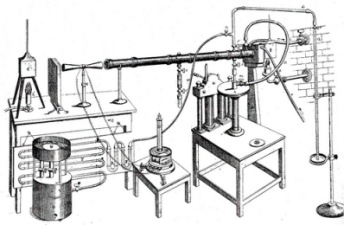
Το 1859, ο 'Αγγλος φυσικός John Tyndall (1820-1893) υπήρξε ο πρώτος που εξέτασε τη σχετική ικανότητα διαφόρων αερίων, όπως το διοξείδιο του άνθρακα, το άζωτο, το οξυγόνο, το μεθάνιο, το όζον κ.α., να απορροφούν την υπέρυθρη ακτινοβολία. Για την πραγματοποίηση αυτής της μελέτης ο Tyndall αξιοποίησε τις δυνατότητες του ενός νέου (τότε) ανιχνευτή υπέρυθρης ακτινοβολίας, της θερμοηλεκτρικής στήλης (thermopile) (θερμοζεύγη συνδεδεμένα σε σειρά). Για τις μετρήσεις αυτές, ο Tyndall έπρεπε να αντιμετωπίσει πολλές πειραματικές δυσκολίες, όπως την ευαισθησία του χρησιμοποιούμενου γαλβανομέτρου (στο σχήμα: το όργανο στο μικρό τραπέζι), αλλά και το είδος των "παραθύρων", που έπρεπε να χρησιμοποιήσει στο σωλήνα. Τελικά χρησιμοποίησε "παράθυρα" από ορυκτό αλάτι (NaCl), που είναι "διαφανές" ως προς την υπέρυθρη ακτινοβολία σε αντίθεση με την ύαλο. Πρώτος ο Tyndall ερμήνευσε τη θέρμανση της ατμόσφαιρας της Γης με βάση τη δυνατότητα των διαφόρων αερίων να απορροφούν την ακτινοβολούμενη θερμότητα (radiant heat, όπως αναφερόταν τότε η υπέρυθρη ακτινοβολία) και κυρίως των ατμών ύδατος, που όπως διαπίστωσε απορροφούσαν εντονότερα από κάθε άλλο αέριο απ' όσα δοκίμασε. Αντίθετα, αέρια όπως το υδρογόνο, το οξυγόνο και το άζωτο τα χαρακτήρισε ως "τελείως διαφανή" (και πράγματι δεν παρουσιάζουν καμία απορρόφηση στο υπέρυθρο). Σήμερα οι μετρήσεις του διοξειδίου του άνθρακα, αλλά και άλλων αερίων (π.χ. το μονοξείδιο του άνθρακα στα καυσαέρια αυτοκινήτων) βασίζονται σε συσκευές που λειτουργούν με βάση τις ίδιες αρχές στις οποίες βασίζονταν τα πειράματα του Tyndall. Μετρήσεις του CO2 στο Mauna Loa [Αναφ. 7] Οι μετρήσεις βασίζονται στην ιδιότητα του CO2 να απορροφά στην υπέρυθρη περιοχή του φάσματος. Ο αέρας αντλείται μέσω συστήματος ψυχρών παγίδων για τη δέσμευση της υγρασίας (που επίσης απορροφά στο υπέρυθρο). Στη συνέχεια ο αέρας εισέρχεται σε μια κυλινδρική κυψέλη με επίπεδα "παράθυρα" διαφανή στο υπέρυθρο στα δύο άκρα της. Από το ένα παράθυρο εισέρχεται υπέρυθρη ακτινοβολία και αφού υποστεί εξασθένιση λόγω μερικής απορρόφησης από τα μόρια του CO2, εξέρχεται από το δεύτερο όπου προσπίπτει σε έναν ανιχνευτή.
Να σημειωθεί ότι τα όργανα αυτά δεν χρειάζονται στοιχεία διασποράς (μονοχρωμάτορες) της ακτινοβολίας IR (non-dispersive instruments), αφού δεν απαιτείται η καταγραφή ενός φάσματος, αλλά περιορίζονται στη χρήση ενός φίλτρου μεταξύ κυψελίδας και ανιχνευτή και στην ακριβή μέτρηση της μείωσης έντασης της εξερχόμενης από την κυψελίδα υπέρυθρης ακτινοβολίας. Οι μετρήσεις είναι αυτόματες, συνεχείς και η βαθμονόμηση πραγματοποιείται με τρία "πρότυπα" (αέρας με επακριβώς γνωστή περιεκτικότητα σε CO2) κάθε 1 ώρα. Κατά τη βαθμονόμηση διακόπτεται η ροή ατμοσφαιρικού αέρα στην κυψελίδα και σ' αυτήν εισέρχονται το ένα μετά το άλλο τα τρία πρότυπα αέρια (ατμοσφαιρικός αέρας με επακριβώς γνωστή περιεκτικότητα σε CO2). Το σφάλμα των μετρήσεων στις περισσότερες περιπτώσεις εκτιμάται μικρότερο του 0,2 ppm.
Ενώ η διαδικασία της μέτρησης είναι απλή, είναι εξαιρετικά δύσκολη η παρασκευή των προτύπων βαθμονόμησης, διαδικασία που απαιτεί ειδικούς χειρισμούς και μανόμετρα εξαιρετικής ακρίβειας. Εμπορικοί ανιχνευτές/μετρητές CO2 [Αναφ. 8] Στο εμπόριο κυκλοφορεί μεγάλος αριθμός από φορητούς μετρητές CO2. Οι περισσότεροι από αυτούς βασίζονται πάλι σε μετρήσεις της απορρόφησης του αέρα στην περιοχή του υπερύθρου. Οι μετρητές αυτοί είναι κατάλληλοι για μετρήσεις CO2 σε κλειστούς χώρους (γραφεία, βιοτεχνίες, σχολικές τάξεις). Επίσης, κυκλοφορεί και ένας αριθμός από ανιχνευτές CO2 τύπου "στερεάς κατάστασης" οι οποίοι βασίζονται σε διάφορες αρχές, όπως η επίδραση του CO2 στην αγωγιμότητα διάφορων υλικών (SnO2), στο ηλεκτροχημικό δυναμικό ισορροπίας ηλεκτροχημικών στοιχείων τηγμάτων αλάτων διαφόρων συνθέσεων (σε μικροσκοπικές ποσότητες για περιορισμό της κατανάλωσης ενέργειας από τις μπαταρίες). Ο παραπλεύρως εικονιζόμενος ανιχνευτή MG811 βασίζεται στο γαλβανικό στοιχείο (σε τήγμα ανθρακικών αλάτων Na και Li και ιοντικούς υπεραγωγούς, όπως το NaSICON ) το οποίο, με τη σειρά του, βασίζεται στις ακόλουθες ηλεκτροδιακές αντιδράσεις:
Κάθοδος: Li2CO3
'Ανοδος: 2Na+
+ 1/2O2 + 2e-
Ολική αντίδραση: Li2CO3
+ 2Na+
Η αναπτυσσόμενη ΗΕΔ μεταξύ των δύο ηλεκτροδίων είναι λογαριθμική συνάρτηση της συγκέντρωσης του CO2 για την περιοχή 350-10.000 ppm (0,035-1% v/v). |
||||||||||||||
 |
 |
 |
 |
 |
|
Μια ποικιλία εφαρμογών του διοξειδίου του άνθρακα: οξυανθρακούχα αναψυκτικά και οινοπνευματώδη ποτά, διογκωτικά υλικά στη μαγειρική (baking powder), πυρόσβεση (για πυρκαγιές ηλεκτρολογικής προέλευσης και από εύφλεκτα υγρά, αδρανής ατμόσφαιρα σε ηλεκτροσυγκολλήσεις. |
||||
Χρήσεις και εφαρμογές του διοξειδίου του άνθρακα [Αναφ. 9]
Το CO2 επειδή σε συνήθεις συνθήκες είναι αδρανές, δεν είναι τοξικό, είναι άφλεκτο, άοσμο, φθηνό και εύκολα να παρασκευασθεί σε μεγάλες ποσότητες χωρίς προσμίξεις, χρησιμοποιείται στη βιομηχανία τροφίμων, στη βιομηχανία πετρελαίου και βρίσκει εφαρμογές σε πλήθος καταναλωτικών προϊόντων που απαιτούν πεπιεσμένο, καθαρό, άφλεκτο και φθηνό αέριο. Χρησιμοποιείται από τα αναβράζοντα δισκία βιταμινών και φαρμάκων μέχρι τις ανατινάξεις στα ορυχεία, όπως και για την εξολόθρευση εντόμων. Το CO2 υπό πίεση (συνήθως ως υπερκρίσιμο ρευστό) παρουσιάζει αντιμικροβιακή δράση και έχει εξετασθεί η αποτελεσματικότητά του για την αποστείρωση νοσηλευτικού υλικού και ιατρικών εργαλείων.
 |
 |
|
Αριστερά: Ξηρός πάγος (στερεοποιημένο CO2) [πηγή]. Δεξιά: Διάλυμα CO2 σε ακετόνη (κατάλληλο σε περιπτώσεις που χρειάζεται ρευστό ψυκτικό μέσο) [πηγή]. |
|
Το CO2 χρησιμοποιείται για την παραγωγή αεριούχων ποτών (fizzy drinks), ενώ στον καμπανίτη οίνο (champagne) παράγεται με δευτερογενή ζύμωση μετά την εμφιάλωση. Η μαγιά της αρτοποιίας παράγει CO2 από τη ζύμωση των σακχάρων στο εσωτερικό της ζύμης, ενώ άλλα προϊόντα, όπως το baking powder (μίγμα όξινου τρυγικού καλίου και NaHCO3) και η μαγειρική σόδα (NaHCO3), απελευθερώνουν CO2, όταν διαλυθούν σε νερό, όταν θερμανθούν ή όταν εκτεθούν σε οξέα και χρησιμοποιούνται ως διογκωτικά μέσα στη μαγειρική και ζαχαροπλαστική.
Ως άφλεκτο αέριο, το CO2 χρησιμοποιείται υπό πίεση σε ορισμένους πυροσβεστήρες, που είναι σχεδιασμένοι για κατάσβεση πυρκαγιών που οφείλονται σε ηλεκτρικά βραχυκυκλώματα και σε εύφλεκτα υγρά. Ειδικοί πυροσβεστήρες με CO2 χρησιμοποιούνται και για την πυροπροστασία πλοίων και μηχανοστασίων. Ωστόσο, οι πυροσβεστήρες με CO2 δεν πρέπει να χρησιμοποιούνται αν δεν υπάρχει οδός διαφυγής και σε κλειστούς χώρους. Στα εργαστήρια χημείας δεν πρέπει να χρησιμοποιούνται για πυρκαγιές οφειλόμενες σε ανάφλεξη δραστικών μετάλλων (όπως αναφέρθηκε παραπάνω).
Το CO2 μπορεί να χρησιμοποιηθεί για τη δημιουργία αδρανούς ατμόσφαιρας μέσα στην οποία γίνονται συγκολλήσεις, αν και στις υψηλές θερμοκρασίες που αναπτύσσονται μπορεί να οξειδώσει αρκετά σχετικώς δραστικά μέταλλα (π.χ. το αλουμίνιο). Η χρήση του στην αυτοκινητοβιομηχανία για τον σκοπό αυτό είναι πολύ συνηθισμένη, επειδή είναι πολύ φθηνότερο από το αέριο αργό (Ar) ή το ήλιο (He). Ακόμη, το CO2 χρησιμοποιείται ως μέσο ελέγχου του pH των κολυμβητηρίων. Με τη συνεχή προσθήκη CO2 στο νερό, διατηρείται το pH σε χαμηλά επίπεδα. Με την πρακτική αυτή αποφεύγεται η χρήση πιο επικίνδυνων και διαβρωτικών οξέων.
Χρήση του CO2 σε φαρμακευτικές, βιολογικές, ιατρικές και άλλες χημικές διεργασίες. Στη χημική βιομηχανία, το CO2 χρησιμοποιείται σε μεγάλες ποσότητες για την παραγωγή ουρίας, ανθρακικών και όξινων ανθρακικών αλάτων και σαλικυλικού νατρίου. Σε θερμοκήπια, το CO2 χρησιμοποιείται για την καταπολέμηση βλαβερών ζωυφίων, αραχνών και ακάρεων. Στην ιατρική, το CO2 προστίθεται στο καθαρό οξυγόνο μέχρι ποσοστού 5% για την τόνωση της αναπνοής μετά από επεισόδια άπνοιας και για να σταθεροποιηθεί η ισορροπία O2/CO2 στο αίμα.
 |
 |
|
Αριστερά: 'Eνα απλό εργαστηριακό πείραμα: Εκχύλιση λεμονενίου από φλούδια πορτοκαλιού με υγρό CO2. ΠΡΟΣΟΧΗ! Απαιτείται ιδιαίτερη προσοχή στον χειρισμό των φιαλιδίων, αφού στο εσωτερικό τους επικρατεί μεγάλη πίεση. [Αναφ. 9δ-στ]. Δεξιά: Ειδικά δοχεία για ασφαλέστερες και περισσότερο ελεγχόμενες εκχυλίσεις με υγρό ή υπερκρίσιμο CO2. |
|
Το υγρό και κυρίως το στερεό CO2, γνωστό ως ξηρός πάγος (dry ice), αποτελούν σημαντικά ψυκτικά μέσα, κυρίως στη βιομηχανία τροφίμων για τη μεταφορά και αποθήκευση παγωτών και άλλων κατεψυγμένων προϊόντων. Ο ξηρός πάγος χρησιμοποιείται για μεταφορές υπό ψύξη υλικών σε περιπτώσεις που δεν είναι πρακτικά τα ογκώδη ψυγεία. 'Ετσι, ευαίσθητα χημικά και βιοχημικά αντιδραστήρια (π.χ. ένζυμα) συχνά ταχυδρομούνται από τους παραγωγούς στα ερευνητικά εργαστήρια περιβαλλόμενα από ξηρό πάγο σε κιβώτια από αφρώδες πολυστυρένιο (Styrofoam) ως θερμομονωτικό υλικό. Στα χημικά εργαστήρια, όποτε απαιτείται ρευστό ψυκτικό μέσο (π.χ. στις "κρυοπαγίδες" δέσμευσης πτητικών ενώσεων), χρησιμοποιείται διάλυμα ξηρού πάγου σε ακετόνη, το οποίο μπορεί να διατηρήσει τη θερμοκρασία στους -78ºC.
Ο ξηρός πάγος χρησιμοποιείται συχνά στα οινοποιεία για την ταχεία ψύξη των σταφυλιών με σκοπό την αποτροπή της πρόωρης ζύμωσης. Το κύριο πλεονέκτημα της χρήσης του είναι το ότι ψύχει τα σταφύλια χωρίς προσθήκη νερού, το οποίο θα μπορούσε να αραιώσει τα σάκχαρα στο γλεύκος των σταφυλιών και να μειώσει τη συγκέντρωση της αιθανόλης στο τελικό προϊόν. Το αέριο CO2, το οποίο προκύπτει από την εξάχνωση του ξηρού πάγου, επειδή είναι βαρύτερο από τον αέρα, συσσωρεύεται στον πυθμένα των δεξαμενών, δημιουργώντας ένα περιβάλλον, που βοηθά στην καταπολέμηση των βακτηρίων τα οποία προέρχονται από τα σταφύλια, μέχρι να αρχίσει η ελεγχόμενη ζύμωση.
Ως υγρό (όχι κατ' ανάγκη σε υπερκρίσιμη κατάσταση), το CO2 χρησιμοποιείται ως εκχυλιστικό μέσο αιθέριων ελαίων από φυσικά προϊόντα, συνδυάζοντας πολλά πλεονεκτήματα, όπως μεγάλη εκχυλιστική ικανότητα, φιλικότητα προς το περιβάλλον και χαμηλό κόστος. Η απομάκρυνσή του μετά την εκχύλιση πραγματοποιείται χωρίς καμία θέρμανση και χωρίς να αφήσει το παραμικρό υπόλειμμα στο εκχυλισμένο υλικό.
Η διαδικασία της εκχύλισης με υγρό CO2 σε μικρή κλίμακα είναι απλή: αρκεί να κλειστεί το υπό εκχύλιση υλικό με τεμάχια ξηρού πάγου σε σφραγισμένο φιαλίδιο, οπότε με ελαφριά θέρμανση σχηματίζεται (υπό πίεση) υγρό CO2. Εάν η πίεση και η θερμοκρασία υπερβούν τις αντίστοιχες κρίσιμες τιμές (31,1ºC, 72,9 atm), το υγρό CO2 μετατρέπεται σε υπερκρίσιμο ρευστό, γεγονός το οποίο επιταχύνει την εκχύλιση και αυξάνει την απόδοσή της. Τυπικό παράδειγμα αποτελεί η εκχύλιση λεμονενίου από φλούδια πορτοκαλιού, η οποία έχει προταθεί και χρησιμοποιείται ως ένα απλό και εξαιρετικά διδακτικό πείραμα "πράσινης χημείας". Βέβαια, θα πρέπει κατά τη διεξαγωγή του πειράματος να λαμβάνονται όλα τα απαραίτητα μέτρα προστασίας λόγω των υψηλών πιέσεων που αναπτύσσονται στο φιαλίδιο [Αναφ. 9δ-στ].
Το CO2 ως υπερκρίσιμο ρευστό. Ως υπερκρίσιμο ρευστό το CO2 μπορεί να χρησιμοποιηθεί στην άντληση πετρέλαιο, ενώ λειτουργεί ταυτόχρονα ως προωθητικό υπό πίεση και μειώνει σημαντικά το ιξώδες του πετρελαίου, επιτρέποντας έτσι την ομαλότερη και ταχύτερη ροή του προς την επιφάνεια της γεώτρησης. Το υπερκρίσιμο CO2 χρησιμοποιείται στις φαρμακοβιομηχανίες ως λιγότερο τοξική εναλλακτική λύση στη θέση παραδοσιακών διαλυτών, όπως είναι το χλωροφόρμιο (CΗCl3). Επίσης, χρησιμοποιείται στο ξηρό καθάρισμα των ρούχων στα στεγνοκαθαριστήρια, σε αντικατάσταση των ηπατοτοξικών χλωριωμένων υδρογονανθράκων, όπως το υπερχλωροαιθυλένιο (C2Cl4).
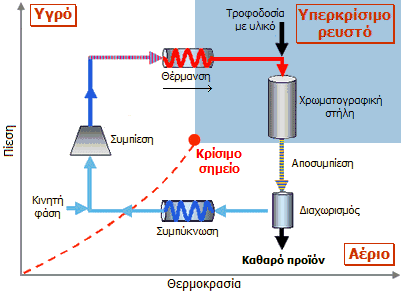
Στα χημικά εργαστήρια, το υπερκρίσιμο CO2 χρησιμοποιείται ως κινητή φάση στη χρωματογραφία υπερκρίσιμου ρευστού (supercritical fluid chromatography, SFC), μια ειδική μορφή χρωματογραφίας που συνδυάζει τα πλεονεκτήματα της αεριοχρωματογραφίας (μικροί χρόνοι έκλουσης, δυνατότητα χρήσης των υπερευαίσθητων αεριοχρωματογραφικών ανιχνευτών, όπως του ανιχνευτή ιοντισμού φλόγας, FID) με τα πλεονεκτήματα της υγροχρωματογραφίας (δυνατότητα διαχωρισμού και μη πτητικών ενώσεων).
 |
 |
 |
|
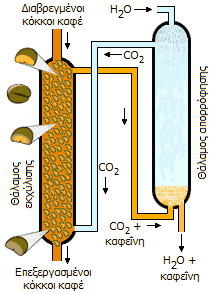
Αριστερά: Σύστημα (αρχή) παρασκευαστικής χρωματογραφίας υπερκρίσιμου ρευστού [πηγή]. Στο σχήμα φαίνεται ο κύκλος και η κατάσταση της κινητής φάσης (εκλούστης) ως προς το διάγραμμα φάσεών του. Μέσον: Εργαστηριακή συσκευή εκχύλισης με υπερκρίσιμο CO2 [πηγή]. Δεξιά: Διάταξη (αρχή) συνεχούς εκχύλισης συνεχούς εκχύλισης της καφεΐνης από κόκκους καφέ για την παρασκευή αποκαφεϊνωμένου καφέ με υπερκρίσιμο CO2 (βλ. Χημική ένωση του μήνα: Καφεΐνη). |
||
Ως εκχυλιστικό μέσο, το υπερκρίσιμο CO2 θεωρείται εξαιρετικός διαλύτης, μη τοξικός και φιλικός προς το περιβάλλον, διαλύτης που δεν αφήνει το παραμικρό ίχνος του στον εκχυλιζόμενο προϊόν. 'Οπως προαναφέρθηκε, xαρακτηριστικό γνώρισμα των υπερκρίσιμων ρευστών είναι το ότι η εκχυλιστική τους ικανότητα αυξάνεται με αύξηση της πίεσης υπό την οποία πραγματοποιείται η εκχύλιση. Με απλή μείωση της ασκούμενης πίεσης επέρχεται καθίζηση της διαλυμένης (εκχυλισμένης) ουσίας, μετά την απομάκρυνση της οποίας, με νέα αύξηση της πίεσης το υπερκρίσιμο ρευστό είναι έτοιμο να επαναλάβει νέο κύκλο εκχύλισης [Αναφ. 3ζ,η].
Η πλέον γνωστή εφαρμογή του υπερκρίσιμου CO2 είναι η απομάκρυνση της καφεΐνης από τον καφέ για την παρασκευή του ονομαζόμενου αποκαφεϊνωμένου καφέ (decaf). Oι πράσινοι κόκκοι καφέ εμποτίζονται με νερό και στη συνέχεια, ρευστό υπερκρίσιμο CO2 (σε θερμοκρασία περίπου -93°C) διοχετεύεται από το κάτω μέρος της στήλης με αποτέλεσμα η καφεΐνη να διαχέεται από τους κόκκους μέσα στο CO2 (βλέπε, Χημική ένωση του μήνα: Καφεΐνη). Δεκάδες χιλιάδες τόνοι κόκκων καφέ απαλλάσσονται από την καφεΐνη ετησίως με τη μέθοδο αυτή [Αναφ. η].
|
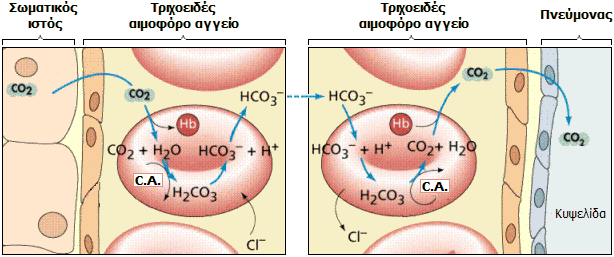
Μηχανισμός αποβολής του CO2 με την αναπνοή. Αριστερά: Το CO2 από τους ιστούς διαχέεται στο πλάσμα του αίματος, όπου επέρχεται ταχύτατα η ισορροπία CO2/H2CO3/HCO3- με τη βοήθεια του ενζύμου ανθρακική ανυδράση (carbonic anhydrase, C.A.). Μικρότερο ποσοστό του συνδέεται χαλαρά με την αιμοσφαιρίνη (Hb) των ερυθρών αιμοσφαιρίων. Δεξιά: Με την κυκλοφορία του αίματος το πλάσμα και τα αιμοσφαίρια μεταφέρουν το δεσμευμένο CO2 στις κυψελίδες (alveoli) των πνευμόνων, όπου ακολουθείται η αντίστροφή πορεία των προηγούμενων αντιδράσεων και τελικά το CO2 αποβάλλεται με την εκπνοή. |
Εξωτερική αναπνοή: Αποβολή του CO2 από τον οργανισμό [Αναφ. 10]
Το CO2 αποτελεί κύριο προϊόν του καταβολισμού των τροφών, το οποίο σε μεγάλες συγκεντρώσεις στους ιστούς και στο αίμα είναι τοξικό, διαταράσσει την οξεοβασική ισορροπία του οργανισμού και επομένως πρέπει να αποβάλλεται από τον οργανισμό, με τον ίδιο ρυθμό με εκείνον που δημιουργείται. Με την κυκλοφορία του, το αίμα (ως "φλεβικό αίμα") παραλαμβάνει το CO2 από τους ιστούς, όπου δημιουργείται, και το μεταφέρει στους πνεύμονες, όπου εκεί αποβάλλεται με την εκπνοή, ενώ παραλαμβάνει οξυγόνο (ως "αρτηριακό" αίμα) και το μεταφέρει στους ιστούς για τις βιοχημικές "καύσεις".
Το CO2, το οποίο είναι κατά πολύ πιο ευδιάλυτο στο αίμα σε σχέση με το οξυγόνο, μεταφέρεται με το αίμα με τρεις διαφορετικές μορφές: (α) Ως CO2 διαλυμένο στο αίμα (περίπου το 5-10% της συνολικής ποσότητάς του), (β) ως CO2 συνδεδεμένο αντιστρεπτά με την αιμοσφαιρίνη και άλλες πρωτεΐνες (περίπου το 10-20%) και (γ) ως όξινο ανθρακικό ιόν (η μεγαλύτερη ποσότητά του).
Η αιμοσφαιρίνη, το κύριο μόριο-μεταφορέας οξυγόνου στα ερυθρά αιμοσφαίρια, μπορεί να μεταφέρει και Ο2 (αρτηριακό αίμα) και CO2 (φλεβικό αίμα). Ωστόσο, το CO2 δεσμεύεται σε διαφορετικό μέρος του μορίου της αιμοσφαιρίνης από εκείνο όπου δεσμεύεται το Ο2. 'Οταν η δέσμευση του Ο2 είναι αυξημένη, μειώνεται η ποσότητα του CO2 που δεσμεύεται από την αιμοσφαιρίνη και αντιστρόφως εξαιτίας του αλλοστερικού φαινομένου.
Η εκδίωξη του ενός μορίου (Ο2) από το άλλο (CO2) στους ιστούς και η αντίστροφη πορεία στους πνεύμονες, διέπεται από τους κλασικούς νόμους χημικής ισορροπίας (δράση μαζών) και αποτελούν την ουσία της αναπνοής.
|
H εκπνοή και εισπνοή αέρα σε μια σακούλα (στην ουσία: η εισπνοή αέρα με αυξημένη περιεκτικότητα σε CO2), όπως και η πόση οξυανθρακούχων αναψυκτικών συχνά μπορεί να σταματήσει τον λόξυγκα [πηγή]. |
Το εισερχόμενο στα αιμοσφαίρια CO2 μετατρέπεται ταχύτατα σε HCO3- χάρις στο ένζυμο ανθρακική ανυδράση (carbonic anhydrase, C.A.) και η αντιστάθμιση φορτίων γίνεται με έξοδο χλωριούχων από το αιμοσφαίριο. Αυτός είναι και ο λόγος για τον οποίο η συγκέντρωση χλωριούχων στο φλεβικό αίμα είναι υψηλότερη από εκείνη του αρτηριακού.
Μικρό μέρος των HCO3- μεταφέρεται και στο πλάσμα του αίματος, συμβάλλοντας στη διατήρηση του pH του στα φυσιολογικά όρια. Στους πνεύμονες οι προηγούμενες αντιδράσεις και ακολουθούν την αντίστροφη πορεία. Συνήθως ο εκπνεόμενος αέρας περιέχει 4 % έως 5 % CO2, ενώ το οξυγόνο είναι κατά 4 % έως 5 % λιγότερο από εκείνο του εισπνεόμενου αέρα της εισπνοής. Ο άνθρωπος εκπνέει περίπου 1 Kg CO2 κάθε ημέρα.
 Τοξικότητα του CO2
σε υψηλές συγκεντρώσεις [Αναφ. 11]
Τοξικότητα του CO2
σε υψηλές συγκεντρώσεις [Αναφ. 11]
Το CO2 σε χαμηλές συγκεντρώσεις (<0,5% v/v) είναι μη τοξικό αέριο. Ωστόσο, η παρατεταμένη έκθεση σε υψηλότερες συγκεντρώσεις μπορεί να προκαλέσει οξέωση και να έχει αρνητικές συνέπειες για τον μεταβολισμό του ασβεστίου και του φωσφόρου. Σε υψηλές συγκεντρώσεις μπορεί να προκαλέσει καρδιακές αρρυθμίες. Σε κλειστούς χώρους με πολλούς ανθρώπους χωρίς εξαερισμό, παρατεταμένη έκθεση σε περιεκτικότητα 1% v/v σε CO2 μπορεί να προκαλέσει υπνηλία, ενώ σε περιεκτικότητα 2% v/v το CO2 αρχίζει να συμπεριφέρεται ως ήπιο ναρκωτικό. Αυξάνει την αρτηριακή πίεση και τον καρδιακό ρυθμό, ενώ φαίνεται πως μειώνει την ακουστική οξύτητα.
Ιδιαίτερη σημασία έχει η παρακολούθηση και ο έλεγχος του CO2 σε τάξεις σχολείων, δεδομένου ότι ακόμη και σχετικά μικρές συγκεντρώσεις (1000 ppm) επηρεάζουν αρνητικά τους μαθητές ως προς την ικανότητα συγκέντρωσης και παρακολούθησης των μαθημάτων.
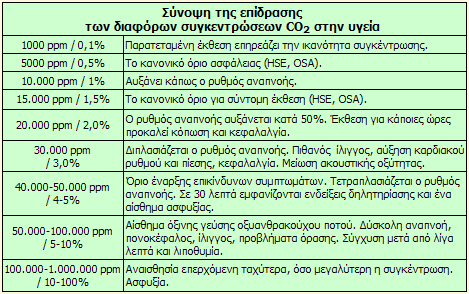
Σε περιεκτικότητα 5% v/v προκαλεί διέγερση του αναπνευστικού συστήματος, ζάλη, σύγχυση, κεφαλαλγία και δύσπνοια. Για περιεκτικότητα 8% v/v προκαλείται κεφαλαλγία, εφίδρωση, παραισθήσεις και απώλεια συνείδησης μετά την έκθεση για 5-10 min. Στον παραπλεύρως πίνακα συνοψίζονται τα συμπτώματα που εμφανίζονται στον άνθρωπο σε μια ατμόσφαιρα διαφόρων συγκεντρώσεων CO2.
Λόγω των κινδύνων για την υγεία που συνδέονται με την έκθεση σε υψηλές συγκεντρώσεις CO2, ο Οργανισμός Επαγγελματικής Ασφάλειας και Υγείας των ΗΠΑ (Occupational Safety and Health Administration, OSHA), νομοθέτησε ως όρια και μέση έκθεση για υγιείς ενήλικες για 8ωρη εργασία τα 5000 ppm (0,5% v/v). Το μέγιστο επίπεδο ασφάλειας για βρέφη, παιδιά, ηλικιωμένους και άτομα με προβλήματα υγείας είναι σημαντικά μικρότερο. Για σύντομες (μέχρι 10 min) εκθέσεις στο CO2, το όριο είναι 30.000 ppm (3% v/v). Πάντως, συγκεντρώσεις που υπερβαίνουν το 4% v/v πρέπει να θεωρούνται ως άμεσα επικίνδυνες για την υγεία του ανθρώπου.
Η συγκέντρωση CO2 (συνήθως μεταξύ 300 ppm και 2500 ppm) χρησιμοποιείται ως δείκτης ποιότητας του αέρα σε εσωτερικούς χώρους. Σε κλειστούς και μη αεριζόμενους ικανοποιητικά χώρους, συγκεντρώσεις μεγαλύτερες από 1000 ppm (π.χ. από την εκπνοή πολλών ανθρώπων) συνήθως προκαλούν δυσφορία σε ποσοστό πάνω από το 20% των ανθρώπων. Στα 2000 ppm (0,2% v/v), οι περισσότεροι αισθάνονται ενόχληση και πολλοί υποφέρουν από ναυτία και πονοκεφάλους.
|
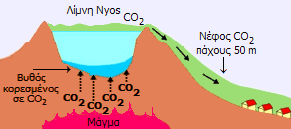
Το καταστροφικό περιστατικό της λίμνης Nyos του Καμερούν [Αναφ. 12] Η λίμνη Nyos, στο Καμερούν, έχει σχηματισθεί στον κρατήρα ενός ηφαιστείου που είχε εκραγεί πριν 500 περίπου χρόνια. Η λίμνη έχει επιφάνεια περίπου 1,5 τετραγωνικού χιλιομέτρου και μέγιστο βάθος 230 m. Από ρωγμές του πυθμένα εισρέει στη λίμνη CO2 ηφαιστειακής προέλευσης. Τα νερά της λίμνης δεν ανανεώνονται σε σημαντικό βαθμό και ουσιαστικά είναι στάσιμα, με αποτέλεσμα τα χαμηλότερα στρώματα των υδάτων της λίμνης να περιέχουν μεγάλες συγκεντρώσεις CO2 λόγω της επικρατούσας εκεί υψηλής υδροστατικής πίεσης.
Το CO2, ως ειδικώς βαρύτερο από τον ατμοσφαιρικό αέρα πλημμύρησε την επιφάνεια της λίμνης και ξεχύθηκε στις πλαγιές του ηφαιστειακού κρατήρα, όπου υπήρχαν κατοικούμενα χωριά. Αυτό το πυκνό και βαρύ "νέφος" CO2 εξόντωσε με ασφυκτικό θάνατο κάθε ζωντανή ύπαρξη σε ακτίνα σχεδόν 25 χιλιομέτρων γύρω από τον κρατήρα. Το γεγονός αυτό κόστισε τη ζωή περίπου 1700 κατοίκων της περιοχής και 3500 αγροτικών ζώων. Υπολογίστηκε ότι πρέπει να εκλύθηκε 0,7 έως 1 κυβικό χιλιόμετρο CO2. Αντίστοιχα γεγονότα είχαν συμβεί σε μικρότερη κλίμακα και παλαιότερα σε άλλες παρακείμενες λίμνες - κρατήρες. Σύμφωνα με τους υπολογισμούς των επιστημόνων, τέτοια καταστροφικά περιστατικά θα μπορούσαν να συμβαίνουν στις λίμνες αυτές κάθε 10 έως 30 χρόνια. Αυτό το χρονικό διάστημα χρειάζεται να σωρευθεί η "κρίσιμη" ποσότητα CO2 στα νερά των λιμνών. Το 1995, για να αποφευχθούν στο μέλλον αυτές οι βίαιες εκτονώσεις CO2, μια ομάδα Γάλλων επιστημόνων, υπό τη διεύθυνση του φυσικού-μηχανικού Michel Halbwachs, δοκίμασε με επιτυχία ένα σύστημα αυτοσυντηρούμενου σιφωνισμού των υδάτων της λίμνης (βλέπε σχήμα παρακάτω), που προκαλεί μια σταθερή και ελεγχόμενη εκτόνωση του CO2. Με χρηματοδότηση των ΗΠΑ εγκαταστάθηκε και λειτουργεί μόνιμα από το 2001 το σύστημα ήπιας εκτόνωσης του CO2 της λίμνης Nyos.
|
||||||||
 |
 |
 |
 |
|
Τα ονομαζόμενα "καρότα" πάγου, που λαμβάνονται από πανάρχαιους παγετώνες πολικών περιοχών (Γροιλανδία, Ανταρκτική), "εξιστορούν" τις κλιματικές μεταβολές και τη σύσταση της ατμόσφαιρας σε βάθος χιλιετιών (από τις εγκλωβισμένες φυσαλίδες αέρα). Περίφημη είναι μια γεώτρηση σε περιοχή της Ανταρκτικής 3200 m πάνω από τη επιφάνεια της θάλασσας, γνωστής ως "Dome C" (Dome: Θόλος). Επιδιώκεται η γεώτρηση να γίνεται στο υψηλότερο σημείο του "θόλου" ενός παγετώνα, [Αναφ. 13α]). Η γεώτρηση αυτή απέδωσε "καρότο" συνολικού μήκους 3,27 km (ολοκληρώθηκε το 2004), το οποίο μας "διηγείται" ιστορία σε βάθος 800 χιλιάδων ετών [πηγή]. Τα "καρότα" πάγου φυλάσσονται σε ειδικές εγκαταστάσεις του U.S. National Ice Core Laboratory, στο Denver του Colorado και από εκεί διατίθενται σε ερευνητικές ομάδες σε όλο τον κόσμο [Αναφ. 13]. |
|||
 |
|
|
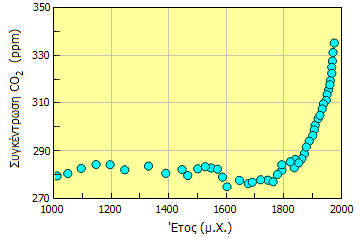
Αριστερά: Συγκέντρωση του CO2 στην ατμόσφαιρα κατά την τελευταία χιλιετία [πηγή]. Δεξιά: Τεμάχιο "αρχαίου" πάγου με εγκλωβισμένες φυσαλίδες "αρχαίας" ατμόσφαιρας [πηγή]. |
|
Το μέλλον του CO2 ή "πώς θα βάλουμε το τζίνι στο μπουκάλι" [Αναφ. 13, 14]
Η προοπτική περαιτέρω αύξησης της συγκέντρωσης του ατμοσφαιρικού CO2 καταφαίνεται από το παραπλεύρως διάγραμμα τιμών συγκεντρώσεων για τη χιλιετία 1000-2000 μ.Χ. με βάση μετρήσεις σε θύλακες ατμοσφαιρικού σε δείγματα πάγου ("καρότα") διαφορετικών στρωμάτων της Ανταρκτικής. Υπενθυμίζεται ότι σήμερα η συγκέντρωση του ατμοσφαιρικού CO2 ήδη ξεπέρασε τα 400 ppm (μέτρηση 1ης Μαΐου 2014: 401,44 ppm. Την πιο πρόσφατη μέτρηση μπορούμε να τη δούμε εδώ ) [Αναφ. 13].
Η συσχέτιση μεταξύ της συχνότητας εμφάνισης ακραίων και καταστροφικών καιρικών φαινομένων με την αύξηση της μέσης θερμοκρασίας της ατμόσφαιρας είναι γενικά αποδεκτή, αν και κατά καιρούς έχουν διατυπωθεί αντίθετες απόψεις. Ωστόσο, τη συσχέτιση της αύξησης της μέσης θερμοκρασίας με την αύξηση της συγκέντρωσης του ατμοσφαιρικού CO2 είναι πολύ δύσκολο για οποιονδήποτε να την αμφισβητήσει.
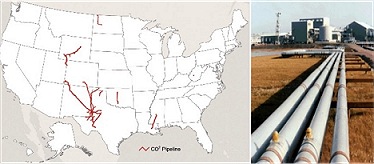
Η "λύση" που έχει προταθεί και συζητείται σοβαρότερα είναι η συμπίεση του CO2 και η αποθήκευσή του ως υγρού σε υπόγειες κοιλότητες και σε μεγάλα βάθη υπό πίεση. Ακόμη θα μπορούσε να διοχετευθεί σε κοιλώματα σχεδόν εξαντλημένων κοιτασμάτων πετρελαίου. Η πίεση μάλιστα που θα ασκούσε θα βοηθούσε στην άντληση και των τελευταίων υπολειμμάτων πετρελαίου. 'Ηδη, από το 2007 στις ΗΠΑ υπάρχει δίκτυο συνολικού μήκους 9.000 km μεταφοράς υγρού CO2 από εργοστάσια ηλεκτρικής ενέργειας ή βιομηχανικά συγκροτήματα προς πετρελαιοπαραγωγές περιοχές.
Η διαδικασία αυτή αναφέρεται ως σύλληψη και αποθήκευση διοξειδίου του άνθρακα (carbon dioxide capture and storage, CCS).
Εκτιμάται ότι σε βάθος χρόνου, το αποθηκευμένο CO2 σταδιακά θα μπορούσε να σταθεροποιηθεί υπό τη μορφή ανθρακικών ορυκτών με αντιδράσεις ανταλλαγής με πυριτικά ορυκτά, όπως π.χ. με τον σερπεντίνη:
Mg3Si2O5(OH)4 +
3
CO2
![]() 3
MgCO3 + 2
SiO2
+
2
H2O
3
MgCO3 + 2
SiO2
+
2
H2O
Θεωρητικά, το 22% των ορυκτών μπορούν δώσουν ανάλογες αντιδράσεις δέσμευσης (sequestration) του CO2 [Αναφ. 14ζ,η].
|
Δίκτυο αγωγών υγρού CO2 των ΗΠΑ κατά το 2007 [πηγή]. |
Η μεταφορά του CO2 στα βάθη των ωκεανών έχει απορριφθεί λόγω της οξίνισης που θα προκαλούσε και η οποία ήδη έχει φθάσει σε κρίσιμα επίπεδα.
Ωστόσο, η συμπίεση του CO2 είναι από μόνη της είναι μια δαπανηρή και ενεργοβόρα διαδικασία και επομένως η ίδια η δέσμευση του CO2 απαιτεί ενέργεια (το κόστος εκτιμάται σε 50-70 δολάρια/τόνο) μέρος της οποίας μπορεί να προέρχεται από την καύση ορυκτών καυσίμων. Επιπλέον, και αν ακόμη ήταν ενεργειακώς εφικτή η συμπίεση αυτή με κατανάλωση εξολοκλήρου π.χ. πυρηνικής ή υδροηλεκτρικής ενέργειας, εγείρεται το ερώτημα ως προς κατά πόσο θα μπορούσε να θωρηθεί ασφαλής αυτή η "αποθήκευση" του CO2 και αν θα μπορούσε να οδηγήσει κάποτε σε καταστροφές ανάλογες με εκείνες της λίμνης Nyos.
Μια επιστημονικώς ενδιαφέρουσα λύση είναι η αξιοποίηση της ηλιακής ενέργειας για τη μετατροπή του CO2 σε υδρογονανθρακικά καύσιμα με βάση τη γενική αντίδραση:
xCO2 +
y/2 H2O
+ ηλιακή ενέργεια
![]() CxHy + (x + y/4)
O2
CxHy + (x + y/4)
O2
Δοκιμές έδειξαν ότι πράγματι είναι εφικτή η αντίδραση αυτή (αντίστροφη της διαδικασίας καύσης), ωστόσο οι μέχρι σήμερα αποδόσεις είναι απελπιστικά μικρές. Η μόνη λύση για να τιθασευθεί η αύξηση του CO2 είναι ο περιορισμός της χρήσης ορυκτών καυσίμων ακόμη περισσότερο. Το πρωτόκολλο του Kyoto υπήρξε μια καλή αρχή, ωστόσο οι καταστάσεις και οι μετρήσεις δείχνουν ότι δεν επαρκεί. Πολλά κράτη βρίσκουν τρόπους να παρακάμψουν τους περιορισμούς των εκπομπών CO2 π.χ. με εξαγορές μεριδίων ("δικαιωμάτων στην ατμοσφαιρική ρύπανση") άλλων κρατών, ενώ άλλα κράτη (και κατά κανόνα οι σημαντικότεροι ρυπαντές) δεν δέχονται κανένα έλεγχο.
Ίσως πλησιάζει η ώρα της εγκατάλειψης των ορυκτών καυσίμων. 'Αλλωστε ο χρόνος ζωής των γνωστών αποθεμάτων πετρελαίου μετρείται πλέον σε δεκαετίες. Αναπόφευκτα λοιπόν, η ανθρωπότητα θα οδηγηθεί στο μέχρι στιγμής τελειότερο καύσιμο, που δεν είναι άλλο από το υδρογόνο. Η μελέτη της παραγωγής υδρογόνου με βάση τη γενική αντίδραση:
Η2Ο + ηλιακή ενέργεια
![]() Η2 + 1/2 Ο2
Η2 + 1/2 Ο2
έχει σημειώσει μεγαλύτερες προόδους σε σχέση με την αντίστοιχη της μετατροπής του CO2 σε υδρογονάνθρακες. Η τεχνολογία χρήσης του Η2 ως καυσίμου έχει προχωρήσει σε σημείο που ίσως και σήμερα ακόμη θα μπορούσε να αξιοποιηθεί. Ως προς το γιατί δεν αξιοποιείται, μπορεί ο καθένας να κάνει τις εκτιμήσεις του.