 |
 |
|
Αριστερά:
Ο διάσημος 'Αγγλος φυσιοδίφης, θεολόγος, ιερέας και χημικός
Joseph Pristley (1733-1804). Ο πρώτος που απομόνωσε το
οξυγόνο, αν και δεν το αναγνώρισε ως ξεχωριστό στοιχείο,
επηρεασμένος από τη φλογιστική θεωρία της οποίας υπήρξε ένθερμος
οπαδός. Δεξιά: Τα σκεύη που χρησιμοποίησε στις μελέτες
πάνω σε διάφορα "είδη αέρα". |
Ιστορία της
ανακάλυψης του υποξειδίου του αζώτου
Το υποξείδιο του αζώτου
ή πρωτοξείδιο του αζώτου
(nitrous oxide, N2O.
'Αλλες ονομασίες: dinitrogen oxide -IUPAC-, nitrogen
protoxide).
'Αλλη ελληνική ονομασία του οξειδίου, που αποτελεί απευθείας απόδοση της
κοινής αγγλικής ονομασίας του (και με βάση ότι η κατάληξη -ous
αποδίδεται στα ελληνικά ως -ώδες) είναι νιτρώδες οξείδιο,
ωστόσο αυτή η ονομασία έχει τη μοναδικότητα στην ελληνική χημική
ονοματολογία της χρήσης επιθέτου μπροστά στο "οξείδιο" .
Είναι ένα άχρωμο,
άφλεκτο και σταθερό
αέριο με μια πολύ ελαφριά γλυκιά οσμή και γεύση. Ανακαλύφθηκε από τον
διάσημο 'Αγγλο χημικό και θεολόγο, όπως και τελευταίο υπερασπιστή της
"φλογιστικής" θεωρίας,
Joseph Pristley
(1733-1804), ο οποίος το περιέγραψε στη δημοσίευσή του (1772) με τίτλο: "Παρατηρήσεις
σε διαφορετικά είδη αέρα" (Observations
on Different Kinds of Air).
Ο
Pristley έγινε διάσημος για την ανακάλυψη και
πολλών αερίων (Ο2,
ΝΟ, ΝΗ3, HCl,
CO, CO2,
SO2). Ωστόσο, η προσήλωσή
του στη φλογιστική θεωρία, όπως και η τάση του να αναμιγνύει θεολογικά και φιλοσοφικά
δόγματα με τη χημεία,
τον έφεραν σε
αντιπαράθεση με τον θεμελιωτή της σύγχρονης χημείας, τον
Antoine-Laurent
Lavoisier
(1743-1794).
Ο
Pristley παρασκεύασε τυχαία το Ν2Ο
όταν διαπίστωσε μια βραδεία μείωση του όγκου του NO,
μόλις
το αέριο αυτό
ερχόταν σε επαφή με μουσκεμένα με νερό ρινίσματα σιδήρου. Η αντίδραση που
πραγματοποιήθηκε και συνεπάγεται μείωση του αρχικού όγκου του αερίου στο μισό,
μπορεί να αποδοθεί
ως εξής:
Fe +
2 ΝΟ + Η2Ο
 Fe(OH)2 + N2O
Fe(OH)2 + N2O
O Pristley "καθάρισε" το
λαμβανόμενο αέριο περνώντας το μέσα από νερό και το ονόμασε αποφλογιστικοποιημένο
νιτρώδη αέρα (dephlogisticated
nitrous air). Η ονομασία αυτή οφείλεται στο ότι ο Pristley είχε
διαπιστώσει την ικανότητα του αερίου να συντηρεί την καύση, βλέποντας ένα κερί να καίει μέσα στο αέριο αυτό και μάλιστα με ιδιαίτερα λαμπρή φλόγα.
'Ετσι, σύμφωνα με
τη φλογιστική θεωρία, το αέριο είχε την ικανότητα να αποσπά
το φλογιστόν από τις καύσιμες ουσίες.
Χαρακτηριστικά, ο Pristley είχε ονομάσει το οξυγόνο αποφλογιστικοποιημένο αέρα (dephlogisticated
air), ενώ το μονοξείδιο του αζώτου (ΝΟ) νιτρώδη αέρα (nitrous
air). Ο Pristley πίστεψε ότι το νέο αυτό αέριο θα μπορούσε να
χρησιμοποιηθεί ως συντηρητικό, αλλά οι δόκιμες απέβησαν άκαρπες.
Το 1785, ο Γάλλος χημικός
Claude Louis Berthollet (1748-1822) παρασκεύασε υποξείδιο του αζώτου
με θέρμανση νιτρικού αμμωνίου. Από τότε, μέχρι και σήμερα, η μέθοδος του
Berthollet χρησιμοποιείται ευρύτατα για την εργαστηριακή και βιομηχανική
παρασκευή του Ν2Ο. H μέθοδος
αυτή είναι αρκετά επικίνδυνη, επειδή το τήγμα του νιτρικού αμμωνίου μπορεί
να εκραγεί αν η θερμοκρασία του ξεπεράσει τους 300ºC:
NH4NO3
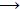 N2O + 2 H2O (ΔH =
-36,8 kJ/mol)
N2O + 2 H2O (ΔH =
-36,8 kJ/mol)
Ανακάλυψη
των αναισθητικών ιδιοτήτων
του υποξειδίου του αζώτου
[Αναφ. 2]. Τις αναισθητικές ιδιότητες του
υποξειδίου του αζώτου ανακάλυψε ο
Humphry
Davy
(1778-1829) σε
ηλικία μόλις είκοσι ετών. Ο Davy, διαβάζοντας τα βιβλία του
Lavoisier, είχε γοητευτεί από τη Χημεία και ασχολήθηκε με αυτήν από
πολύ μικρή ηλικία. Ο Davy είναι σήμερα γνωστός
κυρίως για την απομόνωση των μετάλλων νατρίου και καλίου με ηλεκτρόλυση,
όπως επίσης και του μαγνησίου, του βαρίου και του βορίου.
Μια σημαντική ανακάλυψη του Davy
(1815) η οποία πρέπει να έσωσε πολλές
ανθρώπινες ζωές, ήταν η περίφημη ομώνυμη λυχνία ασφαλείας,
την οποία χρησιμοποιούσαν οι ανθρακωρύχοι στις στοές των ανθρακωρυχείων, χωρίς να
δημιουργείται κίνδυνος ανάφλεξης των εύφλεκτων αερίων και καταστροφικής
έκρηξης (βλ. Χημική
ένωση του μήνα:
Μεθάνιο).
 |
 |
 |
|
Humphry
Davy
(1778-1829). Διαπίστωσε πρώτος τις αναισθητικές ιδιότητες του Ν2Ο. |
Συσκευή που σχεδιάστηκε από τον
James Watt για την παρασκευή, καθαρισμό, αποθήκευση και διανομή
προς εισπνοή αερίων
του
Pneumatic Institution (δεξιά).
|
Ο νεαρός
Davy εργαζόταν ως βοηθός του ιατρού
Thomas
Beddoes (1760-1808), ο οποίος
είχε ιδρύσει ένα κάπως παράδοξο για την εποχή
ινστιτούτο
μελέτης διαφόρων "ιατρικών αερίων" (Pneumatic
Institution for Relieving Diseases by Medical Airs)
στο Bristol της Αγγλίας. Το ινστιτούτο αυτό ήταν εξοπλισμένο με κατάλληλες συσκευές για την παραγωγή
και αποθήκευση διαφόρων
αερίων σε σχετικά μεγάλες ποσότητες και τη χορήγησή τους σε εθελοντές για να
διαπιστωθούν τυχόν θεραπευτικές ιδιότητές τους κυρίως για τη φυματίωση, αλλά και άλλες
πνευμονολογικές παθήσεις. Ο Davy δοκίμαζε αδίστακτα κάθε αέριο στον εαυτό του και
μάλιστα σε μια περίπτωση παρά λίγο να
χάσει τη ζωή του, όταν δοκίμασε να αναπνεύσει ένα μίγμα υδρογόνου - μονοξειδίου
του άνθρακα.
Ο
Davy ανέλαβε τη μελέτη του N2O,
το οποίο χορηγούσε στον εαυτό του, αλλά και σε επισκέπτες του ινστιτούτου.
Σύντομα διαπίστωσε ότι το αέριο αυτό
προκαλούσε μια ελαφριά αναισθητική δράση, όταν σε διαπίστωσε σημαντική μείωση του πονόδοντου
από τον οποίο υπέφερε. Επιπλέον, διαπίστωσε
μια αρκετά
παράδοξη επίδραση αυτού του αερίου: σε πολλές περιπτώσεις η εισπνοή του
αερίου προκαλούσε
ένα είδος ευφορίας, νευρικού γέλιου,
μέθης και γενικά μιας κατάστασης ευθυμίας, που συχνά οδηγούσε αυτόν που το
είχε εισπνεύσει σε φαιδρές και ανόητες ενέργειες.
Για την περίεργη αυτή ιδιότητα ο
νεαρός Davy ονόμασε το υποξείδιο του αζώτου
ιλαρυντικό αέριο (laughing
gas). Μια άλλη ονομασία που δόθηκε στο αέριο αυτό με τις παράδοξες
ιδιότητες ήταν γλυκό αέριο (sweet gas) λόγω
μιας ελαφριάς γλυκιάς γεύσης που άφηνε σε όσους το εισέπνεαν.
Το 1800, o Davy εξέδωσε ένα
βιβλίο 580 σελίδων(!) με τίτλο: "'Ερευνες
χημικές και φιλοσοφικές: αφορούσες κυρίως το υποξείδιο του αζώτου ή
αποφλογιστικοποιημένο αέρα και την εισπνοή του" (Researches
chemical and philosophical: chiefly concerning nitrous oxide or
dephlogisticated nitrous air and its respiration), όπου πρότεινε τη
χρήση του υποξειδίου του αζώτου
στην ιατρική. Χρειάστηκε να περάσουν περισσότερα από σαράντα χρόνια για να
πραγματοποιηθεί αυτή η πρόταση, κυρίως λόγω της δυσκολίας της παρασκευής καθαρού αερίου,
αφού η παρουσία μικροποσοτήτων άλλων οξειδίων του αζώτου το καθιστούσαν
επικίνδυνο για τους ασθενείς.
Ωστόσο, οι "ευφορικές"
ιδιότητες του υποξειδίου του αζώτου έγιναν αμέσως ευρύτερα γνωστές και ήδη από το
1799 άρχισαν να διοργανώνονται κοινωνικές συναθροίσεις (laughing
gas parties), κυρίως μεταξύ της εύπορης αστικής τάξης
-δεδομένου του σχετικά μεγάλου κόστους του αερίου-, στις οποίες οι προσκαλεσμένοι δοκίμαζαν τα παράδοξα αποτελέσματα της εισπνοής
ποσοτήτων του αερίου, το οποίο έφτασε να αποτελεί ένα είδος ψυχοτρόπου ουσίας, κάτι σαν
LSD της εποχής. 'Ετσι, η χρήση του υποξειδίου του
αζώτου για
διασκεδάσεις (recreational use) και για δημόσια θεάματα προηγήθηκε
κατά σαράντα χρόνια των ιατρικών εφαρμογών του.
Σήμερα, εκτός από τη χρήση
του υποξειδίου του αζώτου ως αναισθητικού αερίου (κυρίως στην οδοντιατρική),
χρησιμοποιείται στη βιομηχανία προϊόντων γάλακτος ως προωθητικό αέριο σε
εμφιαλωμένες κρέμες (σαντιγί), ως οξειδωτικό αέριο σε
μηχανές αυτοκινήτων και μοτοσικλετών αγώνων, στη φασματοφωτομετρία ατομικής
απορρόφησης ως οξειδωτικό καυσίμου (αντί αέρα ή οξυγόνου) και στη βιομηχανία ημιαγωγών
ως διαβρωτικό-οξειδωτικό.
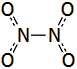
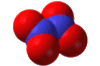
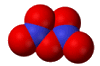
Χημική
δομή του υποξειδίου του αζώτου [Αναφ. 3]
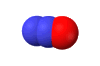
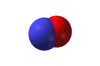
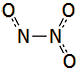
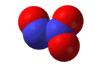
Το υποξείδιο του αζώτου
είναι ισοστερές (ισοηλεκτρονιακό και ισοατομικό) με το διοξείδιο του άνθρακα,
ως προς το οποίο
παρουσιάζει αξιοσημείωτες ομοιότητες: Το Ν2Ο
έχει γραμμική δομή (Ν=Ν=Ο) παρόμοια με εκείνη του CO2
(Ο=C=O). Και τα δύο οξείδια έχουν ουσιαστικά την ίδια σχετική μοριακή
μάζα και το σημείο ζέσεως του Ν2Ο
(-88,5ºC)
βρίσκεται πολύ κοντά στο σημείο ζέσεως (ακριβέστερα εξάχνωσης) του
CΟ2
(-78ºC).
 Η
ποσοτική περιγραφή του είδους των δεσμών, των ηλεκτρονιακών πυκνοτήτων και
των ηλεκτροστατικών δυνάμεων στο Ν2Ο
αποτελούσε πάντοτε ένα πρόβλημα για τους θεωρητικούς χημικούς, πολύ πιο
δύσκολο από το αντίστοιχο πρόβλημα για το CO (βλ. Χημική ένωση του μήνα:
Μονοξείδιο του άνθρακα), το οποίο παραδοσιακά ήδη αποτελούσε μια δύσκολη
περίπτωση.
Η
ποσοτική περιγραφή του είδους των δεσμών, των ηλεκτρονιακών πυκνοτήτων και
των ηλεκτροστατικών δυνάμεων στο Ν2Ο
αποτελούσε πάντοτε ένα πρόβλημα για τους θεωρητικούς χημικούς, πολύ πιο
δύσκολο από το αντίστοιχο πρόβλημα για το CO (βλ. Χημική ένωση του μήνα:
Μονοξείδιο του άνθρακα), το οποίο παραδοσιακά ήδη αποτελούσε μια δύσκολη
περίπτωση.
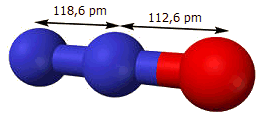
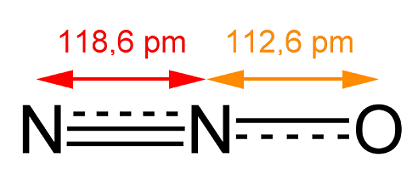
Tο
μόριο του υποξειδίου του αζώτου είναι γραμμικό και μη συμμετρικό μόριο του
οποίου η ηλεκτρονιακή μορφή μπορεί να παρασταθεί με τη μεσομέρεια που
υποδηλώνεται (κυρίως) από τους κατά Lewis τύπους Ια και Ιβ
ή (ισοδύναμα) τους τύπους ΙΙα και ΙΙβ. Και στις δύο μεσομερείς μορφές και
στα τρία άτομα τηρείται ο
κανόνας
της οκτάδας (octet rule).
Επιπλέον, και στις δύο μορφές το μεσαίο άτομο αζώτου έχει περίσσευμα θετικού
φορτίου αφού παρέχει ηλεκτρόνιο είτε στο άτομο οξυγόνου (μορφή α), είτε στο
ακρινό άτομο αζώτου (μορφή β), τα οποία έτσι διαθέτουν περίσσευμα αρνητικού
φορτίου. Επικρατέστερη μορφή είναι η Ια (ή ΙΙα), που είναι και πιο συμβατή
με τη μεγαλύτερη ηλεκτραρνητικότητα του οξυγόνου ως προς το άζωτο.
Σημείωση: Τα χρώματα στα
ηλεκτρόνια των δομών Ια και Ιβ βοηθούν μόνο στην παρακολούθηση των
ηλεκτρονίων που προσφέρει ή δέχεται το κάθε ένα άτομο του μορίου. Στην
πραγματικότητα τα ηλεκτρόνια εναλλάσσονται μεταξύ τους και δεν διακρίνονται
πλέον σε ηλεκτρόνια
του ενός ή του άλλου ατόμου.
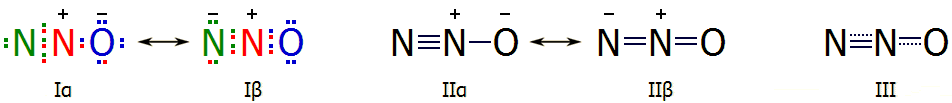
Και οι δύο μορφές συνενώνονται στον τύπο ΙΙΙ (δομή συντονισμού), που υποδηλώνει
τάξη δεσμού 2 έως 3 για το δεσμό Ν-Ν (ακριβής τιμή:
2,73) και 1 έως 2 για τον δεσμό Ο-Ν (ακριβής τιμή: 1,61). Το μόριο εμφανίζει
μια (κατά μέση τιμή) άνιση κατανομή φορτίου, που οδηγεί σε μια σχετικώς μικρή τιμή
διπολικής ροπής
0,166 D (Debye). Κατά
πάσα πιθανότητα το αρνητικό σκέλος του διπόλου βρίσκεται προς το άτομο του
οξυγόνου, λόγω της μεγαλύτερης ηλεκτροαρνητικότητας του Ο έναντι του Ν, όπως και
λόγω της ισχύος του
δεσμού Ν-Ν (δηλ. επικρατεί η δομή Ια ή η ΙΙα).
Συγκριτικά, δίνονται κάποιες
ενδεικτικές τιμές διπολικής ροπής (σε D) ορισμένων απλών μορίων (σε
αέρια φάση):
|
Οξείδια του
αζώτου και συνοπτική περιγραφή των ιδιοτήτων τους
Το άζωτο σχηματίζει
μια σειρά οξειδίων των οποίων οι χημικοί τύποι και οι κύριες
φυσικές και χημικές ιδιότητες παρουσιάζονται σχηματικά στον
επόμενο πίνακα:
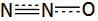 |
 |
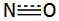 |
 |
 |
 |
|
Υποξείδιο του αζώτου
ή
οξείδιο διαζώτου
(Nitrous oxide) Ν2Ο:
'Αχρωμο
αέριο, σ.τ. -90,86ºC,
σ.ζ.
-88,48ºC. Πρακτικώς χημικώς αδρανές σε συνήθεις
θερμοκρασίες. Διασπάται σε υψηλές θερμοκρασίες (>600ºC). Χρησιμοποιείται ως αναισθητικό αέριο. |
Μονοξείδιο του αζώτου (Nitric oxide), ΝΟ:
'Αχρωμο
αέριο, σ.τ. -164ºC,
σ.ζ.
-152ºC. Χημικώς δραστικό. Αντιδρά αμέσως με το
οξυγόνο του αέρα παρέχοντας το τοξικό ΝΟ2. Διασπάται
στα συστατικά του σε υψηλές θερμοκρασίες (1100-1200ºC). Δρα ως υποκαταστάτης. Παρουσιάζει έντονη
βιοχημική δράση. |
Τριοξείδιο διαζώτου (Dinitrogen trioxide), Ν2Ο3:
Βαθυκύανο
στερεό ή υγρό,
σ.τ. -100,1ºC,
σ.ζ. 3ºC.
Σταθερό μόνο σε πολύ χαμηλές θερμοκρασίες. Ανυδρίτης του νιτρώδους οξέος (ΗΝΟ2).
Αντιδρά με το νερό παρέχοντας νιτρώδες οξύ το οποίο
διασπάται σύντομα σε ΝΟ και ΗΝΟ3.
Διασπάται σταδιακά πάνω από το σ.τ. σε
NO και ΝΟ2.
|
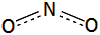 |
 |
 |
 |
 |
 |
|
Διοξείδιο αζώτου (Nitrogen dioxide), ΝΟ2:
'Εντονα
πορτοκαλόχρωμο αέριο,
σ.ζ. 21ºC.
Χημικώς δραστικό, ισχυρό οξειδωτικό, χαρακτηριστικής
γλυκιάς οσμής (σε χαμηλές συγκεντρώσεις), τοξικό.
Βρίσκεται σε ισορροπία με το Ν2Ο4. Αντιδρά με το νερό παρέχοντας
ΗΝΟ2
και ΗΝΟ3.
|
Τετροξείδιο
του διαζώτου (Dinitrogen tetroxide), Ν2Ο4:
'Αχρωμο
αέριο/πορτοκαλόχρωμο
υγρό,
σ.τ. -11ºC,
σ.ζ.
21ºC.
Βρίσκεται πάντοτε σε ισορροπία με το διοξείδιο του
του αζώτου και έχει τις ίδιες χημικές ιδιότητες.
Χρησιμοποιείται ως υγρό καύσιμο (οξειδωτικό)
πυραύλων.
|
Πεντοξείδιο του διαζώτου ή
νιτρικός ανυδρίτης (Dinitrogen tetroxide, nitric
acid anhydrite), Ν2Ο5:
Λευκό κρυσταλλικό στερεό,
σ.τ. 41ºC,
σ.ζ.
(εξαχνώνεται) 47ºC.
Ισχυρό οξειδωτικό, αντιδρά με το νερό παρέχοντας
νιτρικό οξύ.
|
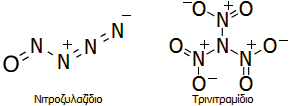
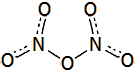
'Αλλες
ενώσεις αζώτου - οξυγόνου λιγότερο γνωστές είναι:
α) Το
νιτροζυλαζίδιο (nitrosylazide) με
μοριακό τύπο Ν4Ο.
Παρασκευάζεται με αντίδραση νιτροζυλοχλωριδίου (NOCl)
με νατραζίδιο (NaN3).
Πρόκειται για ένα ελαφρά κίτρινο στερεό, σταθερό μόνο σε πολύ
χαμηλές θερμοκρασίες (<-50ºC).
β) Το
τρινιτραμίδιο (trinitramide) με
μοριακό τύπο Ν4Ο6
του οποίου η ύπαρξη αποδείχθηκε μόλις πρόσφατα (2010). Θεωρείται πως θα μπορούσε να αποτελέσει
δραστικότατο
προωθητικό πυραύλων.
Οι συντακτικοί τύποι
αυτών των δύο ενώσεων δίνονται παραπλεύρως.
|
Παρασκευές του υποξειδίου του αζώτου
[Αναφ. 1γ, 3]
Βιομηχανική μέθοδος. Το υποξείδιο του αζώτου παρασκευάζεται σε
βιομηχανική κλίμακα με θερμική διάσπαση στερεού νιτρικού αμμωνίου (αντίδραση
1) ή ισομοριακού μίγματος NaNO3
και (NH4)2SO4. Η ίδια αντίδραση μπορεί να χρησιμοποιηθεί και
για την εργαστηριακή παρασκευή μικρών ποσοτήτων του αερίου.
Το νιτρικό αμμώνιο διασπάται
στην περιοχή θερμοκρασιών 180-250ºC,
αλλά σε θερμοκρασίες μεγαλύτερες από 300ºC
η αντίδραση γίνεται εκρηκτική. Στο άλας αυτό συνυπάρχουν μία αναγωγική ομάδα
(κατιόν αμμωνίου, Ν με αριθμό οξειδώσεως -3) και μία οξειδωτική ομάδα
(νιτρικό ανιόν, Ν με αριθμό οξειδώσεως +5) και το γεγονός αυτό το καθιστά "μετασταθερό". 'Ετσι, το ΝΗ4ΝΟ3 πρέπει να θεωρηθεί γενικά ως
μια χημική ένωση που απαιτεί προσεκτικούς χειρισμούς και υπάρχει
ιστορικό
τρομακτικών εκρήξεών του.
Στη βιομηχανική παρασκευή
υποξειδίου του αζώτου ο αντιδραστήρας
που περιέχει το ΝΗ4ΝΟ3 θερμαίνεται με υπέρθερμο ατμό στους 250ºC
και επειδή η αντίδραση διάσπασής του είναι εξώθερμη, απαιτείται προσεκτικός
έλεγχος της θερμοκρασίας.
Ωστόσο, παρά τον έλεγχο αυτό υπήρξαν περιπτώσεις εκρήξεων που κατέστρεψαν τόσο
τα εργοστάσια, όσο και τις παρακείμενες κατοικίες (το
1966 στη βιομηχανία Ohio
Chemical, στο Montreal και το 1977 στη
βιομηχανία Air
Products & Chemicals, στο Delaware City).
Σε μικρό ποσοστό το NH4NO3
διασπάται προς Ν2 και ΝΟ
(αντίδραση 2), αλλά και προς ΝΗ3
και ΗΝΟ3. Το παραγόμενο Ν2Ο
πρέπει να απαλλαχθεί από μικροποσότητες όξινων (ΝΟ2,
ΗΝΟ3)
και αλκαλικών προσμίξεων (ΝΗ3) με διαβίβαση των αερίων προϊόντων
διάσπασης μέσω διαλυμάτων ισχυρής βάσης και ισχυρού οξέος,
ενώ μικροποσότητες ΝΟ δεσμεύονται με διάλυμα
FeSO4
σχηματίζοντας καστανόχρωμο σύμπλοκο [γνωστό από τη δοκιμασία
ανίχνευσης νιτρικών σε ισχυρώς όξινο διάλυμα με άλατα Fe(II)] (αντίδραση 3):
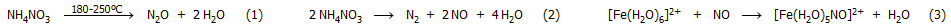
Μηχανισμός της
αντίδρασης διάσπασης του NH4NO3
Αν και η
αντίδραση (1) είναι μια απλή αντίδραση απόσπασης ύδατος, ο
μηχανισμός της είναι πιο πολύπλοκος και εμπλέκει αντιδράσεις
οξειδοαναγωγής μεταξύ των ατόμων αζώτου με αριθμούς οξείδωσης -3
και +5. Αυτό αιτιολογεί και την παρουσία Ν2
και ΝΟ ως παραπροϊόντα της αντίδρασης. Πιθανός μηχανισμός της
διάσπασης του ΝΗ4ΝΟ3
είναι ο εξής: Το άλας διασπάται σε αμμωνία και νιτρικό οξύ,
ακολουθεί αυτοπρωτόλυση του νιτρικού οξέος, που παρέχει το
κατιόν του νιτρωνίου, το οποίο αντιδρά με την αμμωνία με τελικό
σχηματισμό Ν2Ο,
σύμφωνα με τις αντιδράσεις:
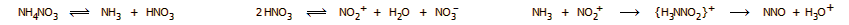
Ο μηχανισμός αυτός
συμβαδίζει με τα προϊόντας της θερμικής διάσπασης ισοτοπικά
σημασμένου ΝΗ4ΝΟ3: Το 15ΝΗ4ΝΟ3
παρέχει 15ΝΝΟ, ενώ το ΝΗ415ΝΟ3
παρέχει Ν15ΝΟ. |
 |
Η εργαστηριακή παρασκευή υποξειδίου
του αζώτου με θέρμανση στερεού νιτρικού αμμωνίου
ΑΠΟΤΕΛΕΙ ΕΝΑ
ΕΠΙΚΙΝΔΥΝΟ ΠΕΙΡΑΜΑ
!!
Και αν ακόμη αποφευχθεί κάποια
έκρηξη, το παραγόμενο αέριο περιέχει ποσότητες άλλων οξειδίων του
αζώτου ή νιτρικού οξέος που το καθιστούν
ιδιαίτερα επικίνδυνο για εισπνοή. |
 |
Εργαστηριακές μέθοδοι.
Η θερμική διάσπαση του νιτρικού αμμωνίου αποτελεί την κύρια και συχνότερα
αναφερόμενη εργαστηριακή
μέθοδο παρασκευής μικρών ποσοτήτων υποξειδίου του αζώτου. Ωστόσο, η μέθοδος
αυτή για τους λόγους που προαναφέρθηκαν δεν είναι ασφαλής και έχουν προταθεί
διάφορες παραλλαγές της.
Αναφέρεται πως η προσθήκη μικρής ποσότητας
φωσφορικών αλάτων καθιστά τη διάσπαση του ΝΗ4ΝΟ3
εφικτή και σε χαμηλότερες θερμοκρασίες και επομένως ασφαλέστερη. Μια επίσης ασφαλέστερη παραλλαγή της μεθόδου βασίζεται
στη θέρμανση διαλύματος ΝΗ4ΝΟ3
σε αραιό ΗΝΟ3
παρουσία χλωριούχου άλατος
[Αναφ. 3γ].
Μια ασφαλής εργαστηριακή παρασκευή
υποξειδίου του αζώτου, που δεν βασίζεται στο ΝΗ4ΝΟ3, πραγματοποιείται με ανάμιξη υδατικών διαλυμάτων νιτρώδους άλατος
(π.χ. NaNO2)
και άλατος υδροξυλαμίνης (π.χ. Η3ΝΟΗ+Cl-)
(αντίδραση 4). Η αντίδραση είναι εξώθερμη και ανάλογα με τις συγκεντρώσεις
των διαλυμάτων, ενδεχομένως θα χρειαστεί ψύξη του αντιδρώντος μίγματος για
να αποφευχθεί μια έντονη αντίδραση. Ανάλογη είναι και η παρασκευή υποξειδίου
του αζώτου με αντίδραση νιτρώδους άλατος
με άλατα υδραζίνης ή του υδραζωτικού οξέος σε όξινο περιβάλλον (βλ. Χημική ένωση του
μήνα:
Υδραζωτικό οξύ και άλατά του) (αντιδράσεις 5 και 6). Σε κάθε περίπτωση, και με τις αντιδράσεις αυτές
το λαμβανόμενο αέριο μπορεί να περιέχει μικροποσότητες άλλων τοξικών
οξειδίων του αζώτου (ΝΟ, ΝΟ2)
και δεν είναι κατάλληλο για εισπνοή αν προηγουμένως δεν υποστεί διαδικασία
καθαρισμού:
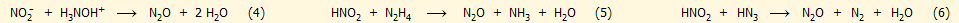
Μικροποσότητες υποξειδίου του αζώτου (μαζί με
άλλα οξείδια του αζώτου) μπορεί να παραχθούν κατά την αντίδραση σχετικά
αραιού νιτρικού οξέος με μέταλλα. Καλύτερες αποδόσεις λαμβάνονται κατά την
αναγωγή του νιτρικού οξέος με διάλυμα Sn(ΙΙ) σε HCl (αντίδραση 7):
4 SnCl2 + 8 HCl +
2 HNO3
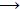 4 SnCl4 + N2O + 5 H2O
(7)
4 SnCl4 + N2O + 5 H2O
(7)
Ανάλογα, υποξείδιο του αζώτου παράγεται κατά την
οξείδωση μυρμηκικού και οξαλικού οξέος με νιτρικό οξύ. Το υποξείδιο του αζώτου αποτελεί
σημαντικό παραπροϊόν της
βιομηχανικής παραγωγής νιτρικού οξέος με οξείδωση της αμμωνίας, όπως επίσης και της οξείδωσης της κυκλοεξανόλης
με νιτρικό οξύ για την παρασκευή αδιπικού οξέος, το οποίο χρησιμοποιείται σε
μεγάλες ποσότητες για την παρασκευή Nylon (βλ. παρακάτω).
Χημικές ιδιότητες του υποξειδίου του αζώτου
Σε συνήθεις θερμοκρασίες το
υποξείδιο του αζώτου είναι ουσιαστικά χημικώς αδρανές. Δεν αντιδρά με
οξέα, βάσεις, ισχυρά αναγωγικά ή οξειδωτικά μέσα, ακόμη και με τα μέταλλα
των αλκαλίων και τα αλογόνα. Λόγω της μεγάλης ενέργειας ενεργοποίησης της
διάσπασής του, το Ν2Ο απαιτεί υψηλές θερμοκρασίες
(πάνω από τους 600ºC)
για να καταστεί θερμοδυναμικώς ασταθές και να διασπαστεί στα συστατικά του παρέχοντας
σημαντικά ποσά θερμότητας (αντίδραση 8):
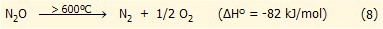
Η καταλυτική διάσπαση του υποξειδίου του αζώτου
σε χαμηλότερες θερμοκρασίες αποτελεί ερευνητικό αντικείμενο ιδιαίτερου
ενδιαφέροντος μετά τη διαπίστωση του γεγονότος ότι το Ν2Ο
αποτελεί αέριο θερμοκηπίου και λόγω των προσπαθειών που καταβάλλονται για τη
μείωση των βιομηχανικών εκπομπών του (βλ. παρακάτω).
To N2O
θα μπορούσε να θεωρηθεί ως ανυδρίτης του ασταθούς
υπονιτρώδους οξέος (hyponitrous acid, Η2Ν2Ο2),
στο σημείο που και το CO θα μπορούσε να θεωρηθεί ως ανυδρίτης του μυρμηκικού
οξέος. Ωστόσο, αν και τα δύο οξείδια αποτελούν προϊόντα αφυδάτωσης των δύο
οξέων (αντιδράσεις 9 και 10), οι αντιδράσεις αυτές δεν διαθέτουν την
αντιστρεπτότητα που
προϋποθέτει ο όρος "ανυδρίτης οξέος", ώστε τα δύο οξείδια να
χαρακτηρισθούν ανυδρίτες των αντίστοιχων οξέων.
Η2Ν2Ο2
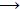 Ν2Ο + Η2Ο
(9) HCOOH
Ν2Ο + Η2Ο
(9) HCOOH
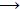 CO + H2O
(10)
CO + H2O
(10)
Κάθε καύσιμο αέριο (π.χ. υδρογόνο, μεθάνιο,
ακετυλένιο) καίγεται σε μίγμα με το υποξείδιο του αζώτου παρέχοντας φλόγα
μεγάλης θερμοκρασίας, δεδομένου ότι κατά την καύση αποδίδεται και η ενέργεια
που είναι αποθηκευμένη στο ίδιο οξειδωτικό (αντιδράσεις 10-12):
H2 + N2O
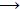 H2O + N2 (11)
CH4 + 3
N2O
H2O + N2 (11)
CH4 + 3
N2O
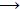 CO2 + 3
N2
(12) C2H2
+ 5
N2O
CO2 + 3
N2
(12) C2H2
+ 5
N2O
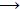 2 CO2
+ 5
N2 + H2O
(13)
2 CO2
+ 5
N2 + H2O
(13)
Στο σημείο αυτό θα πρέπει να τονιστεί το ότι το
Ν2Ο,
παρά το ότι δρα σαν το οξυγόνο, δεν διατηρεί τη ζωή και είναι
ασφυκτικό αέριο, αφού μόνο σε πολύ υψηλές
θερμοκρασίες μπορεί να αποδώσει το οξυγόνο του ή γενικά να δράσει ως
οξειδωτικό.
Μία από τις λίγες αντιδράσεις του υποξειδίου
του αζώτου είναι ο σχηματισμός αζιδίων κατά την αντίδρασή του με τήγμα
αμιδίων των αλκαλίων (αντίδραση 14). Η αντίδραση αυτή χρησιμοποιείται για τη
βιομηχανική παραγωγή νατραζιδίου (NaN3), που αποτελεί την πρώτη ύλη για την παραγωγή πυροκροτητών
και καψυλίων, όπως και κύριο συστατικό του μίγματος που χρησιμοποιείται για την
ακαριαία (σχεδόν εκρηκτική) παραγωγή αζώτου στους αερόσακους ασφαλείας των αυτοκινήτων
(βλ. Χημική ένωση του μήνα:
Υδραζωτικό οξύ και άλατά του). Νατραζίδιο μπορεί να
παραχθεί και με την απ' ευθείας αντίδραση υποξειδίου του αζώτου με διάλυμα
νατρίου σε υγρή αμμωνία, χωρίς να χρειαστεί η προηγούμενη απομόνωση του νατραμιδιου (αντίδραση 15):
2 NaNH2 + N2O
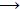 NaN3 + NaOH + NH3
(14)
4 Na + 3 N2O + NH3
NaN3 + NaOH + NH3
(14)
4 Na + 3 N2O + NH3
 NaN3 + 3 NaOH + 2 N2
(15)
NaN3 + 3 NaOH + 2 N2
(15)
|
|
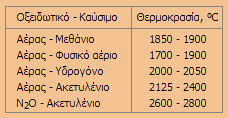
Το
Ν2Ο
στη Φασματομετρία Ατομικής Απορρόφησης
[Αναφ. 3στ]
Το υποξείδιο του
αζώτου χρησιμοποιείται σε αρκετές περιπτώσεις ως οξειδωτικό
αέριο σε συνδυασμό με διάφορα καύσιμα αέρια (κυρίως ακετυλένιο)
στη φασματομετρία ατομικής απορρόφησης φλόγας (flame atomic
absorption spectroscopy) για την επίτευξη φλόγας μεγαλύτερης
θερμοκρασίας. Στον παραπλεύρως πίνακα δίνονται χαρακτηριστικές
θερμοκρασίες των πλέον χρησιμοποιούμενων μιγμάτων
οξειδωτικού-καυσίμου στην τεχνική αυτή.
Σε περιπτώσεις που τα
ανόργανα άλατα
διασπώνται σε άτομα σε ανεπαρκή βαθμό σε ψυχρότερες φλόγες, η φλόγα Ν2Ο
- C2H2
παρέχει αρκετή θερμική ενέργεια για να προκαλέσει πλήρη
διάσπαση. Τυπικό παράδειγμα αποτελεί η παρεμπόδιση που προκαλεί
το ασβέστιο στη μέτρηση αργιλίου, λόγω του σχηματισμού του
δύστηκτου αργιλικού ασβεστίου όταν χρησιμοποιούνται ψυχρότερες
φλόγες. Με τη χρήση φλόγας Ν2Ο
- C2H2,
η παρεμπόδιση του ασβεστίου αποφεύγεται. Ανάλογα, παρακάμπτεται
και η παρεμπόδιση των φωσφορικών ιόντων στον προσδιορισμό
ασβεστίου λόγω του σχηματισμού του δύστηκτου Ca3(PO4)2. |
Το υποξείδιο του αζώτου ως αναισθητικό αέριο
[Αναφ. 4]
 |
 |
 |
|
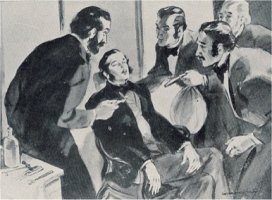
Horace Wells (1815-1848), ο οποίος καθιέρωσε τη
χρήση του υποξειδίου του αζώτου στην οδοντιατρική. Θεωρείται ο
πατέρας των σύγχρονων πρακτικών αναισθησίας. Πέθανε σε ηλικία 33
ετών κάτω από τραγικές συνθήκες. |
Ιστορία της χρήσης
του. 'Οπως αναφέρθηκε εισαγωγικά, ο Davy ήδη από το 1800
είχε προτείνει τη χρήση του υποξειδίου του αζώτου ως αναισθητικού. Ωστόσο,
χρειάστηκε να περάσουν ακόμη 40 χρόνια μέχρις ότου γίνει η πρώτη χρήση του
από τον Αμερικανό οδοντίατρο
Horace Wells (1815-1848).
Ο Wells πειραματίστηκε με επιτυχία
στον εαυτό του ζητώντας από συνάδελφό του να του πραγματοποιήσει μια εξαγωγή
φρονιμίτη. Ωστόσο, το 1845 μια ανεπιτυχής επίδειξη σε νοσοκομείο της
Βοστόνης, πιθανώς λόγω χορήγησης μικρότερης ποσότητας αερίου ή ψευδούς
αντίδρασης του ασθενούς, κατέστρεψε τη
φήμη του ως ιατρού και τον κατέβαλε ψυχικά.
Ο Wells συνέχισε να δοκιμάζει ο ίδιος διάφορες
ναρκωτικές ουσίες, αλλά μετά από μια εβδομάδα συνεχών πειραμάτων που έκανε
στον εαυτό του με χλωροφόρμιο, περιήλθε σε κατάσταση αμόκ με αποτέλεσμα
να διαπράξει αναιτιολόγητες βίαιες ενέργειες. 'Οταν μετά τη σύλληψή του
συνήλθε και κατάλαβε τι είχε κάνει, αυτοκτόνησε.
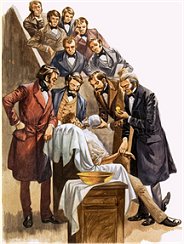
Η ουσιαστική χρήση του υποξειδίου του αζώτου ως
αναισθητικού στην οδοντιατρική άρχισε το 1863 από τον
Gardner Quincy Colton, ο οποίος
το χρησιμοποίησε σε μια σειρά ιδιόκτητων οδοντιατρικών κλινικών ("Colton
Dental Association") στο New Haven και στην Νέα Υόρκη. Μέσα σε τρία
χρόνια, ο Colton και οι συνεργάτες χορήγησαν με επιτυχία το αέριο σε
περισσότερους από 25.000 ασθενείς.
Το υποξείδιο του
αζώτου στην οδοντιατρική. Το υποξείδιο του αζώτου παρέχει μια πολύ
ήπια νάρκωση και μπορεί να χρησιμοποιηθεί μόνο σε ελαφριές επεμβάσεις. Σε
καμιά περίπτωση δεν μπορεί να αντικαταστήσει ισχυρότερες εισπνεόμενες
κλασικές (αιθέρας, χλωροφόρμιο) ή σύγχρονες αναισθητικές ουσίες (αλοθάνιο,
διάφορα φλουράνια) (βλ. Χημική ένωση του μήνα:
Χλωροφόρμιο), που χρησιμοποιούνται σε σοβαρές, αιματηρές εγχειρίσεις.
Σήμερα το υποξείδιο του αζώτου ως αναισθητικό
αέριο χρησιμοποιείται
σχεδόν αποκλειστικά στην οδοντιατρική και κυρίως ως αγχολυτικό
("χαλαρωτικό") και ως συμπλήρωμα άλλων τοπικών
αναισθητικών. Χορηγείται μαζί με οξυγόνο σε αναλογία Ν2Ο:Ο2
από 40:60 έως 70:30 (συνήθως 60:40) και δρα σχεδόν αμέσως, ενώ
αποβάλλεται μέσα σε 3-5 λεπτά από τον οργανισμό μετά τη χορήγηση. Ο ασθενής
υπόκειται σε μια ήπια νάρκωση, εξακολουθεί να είναι δεκτικός σε
προφορικές εντολές και τα αμυντικά για τον οργανισμό αντανακλαστικά (βήχας,
λαρυγγικός σπασμός) λειτουργούν κανονικά. Είναι ιδιαίτερα χρήσιμο για
ασθενείς που αντιμετωπίζουν με φόβο τον οδοντίατρο, όπως επίσης και για παιδιά. Με τη χρήση του, ο
ασθενής ηρεμεί και δέχεται εύκολα την ένεση του τοπικού αναισθητικού.
Γενικώς, συνιστάται να αποφεύγεται η
χορήγηση υποξειδίου του αζώτου σε εγκύους γυναίκες, όπως και σε άτομα που
πάσχουν από έλλειψη βιταμίνης Β12 (κοβαλαμίνη) (βλ. παρακάτω).
|
 |
 |
|
Με ρυθμιστές όπως ο παραπάνω εικονιζόμενος
ρυθμίζεται επακριβώς η αναλογία Ν2Ο:Ο2
κατά τη χορήγηση του Ν2Ο
ως αναισθητικού |
Το
Entonox είναι μίγμα 50:50 Ν2Ο:Ο2
έτοιμο να χρησιμοποιηθεί ως εισπνεόμενο ήπιο αναισθητικό και
αναλγητικό αέριο.
|
Οι πρώτες
συσκευές για την διοχέτευση του αερίου ήταν γνωστές ως
nitrous
oxide inhalers, οι
οποίες σχεδιάσθηκαν
έτσι ώστε να είναι απλή η αποθήκευση και η χορήγηση του αερίου μέσω ενός αναπνευστικού
ασκού από ελαστικό καουτσούκ και ύφασμα (αργότερα είχαν
και μετρητή του αερίου). Σήμερα έχουν αντικατασταθεί με αυτόματες μηχανές
που αποδίδουν το αέριο με ακρίβεια και σε ορισμένες δόσεις αναμιγνύοντάς το σε ρυθμιζόμενες αναλογίες με οξυγόνο. Είναι αυτονόητο ότι
απαιτείται καλός εξαερισμός των ιατρείων στα οποία γίνεται χρήση του αερίου.
Στο εμπόριο διατίθεται σε
φιάλες μίγμα υποξειδίου του αζώτου και οξυγόνου σε αναλογία Ν2Ο:Ο2
50:50 με την εμπορική ονομασία
Entonox. Το μίγμα αυτό είναι
έτοιμο για να χορηγηθεί ως εισπνεόμενο ήπιο αναισθητικό και
αναλγητικό αέριο, χωρίς να χρειάζονται ειδικά συστήματα ρύθμισης
της αναλογίας των αερίων.
Μηχανισμός δράσης.
Το υποξείδιο του αζώτου δρα ως αγχολυτική, αναλγητική και ευφορική
ουσία. Ο μηχανισμός δράσης του αποτελεί το αντικείμενο εντατικής έρευνας και
δεν φαίνεται να έχει διευκρινιστεί πλήρως. Σε πολύ γενικές γραμμές εικάζεται
ότι το Ν2Ο
συνδέεται με κάποιες πρωτεΐνες των μεμβρανών των νευρικών κυττάρων
(νευρώνες), με αποτέλεσμα την τροποποίηση της ροής των ιόντων και της
συναπτικής επικοινωνίας μεταξύ των νευρώνων. Ανάλογα, οι αναισθητικές
ιδιότητες αποδίδονται επίσης και στη μεγάλη λιποφιλικότητά του που
ενδεχομένως τροποποιεί τις ιδιότητες της λιποειδούς μεμβράνης των νευρώνων
με παρόμοια όπως πριν αποτελέσματα. Ειδικότερα συμπεράσματα εξάγονται έμμεσα κυρίως από
τη δράση γνωστών ανταγωνιστών υποδοχέων νευρικών απολήξεων πάνω στην ένταση
της φυσιολογικής δράσης του Ν2Ο.
Στην αγχολυτική δράση του του υποξειδίου του
αζώτου μεσολαβούν οι
υποδοχείς GABA-A (GABA-A receptors, GABA: γ-αμινοβουτυρικό οξύ),
όπως και οι
υποδοχείς NMDA (NMDA receptors, NMDA: Ν-μεθυλο-D-ασπαρτικό οξύ). Η
δράση αυτή είναι παρόμοια με εκείνη των βενζοδιαζεπινών, μιας τάξης
πανίσχυρων αγχολυτικών φαρμάκων. Αυτό αποδεικνύεται από το ότι η χορήγηση ουσιών που μπλοκάρουν τους υποδοχείς των βενζοδιαζεπινών μειώνει και τη δράση του N2O.
Η αναλγητική δράση του υποξειδίου του αζώτου
έχει συνδεθεί με το σύστημα ενδογενών οπιοειδών, όπως είναι π.χ. οι
ενδορφίνες. Σύμφωνα με την περισσότερο αποδεκτή θεωρία η αναλγητική δράση
του οφείλεται στην αλληλεπίδρασή του με τους
υποδοχείς οπιοειδών (opioid receptors), δηλαδή τους υποδοχείς που
ενεργοποιούνται από ναρκωτικά, όπως είναι η μορφίνη και η ηρωΐνη (βλ. Χημική ένωση
του μήνα:
Μεθαδόνη). Στο συμπέρασμα αυτό συνηγορεί το γεγονός ότι η αναλγητική δράση του
N2O είναι περιορισμένη ή ανύπαρκτη σε άτομα στα οποία
έχουν προηγουμένως χορηγηθεί ουσίες όπως αυτές ή ουσίες που μπλοκάρουν τους
υποδοχείς οπιοειδών. Στην ουσία δρα ως
αναστολέας νευροδιαβιβαστών περιορίζοντας την επικοινωνία μεταξύ των
νευρώνων στις συνάψεις τους, προκαλώντας έτσι μια υπολειτουργία του νευρικού
συστήματος [Αναφ. 5].
Η ευφορική δράση του υποξειδίου του αζώτου
συνδυάζεται με την αναλγητική δράση και -σε πολύ γενικές γραμμές- οφείλεται
στην έκλυση
ντοπαμίνης, ως αποτέλεσμα της ενεργοποίησης της
μεσομεταιχμικής διαδρομής ανταμοιβής (mesolimbic
reward pathway) του εγκεφάλου. Ο ερεθισμός των νευρώνων αυτών των περιοχών
του εγκεφάλου δημιουργεί ευχάριστα αισθήματα που ενθαρρύνουν την επανάληψη,
όπως συμβαίνει με πολλές ουσίες η χρήση των οποίων προκαλεί εθισμό σε μικρό
ή μεγάλο βαθμό (βλ.
Χημική ένωση του μήνα:
Νικοτίνη).
Τοξικότητα του υποξειδίου του αζώτου
[Αναφ. 6]
|
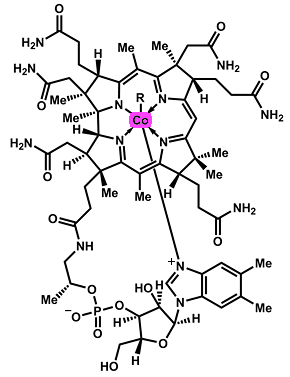
Βιταμίνη Β12 (R:
5'-δεοξυαδενοσύλιο, -CH3,
-OH, -CN) |
Το υποξείδιο του αζώτου δεν είναι καρκινογόνο,
ούτε παρουσιάζει κάποια μεταλλαξιγόνο δράση. Ωστόσο, έχει διαπιστωθεί ότι
χορηγούμενο ως αναισθητικό σε πειραματόζωα (αρουραίους) μπορεί να προκαλέσει αυτόματες αποβολές και
καθυστέρηση στην ανάπτυξη εμβρύων. Επίσης, προκαλεί εμετό και ναυτία στο 15%
των ασθενών, ενώ μακροχρόνια επαγγελματική έκθεση αναστέλλει την ανάπτυξη
των κυττάρων του μυελού των οστών, δηλαδή επιδρά δυσμενώς στην αιμοποιητική
ικανότητα του οργανισμού.
Τα προβλήματα υγείας που προκαλεί η μακροχρόνια εισπνοή
του υποξειδίου του αζώτου οφείλονται στο γεγονός ότι το αέριο αυτό
καταστρέφει τη
βιταμίνη Β12
(κοβαλαμίνη). H B12
είναι απαραίτητη για την ανάπτυξη και τη διατήρηση υγιούς του νευρικού
συστήματος, για την παραγωγή του DNA και για τη δημιουργία των ερυθρών
αιμοσφαιρίων.
Η δραστική μορφή της βιταμίνης περιέχει κοβάλτιο σε μονοσθενή
κατάσταση, Co(I), το οποίο οξειδώνεται από το N2O
προς Co(II) και Co(III), γεγονός το οποίο καθιστά τη βιταμίνη βιοχημικώς
αδρανή. Η βιταμίνη B12 δρα ως συνένζυμο της
συνθετάσης
της μεθειονίνης, ενός βασικού ενζύμου για την αναγέννηση της μεθειονίνης
από την
ομοκυστεΐνη και του
μεταβολισμού του φυλλικού οξέος (βλ. Χημική ένωση του μήνα:
Φυλλικό οξύ) και η απουσία της Β12 αναστέλλει τη λειτουργία του ενζύμου.
Πρόσφατες μελέτες
έδειξαν κάποια συσχέτιση της αναισθησίας με υποξείδιο του αζώτου με την
αύξηση των επιπέδων της ομοκυστεΐνης στο αίμα, που θεωρείται
παράγοντας κινδύνου για την εκδήλωση καρδιαγγειακής
νόσου, αγγειακού εγκεφαλικού επεισοδίου και φλεβικής θρόμβωσης.
|

Παθητικό δοσίμετρο αερίων, όπως του Ν2Ο
[πηγή]. |
Παρατεταμένη έκθεση σε μεγάλες συγκεντρώσεις του αερίου
(π.χ. στους κατά εξακολούθηση χρήστες του αερίου), αλλά ακόμη και στους
εργαζόμενους σε οδοντιατρεία, μπορεί να προκαλέσει
μεγαλοβλαστική αναιμία, ως αποτέλεσμα αναστολής της λειτουργίας του
προανεφερθέντος ενζύμου. Επίσης, προκαλεί μείωση
των λευκών αιμοσφαιρίων, που
είναι σημαντικοί παράγοντες καταπολέμησης των μολύνσεων, όπως και των
αιμοπεταλίων,
που είναι απαραίτητα για την πήξη του αίματος. Η χορήγηση βιταμίνης Β12
θεραπεύει τα συμπτώματα, αλλά η πλήρης θεραπεία είναι μακροχρόνια και συνήθως
ατελής.
Γενικά, η
χορήγηση υποξειδίου του αζώτου σε άτομα που ήδη πάσχουν από ανεπάρκεια βιταμίνης
Β12 χωρίς να το γνωρίζουν (όπως και συνήθως συμβαίνει), είναι πολύ πιθανό να
προκαλέσει σ' αυτά σοβαρά προβλήματα υγείας.
'Ορια
έκθεσης: Η Υπηρεσία Προστασίας του
Περιβάλλοντος (Environmental
Protection Agency,
EPA)
προτείνει η ανώτατη συγκέντρωση του Ν2Ο σε κλειστούς χώρους να μην ξεπερνάει
τα 50 μέρη ανά εκατομμύριο
(ppm).
Μελέτες σε σπίτια και χώρους εργασίας δείχνουν ότι συσκευές θέρμανσης και
καύσης υγραερίου, που δεν έχουν εξωτερικό αερισμό, μπορούν να δημιουργήσουν
υψηλές συγκεντρώσεις που φθάνουν μέχρι και τα 900
ppm.
Τα όρια για έκθεση σε Ν2Ο σε εργασιακό περιβάλλον έχουν ορισθεί στα περίπου 100
ppm
για σύντομο χρονικό διάστημα.
Η μέτρηση
της έκθεσης εργαζομένων (π.χ. σε οδοντοϊατρεία) σε Ν2Ο
συνήθως πραγματοποιείται με διάφορα δοσίμετρα, όπως τα
δοσίμετρο Landauer
(Landauer nitrous oxide
monitor, NITROX(R)).
Πρόκειται για "παθητικά" δοσίμετρα τύπου διάχυσης, τα οποία οι εργαζόμενοι
σε χώρους που υπάρχουν εκπομπές διάφορων αερίων τα φορούν σαν κονκάρδες
(badge). Τα
δοσίμετρα αυτά περιέχουν κατάλληλο
προσροφητικό υλικό (τύπου "μοριακού κόσκινου") το οποίο "παγιδεύει" το
παρακολουθούμενο αέριο ή τους ατμούς πτητικών ενώσεων. Μετά την έκθεση για
καθορισμένο χρονικό διάστημα, τα δοσίμετρα σφραγίζονται και αποστέλλονται στο εργαστήριο του κατασκευαστή,
όπου το προσροφημένο αέριο
εκροφάται από το υλικό με θέρμανση και μετρείται με κάποια ενόργανη αναλυτική τεχνική
(π.χ. αεριοχρωματογραφία ή φασματομετρία υπερύθρου). Στην περίπτωση του Ν2Ο,
όταν χρησιμοποιείται η φασματομετρία υπερύθρου, το όριο της ανίχνευσης (για
το δοσίμετρo Landauer) είναι 2 μg
(προσροφημένου) Ν2Ο.
 |
 |
|
Μεταλλικές
φύσιγγες με υγρό N2O
οι οποίες προσαρμόζονται σε συστήματα διανομής (σιφόν) κρέμας. Η κρέμα
διατηρείται για χρονικό διάστημα μισής
έως μίας ώρας έξω από το κάνιστρο και στη συνέχεια ρευστοποιείται.
|
Χρήση του υποξειδίου του αζώτου ως πρόσθετου
τροφίμων [Αναφ. 7, 1β]
Το υποξείδιο του αζώτου χρησιμοποιείται
ευρύτατα ως
πρόσθετο τροφίμων (Ε942, Κατηγορία Ε900-1550: Διάφορα). Δρα ως αντιοξειδωτικό, βακτηριοστατικό, αφριστικό,
ως προωθητικό αέριο και ως αέριο συσκευασίας. Βρίσκεται υπό πίεση σε
μεταλλικά κάνιστρα που περιέχουν κρέμα γάλακτος (whipped
cream), γνωστή ως "σαντιγί", όπως επίσης και για τη πλήρωση πακέτων με
τσιπς και παρόμοια πρόχειρα γεύματα (σνακς).
Το υποξείδιο του αζώτου είναι εξαιρετικά
διαλυτό στις λιπαρές ουσίες και η κρέμα που βρίσκεται στο κάνιστρο, όταν
βρεθεί στην ατμοσφαιρική πίεση "φουσκώνει" και αποκτά τετραπλάσιο περίπου όγκο από εκείνο που
είχε στο κάνιστρο. Αν στη θέση του N2O
γινόταν χρήση πεπιεσμένου αέρα, αφενός μεν ο όγκος της κρέμας θα διπλασιαζόταν
μόνο,
αφετέρου το λίπος της κρέμας θα τάγκιζε με αποτέλεσμα τη μείωση
του χρόνου ζωής του προϊόντος στο κάνιστρο. Το διοξείδιο του άνθρακα είναι
επίσης ακατάλληλο
επειδή ως όξινο οξείδιο παρουσία νερού θα προκαλούσε το "πήξιμο" της
(curdling) της κρέμας και
επιπλέον θα αλλοίωνε τη γεύση της.
Το μόνο μειονέκτημα του N2O
είναι ότι η "φουσκωμένη" κρέμα (σαντιγί) ρευστοποιείται μέσα σε
μισή έως μία ώρα από την έξοδό της από το κάνιστρο και έτσι είναι ακατάλληλη
για το "γαρνίρισμα" προϊόντων ζαχαροπλαστικής τα οποία δεν χρησιμοποιούνται
αμέσως. Για τη χρήση αυτή (π.χ. στα ζαχαροπλαστεία) το N2O
προσφέρεται σε μεταλλικές φύσιγγες που περιέχουν περίπου 8 g αερίου σε υγρή
μορφή και οι οποίες προσαρμόζονται σε εδικά κάνιστρα διανομής (σιφόν) κρέμας (cream dispensers).
Υπό το πρόσχημα της "νόμιμης" πώλησης
ανταλλακτικών φυσίγγων για συστήματα διανομής κρέμας, διακινούνται παράνομα
στο εμπόριο ανταλλακτικά - φύσιγγες για χρήστες υποξειδίου του αζώτου για σκοπούς διασκέδασης (cream
parties). Στην
Ελλάδα έγινε γνωστή μια τέτοια περίπτωση σε κέντρα διασκέδασης παραθεριστικής
περιοχής το καλοκαίρι του 2011 [Αναφ. 7δ].
|

Ν2Ο |
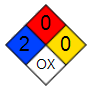
Σήμανση
NFPA για το CO (2: επικίνδυνο,
0: άφλεκτο,
0:
σταθερό, OX:
οξειδωτικό) |
ΠΡΟΣΟΧΗ:
Τονίζεται
ότι η εισπνοή
υποξειδίου του αζώτου για σκοπούς διασκέδασης μπορεί να αποβεί μοιραία,
όσο και αν το αέριο θεωρείται ως μια σχετικώς ασφαλής και ήπια ναρκωτική ουσία.
Είναι ασφαλής και ήπια ΜΟΝΟΝ όταν χορηγείται για ιατρικούς σκοπούς από
ειδικευμένο προσωπικό. Πέραν από τις διαταραχές της αρτηριακής πίεσης, τη ζάλη και την κεφαλαλγία που θα προκαλέσει η
εισπνοή του, η κατάσταση ημιαναισθησίας στην οποία περιέρχεται ο χρήστης
είναι από μόνη της επικίνδυνη, αφού σε περίπτωση ναυτίας, που συχνά
παρατηρείται κατά τις ναρκώσεις με Ν2Ο,
είναι ενδεχόμενο να πνιγεί ο χρήστης από τον ίδιο τον εμετό του.
Επιπλέον, θα πρέπει εδώ να
επαναληφθεί ότι το υποξείδιο του αζώτου είναι ένα ασφυκτικό
αέριο, όπως το άζωτο, δηλ. δεν συντηρεί τη ζωή. Το οξυγόνο που
διαθέτει στο μόριό του δεν υποκαθιστά το οξυγόνο του αέρα και δεν μπορεί να αποδοθεί στον οργανισμό για τις καύσεις
του. 'Ετσι, μια κατάσταση ημιαναισθησίας και με τους πνεύμονες γεμάτους με ένα
ασφυκτικό αέριο είναι ιδιαίτερα επικίνδυνη, που εύκολα μπορεί να οδηγήσει σε
κώμα, μόνιμες εγκεφαλικές βλάβες και θάνατο. Υπενθυμίζεται ότι κατά την
ιατρική χρήση του ως αναισθητικού (ορθότερα ίσως: "χαλαρωτικού") αερίου, το Ν2Ο
χορηγείται ΠΑΝΤΟΤΕ ως μίγμα με καθαρό οξυγόνο, κάτι το οποίο δεν
πραγματοποιείται κατά τη χρήση του για σκοπούς διασκέδασης.
Κατάχρηση υποξειδίου του αζώτου και πιθανές παρενέργειες:
Επιδρά δυσμενώς στη μαθησιακή ικανότητα, όπως και στην ικανότητα οδήγησης - Προκαλεί
ιλίγγους, ναυτία, εμετό και αναπνευστική δυσκολία - Αν εισπνευσθεί και
κρατηθεί η αναπνοή μπορεί να προκαλέσει απότομες αλλαγές στην πίεση στους
πνεύμονες με αποτέλεσμα σοβαρή βλάβη τους - Ανάλογα με τη δόση μπορεί να
προκαλέσει αύξηση ή πτώση της πίεσης, απώλεια της συνείδησης και αδυναμία
του χρήστη ακόμη και να κλείσει τη βαλβίδα της φιάλης Ν2Ο
- Καταστρέφει τη βιταμίνη Β12, γεγονός που οδηγεί σε μούδιασμα και δυσκολία
στην κίνηση των άκρων - ανικανότητα, όπως και ακράτεια ούρων και κοπράνων
[Αναφ.
6ζ].
|
Το υποξείδιο του αζώτου ως ενισχυτής της
απόδοσης μηχανών αυτοκινήτων [Αναφ. 8]
Στους κυλίνδρους της μηχανής
αυτοκινήτου ο αέρας αναμιγνύεται με ατμούς του καυσίμου (βενζίνη,
πετρέλαιο) το οποίο έτσι καίγεται παράγοντας πολλαπλάσιο όγκο μίγματος διοξειδίου
του άνθρακα και υδρατμών, που ασκεί πίεση και ωθεί τα πιστόνια της μηχανής. 'Ετσι,
τίθεται περιορισμός ως προς την ποσότητα του καυσίμου που μπορεί να
εισαχθεί στη μηχανή, αφού θα πρέπει να βρίσκεται υπό καθορισμένη
αναλογία με τον ατμοσφαιρικό αέρα.
Εάν μέρος του αέρα ή ολόκληρη η ποσότητά
του αντικατασταθεί από υποξείδιο του αζώτου, η μηχανή μπορεί να δεχθεί
περισσότερο καύσιμο. Κατά τη θερμική διάσπαση του υποξειδίου του αζώτου
παράγεται μίγμα αζώτου-οξυγόνου, με αναλογία σε οξυγόνο 33% που είναι
κατά 50% μεγαλύτερη από εκείνη του ατμοσφαιρικού αέρα (21%). Επιπλέον, το
υποξείδιο του αζώτου μπορεί να εισαχθεί στη μηχανή υπό την υγρή του
μορφή, γεγονός που επιτρέπει την εισαγωγή επιπλέον ποσοτήτων καυσίμου. Η "έκρηξη"
αυτού του μίγματος παράγει ακόμη μεγαλύτερους όγκους αερίων
και δημιουργεί ακόμη εντονότερη πίεση στα πιστόνια της μηχανής
αυξάνοντας εξαιρετικά την απόδοσή της. Στην αύξηση αυτή συνεισφέρουν και
τα ποσά ενέργειας που εκλύονται κατά τη θερμική διάσπαση του υποξειδίου
του αζώτου (αντίδραση 8).
 |
 |
|
Κατεστραμμένες
μηχανές αυτοκινήτου μετά από κακή χρήση υποξειδίου του
αζώτου ως οξειδωτικού για ενίσχυση της απόδοσής τους
[πηγή]. |
Στο εμπόριο διατίθενται συλλογές
εξαρτημάτων (kit) τροποποίησης
αγωνιστικών αυτοκινήτων και μοτοσικλετών (φιάλη με υγρό Ν2Ο,
σωληνώσεις, ηλεκτρομηχανικές βαλβίδες, διακόπτες και συστήματα ελέγχου).
Με την εγκατάσταση των συστημάτων αυτών δίνεται δυνατότητα στους οδηγούς
να εισάγουν υποξείδιο του αζώτου στη μηχανή, με τον χειρισμό ενός
διακόπτη ("NITRO ON/OFF"), σε περιστάσεις που απαιτείται ιδιαίτερα έντονη ισχύς
(επιτάχυνση, στροφές). Ωστόσο, μια φιάλη
υποξειδίου του αζώτου παρέχει οξειδωτική ισχύ μόνο για λίγα λεπτά
(συνολικώς) λειτουργίας του κινητήρα και όχι για όλη τη διάρκεια της κούρσας,
άλλωστε κάτι τέτοιο δεν θα το άντεχε και η μηχανή του οχήματος, λόγω των
υψηλών πιέσεων και θερμοκρασιών που δημιουργούνται.
Θα πρέπει να τονιστεί ότι η χρήση
αυτών των κιτ πρέπει να περιορίζεται σε αυτοκίνητα και μοτοσικλέτες αγώνων, που
κινούνται σε πίστες δοκιμών ή αγώνων και εφόσον οι κανονισμοί των αγώνων
το επιτρέπουν. Η χρήση τους σε αυτοκίνητα με κοινές μηχανές μπορεί να
προκαλέσει την καταστροφή τους, αλλά και η κίνηση αυτοκινήτων με
τροποποιημένες μηχανές με τον τρόπο αυτό στους δρόμους είναι επικίνδυνη
και για τους άλλους οδηγούς. Σε ορισμένες πολιτείες των ΗΠΑ είναι παράνομη
και τιμωρείται με αυστηρά πρόστιμα και ποινές φυλάκισης σε περιπτώσεις
υποτροπής.
Για να αποφευχθεί η χρήση των φιαλών υποξειδίου του αζώτου αγωνιστικών
αυτοκινήτων για εισπνοές του αερίου, συνήθως σ' αυτό προστίθεται σκόπιμα
σε μικρή αναλογία (100 ppm) διοξείδιο του θείου (SO2),
για να καταστεί δύσοσμο.
Το υποξείδιο του αζώτου είχε χρησιμοποιηθεί
δοκιμαστικά κατά τον 2ο Παγκόσμιο Πόλεμο σε πολεμικά αεροπλάνα,
παρέχοντας στις μηχανές τους δυνατότητα αυξημένης ισχύος ακόμη και σε
μεγάλα ύψη, όπου η κατ' όγκον περιεκτικότητα του αέρα σε οξυγόνο είναι χαμηλή.
Το υποξείδιο του αζώτου
στο περιβάλλον [Αναφ. 9]
Αν και σε ίχνη, το
υποξείδιο του αζώτου πάντοτε αποτελούσε κανονικό συστατικό της ατμόσφαιρας.
Το Ν2Ο αποτελεί ένα αέριο του μεταβολισμού των βακτηρίων,
έτσι εκπομπές του από βακτήρια του εδάφους και των ωκεανών έκαναν το αέριο
αυτό κανονικό συστατικό της ατμόσφαιρας της Γη εδώ και πολλά εκατομμύρια
χρόνια. Ωστόσο, η συγκέντρωσή του στην ατμόσφαιρα αυξάνει γραμμικά με τον χρόνο με
ρυθμό 0,2 έως 0,3%,
λόγω του ανθρωπογενούς N2O και
σήμερα βρίσκεται σε συγκεντρώσεις στην περιοχή των 320-330 ppb (μέρη στο
δισεκατομμύριο). Σήμερα,
η μέτρηση, ο έλεγχος της συγκέντρωσης του Ν2Ο
και ο περιορισμός των εκπομπών του επιβάλλονται, επειδή δρα τόσο ως αέριο
θερμοκηπίου (βλ. Χημική ένωση του μήνα:
Εξαφθοριούχο θείο), όσο και ως αέριο καταστροφικό για τη στιβάδα του όζοντος
(βλ. Χημική ένωση του μήνα:
'Οζον).
Σε
μια σχετικά πρόσφατη (2010) έκθεση της Υπηρεσίας Προστασίας του
Περιβάλλοντος (Environmental Protection Agency) εκτιμάται πως η ετησίως
εκλυόμενη ποσότητα Ν2Ο στην ατμόσφαιρα είναι (κατά μέσον όρο) 18,8
εκατομμύρια τόννοι, από τα οποία 12,1 εκατομμύρια τόννοι (το 64%) προέρχεται
από φυσικές πηγές, αν και τα δεδομένα αλλάζουν από χρόνο σε χρόνο.
Χονδρικά, το 1/3 του ετησίως εκλυόμενου στην ατμόσφαιρα Ν2Ο
οφείλεται στις δραστηριότητες του ανθρώπου, είναι δηλαδή ανθρωπογενές. Από τις ανθρωπογενείς πηγές
Ν2Ο, κυριότερη είναι η γεωργία,
με ετήσια συνεισφορά 2 έως 4 εκατομμυρίων τόννων. Παράγεται από βακτηρίδια
τόσο κατά τις διαδικασίες νιτροποίησης (nitrification,
οξείδωση αμμωνιακών αλάτων προς νιτρικά άλατα), όσο και κατά τις
διαδικασίες απονιτροποίησης ή απονίτρωσης (de-nitrification,
διάσπαση των νιτρικών αλάτων προς Ν2
και Ν2Ο). 'Ετσι, μεγάλες ποσότητες Ν2Ο παράγονται κατά τη βακτηριακή
διάσπαση μέρους των τεραστίων ποσοτήτων αμμωνιακών ή αζωτούχων λιπασμάτων, όπως επίσης
και των απορριμμάτων
εκτρεφόμενων των ζώων [Αναφ. 9ε].
 Κύριες βιομηχανικές πηγές υποξειδίου του αζώτου.
Οι εκπομπές από βιομηχανικές δραστηριότητες
παράγουν το 20% του ανθρωπογενούς υποξειδίου του αζώτου. Υποξείδιο του
αζώτου παράγεται ως παραπροϊόν από τη βιομηχανική παραγωγή νιτρικού οξέος,
αλλά οι μεγαλύτερες ενώ το το μεγαλύτερο ποσοστό τους (85%) προέρχεται από τη βιομηχανική παραγωγή Nylon.
Κύριες βιομηχανικές πηγές υποξειδίου του αζώτου.
Οι εκπομπές από βιομηχανικές δραστηριότητες
παράγουν το 20% του ανθρωπογενούς υποξειδίου του αζώτου. Υποξείδιο του
αζώτου παράγεται ως παραπροϊόν από τη βιομηχανική παραγωγή νιτρικού οξέος,
αλλά οι μεγαλύτερες ενώ το το μεγαλύτερο ποσοστό τους (85%) προέρχεται από τη βιομηχανική παραγωγή Nylon.
'Εχει εκτιμηθεί ότι για
κάθε τόννο παραγόμενου νιτρικού οξέος με καταλυτική οξείδωση της αμμωνίας,
παράγονται κατά μέσον όρο (εξαρτάται από τη χρησιμοποιούμενη τεχνολογία) 8 kg Ν2Ο, λόγω της ανεπιθύμητης
οξείδωσης που αποδίδεται από την αντίδραση [Αναφ.
10α-β]:
2 ΝΗ3 + 2 Ο2
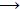 Ν2Ο + 3 Η2Ο
Ν2Ο + 3 Η2Ο
Αντίστοιχα, για κάθε τόννο
παραγόμενου
αδιπικού οξέος
(adipic acid), που αποτελεί πρώτη ύλη για την παραγωγή Nylon,
με οξείδωση της κυκλοεξανόλης ή της κυκλοεξανόνης (ή μίγμα τους) με νιτρικό οξύ παράγονται 300 kg Ν2Ο:
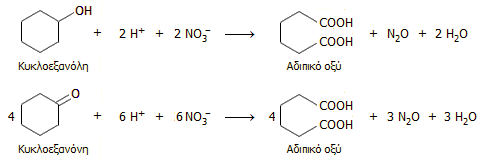
Η συνεχώς
αυξανόμενη παραγωγή Nylon,
εκτιμάται ότι
ευθύνεται περίπου για το 10% της ετήσιας αύξησης του ατμοσφαιρικού N2O. Λόγω των ιδιαίτερα μεγάλων
ποσοτήτων Ν2Ο που παράγονται
κατά τη βιομηχανική παραγωγή αδιπικού οξέος, καταβάλλονται προσπάθειες
αξιοποίησης και ανακύκλωσης του παραγόμενου Ν2Ο.
'Ετσι, έχει επιδιωχθεί:
α) Η αξιοποίηση του N2O ως οξειδωτικού για τη σύνθεση φαινόλης με απ' ευθείας οξείδωση του βενζολίου.
Στη συνέχεια η φαινόλη θα υδρογονωθεί προς κυκλοεξανόλη, η οποία θα οξειδωθεί
(ως άνω) προς αδιπικό οξύ. 'Ετσι αξιοποιείται η οξειδωτική ισχύς του
νιτρικού οξέος που εν μέρει χάνεται ως Ν2Ο.
β) Η καταλυτική διάσπασή
του Ν2Ο προς άζωτο και οξυγόνο (αντίδραση 8).
'Ετσι αξιοποιείται η εκλυόμενη θερμότητα (για όπου μπορεί να χρειαστεί) στη
βιομηχανική μονάδα παραγωγής αδιπικού οξέος
[Αναφ. 10γ-ε].
Το
υποξείδιο του αζώτου ως αέριο θερμοκηπίου. Το υποξείδιο του
αζώτου
αποτελεί "αέριο θερμοκηπίου" έχοντας την ικανότητα να απορροφά την υπέρυθρη
ακτινοβολία (δηλ. ικανότητα "παγίδευσης" της θερμότητας) περίπου 300
εντονότερα απ' όσο το διοξείδιο του άνθρακα. 'Ερχεται τρίτο σε σειρά
σπουδαιότητας από άποψη συμβολής αέριων ουσιών ανθρωπογενούς προέλευσης μετά το
διοξείδιο του άνθρακα και το μεθάνιο, αντιπροσωπεύοντας περίπου το 6% (από άποψη
αποτελέσματος) της συνολικής συνεισφοράς του ανθρώπου στην αύξηση των αερίων
θερμοκηπίου.
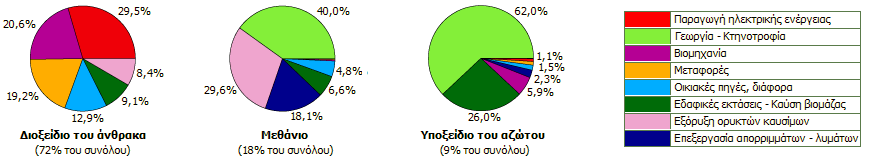
Συνεισφορά στην έκλυση των τριών
κυριότερων "αερίων θερμοκηπίου" κατά τομέα ανθρώπινης δραστηριότητας για το
έτος 2000 [Αναφ. 9α].
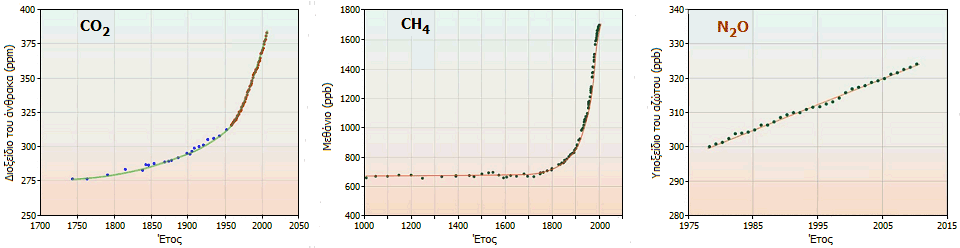
Αύξηση της περιεκτικότητας
της ατμόσφαιρας στα τρία κυριότερα "αέρια θερμοκηπίου", λόγω των διαφόρων
δραστηριοτήτων του ανθρώπου [Αναφ. 9β].
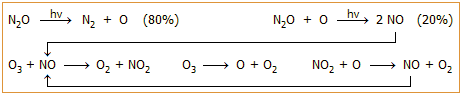 Το
υποξείδιο του αζώτου ως καταστροφέας του όζοντος.
Το Ν2Ο
είναι αέριο που συμβάλλει στην καταστροφή του όζοντος. Μάλιστα, σήμερα, μετά
την απαγόρευση της παραγωγής των χλωροφθορανθράκων (CFC), το υποξείδιο του
αζώτου θεωρείται πλέον ως ο κύριος "καταστροφέας" της στιβάδας του όζοντος.
Το
υποξείδιο του αζώτου ως καταστροφέας του όζοντος.
Το Ν2Ο
είναι αέριο που συμβάλλει στην καταστροφή του όζοντος. Μάλιστα, σήμερα, μετά
την απαγόρευση της παραγωγής των χλωροφθορανθράκων (CFC), το υποξείδιο του
αζώτου θεωρείται πλέον ως ο κύριος "καταστροφέας" της στιβάδας του όζοντος.
Το υποξείδιο του αζώτου, ως
σχετικά αδρανές αέριο, φθάνει με βραδύ ρυθμό ουσιαστικά αναλλοίωτο στην στρατόσφαιρα.
Εκεί υπόκειται σε φωτοχημική διάσπαση παρέχοντας κυρίως (κατά περίπου 80%) άζωτο
και οξυγόνο και δευτερευόντως, αντιδρά με ρίζες οξυγόνου παρέχοντας μονοξείδιο του αζώτου, το οποίο εισέρχεται στον κύκλο
καταστροφής του όζοντος. Η όλη διαδικασία περιγράφεται συνοπτικά από τις παραπλεύρως
αντιδράσεις.











 Η
ποσοτική περιγραφή του είδους των δεσμών, των ηλεκτρονιακών πυκνοτήτων και
των ηλεκτροστατικών δυνάμεων στο Ν2Ο
αποτελούσε πάντοτε ένα πρόβλημα για τους θεωρητικούς χημικούς, πολύ πιο
δύσκολο από το αντίστοιχο πρόβλημα για το CO (βλ. Χημική ένωση του μήνα:
Η
ποσοτική περιγραφή του είδους των δεσμών, των ηλεκτρονιακών πυκνοτήτων και
των ηλεκτροστατικών δυνάμεων στο Ν2Ο
αποτελούσε πάντοτε ένα πρόβλημα για τους θεωρητικούς χημικούς, πολύ πιο
δύσκολο από το αντίστοιχο πρόβλημα για το CO (βλ. Χημική ένωση του μήνα:
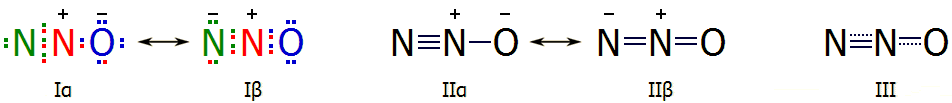









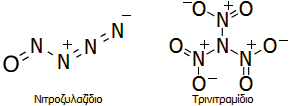



























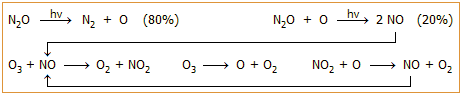 Το
υποξείδιο του αζώτου ως καταστροφέας του όζοντος.
Το
υποξείδιο του αζώτου ως καταστροφέας του όζοντος. 





