Γενικά για το οξείδιο του αργιλίου [Αναφ. 1]
 |
|
 |
|
Αριστερά: Η στυπτηρία (λατ. alumen), το άλας KAl(SO4)2·12H2O, μια εξαιρετικά χρήσιμη ουσία με αιμοστατικές ιδιότητες, γνωστή ήδη από την αρχαιότητα έδωσε το όνομά της στο οξείδιο Al2O3 και στο αντίστοιχο μέταλλο, το αλουμίνιο (αργίλιο), αλλά και σε μια τάξη μικτών θειικών αλάτων. Κέντρο: Το αλχημιστικό σύμβολο της στυπτηρίας (επάνω). Το σύμβολο του Dalton για την αλουμίνα (κάτω). Δεξιά: Σύμπλεγμα κρυστάλλων στυπτηρίας K-Cr, KCr(SO4)2·12H2O, ενός άλατος ιδιαίτερα χρήσιμου στη βυρσοδεψία. |
||
Το αργίλιο αποτελεί το 8% του εξωτερικού φλοιού της Γης και είναι το τρίτο σε αφθονία χημικό στοιχείο μετά το οξυγόνο (47%) και το πυρίτιο (28%), ενώ ο σίδηρος είναι το τέταρτο σε αφθονία στοιχείο (5%). Το οξείδιό του είναι ευρύτερα γνωστό ως αλουμίνα (alumina) και σπανιότερα ως αργιλία. Στις συνήθεις μορφές του το οξείδιο αυτό είναι ένα σκληρό και δύσκαμπτο στερεό, πολύ καλός αγωγός της θερμότητας και εξαιρετικός μονωτής του ηλεκτρικού ρεύματος. Οι κρύσταλλοι του οξειδίου του αργιλίου χαρακτηρίζονται από ισχυρούς ιοντικούς δεσμούς. Το οξείδιο του αργιλίου είναι πρακτικώς αδιάλυτο στο νερό και εξαιρετικά δύστηκτο (σημείο τήξεως 2072°C).
Λεπτό και συνεκτικό στρώμα οξειδίου του αργιλίου (τυπικό πάχος: 4 nm) σχηματίζεται στην επιφάνεια του μεταλλικού αργιλίου. Το στρώμα αυτό προστατεύει το αργίλιο από περαιτέρω οξείδωση και σταθεροποιεί το μέταλλο στο ατμοσφαιρικό περιβάλλον παρά τη μεγάλη χημική δραστικότητά του.
Η ονομασία αλουμίνα (alumina) προέρχεται από τη λατινική ονομασία alum-en (-inis) της στύψης ή στυπτηρίας, KAl(SO4)2·12H2O, μιας ουσίας γνωστής στους αρχαίους 'Ελληνες και Ρωμαίους την οποία παρασκεύαζαν με επεξεργασία ενός ορυκτού (αλουνίτης, γνωστός κατά την αρχαιότητα ως "στυπτηριάτης λίθος": KAl3(SO4)2(OH)6). Η στυπτηρία έχει την ιδιότητα να ξηραίνει και να συστέλλει τους ιστούς, προκαλώντας αιμόσταση και οι ιατροί της εποχής τη χρησιμοποιούσαν κυρίως για τη θεραπεία τραυμάτων. Μεγάλες ποσότητες στυπτηρίας χρησιμοποιούσαν επίσης στη βαφή υφασμάτων ως πρόστυμμα (mordant), δηλαδή ως ουσία που σχηματίζει δυσδιάλυτες ενώσεις με φυσικά οργανικά χρώματα με αποτέλεσμα την προσκόλληση και σταθεροποίηση της βαφής στις ίνες του υφάσματος.
Να σημειωθεί ότι ως "στυπτηρίες" σήμερα χαρακτηρίζονται τα μικτά θειικά άλατα με τον γενικό τύπο M(I)M'(III)(SO4)2·12H2O, όπου Μ(Ι) κατιόν της ομάδας των αλκαλίων (εκτός από το Li) ή το αμμώνιο και Μ'(ΙΙΙ) τρισθενές μεταλλικό κατιόν (κυρίως Al, Cr και Fe). Τα περισσότερα από τα άλατα αυτά κρυσταλλώνονται εύκολα παρέχοντας ευμεγέθεις και συχνά διαυγείς κρυστάλλους.
Για τον ίδιο λόγο, ονομάστηκε αλουμίνιο (aluminium και στις ΗΠΑ: aluminum) το αντίστοιχο μέταλλο, ονομασία που έχει επικρατήσει και στην καθημερινή ελληνική γλώσσα (π.χ. "Αλουμίνιο της Ελλάδος", "προϊόντα αλουμινίου"). Με τον όρο αλουμίνιο αναφερόμαστε στο μέταλλο και με τον όρο αργίλιο (από την ελληνική ονομασία των πλούσιων σε αργίλιο πετρωμάτων: άργιλος) αναφερόμαστε στο στοιχείο και στις ενώσεις του (έτσι, π.χ. το Al2(SO4)3 αναφέρεται ως θειικό αργίλιο και το Al2O3 αναφέρεται ως οξείδιο του αργιλίου).
Οι φυσικές ιδιότητες και η χημική δραστικότητα της αλουμίνας εξαρτώνται από τον τρόπο παρασκευής και επεξεργασίας της. 'Ετσι, αλουμίνα που έχει παρασκευασθεί στο εργαστήριο με σχετικώς ήπια θέρμανση (<900ºC) υδροξειδίου του αργιλίου, διαλύεται εύκολα σε διαλύματα ισχυρών οξέων και βάσεων (επαμφοτερίζον οξείδιο). Ωστόσο, αν πυρακτωθεί σε υψηλές θερμοκρασίες και αφυδατωθεί πλήρως, η διαλυτοποίησή της καθίσταται πλέον δυσχερέστατη. Η αλουμίνα ευκολότερα διαλύεται στο υδροφθορικό οξύ (ο σχηματισμός σταθερών συμπλόκων Al-F διευκολύνει τη διαλυτοποίησή της) και το φωσφορικό οξύ, αλλά και σε τήγματα ισχυρών βάσεων ή σε πυκνά διαλύματά τους με θέρμανση υπό πίεση.
Το οξείδιο του αργιλίου είναι ένα από τα σκληρότερα κεραμικά υλικά, ενώ είναι εξαιρετικώς διαδεδομένο υπό τη μορφή διάφορων πετρωμάτων και ορυκτών, όπως ο βωξίτης, το κυριότερο ορυκτό-μετάλλευμα αλουμινίου κύρια συστατικά του οποίου είναι διάφορες μορφές ένυδρης αλουμίνας. Η αλουμίνα σε σχεδόν καθαρή μορφή βρίσκεται στο ορυκτό κορούνδιο (corundum). Η σμύριδα (emery) αποτελεί μια ακάθαρτη μορφή κορουνδίου. Κρυσταλλικές μορφές της αλουμίνας είναι οι πολύτιμοι λίθοι σάπφειρος (sapphire, ζαφείρι) και ρουβίνιο (ruby, ρουμπίνι), οι οποίοι αποτελούν διαυγείς κρυσταλλικές παραλλαγές του κορουνδίου, όπου ίχνη διαφόρων στοιχείων παρέχουν χαρακτηριστικούς χρωματισμούς.
 |
 |
 |
 |
 |
 |
|
Μορφές Al2O3 και ορυκτών του (από αριστερά προς τα δεξιά): (1) Τυπική μορφή βωξίτη, κύριο μετάλλευμα αλουμίνας και αλουμινίου με περιεκτικότητα σε Al2O3 στην περιοχή 40-60%. Το κοκκινωπό χρώμα του οφείλεται στη σχετικώς μεγάλη περιεκτικότητά του σε Fe2O3. (2) Καθαρό Al2O3, αλουμίνα, προϊόν λαμβανόμενο από τον βωξίτη. (3) Κορούνδιο, σχεδόν καθαρό Al2O3, από τα σκληρότερα ορυκτά, το οποίο χαράσσεται μόνο από τον αδάμαντα. (4) Σμύριδα, μια μορφή κορουνδίου, από τα καλύτερα υλικά λείανσης. (6) Σάπφειροι (ζαφείρια), πολύτιμοι λίθοι, κρυσταλλική μορφή κορουνδίου με γαλάζιο χρώμα οφειλόμενο σε ίχνη Fe(ΙΙ,ΙΙΙ) (>0,1%) και Ti(ΙV). (5) Ρουβίνιο (ρουμπίνι), πολύτιμος λίθος, κρυσταλλική μορφή κορουνδίου με κόκκινο χρώμα οφειλόμενο σε ίχνη (>1%) Cr(III). |
|||||
Ιστορική διαδρομή παραγωγής αλουμίνας και αλουμινίου από βωξίτη [Αναφ. 2]
Το 1761, ο Γάλλος χημικός Guyton de Morveau (1737-1816), συνεργάτης του Lavoisier γνωστός για τη συμβολή του στη συστηματική χημική ονοματολογία, πρότεινε τον όρο alumin (αλουμίνα) για το οξείδιο (βάση) ενός άγνωστου μέχρι τότε μετάλλου του οποίου την παρουσία θεωρούσε βέβαιη στη στυπτηρία (alum). Στη συνέχεια προστέθηκε και η λατινική κατάληξη -ium, όπως συνηθιζόταν στην ονομασία κάθε νέου χημικού στοιχείου και το υποθετικό αυτό στοιχείο ονομάστηκε aluminium. Ο ίδιος ο Lavoisier, στο βιβλίο-σταθμό της Χημείας "Στοιχεία Χημείας" (Elements of Chemistry), θεωρούσε ως πιθανή την ύπαρξη ενός μετάλλου του οποίου το οξείδιο ο ίδιος είχε ονομάσει argilla (αργιλία).
 Το 1808, ο Βρετανός χημικός
Humphry Davy
(1778-1829), διάσημος για την απομόνωση δραστικότατων μετάλλων των των
ομάδων των αλκαλίων και
γαιαλκαλίων (Na, K, Mg, Ca, Ba) με ηλεκτρόλυση τηγμάτων των αλάτων τους, σε επιστολή
του προς τη
Βασιλική Εταιρεία του Λονδίνου έγραψε ότι δεν επέτυχε να απομονώσει τα μέταλλα από
τα οξείδια alumine (Al2O3),
silex (SiO2),
zircone (ZrO2)
και glucine (BeO),
αλλά "αν ήταν τόσο τυχερός" και το είχε καταφέρει, τα στοιχεία αυτά
θα τα ονόμαζε silicium (πυρίτιο),
alumium (μετέπειτα
aluminium, αλουμίνιο, αργίλιο), zirconium
(ζιρκόνιο) και glucium (στη συνέχεια
glucinium, γλυκίνιο και μετέπειτα βηρύλλιο).
Το 1808, ο Βρετανός χημικός
Humphry Davy
(1778-1829), διάσημος για την απομόνωση δραστικότατων μετάλλων των των
ομάδων των αλκαλίων και
γαιαλκαλίων (Na, K, Mg, Ca, Ba) με ηλεκτρόλυση τηγμάτων των αλάτων τους, σε επιστολή
του προς τη
Βασιλική Εταιρεία του Λονδίνου έγραψε ότι δεν επέτυχε να απομονώσει τα μέταλλα από
τα οξείδια alumine (Al2O3),
silex (SiO2),
zircone (ZrO2)
και glucine (BeO),
αλλά "αν ήταν τόσο τυχερός" και το είχε καταφέρει, τα στοιχεία αυτά
θα τα ονόμαζε silicium (πυρίτιο),
alumium (μετέπειτα
aluminium, αλουμίνιο, αργίλιο), zirconium
(ζιρκόνιο) και glucium (στη συνέχεια
glucinium, γλυκίνιο και μετέπειτα βηρύλλιο).
'Ηδη από το 1821, ο Γάλλος γεωλόγος Pierre Berthie (1782-1861) είχε διαπιστώσει ότι το καταλληλότερο μετάλλευμα για την παρασκευή αλουμίνας ήταν ένα ορυκτό (τυπικά πρόκειται για "πέτρωμα") αποτελούμενο από ένυδρη αλουμίνα (σε μίγμα με οξείδια άλλων μετάλλων και κυρίως σιδήρου). Το ορυκτό αυτό βρισκόταν σε σχετικά μεγάλες ποσότητες στην περιοχή της Μεσογείου και το οποίο ονόμασε βωξίτη, από το όνομα της πόλης Γαλλίας (Les Baux in Provence), όπου βρήκε πλούσια κοιτάσματά του (βλ. παρακάτω).
|
|
|||||||||
Απομόνωση αλουμινίου - Πρώιμη βιομηχανία αλουμινίου.Το 1825, o Δανός φυσικός και χημικός Hans Christian Oersted (1777-1851), γνωστός κυρίως για τις εργασίες του στον ηλεκτρομαγνητισμό, διαβίβασε χλώριο μέσω ερυθροπυρακτωμένου μίγματος αλουμίνας και άνθρακα και συνέλεξε το σχετικά πτητικό άλας τριχλωριούχο αργίλιο, το οποίο με αντίδραση με αμάλγαμα μεταλλικού καλίου (1,5% διάλυμα Κ σε Hg) έδωσε μεταλλικό αλουμίνιο:
Al2O3 + 3C
+ 3Cl2 ![]() 2AlCl3 + 3CO AlCl3
+ 3Κ
2AlCl3 + 3CO AlCl3
+ 3Κ ![]() Al + 3ΚCl
Al + 3ΚCl
 |
 |
|
Μια πυραμίδα από αλουμίνιο βάρους 2,8 kg τοποθετήθηκε τιμητικά στην κορυφή του μνημείου του Washington κατά την ανέγερσή του το 1884 [πηγή]. |
|
Ο Oersted παρέλαβε μια μικρή ποσότητα μάλλον ακάθαρτου μετάλλου, το οποίο του φάνηκε να μοιάζει κάπως με τον κασσίτερο. Ωστόσο, η ανακάλυψη αυτή δεν έγινε ευρύτερα γνωστή, αφού η σχετική δημοσίευση έγινε σε ένα μάλλον άσημο επιστημονικό περιοδικό της Δανίας, αλλά και ο ίδιος δεν ενδιαφέρθηκε να συνεχίσει την έρευνα πάνω στο νέο αυτό μέταλλο. Αν και η μέθοδος απομόνωσης του μετάλλου αναφέρεται ως "χημική" θα πρέπει εδώ να τονιστεί ότι το μεταλλικό κάλιο (ή νάτριο που χρησιμοποιήθηκε λίγο αργότερα) παράγεται αποκλειστικά με ηλεκτρόλυση τήγματος του αντίστοιχου χλωριούχου άλατος, επομένως -έστω και έμμεσα- η μέθοδος μπορεί να θεωρηθεί ηλεκτρολυτική.
Ο Oersted γνωστοποίησε τα αποτελέσματά του στον Γερμανό χημικό Friedrich Wöhler (1800-1882), ο οποίος είναι ευρύτερα γνωστός για τη σύνθεση της ουρίας, έναν σταθμό της ιστορία της οργανικής χημείας, αφού έτσι κατέρριψε τη θεωρία της ζωικής δύναμης (vis vitalis). Ο Wöhler αρχικά απέτυχε να παραλάβει αλουμίνιο με τη μέθοδο του Oersted, όμως στη συνέχεια, χρησιμοποιώντας ως αναγωγικό καθαρό κάλιο, απομόνωσε μια ποσότητα του μετάλλου το 1827.
Τα επόμενα 18 χρόνια ο Wöhler συνέχισε να ασχολείται με την απομόνωση του αλουμινίου. Το 1845, είχε συλλέξει αρκετή ποσότητα από το νέο μέταλλο και έχοντας πλέον στη διάθεσή του μια συμπαγή μάζα του, μπόρεσε να μετρήσει το ειδικό βάρος του. 'Ετσι, ανακάλυψε μια από τις σπουδαιότερες ιδιότητες του αλουμινίου: την "αβάσταχτη" ελαφρότητά του, δηλ. το μικρό ειδικό βάρος του (2,70 g/cm3), τιμή πρωτόγνωρη για μέταλλο σταθερό στις συνήθεις ατμοσφαιρικές συνθήκες.
Το 1855, ο Γάλλος χημικός Henri Etienne Saint-Claire Deville (1818-1881) ανέπτυξε μια χημική μέθοδο, παραγωγής αλουμινίου σε μεγάλη κλίμακα με βάση την ίδια σειρά αντιδράσεων, αντικαθιστώντας όμως το ακριβό μεταλλικό κάλιο με το φθηνότερο και σχετικά πιο εύχρηστο μεταλλικό νάτριο. Παρά τη βελτίωση της μεθόδου το μεταλλικό αλουμίνιο εξακολουθούσε να είναι ένα πανάκριβο μέταλλο. 'Ετσι, το 1852 η τιμή του αλουμινίου βρισκόταν στο απλησίαστο ύψος των 1500$/kg, ενώ το 1859 είχε μειωθεί δραστικά στα 40 $/kg, μια τιμή που εξακολουθούσε όμως να είναι μεγάλη.
Το 1855, στη Διεθνή 'Εκθεση του Παρισιού (Paris Exposition Universelle, 1855), δημιούργησε αίσθηση η παρουσίαση στο κοινό του νέου μετάλλου, το οποίο χαρακτηριζόταν ως "ασήμι από τον πηλό (άργιλο)". Δώδεκα ράβδοι αλουμινίου συνολικού βάρους περίπου ενός χιλιογράμμου εκτέθηκαν μαζί με τα κοσμήματα του γαλλικού στέμματος, αφού ήδη το αλουμίνιο εθεωρείτο μέταλλο πολυτιμότερο ακόμη και από τον χρυσό και τον λευκόχρυσο. Μάλιστα, πολλές κυρίες της αριστοκρατίας της εποχής στολίζονταν με κοσμήματα από αλουμίνιο. Χαρακτηριστικό είναι το γεγονός ότι ο αυτοκράτορας της Γαλλίας Louis Napoleon III (1808-1873) έδωσε μια δεξίωση προς τους τιμώμενους ξένους καλεσμένους, όπου χρησιμοποιήθηκαν για πρώτη φορά πιάτα και μαχαιροπήρουνα από αλουμίνιο, ενώ για τους λιγότερο σημαντικούς καλεσμένους τα σερβίτσια ήταν από άργυρο ή χρυσό (!).
Ο Ναπολέων ΙΙΙ έδειξε μεγάλο ενδιαφέρον για το αλουμίνιο, θεωρώντας κατά κάποιο τρόπο το νέο μέταλλο ως "εθνικό επίτευγμα". Μεταξύ άλλων, φιλοδοξούσε να εξασφαλίσει για τον Γαλλικό στρατό προστατευτικούς θώρακες, κράνη και άλλον αμυντικό εξοπλισμό από αυτό το ελαφρύ μέταλλο και προσέφερε άφθονη χρηματοδότηση στον Deville για την κατασκευή χυτηρίων αλουμινίου.
Το 1885 η ετήσια παραγωγή του μετάλλου είχε φθάσει περίπου τους 15 τόνους, ωστόσο παρά τις βελτιώσεις και τη σχετικώς μεγάλη κλίμακα παραγωγής του, αλλά και τη μείωση κατά 90% σε σχέση με τις αρχικές τιμές, η τιμή του αλουμινίου εξακολουθούσε να είναι απαγορευτικά υψηλή για μεγαλύτερες κατασκευές και μια γενικευμένη χρήση του. Η τελευταία (1890) και χαμηλότερη τιμή του αλουμινίου παρασκευασμένου με τη μέθοδο Deville ήταν περίπου 33$/kg, που εξακολουθούσε να είναι πολύ υψηλή για τα δεδομένα εκείνης της εποχής και η χρήση του περιοριζόταν στην κατασκευή πολυτελών σκευών.
 |
 |
 |
 |
 |
| Ο Γάλλος χημικός Henri Etienne Saint-Claire Deville (1818-1881) ξεκίνησε την παραγωγή αλουμινίου σε βιομηχανική κλίμακα (1855). | Louis Napoleon III (1808-1873) υποστήριξε οικονομικά τις προσπάθειες του Deville για τη βιομηχανική παραγωγή αλουμινίου. |
Το 1855, στη Διεθνή 'Εκθεση του Παρισιού (Paris Exposition Universelle) εκτέθηκαν δώδεκα ράβδοι αλουμινίου (συνολική ποσότητα: περίπου 1 kg) μαζί με τα κοσμήματα του γαλλικού στέμματος. |
Κιάλια όπερας (1865) και ένα διακοσμητικό σκεύος, μια φρουτιέρα, (1878) από αλουμίνιο. | |
Βωξίτης [Αναφ. 3] Ως βωξίτης (bauxite) χαρακτηρίζεται ένα πέτρωμα του οποίου κύρια συστατικά είναι μικτά οξείδια - υδροξείδια του αργιλίου. Ανακαλύφθηκε και μελετήθηκε από τον Γάλλο γεωλόγο και μεταλλειολόγο Pierre Berthie (1782-1861) στην νότια Γαλλία (Προβηγκία) στην περιοχή της μικρής πόλης Les Baux-de-Provence, από την οποία πήρε και το όνομά του. Πρόκειται για ιζηματογενές πέτρωμα που σχηματίστηκε με αποσάθρωση αργιλοπυριτικών πετρωμάτων κυρίως μαγματογενούς προέλευσης. Είναι μαλακό (σκληρότητα Mohs: 1 - 3) και με μικρό ειδικό βάρος (2-2,5 g/cm3). Κατά κανόνα έχει κοκκινωπό χρώμα, αν και υπάρχουν κάπως ανοικτόχρωμες ή κατά τόπους λευκές ποικιλίες. Παρατήρηση: Τυπικά, οι διάφοροι βωξίτες είναι πετρώματα (rocks) ως ανομοιογενή μίγματα διάφορων ορυκτών (ores), ωστόσο συχνότερα και καταχρηστικά αναφέρονται ως ορυκτά. Η παρουσία άφθονου βωξίτη διαπιστώθηκε και σε άλλες χώρες της Μεσογειακής Ευρώπης και ιδιαιτέρως πλούσια είναι τα ελληνικά κοιτάσματα βωξίτη στην περιοχή του Παρνασσού. Το κύριο συστατικό του "μεσογειακού" βωξίτη είναι το ένυδρο οξείδιο ή υδροξυοξείδιο του αργιλίου με χημικό τύπο Al2O3·H2O ή AlO(OH), γνωστό (ανάλογα με την κρυσταλλική μορφή του) ως μπαιμίτης (bohemite) ή διάσπορο (diaspore), ενώ κύριο συστατικό του βωξίτη των τροπικών χωρών είναι το περισσότερο εφυδατωμένο οξείδιο ή υδροξείδιο του αργιλίου Al2O3·3H2O ή Al(OH)3, το οποίο είναι γνωστό ως γκιμπσίτης (gibbsite) ή υδραργιλίτης (hydrargillite). 'Ετσι, ο γενικός (μικτός) τύπος που μπορεί να αποδοθεί στα ορυκτά αλουμινίου που περιέχει ο βωξίτης είναι AlOx(OH)3-2x (0<x<1).
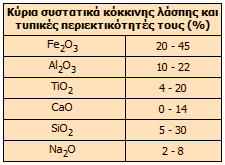
'Αλλα ορυκτά που περιέχουν οι βωξίτες σε διάφορες αναλογίες είναι τα: χαλαζίας (SiO2), λειμωνίτης (Fe2O3·xH2O), αιματίτης (Fe2O3), μαγνητίτης (Fe3O4), σιδηρίτης (FeCO3), ιλμενίτης (FeTiO3), ανατάσης (TiO2), καολινίτης (Al2O3·2SiO2·2H2O) κ.α. Ο βωξίτης σύντομα αντικατέστησε την σχετικώς ακριβή στυπτηρία K-Al ως πηγή αλουμινίου, έτσι η πρώτη βιομηχανική παραγωγή αλουμινίου από τον Deville (1855) βασίστηκε στην αλουμίνα που απομονώθηκε από τον βωξίτη με σύντηξη του ορυκτού με Na2CO3. Ωστόσο, το 1888 ο Αυστριακός χημικός Karl Josef Bayer (1847-1904) ήταν εκείνος που εφηύρε τον οικονομικότερο τρόπο επεξεργασίας του βωξίτη που χρησιμοποιείται σχεδόν αποκλειστικά σήμερα. Η σύνθεση των βωξιτών διαφέρει σημαντικά ανάλογα με την προέλευσή τους. Τυπικές περιεκτικότητες σε διάφορα συστατικά είναι: 40-60% Al2O3, 12-30% σε ελεύθερο και ενωμένο Η2Ο, 1-15% σε ελεύθερο και ενωμένο SiO2, 7-30% Fe2O3, 3-4% TiO2 και μικρές ποσότητες F, P2O5, V2O5. Οικονομικά εκμεταλλεύσιμος για την παραγωγή αλουμίνας και επομένως και αλουμινίου θεωρείται ο βωξίτης, ο οποίος περιέχει περισσότερο από 45-50% Al2O3, λιγότερο από 20% Fe2O3 και μέχρι 10-12% SiO2 (σε διάφορες μορφές). Από 4 έως 5 τόνους βωξίτη (κατά μέσον όρο από 4,2 τόνους ευρωπαϊκού βωξίτη) παράγονται 2 τόνοι αλουμίνας, οι οποίοι παρέχουν 1 τόνο αλουμινίου. Βωξίτης χρησιμοποιείται επίσης στην τσιμεντοβιομηχανία, όπως και στην παραγωγή σιδήρου. Εκτιμάται ότι τα διαπιστωμένα παγκόσμια αποθέματα βωξίτη είναι περίπου 30 δισεκατομμύρια τόνοι, ενώ πολύ περισσότερα πρέπει να είναι τα αποθέματα βωξίτη που ακόμη δεν έχουν καταμετρηθεί. Βωξίτης εξορύσσεται σε πολλές χώρες στις οποίες περιλαμβάνοντα οι εξής (σε παρένθεση: η παραγωγή σε εκατομμύρια τόνους, το 2007): Αυστραλία (62,5), Βραζιλία (25,5), Ινδία (23), Κίνα (21,6), Ινδονησία (16), Τζαμάικα (14,6), Ρωσσία (6,1), Σουρινάμ (5,3), Βενεζουέλα (5,0), Καζακστάν (5,0), Γουιάνα (2,2), Ελλάδα (2,2), Σιέρα Λεόνε (1,2), Γκάνα (1,03), Τουρκία (0,9). Η εξόρυξη βωξίτη αναμφίβολα δημιουργεί μια μεγάλη πληγή στο περιβάλλον. Ειδικά στην περίπτωση επιφανειακών κοιτασμάτων, η εξόρυξή βωξίτη προϋποθέτει πλήρη αποψίλωση της περιοχής. Για παράδειγμα, στη Τζαμάικα η εξόρυξη βωξίτη (επιφανειακά κοιτάσματα) θεωρείται ως μια από τις κυριότερες αιτίες αποδάσωσης της νήσου [Αναφ. 3ζ]. Οι εταιρείες και οι βιομηχανίες εκμετάλλευσης του βωξίτη είναι υποχρεωμένες να καταβάλουν κάθε προσπάθεια περιβαλλοντικής αποκατάστασης των πληγεισών περιοχών, μετά την εξάντληση των σχετικών κοιτασμάτων.
|
||||||||||||||
Ηλεκτρολυτικές μέθοδοι. Το 1886, o Αμερικανός χημικός, εφευρέτης και μετέπειτα επιχειρηματίας Charles Martin Hall (1863-1914) και ο Γάλλος εφευρέτης Paul Heroult (1863-1914) και οι δύο σε ηλικία μόλις 22 ετών, ανεκάλυψαν ανεξάρτητα μεταξύ τους, στην Αμερική και στη Γαλλία αντίστοιχα, την ηλεκτρολυτική μέθοδο παραλαβής του μετάλλου από σύντηγμα αλουμίνας και κρυόλιθου. Ο κρυόλιθος (cryolite, Na3AlF6) είναι ένα σπάνιο ορυκτό, μικτό φθοριούχο άλας νατρίου-αργιλίου, στο τήγμα του οποίου η αλουμίνα παρουσιάζει σημαντική διαλυτότητα. Οι Hall και Heroult διαπίστωσαν ότι η αλουμίνα (σ.τ. 2072ºC) μπορούσε να διαλυθεί σε τηγμένο κρυόλιθο παρέχοντας ευτηκτικό μίγμα με σ.τ. περίπου 1000ºC, όπου μπορούσε να πραγματοποιηθεί αναγωγή του Al(III) με ηλεκτρόλυση προς μεταλλικό αλουμίνιο. Η μέθοδος τους, με τις βελτιώσεις που υπέστει στη συνέχεια, χάραξε τον δρόμο της σημερινής ηλεκτρολυτικής μεθόδου και επέφερε ουσιαστική πλέον μείωση του κόστους του αλουμινίου, το οποίο κατέστησε ένα μέταλλο της καθημερινότητας, δεύτερο σε παραγωγή και εφαρμογές μετά τον σίδηρο.
|
Ο τρεις θεμελιωτές της σύγχρονης παραγωγής αλουμινίου |
||
|
|
|
|
|
(1863-1914) |
(1863-1914) |
(1847-1904) |
Κατά τις πρώτες προσπάθειες απομόνωσης του μετάλλου χρησιμοποιήθηκε ως πηγή αλουμινίου η δαπανηρή στυπτηρίας K-Al, η οποία όμως σύντομα αντικαταστάθηκε από τον βωξίτη, ο οποίος βρισκόταν στη φύση σε άφθονες ποσότητες.
Ο Devill παραλάμβανε την αλουμίνα από τον βωξίτη με μια δύσχρηστη και όχι ιδιαίτερα αποδοτική μέθοδο, που βασιζόταν στη σύντηξη μίγματος λεπτοκονιοποιημένου πετρώματος και Na2CO3 σε υψηλές θερμοκρασίες (μέθοδος Le Chatelier). Ωστόσο, το 1888, ο Αυστριακός χημικός Karl Josef Bayer (1847-1904) συνέβαλε στην περαιτέρω μείωση του κόστους του αλουμινίου, με την επινόηση μιας οικονομικότερης μεθόδου επεξεργασίας του βωξίτη. Οι μέθοδοι αυτές περιγράφονται συνοπτικά στη συνέχεια.
Παρασκευή αλουμίνας - Μέθοδος Bayer [Αναφ. 4]
Εργαστηριακή παρασκευή. Η αλουμίνα παρασκευάζεται βιομηχανικά από τον βωξίτη σε ποσότητες εκατοντάδων εκατομμυρίων τόνων ετησίως και αποτελεί ένα φθηνό χημικό προϊόν. Επομένως, η εργαστηριακή σύνθεσή της από άλλες δαπανηρότερες ή πιο δυσεύρετες ενώσεις του αργιλίου δεν έχει κάποιο νόημα, αν και είναι απλή και εύκολη. 'Ετσι, σε μικρές ποσότητες και στα πλαίσια πειραμάτων επίδειξης, μπορεί να παρασκευασθεί με βραδεία προσθήκη διαλύματος αμμωνίας σε έντονα αναδευόμενο διάλυμα ενός άλατος του αλουμινίου, όπως π.χ. το θειικό αργίλιο, ή σε διάλυμα AlCl3, το οποίο παρασκευάζεται εύκολα με διάλυση μεταλλικού αλουμινίου (π.χ. φύλλο αλουμινίου) σε HCl.
Κατά την προσθήκη περίσσειας αμμωνίας σε διάλυμα άλατος του αργιλίου καθιζάνει ζελατινώδες ίζημα υδροξειδίου του αργιλίου, το οποίο στη συνέχεια συλλέγεται, εκπλένεται και πυρακτώνεται σε θερμοκρασία >900ºC παρέχοντας καθαρό οξείδιο Al2O3:
Al3+ + 3NH3
+ 3H2O
![]() Al(OH)3 + 3NH4+
2Al(OH)3
Al(OH)3 + 3NH4+
2Al(OH)3
![]() Al2O3
+ 3H2O
Al2O3
+ 3H2O
Η χρησιμοποίηση ισχυρών βάσεων (π.χ. NaOH) για την καταβύθιση του Al(OH)3 αποφεύγεται, διότι αφενός μεν περίσσεια ισχυρής βάσης επαναδιαλυτοποιεί το Al(OH)3 με σχηματισμό διαλυτών υδροξυσυμπλόκων του αργιλίου, αφετέρου δε το ζελατινώδες ίζημα Al(OH)3 προσροφά σχετικώς μεγάλες ποσότητες νατρίου από τις οποίες είναι δύσκολο να απαλλαγεί με εκπλύσεις.
Αλουμίνα μπορεί επίσης να παρασκευασθεί επίσης με απ' ευθείας πυράκτωση στυπτηρίας NH4-Al ή άλλων μη πτητικών αλάτων του αργιλίου, π.χ.
2NH4Al(SO4)2·12H2O
![]() Al2O3 + 4SO3 + 2NH3 + 13H2O
Al2(SO4)3
Al2O3 + 4SO3 + 2NH3 + 13H2O
Al2(SO4)3
![]() Al2O3 + 3SO3
2Al(NO3)3
Al2O3 + 3SO3
2Al(NO3)3
![]() Al2O3 + 3N2O5 (
Al2O3 + 3N2O5 (![]() NO2, NO, O2)
NO2, NO, O2)
Βιομηχανική παραγωγή αλουμίνας. Ο Deville επινόησε μια μέθοδο για την παραλαβή καθαρής αλουμίνας από βωξίτες, η οποία είναι γνωστή ως μέθοδος Le Chatelier. Η μέθοδoς βασιζόταν στη σύντηξη λεπτοκονιοποιημένου βωξίτη με Na2CO3 στους 1200ºC, που οδηγεί στον σχηματισμό άνυδρων αργιλικών αλάτων του νατρίου, όπως το (μετα)αργιλικό νάτριο (NaAlO2). Το σύντηγμα διαλυόταν σε νερό, τα αδιάλυτα συστατικά απομακρύνονταν και ακολουθούσε διαβίβαση CO2 στο διήθημα, που παρείχε ίζημα Al(OH)3, το οποίο με πυράκτωση έδινε Al2O3:
Al2O3 + Na2CO3
![]() 2NaAlO2 + CO2
NaAlO2 +
2H2O
2NaAlO2 + CO2
NaAlO2 +
2H2O
![]() Na+ + Al(OH)4-
Na+ + Al(OH)4-
2[Al(OH)4]-
+ CO2
![]() 2Al(OH)3 + CO32- +
H2O
2Al(OH)3
2Al(OH)3 + CO32- +
H2O
2Al(OH)3
![]() Al2O3
+ 3H2O
Al2O3
+ 3H2O
|
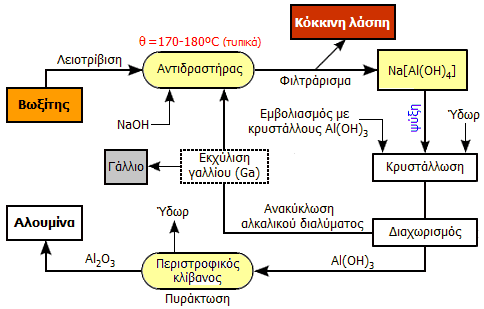
Συνοπτικό διάγραμμα της διεργασίας Bayer (παραλαβή αλουμίνας από βωξίτες). Σε ορισμένες βιομηχανίες παραγωγής αλουμίνας παραλαμβάνεται και το ιχνοστοιχείο γάλλιο από το ανακυκλούμενο αλκαλικό διάλυμα (Bayer's liquor). |
Σήμερα, η αλουμίνα παραλαμβάνεται σχεδόν αποκλειστικά (>95%) από τον βωξίτη με την οικονομικότερη και αποδοτικότερη μέθοδο Bayer (1888). Η μέθοδος Bayer βασίζεται στην επεξεργασία λεπτοκονιοποιημένου βωξίτη, ο οποίος μπορεί να περιέχει 40 έως 60% Al2O3, με πολύ πυκνό διάλυμα NaOH (140-220 g/L) σε κλειστά δοχεία (δηλ. υπό πίεση 5-7 atm) συνήθως στους 170-180ºC.
Κατά την ως άνω επεξεργασία διαλυτοποιούνται επιλεκτικά και με σχετικώς βραδύ ρυθμό οι διάφορες μορφές ένυδρου οξειδίου του αργιλίου (επαμφοτερίζον οξείδιο) που περιέχει ο βωξίτης, όπως είναι το AlO(OH) (διάσπορο, βοημίτης) ή το Al(OH)3 (γκιμπσίτης ή υδραργιλίτης) ή μίγμα τους, τα οποία μετατρέπονται σε διαλυτό αργιλικό νάτριο (sodium aluminate), Na[Al(OH)4]. Στο ίδιο στάδιο διαλυτοποιείται και το SiO2 παρέχοντας πυριτικά ανιόντα:
AlO(OH) + OH- + H2O
![]() [Al(OH)4]- ή/και
Al(OH)3 + OH-
[Al(OH)4]- ή/και
Al(OH)3 + OH-
![]() [Al(OH)4]- SiO2 + 2
OH-
[Al(OH)4]- SiO2 + 2
OH-
![]() SiO32- + H2O
SiO32- + H2O
Οι συνθήκες κάτω από τις οποίες πραγματοποιείται το στάδιο αυτό, εξαρτώνται από τον τύπο του βωξίτη. Βωξίτες αποτελούμενοι κυρίως από AlO(OH), οι αποκαλούμενοι διασπορικοί βωξίτες, απαιτούν εντονότερες συνθήκες αντίδρασης σε σχέση με τους βωξίτες, που αποτελούνται κυρίως από Al(OH)3 τους αποκαλούμενους γκιμπσιτικούς βωξίτες. Οι πρώτοι απαιτούν θερμοκρασία επεξεργασίας: 200-240ºC και συγκέντρωση NaOH: 180-220 g/L, ενώ οι δεύτεροι απαιτούν θερμοκρασία επεξεργασίας: 140ºC και συγκέντρωση NaOH: 140 g/L.
Το παραμένον αδιάλυτο μίγμα, γνωστό ως κόκκινη λάσπη (red mud), ένα πηχτό και καυστικό μίγμα διαλύματος NaOH και (κυρίως) ένυδρου Fe2O3, στο οποίο οφείλει το χαρακτηριστικό κόκκινο χρώμα του, απομακρύνεται ως το κύριο παραπροϊόν της διαδικασίας. Η περιεκτικότητα της κόκκινης λάσπης σε στερεά ποικίλει στην περιοχή 25-50%, ενώ το pH της φθάνει το 13.
Εάν στο αλκαλικό και πυκνό διάλυμα αργιλικού νατρίου, υπάρχουν μικρές ποσότητες διαλυμένων πυριτικών αλάτων, προστίθεται ποσότητα υδροξειδίου του ασβεστίου, ώστε να απομακρυνθούν ως αδιάλυτο CaSiO3 μαζί με την κόκκινη λάσπη. Ωστόσο, εάν τα πυριτικά άλατα στον βωξίτη ξεπερνούν το 10% (ως SiO2), η μέθοδος Bayer δεν είναι πλέον οικονομική, αφού μεγάλο μέρος του αργιλίου καθιζάνει ως δυσδιάλυτο μικτό αργιλοπυριτικό νάτριο (μια τυπική σύσταση που έχει αναφερθεί είναι: 14SiO2·Al2O3·Na2O·3H2O ή Na2Al2Si14O32·3H2O), οπότε θα πρέπει να αναζητηθεί άλλη μέθοδος επεξεργασίας του βωξίτη.
Παρατήρηση:
Συχνά στο αργιλικό νάτριο αποδίδεται ο τύπος NaAlO2
(μετα-αργιλικό νάτριο). Ωστόσο, το άλας αυτό προκύπτει κατά την ισχυρή
θέρμανση του υδροξυσυμπλόκου: Na[Al(OH)4]
![]() NaAlO2
+ 2H2O.
NaAlO2
+ 2H2O.
|
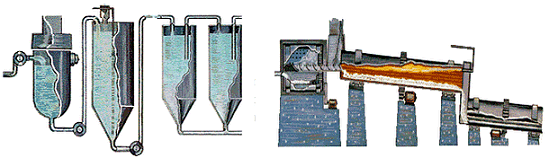
Αριστερά: Συστοιχία δεξαμενών καταβύθισης Al(OH)3. Δεξιά: Περιστροφικός κλίβανος θερμαινόμενος με καύση αερίου όπου το Al(OH)3 μετατρέπεται σε Al2O3 (αλουμίνα) [πηγή]. |
Μετά τη διήθηση και απαλλαγή από τα αδιάλυτα συστατικά ακολουθεί το στάδιο του εμβολιασμού (seeding) κατά το οποίο στο πυκνό αλκαλικό διάλυμα τα αργιλικά ανιόντα σταδιακά διασπώνται παρέχοντας στερεό Al(OH)3.
Ο Bayer ανακάλυψε (1888) ότι η διάσπαση αυτή επιταχύνεται με την προσθήκη μικρής ποσότητας στερεού κρυσταλλικού υδροξειδίου του αργιλίου και επιπλέον ότι το μητρικό αλκαλικό υγρό μπορούσε να ξαναχρησιμοποιηθεί. Ακόμη, διαπίστωσε ότι το Al(OH)3 που καθιζάνει κατά τη διάσπαση των αργιλικών ανιόντων, έχει μορφή συνεκτική και εύκολα διηθήσιμη, σε πλήρη αντίθεση με τη ζελατινώδη μορφή που αποκτά κατά την καθίζηση από όξινα διαλύματα, μορφή η οποία είναι εξαιρετικά δύσκολο να παραληφθεί. Αυτές οι ανακαλύψεις του Bayer συνέβαλαν αποφασιστικά στη μείωση του κόστους παραγωγής αλουμίνας και επομένως και του αλουμινίου.
Το πυκνό διάλυμα αργιλικού νατρίου αντλείται σε μεγάλες δεξαμενές καταβύθισης, που μπορεί να έχουν ύψος μεγαλύτερο και από 24 μέτρα και χωρητικότητες μεγαλύτερες από 1000 κυβικά μέτρα. Εκεί ψύχεται, αραιώνεται και εμβολιάζεται με κρυσταλλικό Al(OH)3 και αναδεύεται μέχρι και τρεις ημέρες, οπότε πραγματοποιείται κατά ελεγχόμενο τρόπο κρυστάλλωση, ώστε να ληφθεί Al(OH)3 με την επιθυμητή κατανομή μεγέθους κρυστάλλων για τα επόμενα στάδια.
Στη συνέχεια, το Al(OH)3 διαχωρίζεται και υπόκειται σε πυράκτωση (calcination) σε υψηλή θερμοκρασία (τυπικά: στους 980ºC) σε περιστροφικούς κλιβάνους (rotary kilns), παρέχοντας καθαρή αλουμίνα (οξείδιο του αργιλίου). Το στάδιο της πυράκτωσης πρέπει να ελέγχεται προσεκτικά, διότι καθορίζει σε σημαντικό βαθμό τις ιδιότητες του τελικού προϊόντος:
[Al(OH)4]-
![]() Αl(OH)3 + OH-
2Al(OH)3
Αl(OH)3 + OH-
2Al(OH)3
![]() Al2O3
+ 3H2O
Al2O3
+ 3H2O
Παραλαβή γαλλίου. Στους βωξίτες συναντώνται διάφορα σπάνια μέταλλα σε ιχνοποσότητες. Σημαντικότερο από αυτά είναι το γάλλιο (Ga), ένα ιδιαίτερα εύτηκτο μέταλλο (σ.τ. 29,8°C). Το γάλλιο, κυρίως ως αρσενίδιο (GaAs) και νιτρίδιο (GaN), χρησιμοποιείται ευρύτατα στη σύγχρονη ηλεκτρονική τεχνολογία. Σήμερα, το 95% του παραγόμενου γαλλίου κατευθύνεται στην παραγωγή ημιαγωγών. Οι ενώσεις του γαλλίου χρησιμοποιούνται στις οθόνες και σε ολοκληρωμένα κυκλώματα μεγάλης ταχύτητας των κινητών τηλεφώνων, στην παραγωγή φωτοεκπομπών διόδων (light emitting diode, LED), λέιζερ στερεάς κατάστασης, φωτοβολταϊκών στοιχείων και πολλών άλλων οπτοηλεκτρονικών (κυρίως) εξαρτημάτων.
 |
 |
 |
|
Σε πολλές βιομηχανίες παραγωγής αλουμίνας επιδιώκεται η παραλαβή του πολύτιμου για τη σημερινή τεχνολογία γαλλίου (Ga). Η κύρια χρήση του γαλλίου σήμερα εντοπίζεται στη σύνθεση του νιτριδίου του (GaN), ενός ημιαγωγού υλικού που χρησιμοποιείται στις λυχνίες LED λευκού φωτός (δεξιά). |
||
Σήμερα, οι μεγαλύτερες ποσότητες γαλλίου (ως νιτρίδιο GaN) χρησιμοποιούνται στα ονομαζόμενα "λευκά LED", τα οποία χρησιμοποιούνται ευρύτατα πλέον για φωτισμό με μικρή κατανάλωση ενέργειας. 'Ετσι, το γάλλιο θεωρείται πλέον ως μέταλλο στρατηγικής σημασίας για τη σύγχρονη ηλεκτρονική τεχνολογία και την εξοικονόμηση ενέργειας.
Δεν υπάρχουν κοιτάσματα συγκεκριμένων ορυκτών γαλλίου. Το στοιχείο αυτό βρίσκεται διάσπαρτο στη φύση και συνοδεύει διάφορα ορυκτά, αλλά πάντοτε σε πολύ μικρές αναλογίες. Το γάλλιο που βρίσκεται στους βωξίτες, με τυπική περιοχή περιεκτικοτήτων: 0,003-0,01% και μέση τιμή το 0,005% ή 50 ppm, είναι ουσιαστικά το μόνο από τα ιχνοστοιχεία του πετρώματος αυτού, του οποίου η παραλαβή μπορεί να έχει κάποια οικονομική σημασία.
Η επεξεργασία στην οποία υπόκεινται οι βωξίτες για την παραλαβή καθαρής αλουμίνας βοηθά έμμεσα και την παραλαβή του γαλλίου. Το γάλλιο, όπως και το αργίλιο, σχηματίζει υδατοδιαλυτά υδροξυσύμπλοκα με αποτέλεσμα το ανακυκλούμενο διάλυμα NaOH (Bayer's liquor) να εμπλουτίζεται σταδιακά με το πολύτιμο αυτό μεταλλικό στοιχείο (π.χ. από μια αρχική αναλογία Ga:Al 1:5000, φθάνει σε αναλογία 1:300). Μια τυπική σύνθεση των ανακυκλούμενων διαλυμάτων και εμπλουτισμένων σε γάλλιο μπορεί να είναι: 100-200 mg Ga/L, 70-120 g Al2O3/L και 140-240 g Na2O/L [Αναφ. 4θ].
Σε αρκετές βιομηχανίες παραγωγής αλουμίνας (και αλουμινίου) επιδιώκεται η παραλαβή του γαλλίου από το διάλυμα NaOH. Η παραλαβή του μετάλλου ξεκινά συνήθως με εκχύλιση με οργανικά συμπλεκτικά μέσα και καταλήγει σε ένα ηλεκτρολυτικό καθαρισμό. Σήμερα, η ετήσια παγκόσμια παραγωγή γαλλίου φθάνει τους (περίπου) 270 τόνους, οι οποίοι προέρχονται κυρίως από τους βωξίτες, έτσι μέχρι στιγμής το γάλλιο είναι το μόνο μέταλλο που παραλαμβάνεται από τον βωξίτη σε βιομηχανική κλίμακα εκτός βέβαια από το αλουμίνιο. Ωστόσο, η παραλαβή του γαλλίου φαίνεται πως δεν είναι σε όλες τις περιπτώσεις οικονομικώς συμφέρουσα.
 |
|
 |
+ |
 |
| Βωξίτης | Αλουμίνα (καθαρό Al2O3) | Κόκκινη λάσπη (κυρίως Fe2O3) |
|
Το μεγάλο πρόβλημα της βιομηχανίας αλουμίνας: Η διάθεση και η αξιοποίηση της "κόκκινης λάσπης" [Αναφ. 5]
Για κάθε τόνο αλουμίνας παράγεται ένας έως δύο τόνοι κόκκινης λάσπης, ανάλογα με την περιεκτικότητα του βωξίτη σε Al2O3 και Fe2O3. Η κόκκινη λάσπη περιέχει χρήσιμα στοιχεία (σίδηρο, υπολείμματα αργιλίου, τιτάνιο), ωστόσο δεν υπάρχει κάποιος οικονομικός τρόπος παραλαβής τους. Κατά κανόνα, η κόκκινη λάσπη φυλάσσεται σε μεγάλες ανοικτές δεξαμενές - τεχνητές λίμνες κατακάθισης (red mud settiling ponds), στις οποίες τα αναχώματα, φράγματα κ.λπ. θα πρέπει να υπόκεινται σε τακτικούς ελέγχους για πιθανές διαρροές. Βασικό μέλημα αποτελεί η κατά το δυνατόν εξουδετέρωση της μεγάλης αλκαλικότητας της κόκκινης λάσπης. Χρησιμοποιούνται διάφοροι τρόποι, όπως εξουδετέρωση με ισχυρά οξέα ή με CO2 προερχόμενο από διάφορες καύσεις στα εργοστάσια αλουμίνας και αλουμινίου, αλλά και από το CO2 της ατμόσφαιρας, έστω και με αργό ρυθμό. Στις τεχνητές λίμνες κατακάθισης αφήνεται η κόκκινη λάσπη να ξηρανθεί κατά το δυνατόν και η εξουδετερωμένη, ως προς την αλκαλικότητά της, ξηρή λάσπη μπορεί να συλλεχθεί από τις περιφέρειες των δεξαμενών και να μεταφερθεί σε άλλους χώρους μόνιμης απόθεσης. Εκτιμάται ότι ετησίως παράγονται περί τα 200 εκατομμύρια τόνοι κόκκινης λάσπης, η διαχείριση και η συσσώρευση της οποίας αποτελεί ένα από τα κυριότερα προβλήματα περιβαλλοντικού χαρακτήρα των εργοστασίων αλουμίνας και αλουμινίου σε όλο τον κόσμο. Δυστυχώς, μικρές μόνο ποσότητες εξουδετερωμένης ξηράς κόκκινης λάσπης μπορούν να αξιοποιηθούν. Πάντως έρευνες έδειξαν ότι αυτά τα κατάλοιπα επεξεργασίας του βωξίτη μπορούν να χρησιμοποιηθούν:
- ως πηγή σιδήρου στην παραγωγή
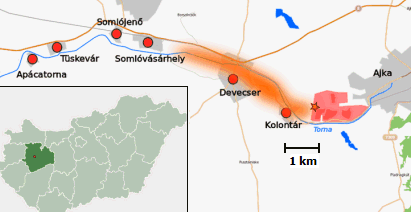
τσιμέντου Εκτιμάται ότι έως το 2025 θα ανακυκλώνεται περίπου το 25% της παραγόμενης κόκκινης λάσπης. Το βιομηχανικό ατύχημα σε εργοστάσιο αλουμίνας στην Ουγγαρία Σχετικά πρόσφατο είναι το ατύχημα που συνέβη σε μεγάλο εργοστάσιο παραγωγής αλουμίνας κοντά στην πόλη Ajka της βορειοδυτικής Ουγγαρίας. Στις 4 Οκτωβρίου του 2010, το ύψους 6 m φράγμα της βορειοδυτικής πλευράς της τεχνητής λίμνης κατακάθισης, η οποία συγκρατούσε τεράστιες ποσότητες κόκκινης λάσπης , κατέρρευσε με αποτέλεσμα την ταχύτατη διαρροή περίπου ενός εκατομμυρίου κυβικών μέτρων κόκκινης λάσπης. 'Ενας χείμαρρος κόκκινης καυστικής λάσπης ύψους 1-2 μέτρων απλώθηκε σε μια περιοχή συνολικής επιφάνειας 40 τετραγωνικών χιλιομέτρων (βλ. χάρτη). Η κόκκινη λάσπη πλημμύρησε τις γειτονικές κοινότητες Kolontar και Devecser, προκαλώντας τον θάνατο 10 και τον σοβαρό τραυματισμό 150 ανθρώπων κυρίως από χημικά εγκαύματα. Στον ποταμό Marcal, ο οποίος δέχτηκε τις μεγαλύτερες ποσότητες κόκκινης λάσπης, νεκρώθηκε κάθε υδρόβια μορφή ζωής και μέσω του ποταμού αυτού και άλλων παραποτάμων, μετά από λίγες ημέρες, η κόκκινη λάσπη κατέληξε στον ποταμό Δούναβη.
|
|||||||||||||
Χημικές ιδιότητες της αλουμίνας [Αναφ. 6]
Χαρακτηριστικό του οξειδίου του αργιλίου είναι ο επαμφοτερίζων χαρακτήρας του, όπως επίσης και η χημική του αδράνεια. Ο επαμφοτερίζων χαρακτήρας καταφαίνεται καλύτερα στο υδροξείδιό του, το οποίο διαλύεται ταχύτατα στα οξέα και στις βάσεις. 'Ετσι σε όξινα και σε αλκαλικά διαλύματα έχουμε τις αντιδράσεις:
Σε pH<4: Al(OH)3
+ 3 Η+
![]() Al3+ + 3 H2O Σε pH>9: Al(OH)3
+ OΗ-
Al3+ + 3 H2O Σε pH>9: Al(OH)3
+ OΗ-
![]() [Al(OH)4]-
[Al(OH)4]-
Ενδεικτικό της χημικής αδράνειας του Al2O3, είναι το ότι το αλουμίνιο, εξαιτίας ενός συνεκτικού, λεπτότατου, σχεδόν μονομοριακού στρώματος Al2O3, προστατεύεται αποτελεσματικά από περαιτέρω οξείδωση. Χωρίς αυτό το στρώμα, το αλουμίνιο ως δραστικό μέταλλο θα αντιδρούσε αυθόρμητα ακόμη και με το νερό. Ο σχηματισμός προστατευτικού στρώματος οξειδίου συμβαίνει και σε άλλα μέταλλα και είναι ένα φαινόμενο γνωστό ως παθητικοποίηση (passivation).
|
|
Είναι χαρακτηριστικό το ότι το
αμάλγαμα αλουμινίου (διάλυμα αλουμινίου σε υδράργυρο), όπου το
μέταλλο δεν προστατεύεται από επιφανειακό Al2O3, αντιδρά με το νερό: Al(Hg) + 3H2O ![]() Al(OH)3
+ 3/2H2
και χρησιμοποιείται ως
ισχυρό αναγωγικό μέσο στην οργανική σύνθεση. Ακόμη είναι εκπληκτικό το ότι
μικρή ποσότητα υδραργύρου μπορεί να καταστρέψει αντικείμενα από
αλουμίνιο. Αν ο υδράργυρος έρθει σε επαφή με τεμάχιο αλουμινίου και αποξεστεί τοπικά το προστατευτικό στρώμα του οξειδίου, σχηματίζεται αμάλγαμα
Hg-Al, το αλουμίνιο οξειδώνεται τοπικά και ο υδράργυρος προωθείται σε νέα
ποσότητα μετάλλου και τελικά μπορεί οξειδωθεί μεγάλο μέρος ή ολόκληρη η ποσότητα του
αλουμινίου.
Al(OH)3
+ 3/2H2
και χρησιμοποιείται ως
ισχυρό αναγωγικό μέσο στην οργανική σύνθεση. Ακόμη είναι εκπληκτικό το ότι
μικρή ποσότητα υδραργύρου μπορεί να καταστρέψει αντικείμενα από
αλουμίνιο. Αν ο υδράργυρος έρθει σε επαφή με τεμάχιο αλουμινίου και αποξεστεί τοπικά το προστατευτικό στρώμα του οξειδίου, σχηματίζεται αμάλγαμα
Hg-Al, το αλουμίνιο οξειδώνεται τοπικά και ο υδράργυρος προωθείται σε νέα
ποσότητα μετάλλου και τελικά μπορεί οξειδωθεί μεγάλο μέρος ή ολόκληρη η ποσότητα του
αλουμινίου.
|
Κρύσταλλοι κορουνδίου (corundum): Η καθαρότερη, συνεκτικότερη, σταθερότερη, σκληρότερη και ειδικώς βαρύτερη μορφή του Al2O3 (α-Al2O3) [πηγή]. |
Με ανοδική οξείδωση το προστατευτικό στρώμα οξειδίου αυξάνεται σε πάχος και αποκτά τη δυνατότητα προσρόφησης χρωμάτων για τη βαφή του μεταλλικού αργιλίου (αλουμινίου).
Η δραστικότητα των συνήθων ισχυρών οξέων έναντι της αλουμίνας είναι ελάχιστη έως μηδενική και εξαρτάται σημαντικά από τη θερμική επεξεργασία που έχει υποστεί (για τη μετατροπή του Al(OH)3 σε Al2O3). 'Οσο μεγαλύτερη είναι η θερμοκρασία πυράκτωσης της αλουμίνας, τόσο μεγαλύτερη είναι η χημική της αδράνεια.
Οι δομικές σχέσεις μεταξύ των διάφορων κρυσταλλικών μορφών του Al2O3 και του Al(OH)3 είναι εξαιρετικά πολύπλοκες και έχουν ιδιαίτερο επιστημονικό και τεχνολογικό ενδιαφέρον. Η πλέον κοινή κρυσταλλική δομή του Al2O3 και σταθερή σε κάθε θερμοκρασία είναι γνωστή ως α-Al2O3, συναντάται στο εξαιρετικής σκληρότητας ορυκτό κορούνδιο (το σκληρότερο ορυκτό μετά τον αδάμαντα, ειδ. βάρος: 4,0 g/cm3), την καθαρότερη φυσική μορφή του Al2O3. Πυράκτωση Al(OH)3 ή διαφόρων αλάτων του αργιλίου στους 1200ºC οδηγεί απ' ευθείας στη δομή α-Al2O3, τη σταθερότερη (καταληκτική) δομή και ουσιαστικά χημικώς αδρανή μορφή του Al2O3.
H αλουμίνα προσβάλλεται ή διαλύεται [Αναφ. 1β] από το υδροφθορικό οξύ, το υγρό υδροφθόριο αλλά και το ίδιο το φθόριο, λόγω της μεγάλης συγγένειας του αργιλίου με το φθόριο και του σχηματισμού σταθερών συμπλόκων Al-F, [AlFx]3-x (x = 1-6):
Al2O3 + 12 HF
![]() 2[AlF6]3- + 3H2O + 6H+
2Al2O3 + 3F2
2[AlF6]3- + 3H2O + 6H+
2Al2O3 + 3F2
![]() 4AlF3 + 3O2
4AlF3 + 3O2
Η συγγένεια του αργιλίου με το φθόριο έχει αξιοποιηθεί ή έχει προταθεί για την απομάκρυνση των φθοριούχων από το πόσιμο ύδωρ με διαβίβασή του μέσω στήλης αλουμίνας, όπως επίσης και για τη δέσμευση ποσοτήτων του εκλυόμενου αερίου HF από τα ηλεκτρολυτικά στοιχεία και τους χώρους εργασίας στα εργοστάσια παραγωγής αλουμινίου. Η ρόφηση (sorption) των φθοριούχων από την αλουμίνα μπορεί να αποδοθεί από τις ακόλουθες αντιδράσεις ισορροπίας:
-AlOH2+(επιφ.)
+ F-
![]() AlF+(επιφ.)
+ H2O -AlOH(επιφ.)
+ F-
AlF+(επιφ.)
+ H2O -AlOH(επιφ.)
+ F-
![]() -AlF(επιφ.)
+ OH-
-AlF(επιφ.)
+ OH-
Στη μεγάλη χημική συγγένεια του αργιλίου με το φθόριο οφείλεται και η διαλυτότητα της αλουμίνας σε τήγματα φθοριούχων αλάτων (όπως στον κρυόλιθο, Na3AlF6), ιδιότητα που αξιοποιείται στην ηλεκτρολυτική παραγωγή αλουμινίου με τη μέθοδο Hall-Héroult (βλ. παρακάτω).
Ο όξινος χαρακτήρας της αλουμίνας "αποκαλύπτεται" κατά τη θέρμανσή της με πυκνά διαλύματα ισχυρών βάσεων προς σχηματισμό διαλυτών υδροξυ-συμπλόκων (συλλογικά γνωστών ως "αργιλικά ανιόντα"), αντίδραση στην οποία βασίζεται η μέθοδος Bayer. Ωστόσο, η πλήρως αφυδατωμένη αλουμίνα αντιδρά δύσκολα με τήγματα βάσεων σε υψηλές θερμοκρασίες παρέχοντας πλήρως αφυδατωμένα αργιλικά άλατα (μετα-αργιλικά). Οι αντιδράσεις αυτές (γνωστές ως "συντήξεις") καθιστούν εφικτές τις διαλυτοποιήσεις δειγμάτων αλουμίνας αλλά και φυσικών αργιλικών ορυκτών.
Al2O3 + 2 OH- +
3H2O
![]() 2 [Al(OH)4]- Al2O3 + 2NaOH
2 [Al(OH)4]- Al2O3 + 2NaOH ![]() 2NaAlO2 + H2O
Al2O3 + Na2CO3
2NaAlO2 + H2O
Al2O3 + Na2CO3
![]() 2NaAlO2 + CO2
2NaAlO2 + CO2
Εφαρμογές της αλουμίνας
|
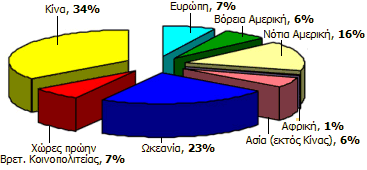
Κατανομή της παγκόσμιας παραγωγής αλουμίνας κατά το έτος 2010 [πηγή]. |
Η παγκόσμια παραγωγή αλουμίνας φθάνει περίπου τα 90 εκατομμύρια τόνους (87,4 εκατομμύρια το 2010), από τους οποίους περισσότεροι από τους μισούς παράγονται σε δύο χώρες, στην Κίνα και στην Αυστραλία (βλ. σχήμα δεξιά) [Αναφ. 7]. Περίπου το 90% της παραγόμενης αλουμίνας χρησιμοποιείται για την παρασκευή αλουμινίου. Το υπόλοιπο 10% της αλουμίνας βρίσκει πλήθος εφαρμογών τελείως διαφορετικών μεταξύ τους, δεδομένου του πλήθους των μορφών που έχει ή μπορεί να αποκτήσει η αλουμίνα και της ποικιλίας των χρήσιμων ιδιοτήτων της (σκληρότητα, ανθεκτικότητα, υψηλό σημείο τήξεως, χημική αδράνεια, καμία τοξικότητα).
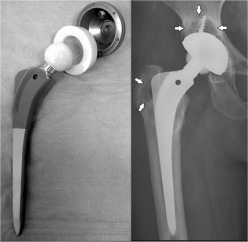 |
 |
|
Αριστερά: Ολική ορθοπλαστική ισχίου. Ο τριβέας του εμφυτεύματος αποτελείται από καθαρή αλουμίνα [πηγή]. Δεξιά: Κεραμικά οδοντικά εμφυτεύματα από αλουμίνα [πηγή]. |
|
Τα ορυκτά της (κορούνδιο, σμύριδα) ή η καθαρή αλουμίνα χρησιμοποιούνται ευρύτατα ως λειαντικά μέσα. Η καθαρή αλουμίνα ή μίγματά της με SiO2 και άλλα οξείδια χρησιμοποιούνται για την κατασκευή κεραμικών αντικειμένων για πλήθος εφαρμογών, όπως και συνθετικών πολύτιμων λίθων (σάπφειροι, ρουβίνια). Κεραμικά υλικά από αλουμίνα χρησιμοποιούνται ορθοπεδικά και οδοντιατρικά εμφυτεύματα.
Στα χημικά εργαστήρια η αλουμίνα χρησιμοποιείται ως στατική φάση σε χρωματογραφικούς διαχωρισμούς (χρωματογραφία στήλης και λεπτής στιβάδας) και ως ξηραντικό.
Στη χημική βιομηχανία η αλουμίνα χρησιμοποιείται ως καταλύτης συνήθως σε αντιδράσεις απόσπασης ύδατος. Για παράδειγμα, διαβίβαση ατμών αιθανόλης υπεράνω πυρακτωμένης αλουμίνας έχει ως αποτέλεσμα παραγωγή αιθυλενίου (βλ. Χημική ένωση του μήνα: Αιθυλένιο). Επίσης η αλουμίνα χρησιμοποιείται ως φορέας-υπόστρωμα άλλων καταλυτών.
Στη συνέχεια περιγράφονται ορισμένες από τις εφαρμογές της αλουμίνας.
Λειαντικά αλουμίνας [Αναφ. 8]. Η αλουμίνα, στην καθαρότερη φυσική μορφή της, ως το ορυκτό κορούνδιο ή ως σμύριδα (emery), μια μορφή κορουνδίου αναμεμιγμένου με άλλα ορυκτά χρησιμοποιούνται ως λειαντικά μέσα (abrasive). Η Ελλάδα (νήσος Νάξος) και η Τουρκία είναι οι κύριοι παραγωγοί σμύριδας στον κόσμο. Το Alundum είναι ένα τεχνητό υλικό λαμβανόμενο με ισχυρή πύρωση μέχρι τήξης (υαλοποίηση) αλουμίνας ή βωξίτη και αποτελεί ένα είδος τεχνητής σμύριδας. Τα υλικά αυτά τα συναντούμε σε πλήθος εργαλείων και προϊόντων ευρύτατης χρήσης και χαμηλού κόστους, όπως είναι οι σμυριδοτροχοί, σμυριδόπανα και σμυριδόχαρτα διάφορων τύπων.
Ως καθαρή αλουμίνα (99+%), προϊόν πυράκτωσης ή σύντηξης Al(OH)3, κυκλοφορεί στο εμπόριο η ονομαζόμενη διαβαθμισμένη αλουμίνα (graded alumina), η οποία χαρακτηρίζεται από το μέγεθος κόκκου, που μπορεί να κυμαίνεται από μερικές δεκάδες μm έως και 50 nm. Λείες, κατοπτρικές επιφάνειες μετάλλων, οπτικών εξαρτημάτων, δίσκων πυριτίου (wafers), πολύτιμων λίθων και άλλων υλικών μπορούν να επιτευχθούν με λείανση και στίλβωσή τους με σειρά από διαβαθμισμένες αλουμίνες με διαδοχικώς μειούμενο μέγεθος κόκκου (τυπικά: 1,0, 0,3 και 0,05 μm).
'Αλλα υλικά που χρησιμοποιούνται επίσης ως λειαντικά μέσα είναι το σιλικοκαρβίδιο (SiC, silicon carbide, carborundum), η σκόνη αδάμαντος και το πλέον σύγχρονο λειαντικό μέσο νιτρίδιο του βορίου (BN, Borazon), το σκληρότερο υλικό μετά τον αδάμαντα (9,5 βαθμοί κλίμακας Mohs). 'Αλλα συνθετικά λειαντικά μέσα με σκληρότητα στην περιοχή 9-9,5 κλίμακας Mohs είναι τα καρβίδια του βολφραμίου (WC) και του τιτανίου (TiC), ενώ με σκληρότητα στην περιοχή 9,5-10 υπάρχει το διβορίδιο του τιτανίου (TiB2).
Επίσης ευρύτατα χρησιμοποιούνται μίγματα ζιρκονίας (zirconia, ZrO2) και αλουμίνας, που σε αναλογία 2:3 σχηματίζουν ευκολότερα μορφοποιούμενο ευτηκτικό μίγμα (1890ºC). Για τη λείανση υάλινων αντικειμένων και ιδιαίτερα για την κατασκευή φακών χρησιμοποιείται η δημητρία (ceria, CeO2). Μια σύγκριση μεταξύ διαφόρων λειαντικών μέσων μπορεί να αναζητηθεί εδώ.
 |
 |
 |
 |
 |
 |
|
Λειαντικά μέσα κοινής χρήσης που βασίζονται στη σμύριδα (ακάθαρτη μορφή κορουνδίου) και στο Alundum. |
|||||
 |
 |
 |
 |
 |
|
Αλουμίνες διαβαθμισμένες (graded aluminas) διαφορετικού μεγέθους κόκκου για λειάνσεις επιφανειών μετάλλων και άλλων υλικών. Στην τελευταία δεξιά εικόνα: μια συλλογή φιαλών και φιαλιδίων με σκόνη, πάστα ή αιώρημα αλουμίνας διαφορετικού μεγέθους κόκκου. |
||||
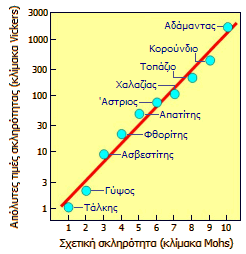
Κλίμακα σκληρότητας κατά Mohs [Αναφ. 9] Η διαδικασία της χάραξης ενός ορυκτού από ένα άλλο για τον καθορισμό του ποιο από τα δύο είναι μαλακότερο ή σκληρότερο αναφέρεται ήδη από το 300 π.Χ. στην εργασία του Θεόφραστου "Περί λίθων" και αργότερα από τον Πλίνιο τον Πρεσβύτερο στην εργασία του Φυσική Ιστορία (Naturalis Historia), περί το 77 μ.Χ. Σήμερα, η πιο γνωστή κλίμακα σκληρότητας είναι εκείνη που εισηγήθηκε και καθιέρωσε το 1812 ο διάσημος Γερμανός ορυκτολόγος Friedrich Mohs (1773-1839), καθηγητής ορυκτολογίας στο Πανεπιστήμιο του Graz (Αυστρίας). Η σκληρότητα (hardness) ενός ορυκτού δεν πρέπει να συγχέεται με την ανθεκτικότητα (toughness). Για παράδειγμα, το διαμάντι είναι το σκληρότερο γνωστό φυσικό υλικό, ωστόσο δεν παύει να είναι και σχετικά εύθραυστο. Η κλίμακα σκληρότητας του Mohs βασίζεται σε δέκα κοινά ορυκτά που τους αποδίδεται σκληρότητα από 1 (ο τάλκης, το μαλακότερο) έως 10 (ο αδάμαντας, το σκληρότερο). Τα δέκα αυτά ορυκτά, οι χημικοί τους τύποι και η απόλυτη σκληρότητά τους δείχνονται παρακάτω. Θα πρέπει να τονιστεί ότι η κλίμακα σκληρότητας Mohs δεν είναι απόλυτη αλλά σχετική και βασίζεται στην αρχή ότι εάν ένα υλικό Α μπορεί να χαράξει το υλικό Β, τότε το Α είναι σχετικώς σκληρότερο από το Β. Υπάρχει μια σχεδόν λογαριθμική σχέση μεταξύ της πραγματικής σκληρότητας και της κλίμακας Mohs. Για παράδειγμα, ο αδάμαντας με σκληρότητα 10 της κλίμακας Mohs δεν έχει "διπλάσια" πραγματική σκληρότητα από τον απατίτη με σκληρότητα 5, αλλά περίπου 30-πλάσια. Στο διάγραμμα αριστερά, δείχνεται η κατά προσέγγιση λογαριθμική σχέση μεταξύ της απόλυτης σκληρότητας (κλίμακα Vickers, λογαριθμικός άξονας τεταγμένων) και της σχετικής σκληρότητας (κλίμακα Mohs, γραμμικός άξονας τετμημένων).
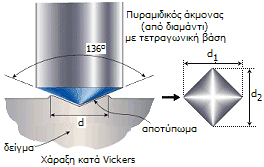
Κλίμακα σκληρότητας Vickers. Η δοκιμασία σκληρότητας Vickers αναπτύχθηκε από τους Robert L. Smith και George E. Sandland της εταιρείας Vickers Ltd, ένα τεράστιο συγκρότημα μεταλλουργίας, ναυπηγείων και κατασκευής μηχανών, για τη μέτρηση της σκληρότητας των υλικών. Η δοκιμασία βασίζεται στην άσκηση πίεσης σε μια λεία επιφάνεια του υλικού από άκμονα στην άκρη του οποίου υπάρχει μικρός αδάμαντας (συνήθως συνθετικός) σχήματος πυραμίδας με τετραγωνική βάση και καθορισμένης γωνίας.
Η πίεση ασκείται για ορισμένο χρονικό διάστημα και στη συνέχεια μετρούνται (με τη βοήθεια μικροσκοπίου) οι διαγώνιοι d1 και d2 της σχηματιζόμενης εσοχής. Για γωνία κορυφής 136º, οι βαθμοί σκληρότητας Vickers (HV: hardness Vickers) υπολογίζονται από τη σχέση: ΗV = δύναμη / επιφάνεια = 1,8544 F / d2 όπου: F είναι η ασκούμενη δύναμη (σε kg δύναμης) και d είναι η μέση τιμή των δύο διαγωνίων της σχηματιζόμενης πυραμιδοειδούς εσοχής (σε mm). Υπάρχουν και άλλες κλίμακες σκληρότητας, όπως η κλίμακα Brinell, όπου η αρχή είναι η ίδια, αλλά το πιεστικό άκρο του άκμονα είναι χαλύβδινο σφαιρίδιο. Σε όλες τις τεχνικές μέτρησης της απόλυτης σκληρότητας αυτό που ουσιαστικά μετρείται, είναι η αντίσταση του εξεταζόμενου υλικού στην πλαστική παραμόρφωση από την άσκηση μιας καθορισμένης πίεσης. |
||||||||||||||||||||||||
Κεραμικά υλικά [Αναφ. 10]. Η αλουμίνα καθαρή ή μετά την προσθήκη διαφόρων υποβοηθητικών προσθέτων, αν θερμανθεί σε υψηλή θερμοκρασία (>1500ºC) υπό πίεση μπορεί να μορφοποιηθεί και να δώσει συμπαγή και ανθεκτικά αντικείμενα. Αυτή η τεχνική μορφοποίησης, που δεν απαιτεί θέρμανση μέχρι τήξης και χύτευση του υλικού, είναι γνωστή ως πυροσυσσωμάτωση (sintering). Τυπικά αντικείμενα, που λαμβάνονται με πυροσυσσωμάτωση της αλουμίνας, είναι κεραμικά σκεύη και εξαρτήματα ειδικής χρήσης όπως ηλεκτρικοί μονωτήρες (π.χ. στα μπουζί αυτοκινήτων), ηλεκτρονικά εξαρτήματα, τριβεία, γουδιά, χωνευτήρια, στεγανωτικοί δακτύλιοι, τεχνητά ανθρώπινα μέλη (κεραμικές αρθρώσεις), οδοντικά εμφυτεύματα, προστατευτικά περιβλήματα ευγενών μετάλλων στα θερμοζεύγη, κυματαγωγοί λέιζερ, υποστρώματα καταλυτών. Πολλά από τα κεραμικά αυτά μπορούν να υποστούν και μηχανική επεξεργασία με τόρνο και φρέζα.
Τα κεραμικά αλουμίνας χαρακτηρίζονται από μεγάλη ανθεκτικότητα, σκληρότητα, θερμική σταθερότητα, αντοχή στη χημική διάβρωση και στις υψηλές θερμοκρασίες και μειωμένη φθορά κατά τη συνεχή χρήση. Τα υλικά αυτά διατηρούν τις μηχανικές τους ιδιότητες σε θερμοκρασίες τουλάχιστον μέχρι τους 1000ºC, τόσο σε οξειδωτική, όσο και σε αναγωγική ατμόσφαιρα. Τυπικά σκεύη και εξαρτήματα από αλουμίνα δείχνονται παρακάτω.
 |
 |
 |
 |
|
Κεραμικά σκεύη και εξαρτήματα από καθαρή αλουμίνα. |
|||
 Ινώδης αλουμίνα [Αναφ. 11].
'Ηδη από τη δεκαετία του 1970, παρασκευάσθηκαν και άρχισαν να κυκλοφορούν
στο εμπόριο με διάφορες εμπορικές ονομασίες (Saffil, Zircal)
ινώδεις μορφές αλουμίνας (95-97% Al2O3,
3-5% SiO2).
Οι ίνες αλουμίνας έχουν πολυκρυσταλλικό χαρακτήρα και διάμετρο 2 έως 6 μm. Οι τεχνικές
οι οποίες χρησιμοποιούνται για την κατασκευή τους καλύπτονται κάτω από
διπλώματα ευρεσιτεχνίας, συνήθως όμως
χρησιμοποιούνται τεχνικές περιδίνησης (spinning)
τήγματος αλουμίνας.
Ινώδης αλουμίνα [Αναφ. 11].
'Ηδη από τη δεκαετία του 1970, παρασκευάσθηκαν και άρχισαν να κυκλοφορούν
στο εμπόριο με διάφορες εμπορικές ονομασίες (Saffil, Zircal)
ινώδεις μορφές αλουμίνας (95-97% Al2O3,
3-5% SiO2).
Οι ίνες αλουμίνας έχουν πολυκρυσταλλικό χαρακτήρα και διάμετρο 2 έως 6 μm. Οι τεχνικές
οι οποίες χρησιμοποιούνται για την κατασκευή τους καλύπτονται κάτω από
διπλώματα ευρεσιτεχνίας, συνήθως όμως
χρησιμοποιούνται τεχνικές περιδίνησης (spinning)
τήγματος αλουμίνας.
Η ινοποίηση ουσιών με περιδίνηση είναι μια παλιά τεχνική κατά την οποία το τήγμα μιας ουσίας περιστρέφεται ταχύτατα και υποχρεώνεται από τη φυγόκεντρο δύναμη να διέλθει μέσω λεπτών οπών ενός περιστρεφόμενου δοχείου. Το πασίγνωστο "μαλλί της γριάς" (cotton candy) αποτελεί το πιο κοινό παράδειγμα παρασκευής λεπτότατων ινών καλαμοσακχάρου με τη μέθοδο της περιδίνησης τήγματός του.
|
Η αρχή είναι η ίδια... |
Οι ίνες σχηματίζουν συσσωματώματα που θυμίζουν βάμβακα και διαμορφώνονται σε "τάπητες" (mats), με φαινομενική πυκνότητα 0,035 g/cm3. Αυτά τα ινώδη υλικά χαρακτηρίζονται από χημική αδράνεια και ανθεκτικότητα σε υψηλές θερμοκρασίες. Το υλικό αυτό μπορεί να χρησιμοποιηθεί σε θερμοκρασίες μέχρι και τους 1600-1650ºC χωρίς οι ίνες να υποστούν σημαντική συρρίκνωση.
Η ινώδης αλουμίνα χρησιμοποιείται ως θερμομονωτικό υλικό σε βιομηχανικούς φούρνους και κλιβάνους, ως ηχομονωτικό, ως υπόστρωμα καταλυτών, όπως και στην οδοντιατρική και τη βιομηχανία ημιαγωγών. Αναφέρεται ότι μπορεί να αντικαταστήσει σε σχετικές εφαρμογές τον αμίαντο (asbestos), χωρίς όμως να παρουσιάζει αντίστοιχη επικινδυνότητα για την υγεία. Για να μειωθεί η επικινδυνότητα αυτή, επιδιώκεται να περιορισθεί η περιεκτικότητα των υλικών αυτών σε ίνες με διάμετρο 1 μm ή μικρότερη, όπως και η περιεκτικότητά του σε ελεύθερο SiO2.
Προσφάτως (2012) άρχισε η παραγωγή και διάθεση ινώδους αλουμίνας με διάμετρο ίνας 90 έως 120 nm (νανοΐνες, nanofibers), με την τεχνική της ηλεκτροπεριδίνησης (electrospinning), κατά την οποία η ίνα δημιουργείται με επίδραση ηλεκτροστατικού, αντί φυγοκεντρικού πεδίου, σε πυκνό, σχετικώς ιξώδες διάλυμα οξικού αργιλίου-πολυβινυλοπυρολιδόνης (PVP), το οποίο μόλις εξέρχεται από το ακροφύσιο υπόκειται σε πυράκτωση μετατρεπόμενο σε νανοΐνες αλουμίνας [Αναφ. 11ια].
Οι δυνατότητες εφαρμογών των νανοϊνών αλουμίνας είναι υπό εξέταση, ωστόσο πιστεύεται ότι υλικό αυτό μπορεί να χρησιμοποιηθεί στην ιατρική, σε σύνθετα υλικά, ως υλικό στήριξης καταλυτών (επιφάνεια ανά μονάδα βάρους: 100-200 m2/g) και ως διαχωριστής (separator) στις μπαταρίες ιόντων λιθίου και σε ηλεκτρικά στοιχεία καυσίμων.
 |
 |
 |
 |
|
Ινώδης αλουμίνα: προϊόντα και μικροφωτογραφίες των ινών. Στην τελευταία εικόνα δεξιά, δείχνονται νανοΐνες (nanofibers) διαμέτρου 90-120 nm. |
|||
|
|
|
 |
 |
|
Φυσικοί (αριστερά) και επεξεργασμένοι (δεξιά) πολύτιμοι λίθοι αποτελούμενοι από σχεδόν καθαρό Al2O3. Επάνω: σάπφειρος, Κάτω: ρουβίνιο |
|
Πολύτιμοι λίθοι από αλουμίνα [Αναφ. 12]. Δύο πολύ γνωστοί πολύτιμοι λίθοι, ο σάπφειρος (ζαφείρι) και το ρουβίνιο (ρουμπίνι), γνωστοί από την αρχαιότητα, αποτελούνται από σχεδόν καθαρό οξείδιο του αργιλίου. Ουσιαστικά πρόκειται για εξαιρετικά καθαρές και διαυγείς μορφές κρυσταλλικού κορουνδίου, των οποίων ο χαρακτηριστικός χρωματισμός οφείλεται σε ιχνοποσότητες μετάλλων. Στον συνήθως γαλαζωπό σάπφειρο ο χρωματισμός οφείλεται σε ίχνη Fe(ΙΙ,ΙΙΙ) (>0,1%) και Ti(ΙV) ή άλλων μετάλλων (ανάλογα με τον χρωματισμό του), ενώ το ερυθρό χρώμα του ρουβινίου οφείλεται σε ίχνη (0,5-1%) Cr(III).
Ο σάπφειρος είναι α-αλουμίνα με ίχνη
Fe(ΙΙ) ή Fe(ΙΙΙ) και Ti(IV). Ο χρωματισμός του σαπφείρου οφείλεται στο φαινόμενο
που είναι κοινό σε πολλές περιπτώσεις έντονα εγχρώμων ουσιών και είναι
γνωστό ως
μεταφορά φορτίου (charge transfer). Τα ιόντα Fe(II) και Ti(IV) αντικαθιστούν
μερικά από τα
ιόντα Al(III) και δημιουργούν στον κρύσταλλο εντοπισμένες περιοχές με άνισο
(μη ισοσταθμισμένο) ηλεκτρικό φορτίο. Η επικάλυψη των εξωτερικών
τροχιακών των δύο ατόμων είναι αρκετή, ώστε να καταστεί εφικτή η μεταφορά ηλεκτρονίου από τον Fe(II) στο
Ti(IV), που θα προκαλέσει μεταβολή σθένους και στα δύο (Fe(2+) + Ti(4+)
![]() Fe(3+) + Ti(3+)) και συγχρόνως μεταβολή
στην ενεργειακή κατάσταση του ηλεκτρονίου με απορρόφηση
ηλεκτρομαγνητικής ακτινοβολίας μήκους κύματος στην περιοχή του κίτρινου.
Αυτό έχει ως
αποτέλεσμα ο κρύσταλλος να αποκτά κυανό χρώμα, δηλ. το συμπληρωματικό του κίτρινου
χρώματος.
Fe(3+) + Ti(3+)) και συγχρόνως μεταβολή
στην ενεργειακή κατάσταση του ηλεκτρονίου με απορρόφηση
ηλεκτρομαγνητικής ακτινοβολίας μήκους κύματος στην περιοχή του κίτρινου.
Αυτό έχει ως
αποτέλεσμα ο κρύσταλλος να αποκτά κυανό χρώμα, δηλ. το συμπληρωματικό του κίτρινου
χρώματος.
|
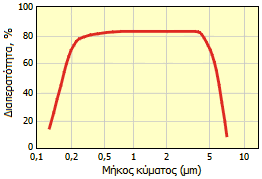
Φάσμα διαπερατότητας άχρωμου σαπφείρου [πηγή]. |
Το 1902, ο Γάλλος χημικός Auguste Verneuil εφηύρε την πρώτη εμπορικώς επιτυχή μέθοδο κατασκευής συνθετικών σάπφειρων και ρουβινίων με μορφή μονοκρυσταλλικού κυλίνδρου (boule). Η μέθοδός του βασίζεται σμε τήξη σε φλόγα υδρογόνου-οξυγόνου λεπτής σκόνης εξαιρετικώς καθαρής αλουμίνας, στην οποία έχουν προστεθεί ελεγχόμενες μικροποσότητες οξειδίων μετάλλων που θα προσδώσουν στον κρύσταλλο το επιθυμητό χρώμα. Εκτός από οξείδια σιδήρου και τιτανίου, οξείδια των μετάλλων νικελίου, κοβαλτίου, βαναδίου, χρωμίου, ουρανίου και θαλλίου, προστιθέμενα σε κατάλληλες αναλογίες μπορούν να προσδώσουν στον σάπφειρο οποιαδήποτε επιθυμητή απόχρωση.
Συνθετικοί σάπφειροι λαμβάνονται σήμερα με τήξη αλουμίνας σε χωνευτήρια από πανάκριβο μεταλλικό ιρίδιο (σ.τ. ιριδίου 2442ºC, σ.τ. αλουμίνας 2072ºC), μια μέθοδο που εφηύρε ο Πολωνός χημικός Jan Czochralski (1885-1953). Ακολουθεί εμβολιασμός του τήγματος με μικρό κρύσταλλο σαπφείρου, ο οποίος υπόκειται σε βαθμιαία ανύψωση (βλ. σχήμα). Η μέθοδος αυτή είναι γενικού χαρακτήρα (μέθοδος Czochralski) και χρησιμοποιείται ευρύτατα κυρίως στη βιομηχανία ηλεκτρονικών εξαρτημάτων για την κατασκευή μονοκρυστάλλων πυριτίου και άλλων ημιαγωγών υλικών. Η αλουμίνα κρυσταλλώνεται στην άκρη σχηματίζοντας επιμήκεις μάζες που θυμίζουν καρότα με διάμετρο μέχρι και 30 cm, οι οποίες μπορεί να φθάσουν σε βάρος τα 200 kg.
Το 2003 η παραγωγή συνθετικού σαπφείρου είχε φθάσει τους 250 τόνους (κυρίως σε ΗΠΑ και Ρωσία). Ο καθαρός και σχετικά φθηνός συνθετικός σάπφειρος έχει βρει πλήθος εφαρμογών στη σύγχρονη τεχνολογία (ηλεκτρονική, χημική ανάλυση, αεροδιαστημική, ιατρική, χειρουργική) [Αναφ. 12ια]. Ο άχρωμος σάπφειρος έχουν χρησιμοποιηθεί σε πολλές ειδικές κατασκευές: από τα καντράν ωρολογίων χειρός ποιότητας μέχρι ειδικές πειραματικές διατάξεις (π.χ. χημικοί αντιδραστήρες με "παράθυρα από σάπφειρο").
Οι κυψελίδες ή τα "παράθυρα" από σάπφειρο παρουσιάζουν εξαιρετική ανθεκτικότητα στη χημική διάβρωση (αντοχή σε οξέα και βάσεις μέχρι τους 1000ºC και στο HF μέχρι τους 300ºC) και στη μηχανική χάραξη και είναι διαφανείς σε μήκη κύματος από 0,2 έως 5,0 μm, που περιλαμβάνει τις περιοχές: υπεριώδες, ορατό και εγγύς υπέρυθρο. 'Eτσι, είναι δυνατή η φασματοσκοπική παρακολούθηση αντιδράσεων κάτω από έντονες συνθήκες θερμοκρασίας και πίεσης, στις οποίες θα ήταν αδύνατον να αντέξουν κυψέλες και "παράθυρα" από άλλα διαφανή υλικά.
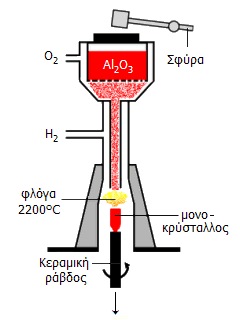 |
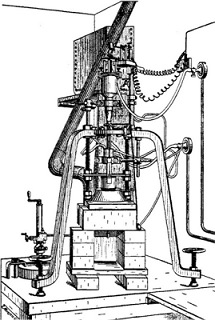 |
 |
 |
|
Από αριστερά προς τα δεξιά: (1) Αρχή μεθόδου Verneuil: Με ελαφρά κτυπήματα της σφύρας, λεπτή σκόνη αλουμίνας (+ ίχνη οξειδίου μετάλλου για χρωματισμό) εισέρχεται στον πυρσό φλόγας Η2-Ο2 (οξυυδρική φλόγα) θερμοκρασίας 2200ºC, όπου τήκεται και προσπίπτει σε μια κεραμική ράβδο η οποία κατέρχεται με βραδύ ρυθμό σε συγχρονισμό με τα κτυπήματα της σφύρας. (2) Η αρχική μορφή της μηχανής Verneuil. (3) Η κεραμική ράβδος (candle) με το αρχικό τμήμα του σχηματιζόμενου κρυστάλλου ρουβινίου. (4) Συνθετικοί σάπφειροι και ρουβίνια. |
|||
 |
 |
 |
 |
 |
|
Κατασκευή συνθετικών πολύτιμων λίθων με τη μέθοδο Czochralski. Το υλικό (εδώ αλουμίνα + οξείδια μετάλλων που θα δώσουν το επιθυμητό χρώμα) τήκεται σε ηλεκτρικά θερμαινόμενο δοχείο από δύστηκτο μέταλλο (π.χ. από ιρίδιο). Καθαρός κρύσταλλος του υλικού έρχεται σε επαφή με την επιφάνεια του τήγματος και ακολουθεί βραδεία ανύψωση (25 mm/h) με σύγχρονη περιστροφή του και σχηματισμός μονοκρυσταλλου. Ο έλεγχος της θερμοκρασίας του τήγματος έχει μεγάλη σημασία. Μεγαλύτερη θερμοκρασία θα τήξει τον κρύσταλλο εμβολιασμού, μικρότερη θα οδηγήσει σε κρυστάλλωση του υλικού στο δοχείο. Η μέθοδος χρησιμοποιείται ευρύτατα στη βιομηχανία ημιαγωγών για την παρασκευή μονοκρυστάλλων πυριτίου, GaAs και άλλων ημιαγωγών υλικών [πηγή]. |
||||
 |
 |
 |
 |
|
Αντικείμενα από συνθετικό άχρωμο σάπφειρο (από καθαρή αλουμίνα). Από αριστερά προς τα δεξιά: (1) Ανεπεξέργαστες ογκώδεις μάζες συνθετικού σαπφείρου βάρους μέχρι και μερικών δεκάδων χιλιογράμμων. (2) και (3): Αντικείμενα από συνθετικό σάπφειρο [πηγή]. (4) Δίσκοι (wafers) σάπφειροι έτοιμοι για χρήση ως υποστρώματα ολοκληρωμένων κυκλωμάτων (chips) ειδικής χρήσης. |
|||
|
Ηλεκτρονιακή δομή Al3+: [Ne] 2p6 Ηλεκτρονιακή δομή Cr3+: [Ar] 3d3 |
Tο ρουβίνιο είναι σάπφειρος ερυθρού χρώματος. Στο ρουβίνιο μικρό ποσοστό των ιόντων Al(ΙΙΙ) έχει αντικατασταθεί από Cr(ΙΙΙ). Σε αντίθεση με το Al(III), το Cr(III) διαθέτει ασύζευκτο ηλεκτρόνιο και αλληλεπιδρά με το φως. Η κρυσταλλογραφική διευθέτηση των ατόμων χρωμίου(III) ευνοεί την απορρόφηση κιτρινοπράσινης ακτινοβολίας, με αποτέλεσμα ο κρύσταλλος να αποκτά το συμπληρωματικό ρόδινο έως ερυθρό χρώμα. Μέρος του απορροφούμενου φωτός, επανεκπέμπεται ως ερυθρή φωταύγεια.
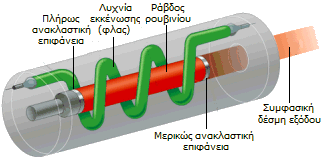
'Οταν η οπτική διευθέτηση στο ρουβίνιο επιτρέπει την εμπρός/πίσω ανάκλαση μεταξύ δύο παράλληλων κατόπτρων και η διέγερση από την κιτρινοπράσινη ακτινοβολία (λ = 694 nm) είναι συνεχής ("οπτικό αντηχείο"), η εκπεμπόμενη φωταύγεια αυξάνεται ταχύτατα σε ένταση. Το φαινόμενο αυτό αξιοποιήθηκε για πρώτη φορά το 1960 για την κατασκευή του πρώτου επιτυχημένου λέιζερ (laser: Light Amplification by Stimulated Emission of Radiation), του λέιζερ ρουμπινίου (ruby laser).
Συνθετικά ρουβίνια κατασκευάζονταν ήδη από τις αρχές του 19ου αιώνα: το 1837, ο Γάλλος χημικός Marc A. Gaudin (1804-1880) κατασκεύασε ρουβίνια με σύντηξη σε υψηλή θερμοκρασία στυπτηρίας ΝΗ4-Al με μικρές ποσότητες οξειδίου του χρωμίου, ωστόσο παρά τις προσπάθειες τριάντα ετών, δεν κατάφερε να λάβει διαφανή ρουβίνια κατάλληλα για την κατασκευή κοσμημάτων.
Εξαιρετικά συνθετικά ρουβίνια, τα οποία μετά τη χάραξη των εδρών είναι δύσκολο να διακριθούν από τα φυσικά ρουβίνια, κατασκευάζονται με τη μέθοδο Verneuil. Με την ίδια μέθοδο κατασκευάζονται οι ράβδοι ρουβινίου που χρησιμοποιούνται στα λέιζερ.
 |
 |
 |
 |
|
Από αριστερά προς τα δεξιά: (1) Αρχή του πρώτου επιτυχούς λέιζερ (λέιζερ ρουμπινίου). (2) Ράβδοι συνθετικού ρουβινίου (κατασκευασμένα με τη μέθοδο Verneui) για εφαρμογές σε λέιζερ [πηγή]. (3) Πανομοιότυπο του πρώτου λέιζερ. (4) Συναρμολογημένο λέιζερ ρουβινίου [πηγή]. |
|||
|
Σφαιρίδια ενεργοποιημένης πορώδους αλουμίνας χρησιμοποιούνται ως ξηραντικό μέσο, το οποίο μπορεί να αναγεννηθεί μετά από ισχυρή θέρμανση [πηγή]. |
Η αλουμίνα ως στατική φάση στη χρωματογραφία [Αναφ. 13]. Η αλουμίνα (Al2O3) και η πυριτία (silica, SiO2) είναι τα συχνότερα χρησιμοποιούμενα ανόργανα υλικά ως στατικές φάσεις σε χρωματογραφικούς διαχωρισμούς για αναλυτικούς και (κυρίως) παρασκευαστικούς σκοπούς. Ενώ η πυριτία έχει αποκλειστικώς όξινο χαρακτήρα (ελεύθερες σιλανολικές ομάδες -Si-OH), η αλουμίνα λόγω του διπόλου Al-O, μπορεί να αποκτήσει όξινο, βασικό ή και ουδέτερο χαρακτήρα, ανάλογα με την προεπεξεργασία της.
Η εμπορικώς διαθέσιμη αλουμίνα για χρωματογραφία στήλης παρασκευάζεται από στερεό υδροξείδιο του αργιλίου με το κατάλληλο κατά περίπτωση μέγεθος κόκκου, το οποίο θερμαίνεται στους 900°C, σε ρεύμα διοξειδίου του άνθρακα. Η επεξεργασία αυτή έχει ως αποτέλεσμα τη λήψη γ-αλουμίνας, μιας ενεργοποιημένης μορφής αλουμίνας με ατελείς κρυστάλλους, πορώδεις κόκκους και μεγάλης επιφάνειας (σε αντίθεση με τους συνεκτικούς κόκκους της α-αλουμίνας). Μετά την επεξεργασία αυτή η επιφάνεια καλύπτεται με ένα λεπτό στρώμα βασικού ανθρακικού άλατος του αργιλίου με χημικό τύπο (κατά προσέγγιση) [Al2(OH)5]2CO3.
 |
|
 |
|
Η αλουμίνα (ειδικής παρασκευής) στο χημικό εργαστήριο χρησιμοποιείται ευρύτατα ως στατική φάση στη χρωματογραφία στήλης για αναλυτικούς και παρασκευαστικούς σκοπούς. |
||
Στη συνέχεια, στη μορφή αυτή της αλουμίνας προσδίδεται ο επιθυμητός όξινος, ουδέτερος ή βασικός χαρακτήρας με επεξεργασία ενός αιωρήματός της 10% (κ.ο.) σε όξινα, ουδέτερα ή βασικά διαλύματα. Στο εμπόριο διατίθεται ως όξινη, ουδέτερη ή βασική αλουμίνα, που τα αντίστοιχα αιωρήματά τους σε ύδωρ παρέχουν σ' αυτό pH 4-5, 7,5-8,5 και 9,5-10,5, αντιστοίχως.
Τα μεγέθη κόκκων της εμπορικώς διαθέσιμης αλουμίνας για χρωματογραφία στήλης κυμαίνονται στην περιοχή των 50 έως 200 μm (με ενεργή επιφάνεια της τάξης των 150-350 m2/g). Στην επιφάνεια της αλουμίνας συναντώνται τα άτομα αργιλίου και οξυγόνου, που δρουν αντίστοιχα ως οξέα και βάσεις κατά Lewis, π.χ.:
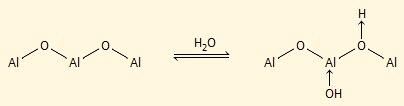
Η βασική αλουμίνα είναι συνηθέστερα χρησιμοποιούμενη μορφή και είναι κατάλληλη για διαχωρισμούς βασικών ή ουδέτερων ενώσεων σταθερών σε αλκάλια, όπως υδρογονάνθρακες, στεροειδή, αλκαλοειδή και βασικές φυσικές χρωστικές ουσίες. Η ουδέτερη αλουμίνα είναι χρήσιμη για τον διαχωρισμό καρβονυλικών ενώσεων, εστέρων, κινονών, γλυκοζιτών και λακτονών, ενώ η λιγότερο χρησιμοποιούμενη όξινη μορφή είναι κατάλληλη για τον διαχωρισμό οξέων, φαινολών και όξινων φυσικών χρωστικών.του
|
Ηλεκτρολυτική παραγωγή αλουμινίου με τη μέθοδο Hall-Héroult [Αναφ. 14] 'Οπως προαναφέρθηκε, το 90% της παγκόσμιας παραγωγής αλουμίνας χρησιμοποιείται για την ηλεκτρολυτική παραγωγή αλουμινίου σύντομη περιγραφή της οποίας ακολουθεί. Η ηλεκτρολυτική παραγωγή του αλουμινίου πραγματοποιείται σε διάλυμα 3-4% της αλουμίνας (Al2O3) σε τήγμα (περίπου στους 1000°C) του ορυκτού κρυόλιθος (cryolite, Na3AlF6), ενός σπάνιου ορυκτού που ανακαλύφθηκε για πρώτη φορά στη Γροιλανδία το 1799. Σήμερα, επειδή τα αποθέματα του ορυκτού δεν επαρκούν, ο κρυόλιθος παρασκευάζεται συνθετικά με πρώτη ύλη τον άφθονο φθορίτη (fluorite, CaF2), π.χ. με την ακόλουθη αλληλουχία αντιδράσεων:
CaF2 + H2SO4
Η διαλυτότητα της αλουμίνας στο τήγμα του κρυολίθου οφείλεται στον σχηματισμό οξoφθοριούχων ιόντων του αργιλίου, με βάση αντιδράσεις όπως:
Al2O3
+ 4AlF4- + 2F-
Κατιόντα αλκαλίων και γαιαλκαλίων και ανιόντα όπως τα προηγούμενα προσδίδουν ηλεκτρική αγωγιμότητα στο τήγμα και τη δυνατότητα ηλεκτρολυτικής αναγωγής του Al(III) προς μεταλλικό Al.
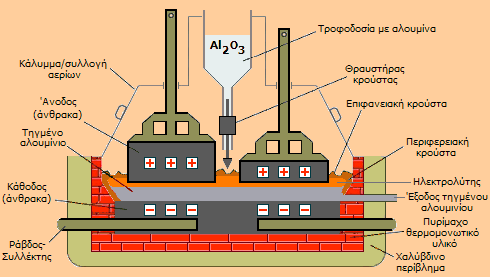
Στα ηλεκτρολυτικά στοιχεία (pots) η άνοδος αποτελείται από αγώγιμο πυρολυτικό άνθρακα που συνήθως παρασκευάζεται με ειδικές μεθόδους (π.χ. με πυράκτωση ασφαλτούχων υλικών με κωκ) συνήθως στα ίδια τα εργοστάσια παραγωγής αλουμινίου (προψημένες άνοδοι, pre-baked anodes). Η πυράκτωση πραγματοποιείται στους 1100-1150°C και μπορεί να διαρκέσει μέχρι και δύο εβδομάδες και αποβλέπει στην ομοιογενοποίηση του μίγματος και τη δημιουργία ανόδων με την κατάλληλη ηλεκτρική αγωγιμότητα και ικανών να αντέξουν στις υψηλές θερμοκρασίες της ηλεκτρόλυσης. Σύμφωνα με μια άλλη τεχνολογία (Soederberg technology), το ανθρακούχο μίγμα εισάγεται απευθείας εκ των άνω στο ηλεκτρολυτικό στοιχείο και η άνοδος δημιουργείται "επί τόπου" με εκμετάλλευση της θερμότητας που εκλύεται κατά την ηλεκτρόλυση. Στις ηλεκτροδιακές αντιδράσεις εμπλέκονται τα οξοφθοριούχα ανιόντα του αργιλίου, ωστόσο, το συνολικό αποτέλεσμά τους μπορεί να γραφεί απλά ως εξής:
Κάθοδος: 2 Al3+ + 6 e-
Το παραγόμενο στην άνοδο οξυγόνο οξειδώνει τον άνθρακα προς CO2 και έτσι οι χρησιμοποιούμενες άνοδοι απαιτούν τακτική αντικατάσταση. Συνήθως αντικαθίστανται μόλις καταναλωθούν τα 2/3 περίπου της μάζας του ανθρακούχου υλικού. Το υπόλοιπο 1/3 της ανόδου (butt) οδηγείται στη μονάδα κατασκευής ανόδων για ανακύκλωση. Η κάθοδος των στοιχείων είναι επίσης από γραφιτικό άνθρακα και βρίσκεται στον πυθμένα του ηλεκτρολυτικού στοιχείου, δεν υφίσταται ουσιαστικά φθορά και καλύπτεται από το παραγόμενο τηγμένο αλουμίνιο, οπότε ουσιαστικά ως κάθοδος δρα το ίδιο το τήγμα του μετάλλου. Η συνολική αντίδραση στο ηλεκτρολυτικό στοιχείο μπορεί να περιγραφεί από την ακόλουθη εξίσωση:
2 Al2O3 + 3 C + ηλεκτρική ενέργεια
Επομένως η ενέργεια που απαιτείται για την αναγωγή της αλουμίνας έχει μικτή προέλευση (χημική + ηλεκτρική), αφού ο άνθρακας μόνος του δεν θα μπορούσε να προκαλέσει αναγωγή στην αλουμίνα (το αργίλιο είναι ισχυρότερο αναγωγικό από τον άνθρακα). Ο καθαρός κρυόλιθος έχει σημείο τήξεως 1012°C, ενώ αν περιέχει και 2-3% Al2O3 μειώνεται περίπου στους 1000°C. Στο τήγμα προστίθεται μια επιπλέον ποσότητα AlF3 που υποβιβάζει ακόμη περισσότερο το σημείο τήξεως στους 950°C. Το τήγμα του ηλεκτρολύτη είναι ειδικώς ελαφρότερο (d = 2 g/cm3) από το τηγμένο αλουμίνιο (σ.τ. 660°C, d = 2,3 g/cm3) , έτσι το τελευταίο είναι συνεχώς καλυμμένο και δεν έρχεται σε επαφή με τον αέρα που θα το οξείδωνε εύκολα στις τόσο υψηλές θερμοκρασίες. Μια τυπική σύνθεση του τήγματος του ηλεκτρολύτη κατά τη διάρκεια της ηλεκτρόλυσης είναι: 79,8% Na3AlF6 + 12,2% AlF3 + 5,0% CaF2 + 3,0% Al2O3.
Η ηλεκτρόλυση πραγματοποιείται συνεχώς με χαμηλές τάσεις μεταξύ των δύο ηλεκτροδίων (4,0-4,5 V), αλλά με τεράστια ρεύματα (150-350 χιλιάδες Ampère). Το ρεύμα αυτό κατανέμεται σε πολλές παράλληλα συνδεδεμένες ανόδους. Η απόσταση μεταξύ κάθε ανόδου και της καθόδου (δηλ. του τηγμένου αλουμινίου) είναι σχετικά μικρή, τυπικά 4 έως 5 cm, για να διατηρείται μικρή η ωμική αντίσταση μεταξύ τους. Mικρότερη ωμική πτώση τάσης iR, συνεπάγεται μικρότερη τάση ηλεκτρόλυσης V και επομένως μικρότερη κατανάλωση ενέργειας. Ωστόσο, η ωμική πτώση τάσης πρέπει να είναι αρκετή, ώστε η εκλυόμενη θερμότητα Joule να διατηρεί τη θερμοκρασία του τήγματος λίγο πιο πάνω από το σ.τ. του ηλεκτρολύτη. Το εκλυόμενο από τις ανόδους CO2 συμβάλλει στην ανάδευση του τήγματος κατά την ηλεκτρόλυση. Κάθε ηλεκτρολυτικό στοιχείο παράγει 1 έως 2 τόνους αλουμινίου την ημέρα. Μέσω της εξίσωσης Faraday μπορεί εύκολα να υπολογιστεί ότι για την παραγωγή 1 τόνου αλουμινίου την ημέρα από ένα ηλεκτρολυτικό στοιχείο και θεωρώντας ως 100% την ηλεκτρολυτική απόδοση, θα πρέπει το στοιχείο αυτό να διαρρέεται από ρεύμα ίσο προς: I = Q/t = [ m(eq) x F(C/eq) ] / t (s) = { [ (106 g) / (27,0/3 g Al/eq Al) ] x (96485 C/eq) } / (24x3600 s) = 124.080,5 A.
Τα αέρια που παράγονται κατά την ηλεκτρόλυση (κυρίως CO2) υπόκεινται σε καθαρισμό (scrubbing), ώστε να απαλλαγούν από φθοριούχες ενώσεις (HF, σωματίδια φθοριούχων αλάτων) για να αποφευχθεί η ρύπανση του περιβάλλοντος. Αυτές οι τοξικές ουσίες εκλύονται σε μικρές ποσότητες από παράλληλες ανεπιθύμητες ηλεκτροδιακές αντιδράσεις και από τις υψηλές θερμοκρασίες της όλης διαδικασίας. Επιπλέον, επιδιώκεται η ανακύκλωση των συλλεγόμενων κατά τον καθαρισμό φθοριούχων αλάτων. Κατά την ηλεκτρόλυση, κατάλληλος μηχανισμός περιοδικά σπάει την επιφανειακή κρούστα και προσθέτει νέα ποσότητα αλουμίνας, ώστε να διατηρείται η περιεκτικότητά της στο τήγμα στην επιθυμητή περιοχή (3 έως 4%) και να περιοριστούν παράπλευρες ανεπιθύμητες ανοδικές αντιδράσεις, όπως π.χ. ο σχηματισμός CO, αλλά και αερίων υπερφθοριανθράκων (κυρίως CF4 και C2F6), που συμβαίνουν όταν μειωθεί η περιεκτικότητα του τήγματος σε αλουμίνα. Οι υπερφθοριάνθρακες είναι χημικώς αδρανή αέρια και έτσι δεν μπορούν να απομακρυνθούν από τις μονάδες καθαρισμού των εκλυόμενων αερίων. Δεν είναι τοξικοί, ωστόσο η παραγωγή τους είναι ανεπιθύμητη, διότι αποτελούν δραστικότατα "αέρια θερμοκηπίου" (βλ. Χημική ένωση του μήνα: Εξαφθοριούχο θείο) και ως εκ τούτου συνιστούν επιβλαβή ατμοσφαιρικό ρύπο. Εκτός από την κανονική τροφοδοσία των ηλεκτρολυτικών στοιχείων με αλουμίνα, είναι απαραίτητη και η τακτική προσθήκη πολύ μικρότερων ποσοτήτων AlF3 και κρυολίθου, για να αναπληρωθούν απώλειές τους λόγω δευτερευουσών αντιδράσεων. Επίσης σημαντικό είναι οι φθαρμένες άνοδοι να αντικαθίστανται χωρίς να διακοπεί η λειτουργία του στοιχείου. Για τον λόγο αυτό σε κάθε στοιχείο υπάρχουν συνήθως δύο συστοιχίες πολλών παράλληλα συνδεδεμένων ανόδων, ώστε κατά τη διάρκεια της αντικατάστασης της μίας να λειτουργούν οι υπόλοιπες. Η ηλεκτρόλυση του Al2O3 είναι διεργασία εξαιρετικώς ηλεκτροβόρα. 'Ενα εργοστάσιο παραγωγής αλουμινίου καταναλώνει ρεύμα όσο μια μικρή πόλη. Ενδεχόμενη διακοπή ρεύματος για παραπάνω από κάποιο χρονικό διάστημα (3-4 ώρες) σημαίνει στερεοποίηση των τηγμάτων στα ηλεκτρολυτικά στοιχεία και με αποτέλεσμα την ουσιαστική καταστροφή τους. Γι' αυτόν τον λόγο, τα περισσότερα εργοστάσια είτε παράγουν επιτόπου την ηλεκτρική ενέργεια που καταναλώνουν, είτε συνδέονται με παραπάνω από μία πηγές ενέργειας (έχουν δηλαδή απευθείας διεθνείς συνδέσεις). Οι απαιτούμενες ποσότητες των διαφόρων υλικών και ενέργειας για την παραγωγή 1 kg αλουμινίου δείχνονται στο επόμενο σχήμα.
|
||||||||||||
Ελληνική παραγωγή αλουμίνας - αλουμινίου [Αναφ. 15]
Στην εταιρεία "Αλουμίνιο της Ελλάδος" ανήκει το μοναδικό εργοστάσιο της Ελλάδος για παραγωγή πρωτόχυτου αλουμινίου. Βρίσκεται στον νομό Βοιωτίας και ιδρύθηκε το 1960 από τη γαλλική εταιρεία Πεσινέ (Pechiney). Από το 2005, η εταιρεία ανήκει στον όμιλο Μυτιληναίου.
To εργοστασιακό συγκρότημα της εταιρείας είναι ένα από τα λίγα πλήρως καθετοποιημένα εργοστάσια στην Ευρώπη, το οποίο παράγει και αλουμίνα και αλουμίνιο. Οι βασικές εγκαταστάσεις του "Αλουμινίου της Ελλάδος" βρίσκονται στο όρμο του Αγίου Νικολάου, κοντά στον οικισμό 'Ασπρα Σπίτια (παραλία Διστόμου). Καλύπτουν έκταση περίπου 1000 στρεμμάτων και είναι σε μεγάλο βαθμό σύγχρονες και αυτοματοποιημένες. Το λιμάνι εξυπηρετεί αποκλειστικά το εργοστάσιο για εκφόρτωση πρώτων υλών (βωξίτη) και φόρτωση των προϊόντων της εταιρείας (αλουμίνας και αλουμινίου). Το ανθρώπινο δυναμικό που απασχολεί το "Αλουμίνιο της Ελλάδος" είναι περίπου 1100 άτομα, ενώ περίπου 400 άτομα απασχολούνται σε συνεργαζόμενες επιχειρήσεις. Πληρέστερα στοιχεία παρέχονται σε δημοσίευση (Τζιμόπουλος, 2006) του Τεχνικού Επιμελητηρίου Ελλάδος [Αναφ. 15β].
 |
 |
 |
|
Οι εγκαταστάσεις της "Αλουμίνιο της Ελλάδος" στον όρμο του Αγίου Νικολάου στη Βοιωτία και οι περιοχές εξόρυξης βωξίτη. |
||
|
Επετειακή έκδοση με αφθονία φωτογραφικού και ιστορικού υλικού σχετικού με την ελληνική παραγωγή αλουμίνας και αλουμινίου (αρχείο PDF, 3,87 MB) |
Εξόρυξη βωξίτη στην Ελλάδα. Η ελληνική παραγωγή βωξίτη ξεπερνάει τους 2.500 εκατομμύρια τόνους/έτος. Ο κλάδος Βωξίτης-Αλουμίνιο-Αλουμίνα είναι σημαντικός για την ελληνική οικονομία: Απασχολούμενα άτομα (άμεσα ή έμμεσα): 40.000, κύκλος εργασιών: 3 δισεκατομμύρια ευρώ (2003). Τα προϊόντα αλουμινίου αποτελούν: το 7% του συνόλου των ελληνικών εξαγωγών ή το 10% των εξαγωγών βιομηχανικών προϊόντων ή το 60% των πωλήσεων προϊόντων αλουμινίου ή το 1% του ΑΕΠ. Η ανεξαρτησία σε πρώτη ύλη του κλάδου του αλουμινίου στην Ελλάδα οδήγησε σε πλήρη καθετοποίηση την παραγωγή και διαμόρφωσε βιομηχανική δραστηριότητα με μεγάλο οικονομικό και εξαγωγικό μέλλον για την Ελλάδα.
Η Ελλάδα κατέχει σημαντική θέση όχι μόνο στην Ευρωπαϊκή Ένωση αλλά και παγκοσμίως καθώς είναι μια από τις σημαντικότερες βωξιτοπαραγωγές χώρες. Η εξόρυξη του βωξίτη στη χώρα μας γίνεται κατά 65% με υπόγειες και 35% με υπαίθριες εκμεταλλεύσεις. Τα βέβαια αποθέματα βωξίτη της Ελλάδας ανέρχονται περίπου σε 130.000.000 τόνους και η ετήσια παραγωγή ξεπερνά τους 2.400.000 τόνους. Οι Ελληνικές εταιρείες παραγωγής βωξίτη είναι τέσσερις ("S&B Bιομηχανικά Ορυκτά", "Ελληνικοί Βωξίται Ελικώνος", "ΔΕΛΦΟΙ - ΔΙΣΤΟΜΟΝ Α.Μ.Ε." (θυγατρική της "Αλουμίνιο της Ελλάδος" - ΑτΕ), "ΕΛΜΙΝ Α.Ε.") και απασχολούν περί τα 700 άτομα.
Περιβαλλοντικές επιπτώσεις. Γενικά, η λειτουργία των βιομηχανιών αλουμίνας και αλουμινίου έχει βαρύτατες επιπτώσεις στο περιβάλλον και ως εκ τούτου, για τον περιορισμό των επιπτώσεων αυτών, τα λαμβανόμενα μέτρα θα πρέπει συνεχώς να εκσυγχρονίζονται, ενώ απαιτούνται συνεχείς περιβαλλοντικοί έλεγχοι.
Οι περιβαλλοντικές επιπτώσεις της λειτουργίας του εργοστασίου της "Αλουμίνιο της Ελλάδος" είναι σοβαρές και έχουν κατά καιρούς δημιουργήσει εντάσεις ανάμεσα στην εταιρεία και την τοπική κοινωνία. Οι επιπτώσεις προέρχονται κυρίως από: έκλυση προϊόντων καύσης πετρελαίου και κυρίως διοξειδίου του θείου (SO2), σκόνης βωξίτη, λεπτόκοκκης σκόνης αλουμίνας. Σημαντικά προβλήματα αποτελούν η απόρριψη της κόκκινης λάσπης βωξίτη στη θάλασσα, η έκλυση αερίων φθοριούχων προϊόντων (κυρίως υδροφθορίου) κατά την ηλεκτρόλυση του αλουμινίου και η έκλυση καυσαερίων χυτηρίων και καμίνων. Σημειώνεται ότι λόγω της ρύπανσης της ατμόσφαιρας με φθοριούχα αέρια είχαν παρατηρηθεί θάνατοι αιγοπροβάτων στην περιοχή. Παρά τις τεχνολογίες αντιρρύπανσης που έχει υιοθετήσει η εταιρεία, ακόμα και σήμερα τα φθοριούχα αέρια εξακολουθούν να αποτελούν μια σημαντική πηγή ρύπανσης στην ευρύτερη περιοχή [Αναφ. 15δ].