|

Διακοσμητικές
λάμπες (salt
lamps) με περίβλημα
από ορυκτό
αλάτι. |
Λαογραφικά
στοιχεία για το αλάτι. Το αλάτι κατείχε
πάντοτε
σημαντική θέση στη ζωή των λαών, στις συνήθειες, στη θρησκεία και στις
παραδόσεις τους. Κατά τους αρχαίους Έλληνες το αλάτι, κυρίως χάρις στην αξία που
είχε για τη συντήρηση τροφίμων, αλλά και τον εύγευστο χαρακτήρα που προσέδιδε
σ' αυτά και γενικότερα την αξία που είχε για την υγεία των ανθρώπων, συμβολίζει τη φιλία και την αλληλεγγύη.
Αυτός είναι και ο λόγος που το αλάτι χρησιμοποιούνταν για να επισφραγίσει
τις συμφωνίες τους και άλλες τελετουργικές πράξεις. Χρησιμοποιούσαν αλάτι
στις θυσίες και στις προσφορές τους προς τους θεούς. 'Ετσι, είχαν τη
συνήθεια να σκορπίζουν αλάτι σε αγρούς που αφιέρωναν στους θεούς τους. Ακόμη
και σε παραμύθια εκθειάζεται η αξία του αλατιού που παρομοιάζεται ή
θεωρείται πως ξεπερνάει ακόμη και την αξία του χρυσού.
Το αλάτι αναφέρεται σε πολλές ελληνικές
παροιμίες: "άλας και τράπεζαν μη παραβαίνειν", "μαζί φάγαμε ψωμί
κι αλάτι" (που σημαίνουν στενή σύνδεση και φιλία), "σε ξένο φαΐ αλάτι
μη ρίχνεις" (μην ανακατεύεσαι σε ξένες υποθέσεις), "τον έκαναν τ'
αλατιού" (δηλαδή τον έδειραν).
Ο Μωσαϊκός Νόμος θεωρεί το αλάτι ως σύμβολο και
ως απαραίτητο στοιχείο κάθε προσφοράς προς τον Θεό. Στην Καινή Διαθήκη το
αλάτι θεωρείται ακρογωνιαίο στοιχείο της ζωής και αναφέρεται ότι ο Χριστός
είχε πει στους μαθητές του: "υμείς εστέ το
άλας της γης". Πολλοί λαοί, όπως οι Ασσύριοι και οι Πέρσες, χρησιμοποιούσαν το
αλάτι στις θρησκευτικές τους τελετές. Οι αρχαίοι Λατίνοι έλεγαν "Nil
sole et sale utilius" (τίποτα πιο
χρήσιμο από τον ήλιο και το αλάτι).
Μέχρι σήμερα έχουν διατηρηθεί αρκετές προλήψεις
σχετικά με το αλάτι. 'Ετσι, δεν δανείζουν αλάτι οι χωρικοί, γιατί πιστεύουν
ότι "ψοφάνε τα ζωντανά". Επίσης αποφεύγουν να χύσουν αλάτι από
την αλατιέρα γιατί θεωρείται γρουσουζιά και πρέπει να ρίξει κανείς λίγο πίσω
του, πάνω από τον ώμο του για να γλυτώσει από την κακοτυχία. Ακόμη θεωρείται
ότι διώχνει τα δαιμόνια και τους ανεπιθύμητους επισκέπτες.
Στη Γερμανία θεωρείται ευλογία η ανακάλυψη αλατούχου πηγής.
Δημοφιλής
παράδοση σε πολλές χώρες της Ευρώπης είναι να ρίχνουν μια χούφτα αλατιού στο
φέρετρο του νεκρού πριν από τον ενταφιασμό. Το αλάτι είναι σύμβολο αθανασίας
και αδιάφθορου χαρακτήρα που θα κρατήσει μακριά τον διάβολο. Στη Σκωτία
συνηθίζεται να
βάζουν λίγο αλάτι κατά τη ζύμωση της μπύρας για να απομακρύνει τις μάγισσες
και τα κακά πνεύματα, στην ουσία όμως με τον τρόπο αυτό αποτρέπουν την επιπλέον
ζύμωση και προστατεύουν το προϊόν από την αλλοίωση.
Το αλάτι στη Λογοτεχνία. Το αλάτι
συναντάται συχνά σε μύθους, παραμύθια και σε τίτλους λογοτεχνικών έργων.
Ενδεικτικά: Μύθοι Αισώπου "Ο
γάιδαρος και το αλάτι", το σουηδικό παραμύθι "Αλάτι
στην ουρά της κίσσας", το παραμύθι των αδελφών Grimm "Η
πριγκίπισσα των μαργαριταριών", το ρωσικό παραμύθι "Το
βουνό από αλάτι", ο νορβηγικός μύθος "Γιατί
η θάλασσα έχει αλάτι;", η ιστορία φαντασμάτων του Charles Dickens "Φεύγοντας
με έναν κόκκο αλατιού", "Αλάτι
της Γης" (George Gissing), το ποίημα του Pablo Neruda "Ωδή
στο αλάτι".
Αλάτι και διατροφή. Το αλάτι έχει την ιδιότητα να εμποδίζει την
ανάπτυξη μικροοργανισμών, γι' αυτό και χρησιμοποιείται για τη συντήρηση των
τροφίμων (αλιπάστωση). Το αλάτι στο παρελθόν ήταν το κύριο συστατικό των αλατισμένων
τροφίμων και στα διάφορα τουρσιά (pickles) μαζί με το ξύδι. Το αλάτι που προέρχεται από τη
θάλασσα (θαλασσινό αλάτι) θεωρείται ωφελιμότερο (λόγω των μικρών ποσοτήτων
ιωδίου που περιέχει) από το ορυκτό και χρησιμοποιείται στην καθημερινή
διατροφή του ανθρώπου. Είναι απαραίτητη μια μικρή ποσότητα από αυτό να
λαμβάνεται καθημερινά με τις τροφές.
Το αλάτι στη διατροφή διευκολύνει
την πέψη, ανοίγει την όρεξη, συντελεί στην έκκριση των γαστρικών υγρών
και είναι κύρια πηγή του HCl που εκκρίνεται στο στομάχι, έτσι
εμποδίζει ανεπιθύμητες ζυμώσεις στο στομάχι και στα έντερα, αποτρέπει τη
δυσκοιλιότητα και βοηθάει στον μεταβολισμό των τροφών που περιέχουν
πρωτεΐνες. Είναι, επίσης, ωφέλιμο σε ορισμένες παθολογικές καταστάσεις,
γιατί εμποδίζει τις εσωτερικές αιμορραγίες, δρα σαν καθαρτικό κ.λπ. Το αλάτι
συντελεί στην αύξηση του αριθμού των ερυθρών αιμοσφαιρίων και τα βοηθά να
προσλαμβάνουν ευκολότερα το οξυγόνο, προσδίδοντας έτσι στο αίμα λαμπρότερο χρώμα.
Παρά την αξία που έχει το αλάτι για την υγεία
του ανθρώπου, η κατάχρησή του στη διατροφή είναι δυνατό να προκαλέσει
αρκετές παθολογικές καταστάσεις και ασθένειες. Η υπερβολική χρήση του στη
διατροφή μπορεί να οδηγήσει σε έλκος, δυσπεψία και νεφρικές βλάβες. Επίσης η υπερβολική χρήση αλατιού επιφέρει αύξηση της
πίεσης του αίματος. Για όλα αυτά επιβάλλεται προσοχή στον καθορισμό της
καθημερινά απαιτούμενης ποσότητας. Η ποσότητα αυτή ποικίλλει ανάλογα με τον
οργανισμό, την ηλικία και τη γενικότερη διατροφή.
|
Κάποια στοιχεία και
περιστατικά από την
ιστορία της οικονομίας του αλατιού
Το αλάτι πάντοτε αποτελούσε πολύτιμο εμπόρευμα. Μάλιστα έχει διατυπωθεί η υπόθεση ότι ο πολιτισμός
ξεκίνησε σε περιοχές κοντά σε ερήμους ακριβώς επειδή εκεί υπάρχαν μεγάλες
ποσότητες αλατιού. Ακόμη, θεωρείται ότι ο πρώτος πόλεμος πραγματοποιήθηκε
κοντά στην αρχαία πόλη Essalt στον ποταμό Ιορδάνη, ίσως λόγω των μεγάλων
αποθεμάτων της πόλης σε αλάτι. Η αξία του προφανώς ήταν τεράστια ιδιαίτερα
σε λαούς που ζούσαν μακριά από πηγές του (θάλασσες και αλατωρυχεία).
'Ενας από τους πρώτους φόρους που
αναφέρονται στην ιστορία είναι εκείνος που επιβλήθηκε από τον Κινέζο
αυτοκράτορα Hsia Yu (2200 π.Χ.) στο εμπόριο του αλατιού. Στο Θιβέτ, ο
Μάρκο Πόλο διαπίστωσε ότι χρησιμοποιούσαν σαν νομίσματα κάτι πίτες από αλάτι
με απεικονίσεις του Μεγάλου Χάνου. Ακόμη και σήμερα, νομαδικές φυλές της
Αφρικής χρησιμοποιούν το αλάτι σαν χρήμα.
Στην αρχαία Ελλάδα αγόραζαν
σκλάβους με αλάτι και από τότε έχει μείνει η υποτιμητική φράση "αυτός δεν
αξίζει το αλάτι του". Οι Ρωμαίοι λεγεωνάριοι συχνά πληρώνονταν με αλάτι
και για τον λόγο αυτό ο μισθός στα λατινικά λεγόταν salarium, που προερχόταν
από τη λατινική ονομασία του αλατιού: sal (γεν. salis).
Στο Τιμπουκτού (σήμερα στο Μαλί)
του 12ου αιώνα, την πύλη της ερήμου της Σαχάρας, έδρα των σοφών της
περιοχής, θεωρούσαν το αλάτι εξίσου πολύτιμο με τα βιβλία και τον χρυσό.
Στη Γαλλία, ο
Ο
Kάρολος ο Ανδεγαυικός (Charles d'
Anjou, 1226-1285) καθιέρωσε ένα φόρο στο αλάτι (gabelle) για να
χρηματοδοτήσει την εκστρατεία του (1259) κατά του Βασιλείου της Νάπολης. Ο
φόρος παρέμεινε και ήταν μια από τις αφορμές που πυροδότησαν τη Γαλλική
Επανάσταση (αν και προσωρινά είχε είχε καταργηθεί). Επί Γαλλικής
Δημοκρατίας ο φόρος αυτός επανήλθε και καταργήθηκε μόλις το 1946.
|
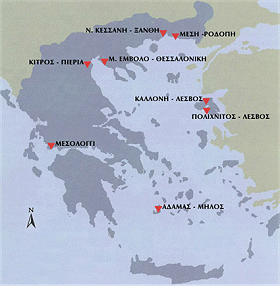
Οι θέσεις των
αλυκών στην Ελλάδα. |
Η Βρετανική μοναρχία επέβαλλε
μεγάλους φόρους στο αλάτι, γεγονός που οδήγησε σε εκτεταμένα δίκτυα μαύρης
αγοράς αλατιού. To 1785, o Κόμης του Dundonald έγραψε ότι κάθε χρόνο στην
Αγγλία συλλαμβάνονταν σχεδόν 10.000 άτομα για λαθρεμπόριο αλατιού.
Η
διώρυγα της
λίμνης 'Ηρι (Erie Canal), με συνολικό μήκος 584 χλμ, συνδέει τις μεγάλες λίμνες με τον
ποταμό Χάντσον της Πολιτείας της Νέας
Υόρκης, είναι γνωστή ως
"η τάφρος που φτιάχτηκε από το
αλάτι", αφού η κατασκευή της (1817-1825) πραγματοποιήθηκε για τη διακίνηση αλατιού
αλατωρυχείων που ανακαλύφθηκαν τότε κοντά στην πόλη Syracuse και
χρηματοδοτήθηκε από τους σχετικούς φόρους
Το 1930, ο
Mahatma Gandhi , διαμαρτυρόμενος κατά του βρετανικού ζυγού, ηγήθηκε
μιας συμβολικής πορείας 200 μιλίων προς τη μικρή πόλη Dandi στα παράλια της
Ινδίας στον Αραβικό Ωκεανό για να μαζέψει αλάτι για
τους φτωχούς της Ινδίας σαν ένδειξη απείθειας προς τους νόμους που επέβαλλαν
φόρο στο εμπόριο αλατιού (The
Gandhi salt march).
Συγκομιδή αλατιού
πραγματοποιούσαν και οι αρχαίοι 'Ελληνες και αποτελούσε μια εξαιρετικά
κοπιαστική εργασία. Οι αλυκές, τα αλοπήγια ("τηγάνια", salt pans) υπήρχαν ήδη από τη
μυκηναϊκή εποχή. Οι αρχαίοι Αθηναίοι το έπαιρναν από αλυκές στη Ραφήνα, τη
Βούλα και το Σούνιο. Οι Βυζαντινοί έπαιρναν το αλάτι τους από αλυκές σε όλο
το Αιγαίο, την Αδριατική και τη Μαύρη Θάλασσα.
Επί οθωμανικής
αυτοκρατορίας, την εκμετάλλευση των αλυκών την είχαν οι κοινότητες ή οι ιδιώτες. Σε κάθε περίπτωση έπρεπε να καταβάλλουν έναν φόρο, γνωστό ως "αλατιάτικο",
στις οθωμανικές αρχές. Το 1823, το αλάτι έγινε μονοπωλιακό είδος και
μέχρι το 1900 όλες οι αλυκές είχαν περάσει στο κρατικό μονοπώλιο.
Το 1893, μετά την
πτώχευση της Ελλάδας επί Τρικούπη, για να αποπληρωθούν τα δάνεια της χώρας
στους ξένους δανειστές εκχωρήθηκε φόρος από το μονοπώλιο αλατιού. Το 1985, μετά δηλ. από 92 χρόνια,
το χρέος
εξοφλήθηκε, οπότε και καταργήθηκε το
μονοπώλιο και ιδρύθηκε η δημόσια επιχείρηση "Ελληνικές Αλυκές Α.Ε.".
Το αλάτι σήμερα φορολογείται με 9% επί της τιμής του.
'Υστερα
από 50 χρόνια, υπήρχαν 25 τέτοιες αλυκές συνολικά. Σήμερα παραμένουν
ελάχιστες: δύο στο Μεσολόγγι, δύο στη Λέσβο (μία στην Καλλονή που είναι και
η πατρίδα της φημισμένης παστής σαρδέλας) και τέσσερις στον Βορρά: στο
Κίτρο, στην Ημαθία, στη Θεσσαλονίκη και στην Ξάνθη. Είναι ιδιωτικοποιημένες
πλέον, αλλά σχεδόν σε όλες το ελληνικό κράτος διατηρεί την πλειονότητα των
μετοχών [Αναφορά 4β].
|
Παραγωγή χλωριούχου νατρίου
[Αναφ. 4]
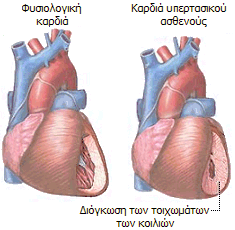
Το χλωριούχο νάτριο βρίσκεται άφθονο στη φύση
και τα αποθέματά του είναι πρακτικώς ανεξάντλητα. Οι τρόποι παραγωγής του ουσιαστικά είναι τρόποι απομόνωσής του και
καθαρισμού του από αυτές τις ανεξάντλητες πηγές, όπως η θάλασσα, οι
αλατούχες λίμνες και τα αλατωρυχεία.
Αλάτι από αλυκές. Αναφέρεται ως
ηλιακό αλάτι
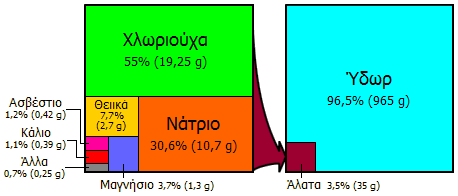
(solar salt). Η θάλασσα περιέχει 3,5% (w/w) διαλυμένα υλικά, από τα οποία το
77% είναι το αλάτι ή το 2,7% (w/w). Το υπόλοιπο 0,8% αποτελείται κυρίως από
ασβέστιο, μαγνήσιο και θειικά ιόντα. Το ηλιακό αλάτι παράγεται με την
επίδραση του ήλιου και του ανέμου πάνω στο νερό της θάλασσας. Το νερό
εξατμίζεται σε διαδοχικές τεχνητές ορθογώνιες ρηχές λεκάνες (ponds), γνωστές
ως αλοπήγια ή τηγάνια.
Προφανώς για
να μπορέσουν να αποδώσουν οι αλυκές απαιτούν περιορισμένες βροχοπτώσεις και υψηλές
ταχύτητες εξάτμισης. Στη Μεσόγειο Θάλασσα οι αλυκές
η ταχύτητα εξάτμισης ξεπερνά τη βροχόπτωση κατά έναν παράγοντα 3:1.
Στην Αυστραλία ο ίδιος παράγοντας μπορεί να φτάσει ακόμη και το 15:1.
Κρύσταλλοι αρχίζουν να εμφανίζονται στο συμπυκνωμένο θαλασσινό νερό (άλμη)
όταν φτάσει η περιεκτικότητά του σε NaCl στο 26%. Καθώς η εξάτμιση του νερού
συνεχίζεται, σχηματίζεται στο χωμάτινο πυθμένα της λίμνης ένα στρώμα
κρυσταλλικού αλατιού πάχους 10 έως 25 cm. Συνήθως δεν παραλαμβάνεται στο
σύνολό του, αλλά αφήνεται ένα μικρό στρώμα που δρα σαν πυθμένας για να
περιοριστεί η μόλυνση του αλατιού με γαιώδεις προσμίξεις.
Στις ελληνικές αλυκές η διαδικασία της
κρυστάλλωσης ξεκινάει τον Απρίλιο. Τον Σεπτέμβριο τα "τηγάνια"
στραγγίζονται από την άλμη (κορεσμένη σε NaCl και πλούσια στο εξαιρετικά
ευδιάλυτο MgCl2) που έχει παραμείνει και παραλαμβάνεται το
κρυσταλλωμένο αλάτι. Το αλάτι αυτό σωρεύεται σε αλατοσωρούς για μια
προκαταρκτική ξήρανση και στη συνέχεια αποθηκεύεται σε σιλό.
Στη συνέχεια το αλάτι μεταφέρεται στις αλατοβιομηχανίες για περαιτέρω καθαρισμό
ή διατίθεται απ' ευθείας για διάφορους σκοπούς. Ο καθαρισμός του αλατιού
αποβλέπει κυρίως στην απομάκρυνση αδιάλυτων γαιωδών προσμίξεων, όπως επίσης
και των αλάτων μαγνησίου, που αυξάνουν την υγροσκοπικότητα του αλατιού (το
MgCl2
είναι εξαιρετικά υγροσκοπικό) και
προσδίδουν σ' αυτό μια πικρή γεύση. Επιπλέον, στο αλάτι που
προορίζεται για τις τροφές, προστίθενται διάφορα
αντισυσσωματικά πρόσθετα (anti-caking additive)
(πυριτικό ασβέστιο, αργιλοπυριτικό ασβέστιο, ανθρακικό μαγνήσιο), όπως
επίσης και ιωδιούχο κάλιο για την παρασκευή ιωδιωμένου αλατιού.
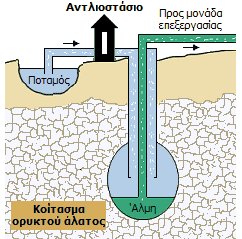
Εξόρυξη με
διάλυση (solution mining). Εξόρυξη αλατιού από υπόγεια κοιτάσματα
χλωριούχου νατρίου μπορεί να πραγματοποιηθεί με συνεχή διαβίβαση γλυκού
νερού (π.χ. από παρακείμενα ποτάμια) μέσω γεωτρήσεων. Το βάθος των
κοιτασμάτων μπορεί να είναι από 150 έως 1500 μέτρα. Η παραλαμβανόμενη άλμη
μεταφέρεται με σωληνώσεις σε χώρους εξάτμισης ή συμπύκνωσης και καθαρισμού.
Πρέπει να σημειωθεί ότι για πολλές βιομηχανικές
χρήσεις, όπως για τη διαδικασία Chloralkali (βλ. παρακάτω) το αλάτι μπορεί
να βρίσκεται σε μορφή πυκνής άλμης (brine) και δεν απαιτείται η χρήση του σε
καθαρή στερεά μορφή. Η διαδικασία αυτή είναι καταλληλότερη για περιοχές όπου
δεν υπάρχει η απαραίτητη ηλιοφάνεια ή η απόσταση από τη θάλασσα είναι
μεγάλη.
 Χημικές και φυσικές ιδιότητες του χλωριούχου νατρίου
[Αναφ. 5]
Χημικές και φυσικές ιδιότητες του χλωριούχου νατρίου
[Αναφ. 5]
Το
χλωριούχο νάτριο (μαζί με το νερό) είναι μια από τις πρώτες χημικές ενώσεις
που μαθαίνει κανείς στα πρώτα μαθήματα Χημείας που θα παρακολουθήσει. 'Ισως είναι
και μία από τις πολύ λίγες χημικές ενώσεις που γνωρίζει το κάθε άτομο με μια μέση
μόρφωση. Το χλωριούχο νάτριο αποτελεί και το πιο συνηθισμένο παράδειγμα που
χρησιμοποιούν οι διδάσκοντες για να αναφερθούν στις διαφορετικές φυσικές,
χημικές και φυσιολογικές ιδιότητες μιας χημικής ένωσης σε σχέση με τις
αντίστοιχες ιδιότητες των συστατικών στοιχείων της. Το παράδειγμα αυτό
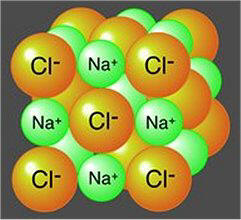
συνήθως
συνοδεύεται από μια εικόνα σαν αυτή που φαίνεται δίπλα, που δείχνει πως δύο
στοιχεία, το ένα στερεό μέταλλο, το άλλο ένα κιτρινοπράσινο αέριο, ιδιαίτερα επικίνδυνα σε ελεύθερη κατάσταση, όταν ενωθούν παρέχουν
μια κοινή και συχνά περιζήτητη ουσία.
Το χλωριούχο νάτριο είναι από χημική άποψη ένα
τυπικό άλας, στο κοινό και πανάρχαιο όνομα του οποίου οφείλεται η γενική
ονομασία αυτής της τάξης των χημικών ενώσεων. Πρόκειται για μια ετεροπολική ένωση που αποτελείται από κατιόντα νατρίου και
ανιόντα χλωρίου κανονικά τακτοποιημένα στο κρυσταλλικό σκελετό και συγκρατούμενα
με κουλομβικές δυνάμεις. Διαλύεται εύκολα στο νερό, αφού τα μόρια του
τελευταίου παρεμβάλλονται μεταξύ των ιόντων και εφυδατώνουν τα ιόντα νατρίου και
χλωρίου και καθιστούν ενεργειακά εφικτή την αποδόμηση του κρυσταλλικού
πλέγματος.
Οι χημικές ιδιότητες του χλωριούχου νατρίου δεν
είναι παρά εκείνες των συστατικών ιόντων του. Διαλύματά του παρέχουν τις
χαρακτηριστικές αντιδράσεις ανίχνευσης νατρίου (π.χ. χρωματίζουν τη φλόγα
κίτρινη), όπως και των ιόντων χλωρίου (π.χ. με διάλυμα νιτρικού αργύρου
παρέχουν δυσδιάλυτο ίζημα AgCl,
διαλυτό σε αραιό διάλυμα αμμωνίας).
Οι
φυσικές ιδιότητες του χλωριούχου νατρίου είναι τυπικές εκείνων των ετεροπολικών ενώσεων. Είναι δύστηκτο στερεό (σ.τ.
801°C). Εξατμίζεται
επίσης σε υψηλή θερμοκρασία (σ.ζ. 1465°C). Η διαλυτότητα του
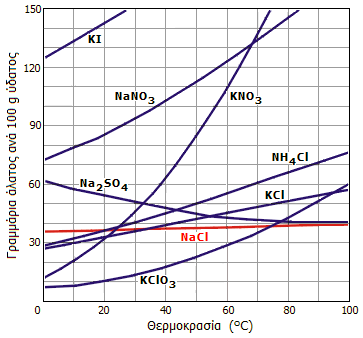
NaCl στο ύδωρ είναι σχετικά μεγάλη και αυξάνεται
σε μικρό βαθμό με αύξηση της θερμοκρασίας του ύδατος, σε αντίθεση με τα
περισσότερα άλατα. Στο επόμενο διάγραμμα δείχνεται η καμπύλη διαλυτότητας του
NaCl μαζί με τις αντίστοιχες άλλων τυπικών αλάτων.
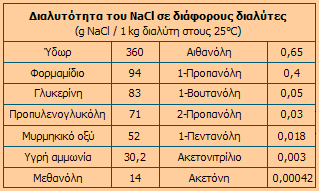
Η
διαλυτότητα του χλωριούχου νατρίου σε οργανικούς διαλύτες είναι πολύ μικρότερη ή
και μηδαμινή σε σχέση με τη διαλυτότητά του στο ύδωρ. Στον επόμενο πίνακα
δίνονται κάποιες τιμές διαλυτότητας του χλωριούχου νατρίου σε ορισμένους
οργανικούς διαλύτες, όπως και στην υγρή αμμωνία.
|
 |
 |
|
Διαλυτότητες διαφόρων του NaCl και
άλλων αλάτων στο νερό
σε διάφορες θερμοκρασίες |
Διαλυτότητα του NaCl σε διάφορους
διαλύτες [Αναφ. 1α] |
|
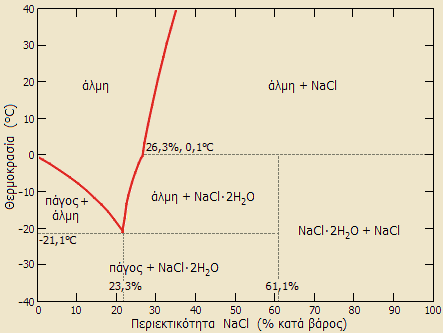 Διάγραμμα
φάσεων του συστήματος
χλωριούχο
νάτριο - ύδωρ [Αναφ. 5] Διάγραμμα
φάσεων του συστήματος
χλωριούχο
νάτριο - ύδωρ [Αναφ. 5]
Στο παραπλεύρως σχήμα
απεικονίζεται το διάγραμμα φάσεων του δυαδικού συστήματος χλωριούχου νατρίου
- ύδατος. Το διάγραμμα φάσεων ενός συστήματος απεικονίζει τις συνθήκες κάτω
από τις οποίες οι θερμοδυναμικώς διακριτές φάσεις μπορούν να βρεθούν σε
ισορροπία.
Για το καθαρό ύδωρ (0%
περιεκτικότητα σε NaCl), το σημείο πήξης βρίσκεται ακριβώς στους 0°C,
δηλ. στη θερμοκρασία αυτή βρίσκεται σε ισορροπία το νερό με τον πάγο. Για
διαλύματα NaCl η θερμοκρασία, στην οποία βρίσκεται σε ισορροπία ο πάγος με
το διάλυμα NaCl (άλμη), μειώνεται, έτσι π.χ. για διάλυμα NaCl 10% (w/w) το
σημείο αυτό βρίσκεται περίπου στους -8°C. 'Ενα ελάχιστο εμφανίζεται για
στους -21,2°C για διάλυμα NaCl 23% (w/w), που αποτελεί το "ευτηκτικό σημείο"
του δυαδικού συστήματος NaCl-H2O.
'Ετσι, η
προσθήκη χλωριούχου νατρίου στο νερό μπορεί να υποβιβάσει τη θερμοκρασία
πήξης μέχρι τους -21,2°C ή (αντίστοιχα) η ανάμιξη πάγου με στερεό NaCl,
θα προκαλέσει τήξη του πάγου αν η θερμοκρασία του είναι μεγαλύτερη από
εκείνη του ευτηκτικού σημείου.
Στη θερμοκρασία του
ευτηκτικού σημείου η άλμη βρίσκεται σε ισορροπία με μίγμα πάγου και μια
διένυδρης μορφής του χλωριούχου νατρίου, του υδροαλίτη (hydrohalite),
που είναι ασταθής σε θερμοκρασίες μεγαλύτερες από τους
-0,1°C,
όπου διασπάται σε κορεσμένη άλμη και στερεό χλωριούχο νάτριο (αλίτη).
|

Κρύσταλλοι υδροαλίτη σε ισορροπία με άλμη. Είναι
εμφανές το διαφορετικό κρυσταλλικό σύστημα (μονοκλινές)
σε σχέση με εκείνο του αλίτη (κυβικό) |
Ο υδροαλίτης
θεωρείται σπάνιο ορυκτό που συναντάται σε παραθαλάσσιες περιοχές πολύ ψυχρών
περιοχών (όπως στην Ανταρκτική).
Κατά την ψύξη διαλυμάτων
πιο πυκνών από 23% διαλυμάτων NaCl, απελευθερώνεται υδροαλίτης και άλμη
μέχρις ότου η άλμη αποκτήσει τη σύσταση του ευτηκτικού μίγματος, ενώ με περαιτέρω
ψύξη (κάτω από τους -21,2°C)
τα πάντα στερεοποιούνται σε μίγμα πάγου και υδροαλίτη.
Αποπάγωση. Χάρις στην ιδιότητα αυτή
(σχηματισμός ευτηκτικού μίγματος) μεγάλο ποσοστό της ετήσιας παραγωγής χλωριούχου
νατρίου διατίθεται για την αποπάγωση (de-icing) του οδικού δικτύου,
των πεζοδρομίων και των αεροδρομίων στις ψυχρές ημέρες του χειμώνα. Για ταχύτερη και
αποτελεσματικότερη αποπάγωση το αλάτι θα πρέπει να είναι ελαφρώς υγρό.
Θεωρητικά 1 μέρος βάρους αλατιού λιώνει 46,3 μέρη βάρους πάγου
θερμοκρασίας
-1°C.
Ωστόσο, στην πράξη δεν είναι απαραίτητη η πλήρης τήξη του πάγου. Αυτό που
χρειάζεται είναι να προληφθεί ή να καταστραφεί η πρόσφυση του πάγου ή του
χιονιού με την επιφάνεια του δρόμου και για το σκοπό αυτό αρκεί το 2% ή και
λιγότερο από τη θεωρητικά απαιτούμενη ποσότητα για την πλήρη τήξη.
Για θερμοκρασίες
χαμηλότερες από τους -21,2°C, αντί NaCl χρησιμοποιείται το ακριβότερο CaCl2,
του οποίου το ευτηκτικό διάλυμα (31% w/w) εμφανίζει θερμοκρασία πήξης -49,8°C.
Θα πρέπει πάντως να
σημειωθεί ότι η αποπαγωτική ικανότητα του αλατιού στην πράξη μειώνεται
εξαιρετικά για θερμοκρασίες μικρότερες των -9°C.
Αν και τα
άλατα αυτά αποτελούν τα φθηνότερα
αποπαγωτικά μέσα, έχουν το μειονέκτημα να διευκολύνουν την οξείδωση σιδηρών
αντικειμένων και είναι συνηθισμένο το θέαμα των οξειδωμένων "φτερών"
αυτοκινήτων στις περιοχές, στις οποίες για πολλούς μήνες και σχεδόν σε καθημερινή βάση χρησιμοποιείται αλάτι για
την αποπάγωση των δρόμων και των εθνικών οδών. Επιπλέον, απασχολεί και η
τοξικότητα των αλάτων αυτών για πολλούς μικροοργανισμούς των εδαφών.
|
Παραγωγή και κύριες χρήσεις του χλωριούχου
νατρίου
Σύμφωνα με την ετήσια έκθεση της Υπηρεσίας
Γεωλογικής Επισκόπησης των ΗΠΑ, η ετήσια παγκόσμια παραγωγή χλωριούχου
νατρίου κατά το 2010 είχε φτάσει σε ποσότητα τα 270 εκατομμύρια τόνους.
Μόνο στις ΗΠΑ η παραγωγή ήταν 45 εκατομμύρια τόνοι. Στις ΗΠΑ μεγαλύτερος
καταναλωτής αλατιού είναι η χημική βιομηχανία που καταναλίσκει το 40% της
παραγωγής του (κυρίως σε μορφή άλμης) για την παραγωγή (κυρίως) χλωρίου και
καυστικού νατρίου, αλλά και πολλών άλλων ουσιών (υποχλωριώδη και χλωρικά
άλατα). 'Ενα μεγάλο ποσοστό 38% του αλατιού χρησιμοποιείται για την αποπάγωση (deicing)
του οδικού δικτύου, ενώ το υπόλοιπο σε διανομείς (8%), στη γεωργία
(4%), στη βιομηχανία τροφίμων (4%), για διάφορες βιομηχανικές χρήσεις
(2%), στην επεξεργασία υδάτων (2%), άλλες χρήσεις και εξαγωγές (2%)
[Αναφ. 7].
Διαδικασία Chloralkali
[Αναφ. 8]
Η διαδικασία Chloralkali είναι μια βιομηχανική
διαδικασία που βασίζεται στην ηλεκτρόλυση πυκνού υδατικού διαλύματος
χλωριούχου νατρίου. Ανάλογα με τον τρόπο που διεξάγεται η ηλεκτρόλυση
(πυκνότητα ηλεκτρολύτη, θερμοκρασία, διαχωρισμός ή μη καθόδου - ανόδου)
μπορούν να ληφθούν αρκετά προϊόντα εκτός από υδρογόνο. Αν τα προϊόντα της
ανοδικής και της καθοδικής αντίδρασης διαχωρίζονται μεταξύ τους, τότε αυτά
είναι το χλώριο (Cl2)
και το υδροξείδιο του νατρίου (NaOH), ενώ, αν αναμιγνύονται το προϊόν είναι υποχλωριώδες νάτριο (NaClO)
σε χαμηλές θερμοκρασίες και χλωρικό νάτριο (NaClO3)
σε υψηλές θερμοκρασίες.
Η διαδικασία Chloralkali πραγματοποιείται σε
ηλεκτρολυτικά στοιχεία υδραργύρου (mercury cells), στοιχεία με
διάφραγμα (diaphragm cells) και σε στοιχεία μεμβράνης (membrane
cells), που διαφέρουν μεταξύ τους ως προς τον τρόπο με τον οποίο αποτρέπεται
η ανάμιξη των προϊόντων της ανόδου και της καθόδου.
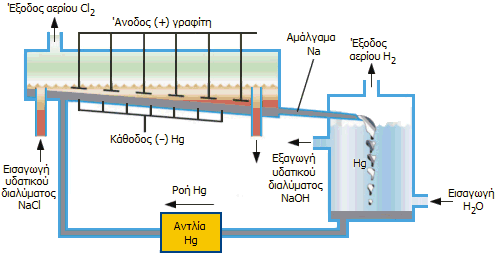 |
|
Διαδικασία Chloralkali με
ηλεκτρολυτικό στοιχείο υδραργύρου (αρχή). |
Σε όλες τις περιπτώσεις η ολική ηλεκτρολυτική
αντίδραση είναι η ακόλουθη:
2 NaCl + 2 H2O +
ηλεκτρική ενέργεια
 2 NaOH + Cl2
+ H2.
2 NaOH + Cl2
+ H2.
Στοιχεία υδραργύρου.
Στο επάνω σχήμα (αριστερά) δείχνεται η αρχή λειτουργίας του υδραργυρικού
ηλεκτρολυτικού στοιχείου. Το πυκνό υδατικό διάλυμα NaCl (σχεδόν κορεσμένο)
εισάγεται στο ηλεκτρολυτικό στοιχείο (σε συνεχή ροή) και έρχεται σε επαφή με
τα ηλεκτρόδια γραφίτη, που αποτελούν την άνοδο, όπως και με τον υδράργυρο,
που αποτελεί την κάθοδο και ρέει προς την ίδια κατεύθυνση. Ο γραφίτης
παρέχει την απαραίτητη χημική αδράνεια ως υλικό της ανόδου, ωστόσο επειδή
σταδιακά φθείρεται κατά τα τελευταία χρόνια έχει αντικατασταθεί από τιτάνιο.
Οι ηλεκτροδιακές
αντιδράσεις είναι:
|
'Ανοδος (θετικό ηλεκτρόδιο από γραφίτη): |
2 Cl-
 Cl2 + 2 e-
Cl2 + 2 e-
|
|
Κάθοδος (αρνητικό ηλεκτρόδιο από υδράργυρο): |
Na+ + e-
 Na
Na |
Θα πρέπει να σημειωθεί ότι στην άνοδο μπορεί να
συμβεί παράλληλα και οξείδωση του ύδατος (δηλ. του οξυγόνου του), σύμφωνα με την αντίδραση:
2 Η2Ο
 4 Η+ + Ο2 + 4 e-
4 Η+ + Ο2 + 4 e-
Ωστόσο, όσο πυκνότερο είναι το διάλυμα NaCl,
τόσο περισσότερο ευνοείται το χλώριο ως προϊόν της ανοδικής αντίδρασης. 'Ετσι,
στην άνοδο εκλύεται χλώριο, το οποίο ψύχεται, ξηραίνεται, υγροποιείται (έτσι
απαλλάσσεται από ίχνη οξυγόνου) και αποθηκεύεται υπό πίεση.
Στην κάθοδο, εξαιτίας του μεγάλου υπερδυναμικού
αναγωγής του Η(+1) σε υδραργυρικά ηλεκτρόδια, πραγματοποιείται αναγωγή των
ιόντων νατρίου και όχι του υδρογόνου του ύδατος. Το νάτριο διαλύεται αμέσως
στον υδράργυρο σχηματίζοντας ρευστό αμάλγαμα, όπου διατηρείται ως μέταλλο,
όσο το αμάλγαμα αποτελεί την κάθοδο του στοιχείου. Το ρευστό αμάλγαμα του
νατρίου ρέει σε έναν ξεχωριστό
αντιδραστήρα που περιέχει καθαρό νερό, όπου ελεύθερο και χωρίς να αποτελεί
πλέον την κάθοδο του στοιχείου, αντιδρά με το νερό σύμφωνα με
την αντίδραση:
2 Na (διαλυμένο σε Ηg) + 2 H2O
 2 NaOH + H2 + Hg
2 NaOH + H2 + Hg
 |
|
Διαδικασία Chloralkali με
ηλεκτρολυτικό στοιχείο μεμβράνης (αρχή). |
'Ετσι, από τον αντιδραστήρα εξέρχεται καθαρό
διάλυμα NaOH, ενώ ο υδράργυρος, απαλλαγμένος από το νάτριο, επανέρχεται στο
ηλεκτρολυτικό στοιχείο. Η όλη διαδικασία είναι συνεχής. Το εξερχόμενο υδατικό
διάλυμα NaCl, αφού απαλλαχθεί από το διαλυμένο χλώριο, το οποίο θα μπορούσε να διαλυτοποιήσει μέρος του υδραργύρου, εμπλουτίζεται με φρέσκο διάλυμα NaCl
και
επανέρχεται στο ηλεκτρολυτικό στοιχείο.
Οι μεγαλύτερες ποσότητες του παραγόμενου
υδραργύρου χρησιμοποιούνταν στα στοιχεία αυτά. Παρόλο που ο υδράργυρος
χρησιμοποιείται σε κλειστό σύστημα, ελάχιστες ποσότητές του είναι πάντοτε
πιθανό να διαφύγουν προς στο περιβάλλον. Επίσης, τα κύρια προϊόντα της
διαδικασίας (χλώριο, καυστικό νάτριο) είναι μολυσμένα με ίχνη ενώσεων
υδραργύρου. Σε μια περίπτωση προκλήθηκε σοβαρή ρύπανση του περιβάλλοντος από
διαρροή υδραργύρου, όπως και δηλητηρίαση μελών μιας φυλής Ινδιάνων (Εταιρεία
Dryden Chemical Company, Οντάριο, Καναδάς 1970). 'Ολα αυτά οδήγησαν στη σταδιακή εγκατάλειψη
των στοιχείων υδραργύρου για τη διαδικασία Chloralkali.
Στοιχεία με διάφραγμα. Στα στοιχεία αυτά η άνοδος (από γραφίτη) διαχωρίζεται από την κάθοδο (από
ανοξείδωτο χάλυβα) με ένα διάφραγμα από ίνες αμιάντου και πολυμερικά υλικά. Το υδατικό διάλυμα NaCl
εισέρχεται στο διαμέρισμα της ανόδου, όπου και διατηρείται σε υψηλότερη
στάθμη ώστε να έχει μια συνεχή ροή προς το διαμέρισμα της
καθόδου. Οι ηλεκτροδιακές αντιδράσεις είναι:
|
'Ανοδος (θετικό ηλεκτρόδιο από γραφίτη): |
2 Cl-
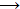 Cl2 + e-
Cl2 + e-
|
| Κάθοδος (αρνητικό
ηλεκτρόδιο από χάλυβα): |
2 Η2Ο
+ 2 e-
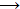 2 ΟΗ- + Η2
2 ΟΗ- + Η2 |
'Ετσι, στην άνοδο παράγεται χλώριο που
συλλέγεται όπως και στην προηγούμενη περίπτωση, ενώ στην κάθοδο, σε αντίθεση
με το στοιχείο υδραργύρου, παράγεται NaOH και υδρογόνο (σε μη υδραργυρικά
ηλεκτρόδια ανάγεται ευκολότερα το Η(+1) του ύδατος παρά το ιόν του νατρίου). 'Oταν
στο διάλυμα της ανόδου (ανολύτη) η περιεκτικότητα σε NaOH φτάσει το 50%
το NaCl απομακρύνεται με διαδικασία εξάτμισης και επανεισάγεται ως
άλμη στο ηλεκτρολυτικό στοιχείο. Ωστόσο, το διάλυμα NaOH πάντοτε περιέχει
προσμίξεις NaCl
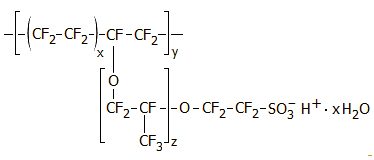 |
 |
|
Τυπική χημική δομή του Nafion και
μια τυπική μορφή του. |
Στοιχεία μεμβράνης. Τα στοιχεία μεμβράνης είναι παρόμοια
σε κατασκευή με τα στοιχεία με διάφραγμα, μόνο που τη θέση του διαφράγματος
καταλαμβάνει ένα πολυμερικό κατιονανταλλακτικό υλικό, το οποίο επιτρέπει τη διέλευση
μόνο σε κατιόντα (cation-exchange membrane, CEM). Αυτό σημαίνει ότι μόνο τα
ιόντα νατρίου μπορούν να περάσουν από το διαμέρισμα της ανόδου προς το
διαμέρισμα της καθόδου και όχι τα ιόντα χλωρίου. Προφανές πλεονέκτημα είναι
ότι το διαμέρισμα της καθόδου δεν μολύνεται από χλωριούχα και το παραγόμενο
NaOH είναι απαλλαγμένο από NaCl.
Μια τυπική κατιονανταλλακτική μεμβράνη που
συνδυάζει τις επιθυμητές ιδιότητες ως προς την επιλεκτική διέλευση των
κατιόντων σε συνδυασμό με χημική αδράνεια (απαραίτητη λόγω της παρουσίας
ελεύθερου χλωρίου στην περιοχή της ανόδου του ηλεκτρολυτικού στοιχείου)
είναι το
Nafion. Πρόκειται για ένα υπερφθοριωμένο πολυμερές
με όξινες σουλφονικές ομάδες, που παρασκευάσθηκε στην εταιρεία Du Pont κατά
τα τέλη της δεκαετίας του 1960. Τα πρωτόνια μπορούν διακινηθούν με "πηδήματα" από τη
μια σουλφονική ομάδα στην άλλη, ενώ μέσω των πόρων μπορούν να διέλθουν τα
κατιόντα, όχι όμως ανιόντα και ηλεκτρόνια. Οι διάφοροι τύποι μεμβρανών Nafion διαφέρουν μεταξύ τους ως προς την αγωγιμότητά τους για διάφορα
κατιόντα.
Το υδρογόνο αποτελεί ένα επιπλέον προϊόν της διαδικασίας Chloralkali.
Οικονομικά δεν προσφέρει πολλά, διότι άλλες πηγές υδρογόνου παρέχουν το
αέριο αυτό με πολύ μικρότερο κόστος. Ωστόσο, μπορεί να χρησιμοποιηθεί ως καύσιμο ή για την επιτόπια παραγωγή υδροχλωρίου.
Μια άλλη ιδέα είναι η τροποποίηση της τυπική διαδικασίας
Chloralkali με σκοπό τη μείωση του κόστους με
κατάργηση της παραγωγής υδρογόνου.
Αυτό μπορεί να επιτευχθεί με αντικατάσταση της καθόδου
παραγωγής υδρογόνου με μια κάθοδο κατανάλωσης οξυγόνου (ηλεκτρόδια
διάχυσης αερίου, που συνήθως χρησιμοποιούνται
στα "στοιχεία καυσίμων"). Τα ηλεκτρόδια διάχυσης αερίου είναι
πορώδη εξασφαλίζουν τεράστια επιφάνειας επαφής του εισαγόμενου αερίου με το
διάλυμα του ηλεκτρολύτη, μειώνοντας σημαντικά τα υπερδυναμικά των
ηλεκτροδιακών αντιδράσεων.
Στην προκειμένη περίπτωση στην πορώδη κάθοδο εισάγεται οξυγόνο,
οπότε αντί να αναχθεί το Η2O
προς H2
[ανάγεται το Η(+1) προς Η(0)], ανάγεται (ευκολότερα) το εισαγόμενο οξυγόνο, Ο2, προς
H2Ο
[ανάγεται το Ο(0) προς Ο(-2)].
To αποτέλεσμα είναι να απαιτείται μικρότερη
εφαρμοζόμενη τάση στο στοιχείο κατά 0,8 έως 1,0 V,
γεγονός που συνεπάγεται μείωση της κατανάλωσης ηλεκτρικής ενέργειας, η οποία
μπορεί να φτάσει και το 30%. Στο
οικονομικότερο αυτό σύστημα στοιχείου μεμβράνης η ολική ηλεκτρολυτική
αντίδραση είναι η ακόλουθη: 2 NaCl + H2O +
1/2 Ο2
+ ηλεκτρική ενέργεια
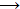 2 NaOH + Cl2
[Αναφ. 8β].
2 NaOH + Cl2
[Αναφ. 8β].
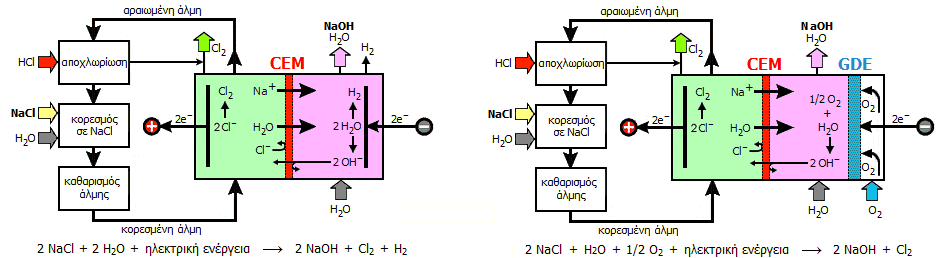
Στοιχεία μεμβράνης για τη
διαδικασία Chloralkali: Αριστερά: Με κάθοδο όπου ανάγεται το ύδωρ, Δεξιά: Με
κάθοδο κατανάλωσης οξυγόνου.
(CEM: Cation
Exchange Membrane, GDE: Gas Diffusion Electrode)

Τα κύρια προϊόντα της
διαδικασίας Chloralkali: Χλώριο, καυστικό νάτριο,
λευκαντικά διαλύματα υποχλωριώδους νατρίου (χλωρίνες), χλωρικό νάτριο.
Παρασκευή
υποχλωριώδους και χλωρικού νατρίου. Απουσία διαφράγματος ή
μεμβράνης το χλώριο, που παράγεται στην άνοδο, έρχεται σε επαφή με το
υδροξείδιο του νατρίου, που παράγεται στην κάθοδο με αποτέλεσμα χημική αντίδραση μεταξύ τους.
Ανάλογα με τη θερμοκρασία, η αντίδραση αυτή μπορεί να οδηγήσει στην παραγωγή υποχλωριωδών
ιόντων
(σε χαμηλές θερμοκρασίες) ή χλωρικών ιόντων (σε θερμοκρασίες >
65°C)
με βάση τις αντιδράσεις:
2 Cl2
+ 2 ΟΗ-
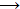 ClO- + Cl- + H2O
3 Cl2
+ 6 ΟΗ-
ClO- + Cl- + H2O
3 Cl2
+ 6 ΟΗ-
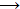 ClO3- + 5 Cl- +
3 H2O
ClO3- + 5 Cl- +
3 H2O
Οι αντίστοιχες ολικές ηλεκτρολυτικές
αντιδράσεις μπορούν να γραφούν ως εξής:
NaCl + H2O + ηλεκτρική ενέργεια
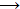 NaClO + H2
NaCl + 3 H2O + ηλεκτρική
ενέργεια
NaClO + H2
NaCl + 3 H2O + ηλεκτρική
ενέργεια
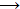 NaClO3 + 3 H2
NaClO3 + 3 H2
|
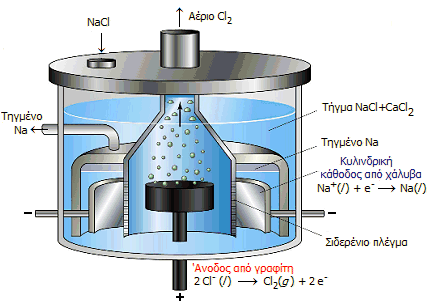
Ηλεκτρολυτικό στοιχείο Downs για την παραγωγή μεταλλικού
νατρίου με ηλεκτρόλυση τήγματος χλωριούχου
νατρίου-χλωριούχου ασβεστίου |
Το υδατικό διάλυμα υποχλωριώδους νατρίου
(3-6% σε NaClO) χρησιμοποιείται ως έχει σε λευκαντικά διαλύματα (στην Ελλάδα
τα διαλύματα αυτά είναι γνωστό με το εμπορικό όνομα "χλωρίνη").
Το χλωρικό νάτριο χρησιμεύει ως πηγή ClO2,
το οποίο σχεδόν στο σύνολό του (κατά 95%) χρησιμοποιείται από τη
χαρτοβιομηχανία για τη λεύκανση του χαρτοπολτού.
Παραγωγή
μεταλλικού νατρίου (Μέθοδος Downs). Το χλωριούχο νάτριο
αποτελεί την πρώτη ύλη για την παραγωγή μεταλλικού νατρίου. Το νάτριο
παράγεται με ηλεκτρόλυση τήγματος μίγματος NaCl και CaCl2
σε σιδερένιο ηλεκτρολυτικό στοιχείο, γνωστό ως στοιχείο Downs, με
άνοδο (θετικό ηλεκτρόδιο) από γραφίτη και κάθοδο (αρνητικό ηλεκτρόδιο)
από ανοξείδωτο χάλυβα. Η ολική ηλεκτρολυτική αντίδραση είναι:
2 NaCl + ηλεκτρική
ενέργεια
 2
Na + Cl2
2
Na + Cl2
Χρησιμοποιείται μίγμα NaCl και CaCl2
(σε αναλογία μάζας 2 προς 3) επειδή το μίγμα αυτό τήκεται σε χαμηλότερη
θερμοκρασία (580°C)
σε σχέση με τη θερμοκρασία τήξης του καθαρού NaCl (801°C). Στην κάθοδο
συλλέγεται νάτριο ,το οποίο στη θερμοκρασία ηλεκτρόλυσης είναι υγρό και
ειδικώς ελαφρότερο από το τήγμα του μίγματος των αλάτων, οπότε επιπλέει
σ' αυτό και συλλέγεται εύκολα (βλ. σχήμα).
Επειδή τα ιόντα νατρίου ανάγονται ευκολότερα
από τα ιόντα ασβεστίου, το παραγόμενο νάτριο δεν περιέχει παρά μόνο ίχνη ασβεστίου
(10-400 ppm, ανάλογα με την ποιότητα), ούτε
απαιτείται η επιπλέον προσθήκη CaCl2
κατά την πορεία της ηλεκτρόλυσης.
'Ετσι, το ηλεκτρολυτικό στοιχείο χρειάζεται να τροφοδοτείται μόνο με NaCl και
ηλεκτρική ενέργεια.
H κατάλληλη
διαμερισματοποίηση του στοιχείου Downs αποτρέπει
την επαφή του αερίου χλωρίου, το οποίο παράγεται στην άνοδο, με το τηγμένο νάτριο
που παράγεται στην κάθοδο, σε αντίθετη περίπτωση η επαφή του αερίου
χλωρίου με το τήγμα νατρίου θα οδηγούσε σε εκρηκτική αντίδραση με
επανασχηματισμό του χλωριούχου νατριου.
Τα σύγχρονα στοιχεία
Downs λειτουργούν με ρεύματα δεκάδων χιλιάδων αμπέρ (25 έως 40 kA) και τάσεις 7 έως 8 volt. Η
απαιτούμενη αντι-ηλεκτρεγερτική δύναμη για την έναρξη της ηλεκτρόλυσης
είναι 3 έως 4 volt και η επιπλέον τάση χρησιμοποιείται για την
υπερνίκηση της ωμικής πτώσης τάσης (iR drop) όπως και το ανοδικό υπερδυναμικό για την έκλυση του αερίου χλωρίου. Το στοιχείο
απαιτεί εξωτερική θέρμανση μόνο
στην αρχή για να τακεί το μίγμα των αλάτων. Στη συνέχεια, η θερμότητα Joule
που παράγεται κατά την ηλεκτρόλυση, είναι αρκετή για να διατηρεί τηγμένο
το μίγμα των δύο αλάτων.
Το κύριο προϊόν της
όλης διαδικασίας είναι το μεταλλικό νάτριο, ενώ δευτερεύον προϊόν είναι το
χλώριο, το οποίο παράγεται κυρίως με τη διαδικασία
Chloralkali.
Η
παγκόσμια παραγωγή μεταλλικού νατρίου εκτιμάται στους 100.000 τόνους
ετησίως.
Είδη αλατιού για
τα τρόφιμα [Αναφ. 9]
Όσο και αν φαίνεται περίεργο, υπάρχουν πολλά
και διαφορετικά είδη αλατιού που χρησιμοποιούνται στο μαγείρεμα και
γενικότερα την κατασκευή τροφίμων. Οι διαφορές μεταξύ τους έγκειται στην
περιεκτικότητά τους σε προσμίξεις, την προέλευση και το μέγεθος των κόκκων
του. Συχνά, διάφοροι τύποι αλατιού φέρουν το όνομα της περιοχής προέλευσης
(αλάτι γαλλικών θαλασσών, αλάτι ιταλικών θαλασσών, αλάτι Ιμαλαΐων, αλάτι
Χαβάης) ή για το προϊόν για το οποίο προορίζονται (αλάτι-πούδρα για
pop-corn, αλάτι χοντρόκοκκο για αρτοσκευάσματα τύπου pretzel).

Ορισμένοι από τους συνηθέστερους τύπους αλατιού
είναι οι εξής:
|

David Marine (1888-1976).
Ο ιατρός που πρότεινε την ιωδίωση του αλατιού. |

Το παραπάνω σήμα αναφέρεται ως
Διεθνές σήμα
(logo) του ιωδιωμένου αλατιού. |
 |
Επιτραπέζιο ή
μαγειρικό αλάτι (table, cooking salt):
Είναι το πιο συνηθισμένο αλάτι και βρίσκεται σε κάθε σπίτι. Συχνά
προσφέρεται ως "ιωδιωμένο" με προσμίξεις ιωδιούχων ή ιωδικών αλάτων καλίου ή
νατρίου (τυπική περιεκτικότητα σε ιώδιο: 50 ppm
Ι). Η παρουσία ιωδίου στις τροφές είναι απαραίτητη για τη βιοσύνθεση της
ορμόνης θυροξίνης. Σε ορισμένες περιπτώσεις η παρουσία ιωδίου είναι
ανεπιθύμητη, διότι έστω και στις μικρές ποσότητες που βρίσκεται, προσδίδει μια
πικρή γεύση σε ορισμένα τρόφιμα, ενώ το ιώδιο σκουραίνει κάποια τουρσιά.
Η ιωδίωση του αλατιού προτάθηκε από τον ιατρό
David Marine
(1988-1976), ο οποίος διεξήγαγε τις πρώτες μελέτες (1907-1916) πάνω
στην επίδραση του ιωδίου στο αλάτι στις περιπτώσεις
βρογχοκήλης (goiter) σε
πληθυσμούς μαθητών του Ohio και του Michigan. Από το 1924 άρχισε να
διατίθεται στις ΗΠΑ ιωδιωμένο αλάτι με αποτέλεσμα τη δραστική μείωση των
περιπτώσεων βρογχοκήλης. Ενδεικτικά, μέσα στα πρώτα έξι χρόνια χρήσης
ιωδιωμένου αλατιού, οι περιπτώσεις βρογχοκήλης στο Detroit μειώθηκαν από
9,7% σε 1,4%. [Αναφ.
9δ].
Η Διεύθυνση Τροφίμων και Φαρμάκων των ΗΠΑ
(FDA) συνιστά ημερήσια πρόσληψη 150 μg ιωδίου για ενήλικες άνδρες και γυναίκες. Η
ποσότητα αυτή βρίσκεται σε 3 g ιωδιωμένου αλατιού που περιέχει 50 ppm ιωδίου
[Αναφ. 9στ].
Το επιτραπέζιο αλάτι περιέχει σχεδόν πάντοτε
μικρές ποσότητες αντισυσσωματικών ουσιών (anti-caking
additives), όπως: πυριτικά άλατα ασβεστίου
(E552),
ανθρακικό μαγνήσιο (E504) και αργιλοπυριτικά άλατα νατρίου
(E554). Οι ουσίες αυτές καλύπτουν τις επιφάνειες των κρυστάλλων
αλατιού και αποτρέπουν τη συγκόλλησή τους από την υγρασία. Σε αυτά τα
αδιάλυτα ή δυσδιάλυτα αντισυσσωματικά πρόσθετα οφείλεται η ελαφριά
θολερότητα των υδατικών διαλυμάτων του επιτραπέζιου αλατιού.
Αλάτι
kosher (kosher salt).
Η συνηθέστερη μορφή αλατιού που χρησιμοποιείται στις εμπορικές
κουζίνες. Ιδιαίτερα συνηθισμένος τύπος αλατιού στις ΗΠΑ, δεν περιέχει κανένα
πρόσθετο, προέρχεται αποκλειστικά από τη θάλασσα και είναι πιο χοντρόκοκκο
σε σχέση με το επιτραπέζιο. Συλλέγεται από τα "τηγάνια" κατά τρόπο που οι
κρύσταλλοί του συσσωματώνονται αποκτώντας μια κάπως αιχμηρή υφή, που το
καθιστούν ικανό να απορροφήσει το αίμα από σφάγια κατά την
επίπασή τους με αυτό. Τα κρέατα αυτά χαρακτηρίζονται ως
kosher και την ίδια ονομασία φέρει αυτός ο τύπος του αλατιού. Ως kosher χαρακτηρίζονται οι τροφές που
είναι φτιαγμένες σύμφωνα με τους διατροφικούς νόμους των
ορθόδοξων Εβραίων (kosher: στην Εβραϊκή γλώσσα σημαίνει καθαρός, αγνός).
Αλάτι για αλιπάστωση (πάστωμα)
(pickling, canning salt). Είναι σαν το επιτραπέζιο,
αλλά χωρίς κάποιο πρόσθετο και κυρίως ιωδιούχα άλατα, η παρουσία των οποίων
μπορεί να αλλοιώσει σε κάποιο βαθμό τον χρωματισμό των συντηρούμενων
τροφίμων. Διατίθεται σε σχετικά
μεγάλες συσκευασίες (σακούλες ή κουτιά). Όποτε χρησιμοποιείται ως
επιτραπέζιο, για να αποφευχθεί η συσσωμάτωσή του
λόγω υγρασίας, στις αλατιέρες προσθέτουν σ' αυτό λίγους κόκκους ρυζιού.
Αλάτι χαβανέζικο
Alaela
(Hawaiian sea salt). 'Οχι ιδιαίτερα διαδεδομένο και σχετικά
ακριβό. Θαλάσσιο αλάτι που δεν έχει υποστεί κάποια διαδικασία καθαρισμού,
πλούσιο σε διάφορα ανόργανα συστατικά που βρίσκονται στο θαλασσινό νερό. Το
ελαφρά κοκκινωπό χρώμα του οφείλεται σε ιχνοποσότητες οξειδίων του σιδήρου.
Αναφέρεται ότι τα επιπλέον αυτά συστατικά τού προσδίδουν μια ιδιαίτερη
νοστιμιά.
Ορυκτό αλάτι (rock salt).
Ο φθηνότερος τύπος αλατιού που δεν είναι κατάλληλο για τη μαγειρική,
αλλά χρησιμεύει στην παραγωγή ψύξης κατά την παρασκευή παγωτών (π.χ. με ανάμιξη με
πάγο σε αναλογία 1 προς 5). Κατά τη διάλυσή του απορροφά θερμότητα
υποβιβάζοντας τη θερμοκρασία του μίγματος. Είναι το αλάτι που
χρησιμοποιείται σε μεγάλες ποσότητες για διάφορους λόγους, όχι όμως σε
τρόφιμα. Μεγάλες ποσότητες αυτού του αλατιού χρησιμοποιούνται για την αποπάγωση πεζοδρομίων και δρόμων.
Αλάτι και Υγεία
[Αναφ. 10]
Πριν από την ανακάλυψη των ψυγείων, ο
κυριότερος τρόπος συντήρησης των τροφίμων ήταν το αλάτι. Ωστόσο,
συχνά το αλάτι ήταν δυσεύρετο και η ημερήσια μέση πρόσληψη
αλατιού δεν ξεπερνούσε τα
0,25 g.
Σήμερα, χάρις στην ευρύτατη
διαθεσιμότητα του αλατιού σε χαμηλές τιμές, εκτιμάται ότι ο μέσος ενήλικας καταναλώνει περίπου 10
g αλάτι ημερησίως, αντί των 4 g που συνιστώνται από διεθνείς
οργανισμούς για τους υγιείς ενήλικες. 'Εχει εκτιμηθεί ότι στις
αναπτυγμένες χώρες η μέση ημερήσια πρόσληψη κυμαίνεται από 9 έως 12
g. Tο 80%
αυτού του αλατιού προέρχεται από επεξεργασμένα τρόφιμα και το
υπόλοιπο προέρχεται από το επιτραπέζιο αλάτι, που επιπλέον
προσθέτουμε στην τροφή.
Η υπέρταση αποτελεί τον τρίτο κατά
σειρά παράγοντα κινδύνου στην Ευρώπη μετά τον καρκίνο και τις
καρδιοπάθειες. Μεγάλες ποσότητες νατρίου μπορεί να επιδεινώσουν
σημαντικά την κατάσταση των υπερτασικών ασθενών.
Σχεδόν το 50% των υπερτασικών είναι
ευαίσθητοι στο αλάτι, πράγμα που σημαίνει ότι η πρόσληψη μεγάλων
ποσοτήτων νατρίου αυξάνει περαιτέρω την αρτηριακή τους πίεση και την
πιθανότητα εμφάνισης επιπλοκών, όπως αγγειακό εγκεφαλικό επεισόδιο,
έμφραγμα κ.ά. Πλήθος επιστημονικών ερευνών υποδεικνύει
ότι μείωση στην πρόσληψη αλατιού σε συνδυασμό με ορισμένες άλλες
ελεγχόμενες διαιτητικές παρεμβάσεις, προκαλεί σημαντική μείωση τόσο
στη συστολική ("μεγάλη") όσο και στη διαστολική ("μικρή") αρτηριακή πίεση. Η επίδραση
των υπερβολικών ποσοτήτων αλατιού είναι ακόμα περισσότερο έντονη σε διαβητικούς,
σε παχύσαρκους και σε ηλικιωμένους υπερτασικούς.
Ο συνδυασμός δίαιτας και περιορισμού
του χλωριούχου νατρίου στην τροφή, που αποκαλείται και δίαιτα τύπου DASH (DASH
diet = Dietary Approaches to Stop Hypertension = Διαιτητική
Προσέγγιση για τον Έλεγχο της Υπέρτασης), έχει αποδειχθεί ότι
μειώνει αποτελεσματικά την αρτηριακή πίεση σε υπερτασικούς
ασθενείς.
 Η δίαιτα DASH αποτελεί ένα μοντέλο διατροφής όπου η
κατανάλωση φρούτων και λαχανικών είναι ιδιαίτερα αυξημένη, τα
γαλακτοκομικά προϊόντα που επιτρέπονται προς κατανάλωση είναι
μηδενικής ή μειωμένης λιποπεριεκτικότητας (0 ή 1% λιπαρά), τα ολικά
και τα κορεσμένα προσλαμβανόμενα λιπαρά είναι ελεγχόμενα και δεν
επιτρέπεται η χρήση αλκοόλ πάνω από 20-30 g στους άνδρες και 10-20 g
στις γυναίκες.
Η δίαιτα DASH αποτελεί ένα μοντέλο διατροφής όπου η
κατανάλωση φρούτων και λαχανικών είναι ιδιαίτερα αυξημένη, τα
γαλακτοκομικά προϊόντα που επιτρέπονται προς κατανάλωση είναι
μηδενικής ή μειωμένης λιποπεριεκτικότητας (0 ή 1% λιπαρά), τα ολικά
και τα κορεσμένα προσλαμβανόμενα λιπαρά είναι ελεγχόμενα και δεν
επιτρέπεται η χρήση αλκοόλ πάνω από 20-30 g στους άνδρες και 10-20 g
στις γυναίκες.
Νεότερες μελέτες δίνουν έμφαση όχι μόνο στην πρόσληψη νατρίου αλλά
και στην ισορροπία νατρίου-καλίου στον οργανισμό, που φαίνεται να
παίζει σημαντικό ρόλο στη ρύθμιση της αρτηριακής πίεσης. Επειδή
αποδεικνύεται δύσκολο να αλλάξουμε συνήθειες που έχουμε μάθει,
αυτό που συστήνεται στους ασθενείς που δυσκολεύονται να μειώσουν το
αλάτι, είναι να τρώνε τροφές με αυξημένη περιεκτικότητα σε κάλιο, διότι αυτό
αντισταθμίζει σημαντικά τα αρνητικά αποτελέσματα της υπερπρόσληψης
νατρίου. Η μέγιστη
αποτελεσματικότητα παρατηρείται, όταν επιτευχθεί παράλληλα η μείωση
στην πρόσληψη νατρίου (έως 2,4 g νατρίου ή έως 3,8 g αλάτι την
ημέρα) και η αύξηση στην πρόσληψη καλίου.
Ο μηχανισμός δράσης του καλίου είναι
απλός: Το κάλιο βοηθάει τον οργανισμό να αποβάλλει το επιπλέον
νάτριο. Επειδή το κάλιο δεν αποθηκεύεται στον οργανισμό, είναι
απαραίτητη η καθημερινή του πρόσληψη. Πλούσιες πηγές καλίου είναι τα
φρούτα (π.χ. μπανάνες, πορτοκάλια, ακτινίδια) και τα λαχανικά και αυτός είναι ένα από τους λόγους που
πρέπει να αυξηθεί η κατανάλωσή τους σε 5 μερίδες την ημέρα. Οι
παραπάνω οδηγίες υιοθετούνται τόσο από τον Παγκόσμιο Οργανισμό
Υγείας, την Παγκόσμια Ομοσπονδία Καρδιολογίας όσο και από τον
Ευρωπαϊκό Οργανισμό Υπέρτασης (2007).
Στην Παγκόσμια Κινητοποίηση για τον
περιορισμό της κατανάλωσης αλατιού συμμετέχει και η Ελληνική Αντιϋπερτασική Εταιρεία με την έκδοση ειδικού φυλλαδίου. 'Οπως
τονίστηκε σε πρόσφατη συνέντευξη Τύπου της Εταιρείας,
σημαντικό ρόλο στην εμφάνιση υπέρτασης παίζουν και εξωτερικοί
παράγοντες, όπως η παχυσαρκία, το κάπνισμα, η κατανάλωση αλκοόλ,
η έλλειψη σωματικής άσκησης , το στρες και η αυξημένη κατανάλωση
αλατιού. Η σχέση μεταξύ του αλατιού και της υψηλής πίεσης
του αίματος (υπέρτασης) είναι άμεση: H κατανάλωση αλατιού αυξάνει
την πίεση του αίματος, ενώ η μείωση του αλατιού στη διατροφή
μειώνει την πίεση. Ας σημειωθεί ότι για κάθε αύξηση της συστολικής
πίεσης κατά 20 mm Hg και κατά 10 mm Hg της διαστολικής (πέρα
από τις τιμές-στόχους) διπλασιάζεται
ο κίνδυνος για καρδιακά επεισόδια [Αναφ.
10ζ].
Θα πρέπει να σημειωθεί ότι δεν λείπουν
και εκείνες οι φωνές που επισημαίνουν ότι η επικινδυνότητα του
αλατιού στη διατροφή του ανθρώπου έχει μάλλον υπερτονισθεί
[Αναφ. 10η], ωστόσο η μείωση της
κατανάλωσης του αλατιού θεωρείται γενικά ως ο πιο φθηνός και
αποτελεσματικός τρόπος βελτίωσης της δημόσιας υγείας
[Αναφ. 10θ].
|
Αλάτια "ειδικής ποιότητας"
Συχνά εμφανίζονται (ιδιαίτερα στο
Διαδίκτυο) διαφημίσεις διάφορων τύπων αλατιού (gourmet
brands), όπου χαρακτηρίζονται ως "φυσικά" ή
"υγιεινά" αλάτια. Οι διαφημίσεις αυτές συχνά δημιουργούν στον καταναλωτή την
εντύπωση ότι τα αλάτια αυτά του προσφέρουν κάτι περισσότερο από το κοινό
επιτραπέζιο αλάτι. Στην πραγματικότητα, όλα τα αλάτια είναι το ίδιο. Η
παρουσία ενδεχομένως άλλων χρήσιμων ιχνοστοιχείων σε κάπως αυξημένες
αναλογίες, δεν κάνει ένα αλάτι
καταλληλότερο από ένα άλλο που τα περιέχει σε μικρότερες αναλογίες. Το αλάτι σε καμιά περίπτωση δεν
είναι ο καταλληλότερος φορέας χρήσιμων ιχνοστοιχείων σε μια δίαιτα με
εξαίρεση ίσως του ιωδιωμένου αλατιού. Το κύριο συστατικό των "καλών" ή
"κακών" αλατιών είναι πάντοτε το χλωριούχο νάτριο και όλων των αλατιών η
υπερκατανάλωση εγκυμονεί τους ίδιους κινδύνους για τους υπερτασικούς
ασθενείς. Η μόνη βέβαιη διαφορά μεταξύ των
διαφημιζόμενων ως "φυσικών" και "υγιεινών" αλατιών, έναντι του κοινού
επιτραπέζιου αλατιού, στην ουσία είναι το πολύ μεγαλύτερο κόστος των πρώτων
[Αναφ. 11].
|
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1. (α) Wikipedia"Sodium
Chloride". (β) Βικιπαίδεια: "Αλάτι".
(γ) Wikipedia: "Salt".
(δ) Wikipedia: "Sea
Water".
2. (α)
Wikipedia: "History
of Salt". (β) www.saltworks.us: "Salt
Information: History of Salt". (γ) www.angelfire.com: "The
Power of Stone: Halite, A Short History of Salt". (δ) www.TexasBeyondHistory.net: "La
Sal del Rey Lake: Salt Mining and Trading near the Rio Grande". (ε)
Κόχυλα Ντ. : "ΑΛΑΤΙ,
το ακατέργαστο πετράδι που δίνει νοστιμιά στη ζωή", Τα ΝΕΑ
OnLine, Οκτώβριος
2009. (στ) Harding A (BBC News, 3/12/2009): "Timbuktu's
ancient salt caravans under threat". (ζ) Weller O,
Dumitroaia G: "The
earliest salt production in the world: an early Neolithic
exploitation in Poiana Slatinei-Lunca, Romania", Antiquity,
79(306) December 2005.
3.
(α)
www.chemicool.com:
"Sodium
facts". (β)
Schag S, Glauser J, Yokose K: "Sodium
Chloride", SRI Consulting, December
2008.
4. (α)
Salt Institute: "FAQS:
Solar Salt Production". (β) Ελληνικές
Αλυκές Α.Ε.: "Περιβαλλοντική Δήλωση Κοινοτικού Συστήματος Οικολογικής
Διαχείρισης και Οικολογικού Ελέγχου (EMAS)",
Φεβρουάριος, 2006 (αρχείο
PDF 1,6 MB). (γ)
Δαλάκα Α, Πετανίδου Θ: "Η Γεωγραφία της Αλοπηγικής Δραστηριότητας στην
Ελλάδα", Εργ. Βιογεωγραφίας και Πολιτισμικής Οικολογίας, Τμήμα Γεωγραφίας,
Πανεπιστήμιο Αιγαίου (αρχείο
PDF 436 KB). (δ) Salt Institute: "Solution
Mining".
5. (α)
http://www.saskschools.ca: "Solutions:
3.1 Solubility Curves". (β) Wikipedia: "Solubility".
6. (α)
Muldrew
K (University of Calgary, Dept. of Physiology & Biophysics): "Cryobiology
(a shrot course): Phase Diagrams". (β) Dutch S (University of
Winsconsin - Green Bay): "Hydrolalite
Structure" Sept 1997 (last update April
2011).
(γ) Light B (University of Washington - Applied Physics Laboratory):
""Freezer
Lab" Simulates Snowball Earth Conditions".
(δ) Salt Institute: "How
does road salt works". (ε) Rastogi N (www.slate.com): "Salting
the Earth: Does road salt harm the environment?". (στ) Wikipedia:
"Deicing".
7. (α)
Kostick DS (U.S. Geological Survey):
"Salt", Mineral Commodity Summaries, Jan
2011
(αρχείο
PDF, 27 KB). (β)
Chestofbook.com: "The
Story of salt".
8. (α)
Wikipedia: "Chloralkali
process". (β) Jörissen J (Dortmund University): "Electrochemical
processes based on ion exchange membranes". (γ)
Bommaraju TV, Orosz PJ, Sokol
EA : "Brine
Electrolysis", Electrochemistry Encyclopedia, Nov.
2001,
(revised Sept. 2007). (δ)
www.chemguide.co.uk: "Manufacturing
chlorine using a diaphragm and a membrane cell". (ε)
corrosio-doctors.org: "Sodium
Production by Electrowinning: Downs' process". (στ)
chem1180.blogspot.com: "19.9-19.11:
Electrolysis of Molten Salts-Stoichiometry of Elecrolysis". (ζ)
Wikipedia: "Down
Cell".
9. (α)
www.saltworks.com: "Sea
Salt & Gourmet Salts - Guide".
(β)
Alden L (The Cook's Thesaurus): "Salt".
(γ) Troemel E (whatscookingamerica.net): "Salt
- The Spice of Life". (δ) International Council for the
Control of Iodine Deficiency Disorders (ICCIDD): "History
of Salt Iodization". (ε) Carpenter KJ: "David
Marine and the Problem of Goiter", The Journal of Nutrition,
135:675-680, 2005.
(στ) Wikipedia: "Iodised
salt".
10. (α) Stibich M:
"Salt
and High Blood Pressure" (About.com, Updated January 29, 2010).
(β)
Sacks FM, Svetkey LP, Vollmer WM, Appel LJ, Bray
GA, Harsha D, Obarzanek E, Conlin PR, Miller ER 3rd, Simons-Morton DG,
Karanja N, Lin PH:
"Effects on blood pressure of
reduced dietary sodium and the dietary approaches to stop
hypertension (DASH) diet", N Engl J Med 344:3-10,
2001 (PubMed).
(γ) Mohan S, Campbell NRC: "Salt and
high blood pressure", Clinical Science 117:1-11, 2009 (αρχείο
PDF 349 KB). (δ) Brown
IJ, Tzoulaki I, Candeias V, Elliott P:
"Salt intakes
around the world: implications for public health", Int J Epidemiol 38:791-813,
2009 (αρχείο
PDF 283 KB).
(ε)
He FJ,
Jenner KH, Mvgregor GA. WASH-world action salt and health. Review.
Kidney Int 78:746-763, 2010 (PubMed).
(στ)
Cappuccio FP, Apewell S, Lincoln P, McPherson K: "Policy options to
reduce population salt intake", Br Med J 343:d4995, 2011 (Abstract).
(ζ) Ανδρεάδης ΕΑ: "Το πρόβλημα της αρτηριακής υπέρτασης σήμερα - Γενικές
κατευθυντήριες οδηγίες", Scientific Society of Evangelismos Hospital (αρχείο
PDF 307 ΚΒ). (η) Rosch PJ (www.health-report.co.uk):
"Take
the Latest Low Sodium Advice... With a Grain of Salt". (θ):
Webster JL, Dunford EK, Hawkes C, Neal BC: "Salt reduction
initiatives around the world", J. Hypertens, 29(6):1043-1050,
2011 (PubMed).
11. (α)
http://www.health-benefit-of-water.com: "Sea
Salt vs. Table Salt".
(β) Mercola.com: "The
13 Amazing Health Benefits of Himalayan Crystal Salt, the Purest
Salt on Earth (and Why You Want to Avoid Conventional Salt)".
(γ) Briggs H (BBC News
- Health): "Sea
salt health claims 'flawed'" (Nov. 17, 2011).
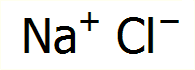





 Χλωριούχο
νάτριο: Μια ουσία διαθέσιμη σε απεριόριστες ποσότητες
Χλωριούχο
νάτριο: Μια ουσία διαθέσιμη σε απεριόριστες ποσότητες


























 Διάγραμμα
φάσεων του συστήματος
Διάγραμμα
φάσεων του συστήματος 





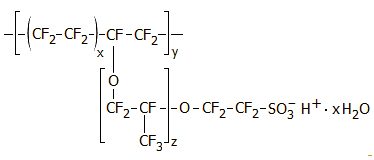














 Η δίαιτα DASH αποτελεί ένα μοντέλο διατροφής όπου η
κατανάλωση φρούτων και λαχανικών είναι ιδιαίτερα αυξημένη, τα
γαλακτοκομικά προϊόντα που επιτρέπονται προς κατανάλωση είναι
μηδενικής ή μειωμένης λιποπεριεκτικότητας (0 ή 1% λιπαρά), τα ολικά
και τα κορεσμένα προσλαμβανόμενα λιπαρά είναι ελεγχόμενα και δεν
επιτρέπεται η χρήση αλκοόλ πάνω από 20-30 g στους άνδρες και 10-20 g
στις γυναίκες.
Η δίαιτα DASH αποτελεί ένα μοντέλο διατροφής όπου η
κατανάλωση φρούτων και λαχανικών είναι ιδιαίτερα αυξημένη, τα
γαλακτοκομικά προϊόντα που επιτρέπονται προς κατανάλωση είναι
μηδενικής ή μειωμένης λιποπεριεκτικότητας (0 ή 1% λιπαρά), τα ολικά
και τα κορεσμένα προσλαμβανόμενα λιπαρά είναι ελεγχόμενα και δεν
επιτρέπεται η χρήση αλκοόλ πάνω από 20-30 g στους άνδρες και 10-20 g
στις γυναίκες.