Οι μέχρι σήμερα
Η χημική ένωση του
μήνα
[Μάρτιος
2010]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες
[Αναφ. 1]:
Εμφάνιση:
'Αχρωμο υγρό, πτητικό,
εξαιρετικά εύφλεκτο με χαρακτηριστική οσμή
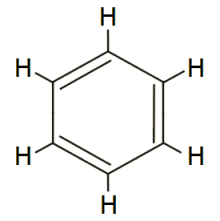
Μοριακός τύπος:
C6H6
Σχετική μοριακή μάζα:
78,11
Σημείο βρασμού: 80,1 ºC
Σημείο τήξης: 5,5 ºC
Πυκνότητα:
0,8787 g/cm3 (15 ºC)
Δείκτης διάθλασης (nD20):
1,501
Διαλυτότητα
στο νερό: 0,188% (23,5 ºC)
Σημείο ανάφλεξης: -11 ºC
Σε οργανικούς
διαλύτες: αναμίξιμο με την αιθανόλη,
διαιθυλαιθέρα, διθειάνθρακα, χλωροφόρμιο, τετραχλωράνθρακα, οξικό οξύ,
ακετόνη, έλαια
Λόγος κατανομής (οκτανόλη/νερό) ως log Pow:
2,13
LD50: 3,8 mL/kg (σε
αρουραίους)
Απορροφάται από το δέρμα.
Καρκινογόνο (επιβεβαιωμένο, προκαλεί καρκινικούς όγκους και λευχαιμία),
μεταλλαξιγόνο (πιθανό), τοξικό για το αίμα και τον μυελό των οστών,
τοξικό για το ήπαρ και το κεντρικό νευρικό σύστημα.
|
 |
|
Βενζόλιο
Benzene
|
 Γενικά για το βενζόλιο
Γενικά για το βενζόλιο
Το
βενζόλιο (benzene) είναι οργανική ένωση με μοριακό τύπο C6H6
και είναι φυσικό συστατικό του αργού πετρελαίου (1-5%). Είναι ένα εξαιρετικά
εύφλεκτο υγρό με χαρακτηριστική οσμή "βενζίνης" και αρκετά πτητικό. Η
καρκινογόνος και μεταλλαξιγόνος δράση του βενζολίου, γνωστή εδώ και πολλές
δεκαετίες, καθιστά επικίνδυνη τη μακροχρόνια έκθεση σε υψηλές συγκεντρώσεις
ατμών του σε εργασιακούς χώρους. Ωστόσο, το βενζόλιο χρησιμοποιείται ευρύτατα ως
βιομηχανικός διαλύτης καθώς και ως πρώτη ύλη για την παραγωγή πλήθους ενώσεων
(πλαστικών, ελαστικών, χρωμάτων, φαρμάκων). Το βενζόλιο προστίθεται σε μικρές
αναλογίες στα καύσιμα
μηχανών εσωτερικής καύσης για να βελτιώσει την ποιότητά τους (αύξηση
του αριθμού
οκτανίων), ιδιαίτερα μετά την κατάργηση του αντικροτικού τετρααιθυλιούχου
μολύβδου, που δεν ήταν πλέον συμβατός με τους τριοδικούς καταλύτες καθαρισμού των
καυσαερίων. Το βενζόλιο λόγω της τοξικότητάς του όπου
είναι δυνατόν αντικαθίσταται με άλλους διαλύτες με σχεδόν παρόμοιες διαλυτικές ή εκχυλιστικές ικανότητες, όπως το τολουόλιο (μεθυλοβενζόλιο), κ-εξάνιο και το
κυκλοεξάνιο.
Το ιστορικό της ανακάλυψης του
βενζολίου
Από τον 17ο αιώνα ήταν ήδη γνωστό ότι η
θέρμανση γαιανθράκων προκαλούσε την έκλυση αερίου που καιόταν με ισχυρό
φωτιστικό αποτέλεσμα (Clayton, 1664). Το 1790, ο
William Murdoch υπήρξε ο πρώτος που
χρησιμοποίησε αυτό το φωτιστικό αέριο
ή φωταέριο (lighting
gas, illuminating gas) για τον φωτισμό του σπιτιού του στο Redruth της Κορνουάλης. Το
παρασκεύαζε θερμαίνοντας ισχυρά γαιάνθρακα μέσα σε σιδερένια δοχεία και
διοχέτευε το παραγόμενο αέριο μέσω μεταλλικών σωλήνων μήκους 20 μέτρων σε
σημεία φωτισμού του σπιτιού του.
Η ιδέα αποδείχθηκε οικονομικά
συμφερότερη
από τη χρήση κεριών και σύντομα επεκτάθηκε για τον φωτισμό βιομηχανικών
εγκαταστάσεων και των οδών του Λονδίνου. Η πρώτη δημόσια περιοχή
που φωτοδοτήθηκε με φωταέριο ήταν η περιοχή του Pall Mall το 1807 και στη
συνέχεια το Westminster και η ομώνυμη γέφυρα του Τάμεση το 1813. Το 1815, ο John Taylor
παρήγαγε φωταέριο με πυρόλυση (στους 600 ºC) διάφορων ελαίων, μια τεχνική που
χρησιμοποιήθηκε σε αρκετές πόλεις της Αγγλίας (Liverpool, Bristol, Hull) από το
1819
[Αναφ. 2].
|

(α) |

(β) |
(γ) |
|
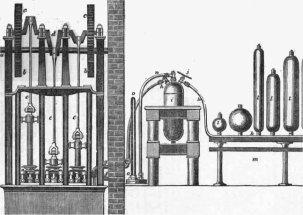
(α) Το σπίτι του William
Murdoch στο Redruth της Κορνουάλης. Το πρώτο σπίτι που φωτοδοτήθηκε
με επιτόπου παραγόμενο φωταέριο (1790). (β) Φανοί φωταερίου εξωτερικών και εσωτερικών χώρων.
(γ) Το σύστημα αντλιών που χρησιμοποίησε ο David Gordon για την
πλήρωση φιαλών (δεξιά) με "φορητό αέριο". |
Το 1819, ο
David Gordon
είχε την ιδέα να διαθέσει στο εμπόριο
το παραγόμενο αέριο
σε χάλκινες φιάλες χωρητικότητας περίπου 7
L
υπό πίεση περίπου 30
Atm ως
φορητό αέριο (portable gas)
και ίδρυσε στην Αγγλία την εταιρεία Portable Gas Company.
Οι φιάλες αυτές μπορούν να θεωρηθούν ως μια πρώιμη μορφή των σύγχρονων
φιαλών υγραερίου με τη βασική διαφορά ότι περιείχαν αέριο υπό υψηλή πίεση και όχι υγροποιημένο αέριο βουτάνιο
(ή μίγμα προπανίου-βουτανίου), το οποίο παραμένει υγρό με σχετικά μικρές πιέσεις και
διαβιβάζεται υπό σταθερή πίεση μέχρι ολικής εξάντλησής του.
 |
|
Michael Faraday
(1791-1867). 'Αγγλος χημικός και φυσικός, γνωστότερος από τις
ανακαλύψεις στο πεδίο του ηλεκτρομαγνητισμού και της ηλεκτροχημείας.
|
Τις φιάλες
φορητού αερίου χρησιμοποιούσαν για τον φωτισμό των οδών περιοχών που δεν
συνδέονταν με σωληνώσεις με τους κεντρικούς σταθμούς παραγωγής φωταερίου.
Ο Gordon διαπίστωσε ότι το προϊόν της πυρόλυσης
από έλαια είχε σχεδόν τριπλάσιο φωτιστικό αποτέλεσμα σε σχέση με αντίστοιχο
προϊόν από την πυρόλυση γαιανθράκων. Το έλαιο που χρησιμοποιούσαν ήταν κυρίως
φαλαινέλαιο (sperm whale oil).
Ωστόσο, το "φορητό αέριο"
παρουσίαζε αρκετά
προβλήματα. Πρόβλημα αποτελούσε ο σχηματισμός στερεών μαζών που έφραζαν τις
σωληνώσεις τις κρύες νύχτες του χειμώνα, όπως και η πτώση της φωτιστικής
ικανότητάς του καθώς μειωνόταν η πίεση στις φιάλες.
Επιπλέον, είχε διαπιστωθεί ότι κατά τη συμπίεση των αέριων πυρόλυσης παραγόταν μια καύσιμη ελαιώδης ουσία,
σε ποσότητες περίπου 140 mL ανά κυβικό μέτρο φωταερίου. Αυτό το
ελαιώδες συμπύκνωμα παρέμενε στη μεταλλική φιάλη και δεν καιγόταν με αποτέλεσμα τη μείωση της φωτιστικής
απόδοσης του "φορητού αερίου" σε σχέση με εκείνη του επιτόπου
παραγόμενου αερίου. Το 1820 ο Gordon ανέθεσε στον
Michael Faraday να εξετάσει αυτό το ελαιώδες
συμπύκνωμα
και να βρει ποια είναι αυτά τα συστατικά που η απουσία τους μείωνε τη
φωτιστική απόδοση του "φορητού αερίου".
 Μετά
από επίπονη εργαστηριακή εργασία λίγων ετών, ο Faraday ανακοίνωσε στις 16
Ιουλίου του 1825 στο Βασιλικό Ινστιτούτο του Λονδίνου, την ανακάλυψη στο
ελαιώδες συμπύκνωμα του "φορητού αερίου" μιας άγνωστης μέχρι τότε ένωσης
άνθρακα-υδρογόνου. Την ουσία αυτή ονόμασε bicarburet of hydrogen (διανθρακούχο
υδρογόνο), ονομασία που δηλώνει μια αναλογία ατόμων Η:C
ίση προς 1:2.
Ο Faraday πάντως δεν είχε αποδώσει κάποιο συγκεκριμένο χημικό τύπο στη νέα ένωση. Το πλήρες άρθρο του Faraday είναι διαθέσιμο από
εδώ (αρχείο PDF 3,15 ΜΒ).
Μετά
από επίπονη εργαστηριακή εργασία λίγων ετών, ο Faraday ανακοίνωσε στις 16
Ιουλίου του 1825 στο Βασιλικό Ινστιτούτο του Λονδίνου, την ανακάλυψη στο
ελαιώδες συμπύκνωμα του "φορητού αερίου" μιας άγνωστης μέχρι τότε ένωσης
άνθρακα-υδρογόνου. Την ουσία αυτή ονόμασε bicarburet of hydrogen (διανθρακούχο
υδρογόνο), ονομασία που δηλώνει μια αναλογία ατόμων Η:C
ίση προς 1:2.
Ο Faraday πάντως δεν είχε αποδώσει κάποιο συγκεκριμένο χημικό τύπο στη νέα ένωση. Το πλήρες άρθρο του Faraday είναι διαθέσιμο από
εδώ (αρχείο PDF 3,15 ΜΒ).
Σημείωση: Το σφάλμα στην αναλογία H:C οφείλεται στο ότι εκείνη την εποχή
η έννοια του ατομικού βάρους δεν είχε ορισθεί με σαφήνεια και χρησιμοποιούσαν τον όρο
'proportional'. 'Ετσι, ως 'proportional' του άνθρακα
λαμβανόταν το 6, αφού η μάζα του ατόμου του άνθρακα συγκρινόταν με τη μάζα του μορίου και όχι του
ατόμου του υδρογόνου,
δηλ. C=6, H2=1.
Ανάλογα, το 'proportional' του οξυγόνου ήταν 8. Δεν γνώριζαν ακόμη τη διατομική φύση των μορίων των κοινών αέριων στοιχείων, αφού θεωρούσαν αδύνατον το άτομο
να έχει χημική "συγγένεια" με τον εαυτό του. Το θέμα των ατομικών βαρών
ξεκαθάρισε αρκετά αργότερα με το
συνέδριο της Καρλσρούης, το 1860.
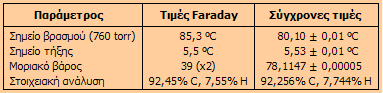
Αξίζει μια σύγκριση των τιμών των φυσικοχημικών
παραμέτρων της νέας αυτής ένωσης (πολύ αργότερα ονομάστηκε βενζόλιο), που ο Faraday
κατάφερε να μετρήσει χρησιμοποιώντας τα φτωχά μέσα εκείνης της εποχής, με τις
αντίστοιχες σύγχρονες τιμές (βλέπε πίνακα). Η αιτία του μεγάλου σφάλματος στο
σημείο βρασμού δεν έχει διευκρινιστεί, αλλά αποδίδεται γενικά στη δυσκολία της
βαθμονόμησης των θερμομέτρων στην περιοχή των 100 ºC, λόγω της έντονης επίδρασης της
βαρομετρικής πίεσης. Το σχετικά υψηλό σημείο τήξης του βενζολίου (5,5 ºC) αιτιολογούσε την απόφραξη των σωληνώσεων
φωταερίου κατά τον χειμώνα, αν και πιο πιθανό αίτιο θεωρείται σήμερα
ο σχηματισμός πάγου από τη συμπύκνωση υδρατμών, δεδομένου ότι αυτό το σημείο
τήξης αφορά εξαιρετικά καθαρό βενζόλιο και υποβιβάζεται σημαντικά από την
παρουσία άλλων οργανικών ενώσεων σε πολύ μικρές ακόμη αναλογίες.
Ο Faraday δεν είχε ιδέα ότι αυτή η ένωση
θα αποτελούσε ακόμη για αρκετές ακόμη δεκαετίες ένα αίνιγμα για τους χημικούς.
Σύσταση των προϊόντων
πυρόλυσης του φαλαινελαίου
[Αναφ. 2β]
To 1968 o Kaiser δημοσίευσε
μια ενδιαφέρουσα μελέτη. Πυρόλησε μικρή ποσότητα φαλαινελαίου σε συνθήκες
παρόμοιες με εκείνες που χρησιμοποιούσε η Portable Gas Company στις αρχές του
19ου αιώνα (θέρμανση στους 600 ºC μέσα σε σιδερένιο σωλήνα) με σκοπό να
μελετήσει τη σύσταση των παραγόμενων αερίων και του παραγόμενου ελαιώδους συμπυκνώματος
για να διαπιστώσει τι ακριβώς είχε στα χέρια του Faraday
όταν πραγματοποιούσε την περίφημη μελέτη του.
Οι αναλύσεις που πραγματοποίησε ο Kaiser έγιναν με τις σύγχρονες πλέον τεχνικές αεριοχρωματογραφίας-φασματοσκοπίας
μαζών (GC/MS).
Στον παρακάτω πίνακα
παρουσιάζονται ενδεικτικά αναλυτικά αποτελέσματα ως προς τη σύσταση των αερίων προϊόντων, όπως
και του ελαιώδους συμπυκνώματος και ειδικότερα του κλάσματος με σ.ζ. 20-120 ºC. Ο Kaiser διαπίστωσε ότι το βενζόλιο αποτελούσε το κύριο συστατικό
του ελαιώδους συμπυκνώματος. Δίπλα στον πίνακα δείχνεται τυπικό αεριοχρωματογράφημα αυτού του κλάσματος,
ενδεικτικό του πλήθους των ενώσεων που περιέχει αυτό το μίγμα. Στο χρωματογράφημα
σημειώνεται η
θέση της κορυφής του βενζολίου.
Από τη μελέτη αυτή προέκυψε ότι το μίγμα που δόθηκε στον Faraday περιείχε τουλάχιστον 320 υδρογονάνθρακες με συγκεντρώσεις μεγαλύτερες από
100 ppm (0,01%). Ακόμη διαπιστώθηκε ότι υπήρχαν αρκετές ουσίες με
φυσικοχημικά χαρακτηριστικά παραπλήσια εκείνων του βενζολίου, οι οποίες δύσκολα θα μπορούσαν να διαχωριστούν ακόμη
και σε
συνθήκες χρωματογραφικής ανάλυσης. Η μελέτη αυτή δείχνει τη σχολαστική και
επίπονη εργαστηριακή δουλειά του
Faraday
με τα υποτυπώδη μέσα εκείνης της εποχής.
|
|

'Ανθη του φυτού Styrax benzoin,
ρητίνη στον κορμό και καθαρισμένη και έλαιο βενζόης. |
Η ονομασία του
βενζολίου. Το 1833, εννέα χρόνια μετά την ανακάλυψη του βενζολίου, ο Γερμανός
χημικός Eilhard Mitscherlich
(1794-1863)
[Αναφ. 2ε]
ανακάλυψε ότι η ουσία που απομόνωσε ο Faraday από το ελαιώδες
συμπύκνωμα του φωτιστικού αερίου, μπορούσε να παραχθεί και με θέρμανση μιας χημικής ουσίας (η
ουσία αυτή ήταν το βενζοϊκό οξύ: C6H5COOH),
η οποία από καιρό είχε απομονωθεί από τη ρητίνη βενζοΐνη ή (στην ελληνική
βιβλιογραφία)
βενζόη (gum benzoin).
Τη βενζόη (μοσχολίβανο) χρησιμοποιούσαν οι φαρμακοποιοί και οι αρωματοποιοί ήδη από τον 15ο αιώνα.
Λαμβάνεται από ένα φυτό της
Ιάβας και της Σουμάτρας με την επιστημονική ονομασία Styrax benzoin.
Τα ονόματα του φυτού και της ρητίνης προέρχονται από την αραβική ονομασία της
ρητίνης luban jawi (: λιβάνι της Ιάβας).
Από τις δύο αυτές αραβικές λέξεις έμελλε να προκύψουν οι ονομασίες πλήθους ενώσεων
και χημικών προϊόντων, που
περιέχουν το συνθετικό "βενζ-".
Το αιθέριο έλαιο
της βενζόης αποτελείται από πολλές αρωματικές (με την έννοια του ευχάριστου
μυρωδικού, αλλά συγχρόνως και με τη χημική έννοια) ενώσεις όπως: βενζοϊκός
βενζυλεστέρας, κιναμμωμικό οξύ, βενζαλδεΰδη και βανιλλίνη.
Η αντίδραση διάσπασης
(αποκαρβοξυλίωσης) του βενζοϊκού οξέος παρουσία ασβέστου μπορεί απλά να
αποδοθεί από την ακόλουθη αντίδραση:
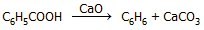
Ο Mitscherlich
πρότεινε για την ουσία αυτή
την ονομασία βενζίνη (benzin), η οποία όμως δεν έγινε δεκτή από
τους χημικούς της εποχής επειδή η κατάληξη -ινη παρέπεμπε σε κάποιο
αλκαλοειδές (π.χ. στρυχνίνη, κινίνη). Μια άλλη πρόταση ήταν βενζόλη
(benzol), από τη γερμανική λέξη öl
που σημαίνει έλαιο, ωστόσο οι Γάλλοι και οι 'Αγγλοι χημικοί την απέρριψαν επειδή
η κατάληξη -ολη παρέπεμπε σε αλκοόλες. Τελικά επικράτησε η ονομασία
benzene, που αποτελεί σήμερα και την επίσημη κατά IUPAC ονομασία της ένωσης.
Πρέπει να σημειωθεί ότι το 1835 ο χημικός
Auguste
Laurent πρότεινε
την ονομασία φαίνιο (pheno), από το Ελληνικό ρήμα "φαίνω", αφού επρόκειτο
για μια ουσία που είχε βρεθεί στο φωτιστικό αέριο. Η ονομασία αυτή ποτέ δεν έγινε
δεκτή, ωστόσο το συνθετικό φαιν- χρησιμοποιήθηκε στην ονομασία της ομάδας C6H5-
(φαινύλιο) και από εκεί για την ονομασία χιλιάδων οργανικών ενώσεων (π.χ.
φαινόλη, φαινυλαμίνη, φαινακετίνη, διφαινύλιο).
Στην ελληνική χημική βιβλιογραφία
επικράτησε η Γερμανικής προέλευσης ονομασία βενζόλιο, δεδομένου ότι οι
πρώτοι 'Ελληνες χημικοί είχαν σπουδάσει χημεία στη Γερμανία. Πολύ σπάνια (κυρίως σε παλαιά
βιβλία) το βενζόλιο βρίσκεται και ως βενζόλη και ακόμη σπανιότερα ως βενζένιο
[Αναφ. 3].
Το 1845, ο
Charles Mansfield απομόνωσε
το βενζόλιο από
τη λιθανθρακόπισσα και έτσι άρχισε η βιομηχανική παραγωγή
του σε μεγάλες πλέον ποσότητες. Φυσικό ήταν πλέον οι χημικοί της εποχής να
ασχοληθούν με τη συστηματική
διερεύνηση των χημικών ιδιοτήτων του. Το 1855, ο
August Wilhelm Hofmann χρησιμοποίησε
τον όρο αρωματικές ενώσεις για να χαρακτηρίσει την ομάδα των
οργανικών ενώσεων που ήταν παράγωγα του βενζολίου, επειδή έτυχε όλες αυτές οι
ενώσεις να έχουν αρωματική
οσμή, κάτι που βέβαια δεν ισχύει για το σύνολο των αρωματικών ενώσεων.
Χημική δομή του βενζολίου - Αρωματικότητα
|
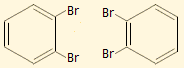
Οι δύο διαφορετικές μορφές του 1,2-διβρωμο- κυκλοτριεξανίου, που ωστόσο δεν
φάνηκε ότι είναι δυνατή η παρασκευή τους |
Από τα μέσα
του 19ου αιώνα οι
χημικοί γνώριζαν πλέον ότι ο ορθός μοριακός τύπος του βενζολίου ήταν
C6H6.
Η σχετικά μικρή αναλογία Η:C οδηγούσε στο συμπέρασμα
ότι πρόκειται για "ακόρεστη" ένωση με συστήματα διπλών ή τριπλών δεσμών.
Ωστόσο, το βενζόλιο δεν έδινε τις από τότε γνωστές αντιδράσεις προσθήκης που
χαρακτήριζαν τις
ακόρεστες ενώσεις, όπως π.χ. η αντίδραση προσθήκης βρωμίου στο αιθυλένιο: CH2=CH2
+ Br2
 BrCH2CH2Br. 'Ετσι,
το βενζόλιο αντί να αντιδρά εύκολα με βρώμιο παρέχοντας προϊόντα προσθήκης,
με αναμενόμενους τύπους C6H6Br2,
C6H6Br4
κ.λπ., αντιδρούσε μάλλον δύσκολα (σε σχέση πάντοτε με τον διαφαινόμενο "βαθμό ακορεστότητάς"
του) και παρουσία σκόνης σιδήρου ή FeBr3 ως καταλύτη, δίνοντας το μονοβρωμοπαράγωγο
C6Η5Br,
που είναι προϊόν αντικατάστασης. Επίσης
λαμβανόταν μόνο
ένα μονοβρωμοπαράγωγο, γεγονός που δηλώνει ότι όλα τα άτομα υδρογόνου στο
μόριο θα έπρεπε να είναι ισοδύναμα.
BrCH2CH2Br. 'Ετσι,
το βενζόλιο αντί να αντιδρά εύκολα με βρώμιο παρέχοντας προϊόντα προσθήκης,
με αναμενόμενους τύπους C6H6Br2,
C6H6Br4
κ.λπ., αντιδρούσε μάλλον δύσκολα (σε σχέση πάντοτε με τον διαφαινόμενο "βαθμό ακορεστότητάς"
του) και παρουσία σκόνης σιδήρου ή FeBr3 ως καταλύτη, δίνοντας το μονοβρωμοπαράγωγο
C6Η5Br,
που είναι προϊόν αντικατάστασης. Επίσης
λαμβανόταν μόνο
ένα μονοβρωμοπαράγωγο, γεγονός που δηλώνει ότι όλα τα άτομα υδρογόνου στο
μόριο θα έπρεπε να είναι ισοδύναμα.
Το 1865, με βάση τα μέχρι
τότε πειραματικά αποτελέσματα, ο
Friedrich August Kekulé διατύπωσε την πρόταση ότι το βενζόλιο αποτελείται από έναν ανθρακικό δακτύλιο που
θα μπορούσε να θεωρηθεί ως το 1,3,5-κυκλοεξατριένιο,
στο οποίο και οι 6 άνθρακες και τα 6 υδρογόνα είναι ισοδύναμα
και για τον λόγο αυτό λαμβανόταν μόνο ένα βρωμοπαράγωγο. Ωστόσο,
τα πειράματα έδειξαν ότι μπορούσαν να ληφθούν μόνο τρία ισομερή διβρωμιωμένα
παράγωγα (το
1,2-διβρωμοκυκλοεξατριένιο, το 1,3-διβρωμο- και το 1,4-διβρωμο-), ενώ θα
αναμένονταν τέσσερα, αφού θα έπρεπε να υπάρχουν δύο διαφορετικά
1,2-διβρωμοκυκλοεξατριένια.
Το 1872, ο
Kekulé
για να
ερμηνεύσει την απουσία δύο μορφών των 1,2-διπαραγώγων τροποποίησε την αρχική
του υπόθεση.
Διατύπωσε την άποψη ότι οι απλοί και οι διπλοί δεσμοί του βενζολίου δεν είναι στατικοί, αλλά "ταλαντώνονται" αλλάζοντας συνεχώς τις θέσεις μεταξύ τους.
Τελικά, η θεωρία του
Kekulé
για τη δομή του βενζολίου επικράτησε και οδήγησε στην υιοθέτηση ανάλογων τύπων
για όλες τις αρωματικές ενώσεις. Το 1890, η "Εταιρεία των
Γερμανών Χημικών" οργάνωσε ειδική τελετή, με το όνομα Benzolfest (:
γιορτή για το βενζόλιο), για να τιμήσει τον Kekulé
με την ευκαιρία της 25ης επετείου από τη δημοσίευση του πρώτου άρθρου του που
πρότεινε τη δομή του βενζολίου ("Sur
la constitution des substances aromatiques". Bulletin de la Societe Chimique de
Paris 3: 98-110, 1865). Στην ομιλία που έδωσε ο Kekulé
αναφέρθηκε στο περίφημο "όνειρό" του, από το οποίο εμπνεύστηκε τη δομή του
βενζολίου, ίσως ένα από τα ωραιότερα "παραμύθια" της χημείας.
 |
 |
 |
|
Αριστερά:
Friedrich
August Kekulé
(1829-1896). Γερμανός οργανικός χημικός. Από τους θεμελιωτές της θεωρίας
των χημικών δομών. Μέσον: Ο "ουροβόρος
όφις" (ouroboros),
από αλχημιστικό χειρόγραφο. Δεξιά: Μια ακόμη χιουμοριστική
αναπαράσταση του βενζολίου. |
Το περίφημο όνειρο του August von Kekulé
Στα περισσότερα συγγράμματα που
έχουν ως θέμα την ιστορία της Χημείας, σπάνια παραλείπεται η περιγραφή του "ονείρου
του Kekulé",
με το οποίο ό ίδιος περιέγραφε το πώς εμπνεύσθηκε (το 1864) την πιθανή δομή του βενζολίου.
Απόσπασμα από την ομιλία του Kekulé
του 1890 ενώπιον της Εταιρείας των Γερμανών Χημικών (από το βιβλίο του "Creativity,
Beyond the Myth of Genius" του Robert Weisberg, έκδ. W. H. Freeman 1992):
"...Γύρισα την πολυθρόνα προς το
τζάκι και μισοκοιμήθηκα. Πάλι τα άτομα χοροπηδούσαν μπροστά μου...
Το μάτι της ψυχής μου ...δεν μπορούσε να ξεχωρίσει μεγαλύτερες δομές με
πολυποίκιλες διαμορφώσεις. Μακριές σειρές, που προσαρμόζονταν μεταξύ τους,
όλες συνταιριάζονταν και συστρέφονταν σαν κινήσεις φιδιών. Αλλά να! Τι ήταν
αυτό; 'Ενα από τα φίδια είχε αρπάξει με τα δόντια του τη δική του ουρά,
στροβιλιζόταν και σαν να με περιγελούσε. Ξύπνησα σαν από μια ξαφνική αστραπή...".
Πολλοί επιστήμονες σήμερα
πιστεύουν ότι το όνειρο του Kekulé δεν ήταν παρά ένα παραμύθι, για να
αποφύγει το μοίρασμα της ανακάλυψης του εξαγωνικού σχήματος του βενζολίου με
τους συνεργάτες του, δεν παύει όμως να αποτελεί μια ωραία ιστορία
[Αναφ. 4].
|
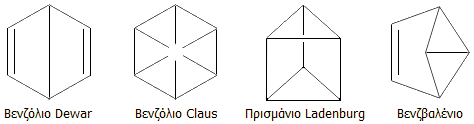
'Αλλες
προτάσεις για τη δομή του βενζολίου.
Αρχικά,
η
δομή του βενζολίου που πρότεινε ο Kekulé
δεν έπεισε
πολλούς χημικούς. Ο λόγος ήταν ότι δομή αυτή με τους τρεις διπλούς δεσμούς δεν μπορούσε ακόμη να ερμηνεύσει το ότι το βενζόλιο παρουσίαζε μια σχετική χημική αδράνεια, που κάθε άλλο
παρά θύμιζε ακόρεστη χημική ένωση.
Θα πρέπει να
σημειωθεί ότι εκείνη την εποχή είχαν προταθεί από άλλους επιστήμονες και άλλες
δομές του βενζολίου, όπως αυτές που δείχνονται παρακάτω.
Σήμερα, οι ενώσεις αυτές έχουν συντεθεί στο εργαστήριο (εκτός από το βενζόλιο
Claus). 'Ολες τους απεδείχθησαν ασταθείς ενώσεις και ισομερίζονται
προς βενζόλιο εκλύοντας μεγάλες ποσότητες
ενέργειας (εξώθερμα).
|
Πόσες χημικές
ενώσεις με τον τύπο C6H6 υπάρχουν ;
[Αναφ. 5]
Οι παραπάνω δομές που προτάθηκαν από
διάφορους επιστήμονες για το βενζόλιο δεν είναι βέβαια οι μοναδικές ενώσεις
άνθρακα - υδρογόνου με τον τύπο C6H6.
Οι
Chandrasekhar και Nagendrappa υπολόγισαν ότι
υπάρχουν 217 βασικά ισομερή με τύπο C6H6,
που αυξάνονται στα 328, αν ληφθούν υπόψη χωριστά και οι διαστερεομερείς (Ε, Ζ) και οι
εναντιομερείς (R, S) μορφές τους. Στο σύνολό τους τα ισομερή αυτά ικανοποιούν
αποκλειστικά και μόνο τις βασικές
προϋποθέσεις σθένους (4 για τον άνθρακα και 1 για το υδρογόνο). Τα ισομερή αυτά,
γνωστά ως ισομερή σθένους (valence isomers), κατά κατηγορία είναι:
|
'Ακυκλες ενώσεις:
|
17 από τις οποίες 2 είναι διαστερεομερή |
|
Μονοκυκλικές ενώσεις: |
71 από τις οποίες 10 είναι διαστερεομερή και εναντιομερή |
|
Δικυκλικές ενώσεις: |
134 από τις οποίες 52 είναι διαστερεομερή και εναντιομερή |
|
Τρικυκλικές ενώσεις: |
87 από τις οποίες 42 είναι διαστερεομερή και εναντιομερή |
|
Τετρακυκυκλικές ενώσεις:
|
19 από τις οποίες 5 είναι διαστερεομερή και εναντιομερή |
Είναι γνωστό ότι
συστήματα με ακετυλενικά κέντρα και αλλενικούς (>C=C=C<) δεσμούς προτιμούν τη
γραμμική γεωμετρία και κάθε απόπειρα ένταξής τους σε κυκλικές δομές επιφέρει
σημαντικές διατάσεις (strains). Επίσης οι πολυκυκλικές δομές δεν μπορούν να δεχθούν
διπλούς δεσμούς σε κοινούς άνθρακες των δακτυλίων (κανόνας του Bredt) και πολλά από τα
παραπάνω πολυκυκλικά ισομερή
παραβιάζουν ξεκάθαρα αυτήν την
απαίτηση.
Από όλα τα παραπάνω ισομερή, μόνο
40 έχουν παρασκευασθεί στο εργαστήριο και ίσως θα μπορούσαν να
παρασκευασθούν άλλα τόσα. 'Ισως είναι περιττό να
αναφερθεί ότι το σταθερότερο απ' όλα αυτά τα ισομερή είναι φυσικά το ίδιο το βενζόλιο, το οποίο
είναι και μία από τις σταθερότερες οργανικές ενώσεις.
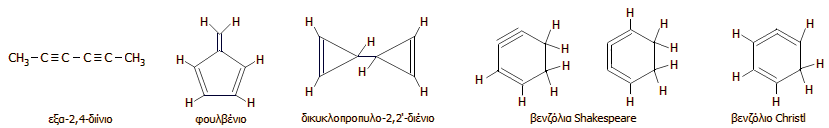
Παραπάνω απεικονίζονται ορισμένα
από τα ισομερή του βενζολίου. Τα τρία πρώτα είναι σχετικώς σταθερές ενώσεις. Τα βενζόλια
Shakespeare και Christl είναι αδύνατον να
απομονωθούν λόγω της μεγάλης διάτασης των δεσμών, ωστόσο φαίνεται ότι
σχηματίζονται παροδικά σε ορισμένα σχήματα οργανικών συνθέσεων παρέχοντας στο
τέλος
σταθερά προϊόντα προσθήκης. |
Περιγραφή της δομής του βενζολίου με βάση τη θεωρία του
συντονισμού.
Για να ερμηνευθούν οι ιδιότητες
του βενζολίου χρησιμοποιήθηκε η θεωρία του συντονισμού (resonance). Το βενζόλιο μπορεί να περιγραφεί ως ένα υβρίδιο δύο ισοδύναμων δομών
Kekulé,
κατά τις οποίες κάθε σύνδεση άνθρακα-άνθρακα,
αντιστοιχεί κατά μέσο όρο με 1,5 δεσμό, δηλαδή, σε μια ενδιάμεση κατάσταση
μεταξύ απλού (C-C)
και διπλού δεσμού (C=C),
που μπορεί να αποδοθεί σχηματικά ως εξής:
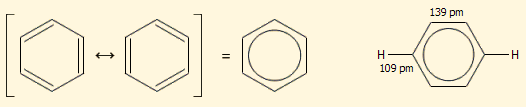
Η παρουσίαση με τον κύκλο
προτάθηκε από τον Robert Robinson
(βραβείο Nobel 1947) και είναι αρκετά εύχρηστη, ωστόσο οι τύποι του
Kekulé
εξακολουθούν να χρησιμοποιούνται ευρύτατα στη σύγχρονη χημική βιβλιογραφία
επειδή διευκολύνουν περισσότερο τον έλεγχο του σθένους του άνθρακα.
Σύμφωνα με τη θεωρία του
συντονισμού που διαμορφώθηκε τη δεκαετία του 1930 από διάφορους επιστήμονες και
ιδιαίτερα από τον
Linus Pauling, οι
δομές συντονισμού είναι υποθετικές και όχι πραγματικές. Το βενζόλιο διαθέτει μία
και μόνη αναλλοίωτη υβριδική δομή, που συνδυάζει τα χαρακτηριστικά και των δύο δομών
συντονισμού. Πράγματι, μετρήσεις με ακτίνες Χ έδειξαν ότι το μήκος του δεσμού C-C
δεν είναι εναλλασσόμενο μεταξύ του γνωστού μήκους του απλού (153
pm) και διπλού
(134 pm) δεσμού, αλλά όλοι
οι δεσμοί έχουν ένα ενδιάμεσο μήκος 139 pm. Το
γεγονός αυτό αποκλείει μια δομή ανάλογη εκείνης του συζυγούς κυκλοεξατριενίου
(μόριο το οποίο δεν υφίσταται). 'Ισοι επίσης μεταξύ τους είναι όλοι οι δεσμοί C-H
(109 pm).
Οι διαφορετικές δομές συντονισμού δεν
είναι απαραίτητο να είναι ισοδύναμες, ωστόσο όσο οι δομές προσεγγίζουν την
ισοδυναμία και όσο περισσότερες δομές συντονισμού υπάρχουν τόσο σταθερότερο γίνεται το μόριο,
γεγονός που ερμηνεύει τη σταθερότητα του βενζολίου.
|
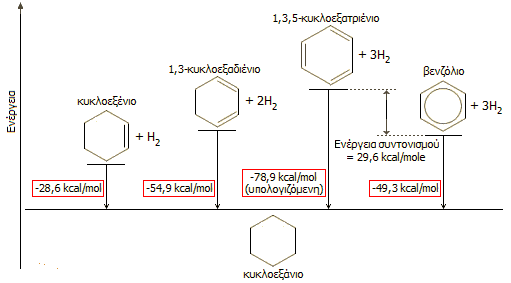 Κατά
πόσο σταθεροποιεί ο συντονισμός το βενζόλιο;
[Αναφ. 6α] Κατά
πόσο σταθεροποιεί ο συντονισμός το βενζόλιο;
[Αναφ. 6α]
Στο επόμενο σχήμα δείχνονται σε διάγραμμα οι
εκλυόμενες ενέργειες κατά τις (εξώθερμες) υδρογονώσεις ακόρεστων παραγώγων του
κυκλοεξανίου και του βενζολίου. Από τις τιμές αυτές μπορεί να υπολογιστεί η
ενεργειακή σταθεροποίηση που προσφέρει ο συντονισμός στο βενζόλιο.
Η υδρογόνωση του κυκλοεξενίου (κ1) είναι εξώθερμη
κατά ΔΗ1º
= -28,6 kcal/mole (τυπική για υδρογόνωση cis-διπλού δεσμού).
Η πλήρης υδρογόνωση του 1,3-κυκλοεξαδιενίου
(κ2) είναι εξώθερμη κατά ΔΗ2º
= -54,9 kcal/mole, κάτι λιγότερο από το διπλάσιο του κυκλοεξενίου, λόγω της
σταθεροποίησης συντονισμού (συντ) του συζυγούς διενίου. Η ενέργεια αυτή μπορεί
να εκτιμηθεί ως εξής:
ΔΗσυντº
= 2 x ΔΗκ1º
- ΔΗκ2º
= 2 x (28,6) - 54,9 = +2,3 kcal/mol.
Η υδρογόνωση του
1,3,5-κυκλοεξατριενίου (κ3) [μόριο το οποίο δεν υπάρχει, αφού αν υπήρχε ακαριαία
θα γινόταν βενζόλιο] θα έπρεπε να είναι εξώθερμη κατά:
ΔΗκ3º
= (3 x
ΔΗκ1º)
+ (3 x ΔΗσυντº
) =
(3 x -28,6) + (3 x 2,3) = -78,9 kcal/mol.
Ωστόσο,
το πείραμα απέδειξε ότι κατά την πλήρη υδρογόνωση του βενζολίου (βενζ)
εκλύεται λιγότερη ενέργεια από την παραπάνω υπολογιζόμενη ενέργεια και είναι
ΔΗβενζº
= -49,3 kcal/mol.
Αυτή η διαφορά αποδεικνύει ότι το βενζόλιο
είναι σταθερότερο μόριο από το (υποθετικό) 1,3,5-κυκλοεξατριένιο κατά: ΔΗº
=
(-49,3) - (-78,9) = 29,6 kcal/mol.
Αυτή η διαφορά
των περίπου 30 kcal/mol ονομάζεται ενέργεια συντονισμού (resonance
energy) του βενζολίου. 'Αλλοι όροι που χρησιμοποιούνται για την ίδια ενέργεια είναι: ενέργεια
απεντοπισμού (delocalization energy), αρωματική σταθεροποίηση (aromatic
stabilization) ή απλά αρωματικότητα (aromaticity). |
Η
περιγραφή της δομής του βενζολίου με μοριακά τροχιακά
[Αναφ. 6].
Η προσέγγιση της δομής του βενζολίου μέσω μοριακών
τροχιακών (molecular
orbitals,
MO)
δίνει έμφαση στην κυκλική συζυγία του μορίου του βενζολίου και στην ισοδυναμία
των 6 δεσμών C-C. 'Ολες οι γωνίες του εξαγώνου είναι 120ο, όλα τα άτομα άνθρακα έχουν υβριδισμό sp2 και
διαθέτουν ένα τροχιακό p κάθετο στο επίπεδο του εξαμελούς δακτυλίου,
το οποίο μπορεί να σχηματίσει σε π-δεσμό με το διπλανό.
Εφόσον τα 6 τροχιακά
p είναι ισοδύναμα,
δεν είναι δυνατόν να εντοπισθούν δεσμοί π στους οποίους συγκεκριμένο
τροχιακό p
επικαλύπτεται με ένα μόνο γειτονικό τροχιακό
p.
Στην πραγματικότητα, κάθε τροχιακό
p επικαλύπτεται
εξίσου καλά και με τα δύο γειτονικά τροχιακά
p,
με αποτέλεσμα η αναπαράσταση του βενζολίου να είναι 6 ηλεκτρόνια π πλήρως
απεντοπισμένα γύρω από τον δακτύλιο, δηλαδή το καθέ ηλεκτρόνιο δεν ανήκει πλέον σε
συγκεκριμένο άτομο άνθρακα αλλά μπορεί να βρίσκεται οπουδήποτε σε ένα είδος δακτυλιδοειδούς νέφους. Επομένως, το βενζόλιο διαθέτει δύο
δακτυλιοειδή ηλεκτρονιακά νέφη, το ένα πάνω και το άλλο κάτω από το επίπεδο του
δακτυλίου. Τα 6 p ηλεκτρόνια
του βενζολίου καταλαμβάνουν τα τρία δεσμικά μοριακά τροχιακά και είναι
απεντοπισμένα γύρω από ένα πλήρως συζυγιακό σύστημα, γεγονός που σταθεροποιεί το βενζόλιο κατά περίπου 30
kcal/mol.
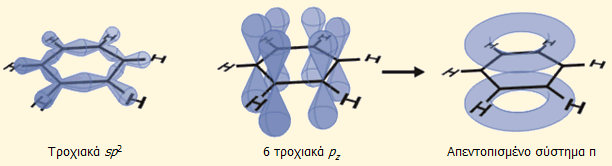
|
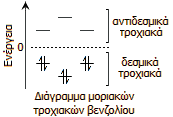 Γιατί
4n+2; Γιατί
4n+2;
Σύμφωνα με τη θεωρία των
μοριακών
τροχιακών του Hückel,
μια ένωση εμφανίζεται ιδιαίτερα σταθερή εάν όλα τα δεσμικά μοριακά τροχιακά της
έχουν συμπληρωθεί με συζευγμένα ηλεκτρόνια. Στην περίπτωση των
αρωματικών ενώσεων αυτό ισχύει. Στις αρωματικές ενώσεις, 2 ηλεκτρόνια συμπληρώνουν το
μοριακό τροχιακό χαμηλότερης ενέργειας και 4 ηλεκτρόνια πληρούν τα μοριακά
τροχιακά του επόμενου ενεργειακού επιπέδου (ο αριθμός των επιπέδων εκφράζεται
από το n). 'Ετσι, όλα τα δεσμικά μοριακά τροχιακά
έχουν συμπληρωθεί, ενώ όλα τα αντιδεσμικά είναι κενά. Αυτό σημαίνει ότι υπάρχουν
συνολικά 4n+2 ηλεκτρόνια και δείχνεται στο παραπλεύρως
διάγραμμα.
Το βενζόλιο έχει
6 π ηλεκτρόνια, τα 2 π συμπληρώνουν το τροχιακό χαμηλότερης ενέργειας, τα άλλα 4
π τα τροχιακά της επόμενης ενεργειακής στάθμης, ενώ όλα τα αντιδεσμικά τροχιακά
είναι κενά. |
|

Μονάδα καταλυτικής
αναμόρφωσης |
Χρήσεις
του βενζολίου
Το βενζόλιο χρησιμοποιείται ως
διαλύτης σε πολλές χημικές διεργασίες, αν και τα τελευταία χρόνια έχει
αντικατασταθεί από άλλους διαλύτες λόγω της τοξικότητας και της καρκινογόνου δράσης
του.
Αποτελεί την πρώτη ύλη ή την
ενδιάμεση χημική ένωση για την παρασκευή πλήθους αρωματικών ενώσεων όπως: στυρόλιο, φαινόλη,
νιτροβενζόλιο και ανιλίνης, αλκυλοβενζόλια, χλωροβενζολία, αλλά και μη
αρωματικών ενώσεων, όπως το κυκλοεξάνιο και τον μηλεϊνικό ανυδρίτη.
Με τη σειρά τους αυτές οι χημικές αυτές
ενώσεις χρησιμοποιούνται στη χημική βιομηχανία για την παραγωγή μια αφθονίας
υλικών και ουσιών όπως: πλαστικά,
ρητίνες, χρώματα, εντομοκτόνα, φαρμακευτικά προϊόντα κ.λπ.
Το βενζόλιο, όπως και οι άλλοι
αρωματικοί υδρογονάνθρακες, όπως το τολουόλιο (μεθυλοβενζόλιο) και τα ξυλόλια
(διμεθυλοβενζόλια), χρησιμοποιούνται ως πρόσθετα στη
βενζίνη για την αύξηση του βαθμού οκτανίων τυπικά σε αναλογίες 1-2% (το καθαρό
βενζόλιο αντιστοιχεί σε 150 βαθμούς οκτανίου).
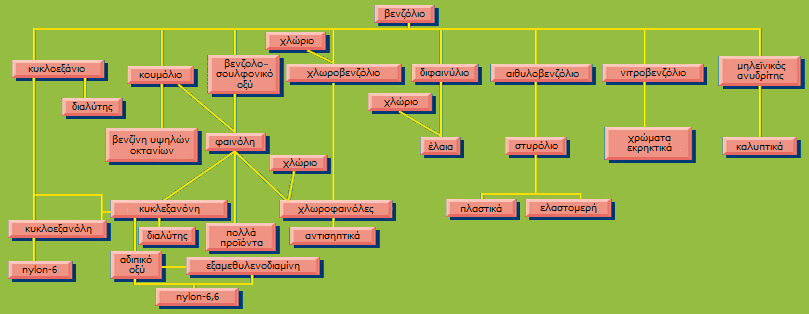
Ορισμένα από τα κυριότερα προϊόντα του
βενζολίου (από την Encyclopaedia Britannica, 1998)
Προβλήματα στην υγεία των εργαζομένων
και μεταβολισμός του βενζολίου
Οι πρώτες έρευνες για την
επίδραση του βενζολίου στην υγεία του ανθρώπου, αφορούσαν εργαζόμενους στις
χημικές βιομηχανίες που εκτίθονταν σε υψηλές συγκεντρώσεις (λόγω της πτητικότητάς
του)
και για μεγάλο χρονικό διάστημα. Εισπνοή μεγάλων ποσοτήτων ατμών του για σύντομο
χρονικό διάστημα του προκαλεί ζάλη,
ταχυκαρδία, πονοκέφαλο, εμετό και σπασμούς.
Το βενζόλιο εισέρχεται στον
οργανισμό κυρίως μέσω της εισπνοής των ατμών του και δευτερευόντως μέσω της
απορρόφησής του από το δέρμα. Οι περισσότεροι άνθρωποι αντιλαμβάνονται από την
οσμή το βενζόλιο στον αέρα, όταν βρίσκεται σε συγκεντρώσεις 1,5-4,7 ppm και στο
νερό σε συγκεντρώσεις 2 ppm (ppm: μέρη ανά
εκατομμύριο, στα αέρια σε όγκους, στα υγρά/στερεά σε βάρος, 1 ppm βενζολίου στον
αέρα αντιστοιχεί προς 3,19 mg βενζολίου/m3).
|

Το κάπνισμα για
τους καπνιστές αποτελεί την κύρια πηγή πρόσληψης βενζολίου. |
Το εισπνεόμενο βενζόλιο περνάει
στην κυκλοφορία του αίματος. Το βενζόλιο συσσωρεύεται σε λιπώδεις ιστούς και
στον μυελό των οστών. 'Εχει
βρεθεί ότι το κάπνισμα ενός τσιγάρου απελευθερώνει 50 έως 150 μg βενζολίου. Στις
ΗΠΑ, σε εθνική βάση, έχει εκτιμηθεί ότι το κάπνισμα αποτελεί το 89% της έκθεσης
σε βενζόλιο μεταξύ των καπνιστών και το παθητικό κάπνισμα για το 10% της έκθεσης
σε βενζόλιο για τους μη καπνιστές [Αναφ. 8].
Το βενζόλιο είναι γνωστό ως καρκινογόνο του
αιμοποιητικού συστήματος, αυξάνει τον κίνδυνο για λευχαιμία, λεμφογενή λευχαιμία
και μυελογενή λευχαιμία. Πειράματα με πειραματόζωα έδειξαν ότι το βενζόλιο
μπορεί να διαπεράσει τον πλακούντα.
Η νόσος που συνδέεται άμεσα με
χρόνια δηλητηρίαση από το βενζόλιο είναι η απλαστική αναιμία, κατά την
οποία ο μυελός των οστών παύει να παράγει αρκετά ερυθρά και λευκά αιμοσφαίρια
και αιμοπετάλια. Ο ασθενής αισθάνεται συνεχώς κόπωση, λόγω των λίγων ερυθρών
αιμοσφαιρίων, παθαίνει εύκολα
λοιμώξεις και αιμορραγίες λόγω των ανεπαρκών
λευκών αιμοσφαιρίων και αιμοπεταλίων, αντίστοιχα.
Επιδημιολογικές έρευνες με
εργαζόμενους στη χημική βιομηχανία έχουν πιστοποιήσει την καρκινογόνο δράση του
βενζολίου και οι ασθένειες αυτές θεωρούνται επαγγελματικές ασθένειες.
Οι εργαζόμενοι στη βιομηχανία ελαστικών έχουν αυξημένο κίνδυνο για καρκίνους του
λεμφικού και αιμοποιητικού συστήματος, ουροδόχου κύστης, πνεύμονα, προστάτη και
στομάχου [Αναφ 9].
Ανώτατες επιτρεπόμενες συγκεντρώσεις βενζολίου. Οι επιτρεπόμενες
συγκεντρώσεις για το βενζόλιο στο εργασιακό περιβάλλον ήταν πριν αρκετές
δεκαετίες 100
ppm,
αλλά οι επιδημιολογικές έρευνες προσδιόριζαν τον αυξημένο κίνδυνο ακόμη και για
10 ppm.
Χαρακτηριστική είναι η σταδιακή μείωση αυτού του ορίου: 100
ppm (1946), 25 ppm (1957-62), 10 ppm (1977). Από το 1990 το ανώτατο επιτρεπόμενο όριο
έγινε πλέον 0,1
ppm
σε όλες τις αναπτυγμένες βιομηχανικές χώρες, στις χώρες της Ευρωπαϊκής
'Ενωσης και στην Ελλάδα.
Μεταβολισμός του βενζολίου. 'Οπως προαναφέρθηκε το βενζόλιο είναι μια
"ανθεκτική" χημική ένωση, που δύσκολα μετέχει σε χημικές αντιδράσεις
σε ήπιες συνθήκες, ωστόσο υπόκειται σε
μεταβολισμό και η τοξικότητά του εντοπίζεται στα προϊόντα μεταβολισμού του και όχι στο ίδιο.
Μικρό μέρος του προσλαμβανόμενου βενζολίου εξέρχεται με την εκπνοή. Κατά τον μεταβολισμό του οξειδώνεται
στο ήπαρ από διάφορες οξειδάσες της οικογένειας του κυτοχρώματος Ρ450 προς οξείδιο του
βενζολίου [Αναφ. 10], ένα εποξείδιο, δραστικό ενδιάμεσο με χρόνο
υποδιπλασιασμού λίγων μόνο λεπτών. Το γενικό σχήμα μεταβολισμού
του βενζολίου στον οργανισμό του ανθρώπου δείχνεται παρακάτω.
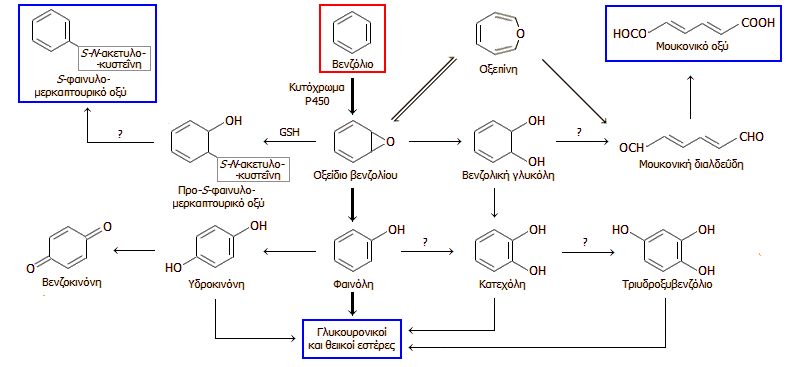
Γενικό σχήμα μεταβολισμού του
βενζολίου: Τα κυριότερα προϊόντα μεταβολισμού περικλείονται στα μπλε ορθογώνια.
Αναφέρονται τουλάχιστον τρεις
διακριτές μεταβολικές οδοί. Κατά την πρώτη μεταβολική οδό το εποξείδιο
οξειδώνεται σε
φαινόλη, η οποία μπορεί να οξειδωθεί περαιτέρω προς υδροκινόνη και βενζοκινόνη
και άλλα υδροξυπαράγωγα του βενζολίου. Η φαινόλη και τα άλλα υδροξυ-παράγωγα του βενζολίου
είναι ισχυροί αιματοτοξικοί παράγοντες και
αποβάλλονται από τον οργανισμό ως γλυκουρονικοί ή θειικοί εστέρες. Κατά τη δεύτερη μεταβολική οδό το οξείδιο
του βενζολίου οξειδώνεται προς μουκονική διαλδεΰδη και τελικά προς
μουκονικό οξύ (mucus: βλέννα). Κατά την τρίτη μεταβολική οδό το οξείδιο του βενζολίου καταλήγει προς
S-φαινυλομερκαπτουρικό οξύ. 'Εχει εξετασθεί
η σχετική αιματοτοξική δραστικότητα του βενζολίου και ορισμένων από τους
μεταβολίτες του. Ενδεικτικά, η υδροκινόνη και η κατεχόλη εμφανίζονται 10 φορές
τοξικότερες, ενώ η μουκονική διαλδεΰδη και η βενζοκινόνη 1000 φορές
[Αναφ. 10β].
Από τα προϊόντα μεταβολισμού
του βενζολίου, ενδιαφέρον παρουσιάζουν το μουκονικό οξύ και
το
S-φαινυλομερκαπτουρικό οξύ. Σε αντίθεση με τη φαινόλη
και τα άλλα υδροξυπαράγωγα του βενζολίου, το μουκονικό οξύ και το S-φαινυλομερκαπτουρικό
οξύ και το προϊόν της υδρόλυσής του, η S-φαινυλοκυστεΐνη, αποτελούν καλούς
βιοδείκτες (biomarkers) του βενζολίου και η συγκέντρωσή τους στα βιολογικά
υγρά μπορεί να χρησιμεύσει ως μέτρο της έκθεσης του οργανισμού σε βενζόλιο
[Αναφ. 11].
Καρκινογονικότητα του βενζολίου
[Αναφ. 12].
Ο μηχανισμός της καρκινογόνου δράσης του βενζολίου διαφέρει σημαντικά από την
καρκινογόνο δράση άλλων γνωστών καρκινογόνων ενώσεων (π.χ. πολυπυρηνικών
αρωματικών υδρογονανθράκων, των αφλατοξινών). Το ίδιο δεν μπορεί να συνδεθεί με
οποιοδήποτε τρόπο με το DNA, οπότε η καρκινογόνος δράση αποδίδεται στα προϊόντα
μεταβολισμού του
[Αναφ. 12α].
 Η υπόθεση ότι
το βενζόλιο μεταβολίζεται μέσω σχηματισμού του οξειδίου του βενζολίου είχε
διατυπωθεί από το 1968, αλλά επιβεβαιώθηκε σχεδόν 30 χρόνια αργότερα.
Οι
μεταβολίτες αυτοί θεωρείται ότι μπορούν να δημιουργήσουν οξυγονούχες ελεύθερες
ρίζες (ROS:
reactive oxygen species) ικανές να προκαλέσουν οξειδωτικές βλάβες στο DNA.
Η υπόθεση ότι
το βενζόλιο μεταβολίζεται μέσω σχηματισμού του οξειδίου του βενζολίου είχε
διατυπωθεί από το 1968, αλλά επιβεβαιώθηκε σχεδόν 30 χρόνια αργότερα.
Οι
μεταβολίτες αυτοί θεωρείται ότι μπορούν να δημιουργήσουν οξυγονούχες ελεύθερες
ρίζες (ROS:
reactive oxygen species) ικανές να προκαλέσουν οξειδωτικές βλάβες στο DNA.
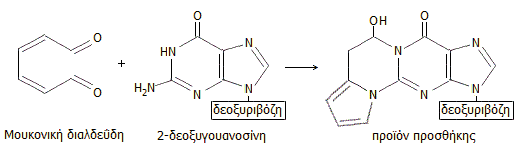
Πέραν των οξυγονούχων ριζών
έχει διατυπωθεί η υπόθεση ότι και άλλα προϊόντα του μεταβολισμού του βενζολίου
μπορούν να προκαλέσουν βλάβες στο DNA. Το οξείδιο του βενζολίου
βρίσκεται σε ισορροπία με το ταυτομερές του, την οξεπίνη (οξακυκλοεπτατριένιο),
η οποία υπόκειται σε οξειδωτική διάνοιξη του επταμελούς δακτυλίου προς μουκονική
διαλδεΰδη. 'Εχει διαπιστωθεί in
vitro ότι
η μουκονική διαλδεΰδη αντιδρά με τη 2-δεοξυγουανοσίνη δίνοντας ένα τετρακυκλικό
προϊόν προσθήκης (βλ. αντίδραση δεξιά). Εάν αυτό συμβαίνει και στις μονάδες 2-δεοξυγουανοσίνης του DNA,
τότε είναι πολύ πιθανή και η συνεισφορά της μουκονικής διαλδεΰδης στη μεταλλαξιγόνο δράση του βενζολίου
[Αναφ. 13].
|

Το γαλλικό
εμφιαλωμένο νερό Perrier. Η ανίχνευση ιχνών βενζολίου σε λίγες
φιάλες του οδήγησε στην απόσυρση 160 εκατομμυρίων φιαλών του. |
Το βενζόλιο στο περιβάλλον
Το βενζόλιο σε ίχνη αποτελεί φυσικό συστατικό
της ατμόσφαιρας
(κλάσμα του ppb ή λίγα ppb), αφού ποσότητές του παράγονται κατά φυσικό τρόπο κατά τις ηφαιστειακές εκρήξεις και
τις πυρκαγιές των δασών. Ενδεικτικά: στις ακατοίκητες περιοχές του πλανήτη
βρίσκεται σε συγκέντρωση 0,16 ppb, στις αγροτικές περιοχές 0,46 ppb, ενώ στις
αστικές περιοχές 1,8 ppb (1 ppb: μέρος στο δισεκατομμύριο κατ' όγκο -στα αέρια-,
αντιστοιχεί προς 3,19 μg βενζολίου/m3). Ωστόσο, το μεγαλύτερο ποσοστό (ίσως και >90%) του
βενζολίου της ατμόσφαιρας οφείλεται σε ανθρωπογενείς πηγές. 'Ετσι,
η χρήση βενζολίου στη βενζίνη
για να αυξήσει τον αριθμό οκτανίων είναι φυσικό να προκαλεί εκπομπή σημαντικών
ποσοτήτων βενζολίου και άλλων αρωματικών οργανικών ενώσεων σε αστικές περιοχές.
Ορισμένοι επιστήμονες επικεντρώνουν την προσοχή τους στο γεγονός αυτό και
θεωρούν ότι ένα μέρος της αύξησης των καρκίνων του αιμοποιητικού συστήματος, που
δεν σχετίζονται με επαγγελματικές εκθέσεις, μπορεί να οφείλεται σε αυτό, δηλαδή
τα καυσαέρια των αυτοκινήτων και τη χρήση βενζίνης
[Αναφ. 14].
|
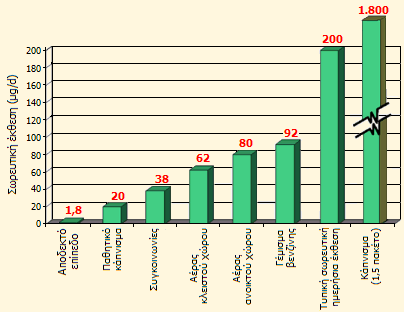
Σωρευτική ημερήσια
έκθεση του ανθρώπου σε βενζόλιο από διάφορες πηγές, χώρους ή
δραστηριότητες. Η μέση ημερήσια τυπική έκθεση είναι 200 μg.
Συγκριτικά, η έκθεση ενός καπνιστή 1,5 πακέτου τσιγάρων είναι 1800
μg (από την Αναφ. 16δ). |
Η βελτίωση
των αναλυτικών μεθόδων επιτρέπει την ανίχνευση και μέτρηση του βενζολίου (αλλά
και πολλών άλλων ρύπων) σε εξαιρετικά χαμηλές συγκεντρώσεις και είναι φυσικό
πλέον να ανιχνεύονται ρύποι εκεί που παλαιότερα πιστευόταν πως δεν υπήρχαν, όπως
και να τίθενται ακόμη χαμηλότερα ανεκτά όρια από τους αρμόδιους εθνικούς και
διεθνείς οργανισμούς ελέγχου.
Χαρακτηριστική περίπτωση αποτελεί η ανίχνευση βενζολίου στο εμφιαλωμένο φυσικό οξυανθρακούχο μεταλλικό
νερό Perrier, ένα διεθνώς διακινούμενο γαλλικό προϊόν. Το 1990, στη Βόρεια
Καρολίνα επιστήμονες του πολιτειακού εργαστηρίου ελέγχου μέτρησαν σε αρκετές φιάλες νερού Perrier βενζόλιο σε
συγκεντρώσεις 12 έως 20 ppb.
Το αποτέλεσμα ήταν η απόσυρση 160 εκατομμυρίων
φιαλών Perrier σε όλο τον κόσμο, από τα οποία τα 70 στις ΗΠΑ. Η εταιρεία ανέφερε ότι αυτή η μικρή συγκέντρωση οφειλόταν στη
μη αντικατάσταση φίλτρου καθαρισμού του νερού. Παρά την ανακοίνωση της Διεύθυνσης Τροφίμων και
Φαρμάκων των ΗΠΑ (FDA) ότι ο κίνδυνος ήταν αμελητέος, η αγορά του Perrier στις
ΗΠΑ κατέρρευσε και η εταιρεία έφτασε στα όρια της πτώχευσης
[Αναφ. 15].
Πιο πρόσφατη υπήρξε η ανίχνευση ιχνών
βενζολίου σε εμφιαλωμένους χυμούς. Διαπιστώθηκε ότι το βενζόλιο αυτό προέρχεται
από την αποκαρβοξυλίωση του βενζοϊκού οξέος (που συχνά προστίθεται ως
συντηρητικό στους φυσικούς χυμούς) υπό την επίδραση του ασκορβικού οξέος, του
ηλιακού φωτός και την καταλυτική παρουσία ιχνών ορισμένων μετάλλων.
Να σημειωθεί ότι η Παγκόσμια Οργάνωση Υγείας (WHO)
συνιστά ως μέγιστη ανεκτή συγκέντρωση βενζολίου στο πόσιμο νερό τα 10 ppb, ενώ το όριο
αυτό είναι 5 ppb στις ΗΠΑ και τον Καναδά και μόλις 1 ppb στην Ευρωπαϊκή 'Ενωση.
Θα πρέπει βέβαια να σημειωθεί ότι εάν ένας έπινε μια φιάλη εμφιαλωμένου χυμού
(350 mL) με τη μεγαλύτερη συγκέντρωση που έχει μετρηθεί μέχρι στιγμής (88 ppb),
θα εισήγαγε στον οργανισμό του 31 μg βενζολίου. Συγκριτικά, ένας μέσος καπνιστής
1,5 πακέτου τσιγάρων την ημέρα εισάγει στον οργανισμό του πολύ μεγαλύτερες
ποσότητες βενζολίου, που διάφορες μελέτες τις προσδιορίζουν στην περιοχή των
1800 μg βενζολίου, σχεδόν 10 φορές περισσότερο από έναν μη καπνιστή [Αναφ. 16].
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1.
(α) Merck Index, 12th ed, σελ. 1101. (β)
Wikipedia: "Benzene".
(γ) ScienceLab.com: "Material Safety Data Sheet (MSDS): Benzene" (αρχείο
PDF, 80 KB). (δ) INCHEM home: "Benzene".
2. (α) Faraday M: "On New Compounds
of Carbon and Hydrogen, and on Certain Other Products Obtained during the
Decomposition of Oil by Heat", Philosophical Transactions of the Royal Society
of London 115: 440-466, 1825 (Abstract). (β) Kaiser R: " 'Bircarburet of
Hydrogen'. Reappraisal of the discovery of benzene in 1825 with the analytical
methods of 1968", Angew. Chem. Internat. Edit., 7(5): 345-350, 1968 (Abstract).
(γ) Early London Gas Industry: "The
London Portable Gas Company". (δ) Wikipedia: "Gas
lighting". (ε) Wikipedia: "Eilhard
Mitscherlich".
3. (α) May P:
Simple Molecules and Molecules in the Environment: "Benzene"
(Imperial College). (β)
TutorVista.com: "IUPAC
names benzene ring".
4. (α) Rothermich ME, Zipprich N
(Woodrow Wilson Institute): "Friedrich
August Kekulé:
A Scinetist and a Dreamer",
1992 (β) Dreams of Famous People (dreamtalk.hypermart.net):
"Fredrich
August von Kekule". (γ) Wikipedia: "Friedrich
August Kekulé von Stradonitz".
5. (α) Chandrasekhar J: "Molecule of
the month: Isomers of benzene - Still pursuing dreams", Resonance, 80-83,
1996 (αρχείο
PDF, 99 KB). (β) Nagendrappa G: "Benzene and its isomers: How many
structures can we draw for C6H6", Resonance 74-78, 2001 (αρχείο
PDF, 99 KB).
6. (α) Vollhard
ΚPC: "Organic Chemistry", WH Freeman and Co., New york,
1987. (β) McGraw Hill, Higher Education: "Aromaticity".
(γ) ChemGuide: "Bonding
in benzene". (δ) TutorVista.com: "Structure
of benzene". (ε) Wikipedia: "Hückel's
rule". (στ)
ChemWiki: "Hückel's
Rule".
(στ) O=Chem (The University of South Main): "Aromaticity
and Hückel's Rule". (ζ) Michigan State University: "Aromaticity:
Benzene and other aromatic compounds".
7. (α) ChemGuide:
"Manufacturing
arenes: Catalytic reforming". (β)
Wikipedia: "Catalytic
reforming". (γ) TutorVista.com: "Preparation
of benzene".
8. (α) American Cancer Society: "Benzene".
(β) Eco-USA.net: "Benzene".
(γ) US Environmental Protection
Agency, Technology
Transfer Network, Ait Toxics Website: "Benzene".
(
9. (α)
Decouflé P, Blattner WA, Blair A: "Mortality among chemical workers exposed to
benzene and other agents", Environ Res. 30(1):16-25, 1983 (PubMed).
(β) Arp EW, Wolf PH,
Checkoway H: "Lymphocytic leukemia and exposure to benzene and other solvents in
the rubber industry", Occupational Medicine 25: 598-602, 1983 (PubMed).
γ) Ghantous H, Danielsson BR: "Placental
transfer and distribution of toluene, xylene and benzene, and their metabolites
during gestation in mice", Biol Res Pregnancy Perinatol. 7(3):98-105, 1986
(PubMed).
(δ) Rinsky RA: "Benzene and
leukemia: an epidemiologic risk assessment",
Environ Health Perspect.
82:189-191,
1989 (PubMed).
(ε) Austin H, Delzell
E, Cole P: "Benzene and leukemia: a review of the literature and risk assessment",
Am J Epidemiology 127: 419-439, 1988 (PubMed).
(στ) Wong O:
"Risk of
acute myeloid leukaemia and multiple myeloma in workers exposed to benzene",
Occupational and Environmental Medicine 52:380-384, 1995
(PubMed).
10. (α) Jerina D, Daly J, Witkop B,
Zaltzman-Nirenberg P, Udenfriend S: "Role of the arene oxide-oxepin system in
the metabolism of aromatic substances. I. In-vitro conversion of benzene
oxide to a premercapturic acid and dihydrodiol", Arch. Biochem. Biophys.,
128, 176-193, 1968.
(β)
Snyder R, Hedli CC: "An
Overview of Benzene Metabolism",
Environmental Health Perspectives,104(6), 1996. (γ) Turner MJ, Meyer M, Kedderis GL, Bechtold WE, Schlosser PM: "Identification of
benzene oxide as a product of benzene metabolism by mouse, rat, and human liver
microsomes", Carcinogenesis 18(9):1695-1700, 1997 (αρχείο
PDF 256 KB).
11. (α) Boogaard PJ, van Sittert NJ:
"Suitability of S-phenyl mercapturic
acid and trans-trans-muconic acid as biomarkers for exposure to low
concentrations of benzene", Environ Health
Perspect. 104(6):
1151-1157, 1996 (PubMed).
(β) Bechtold WE, Strunk MR: "S-phenylcysteine in albumin as a benzene biomarker",
Environ Health Perspect,
104(Suppl 6):
1147-1149, 1996 (αρχείο
PDF 481 KB). (γ) Melikian
AA, Prahalad AK, Secker-Walker RH: "Comparison of the levels of the urinary
benzene metabolite trans,trans-muconic acid in smokers and nonsmokers and the
effectis of pregnancy", Cancer Epidemiology, Biomarkers & Prevention, 3:239-244,
1994 (αρχείο
PDF 897 KB).
12. (α)
Smith T: "The
mechanism of benzene-induced leukemia: a hypothesis and speculation on the
causes of leukemia", Environ Health Perspect 104(Suppl 6):1219-1225, 1996.
(β) Golding BT, Watson WP:
"Possible mechanisms of carcinogenesis after exposure to benzene",
IARC Sci Publ. (150):75-88,
1999 (PubMed).
(γ) Whysner J, Reddy MV, Ross PM, Mohan M, Lax EA: "Genotoxicity of benzene and
its metabolites", Mutat Res. 566(2):99-130, 2004 (PubMed). (δ) Atkinson TJ: "A
review of the role of benzene metabolites and mechanisms in malignant
transformation: Summative evidence for a lack of research in nonmyelogenous
cancer types",
International Journal of Hygiene and Environmental Health,
212(1):1-10, 2009 (PubMed).
13. (α)
Golding BT, Bleasdale C, MacGregor JO, Nieschalk J, Pearce K, Watson WP: "Chemistry
of muconaldehydes of possible relevance to the toxicology of benzene",
Environmental Health Perspectives, 104:1201-1209, 1996. (PubMed).
(β) Bleasdale C,
Cameron R, Edwards C, Golding BT: "Dimethyldioxirane converts benzene oxide/oxepin
into (Z,Z)-muconaldehyde and sym.-oxepin oxide: modeling the metabolism of
benzene and its photo-oxidative degradation", Chem Res Toxicol, 10:1314-1318,
1997 (Abstract).
(γ) Bleasdale C (Newcastle University): "Research
acitvities:
Molecular carcinogenesis of benzene".
14.
(α) Steineck G, Plato
N, Gerhardsson M, Norell SE, Hogstedt C: "Increased risk of urothelial cancer in
Stockholm during 1985-87 after exposure to benzene and exhausts", Internation
Journal of Cancer 45:1012-1017, 1990 (PubMed).
(β)
Wolff SP:
"Correlation between car
ownership and leukaemia: is non-occupational exposure to benzene from petrol and
motor vehicle exhaust a causation in leukaemia and lymphoma?"
Experienta 48:301-304, 1992 (PubMed).
(γ) Johnson GT,
Harbison SC,
McCluskey JD,
Harbison RD:
"Characterization of cancer risk from airborne benzene
exposure",
Regul Toxicol Pharmacol.
55(3):361-366, 2009 (PubMed).
15. (α) Wikipedia: "Perrier".
(β) TheFreeLibrary.com: "Again
with the benzene? Remember the pointless Perrier scare? Some lawyers and
consumer groups hope you don't".
(γ) www.practicallyedible.com: "Perrier
water".
16.
(α) Gardner LK, Lawrence GD: "Benzene production
from decarboxylation of benzoic acid in the presence of ascorbic acid and a
transition-metal catalyst", J. Agric. Food Chem.,
41(5):693-695, 1993 (Abstract).
(β) Wikipedia: "Benzene
in soft drinks". (γ) Federal
Institute for Risk Assessment (BFR) (Γερμανίας): "Indications
of the possible formation of benzene from benzoic acid in foods",
BfR Expert Opinion No. 013/2006, 1
December 2005 (αρχείο
PDF, 55 KB). (δ)
North Carolina Department of Environmental and Natural Resources, Division of
Air Quality: "Daily
environmental exposures to benzene". (ε)
Wallace
LA: "Major sources
of benzene exposure", Environ Health Perspect 82:165-169,
1989 (αρχείο
PDF, 1,06 ΜΒ).
(στ)
Darrall KG,
Figgins JA, Brown RD, Phillips GF:
"Determination of benzene and associated
volatile compounds in mainstream cigarette smoke", Analyst 123: 1095-1101,
1998 (αρχείο
PDF, 89 ΚΒ).
Ενδιαφέροντα άρθρα ανασκόπησης για το βενζόλιο, τα όρια
έκθεσης και τις επιπτώσεις του στην υγεία
- World
Health Organization: Air Quality Guidelines - Second Edition: "Chapter 5.2:
Benzene" (αρχείο
PDF 81 KB).
- Infante PF: "4. Benzene: an historical
perspective on the American and European occupational setting", (αρχείο
PDF 155 KB).
|
Αποποίηση
ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η
ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο
έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν
τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες.
Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε
εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις
ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα Χημείας επικυρώνει ή καθ'
οιονδήποτε τρόπο αποδέχεται το περιεχόμενό
τους. |






 Μετά
από επίπονη εργαστηριακή εργασία λίγων ετών, ο Faraday ανακοίνωσε στις 16
Ιουλίου του 1825 στο Βασιλικό Ινστιτούτο του Λονδίνου, την ανακάλυψη στο
ελαιώδες συμπύκνωμα του "φορητού αερίου" μιας άγνωστης μέχρι τότε ένωσης
άνθρακα-υδρογόνου. Την ουσία αυτή ονόμασε bicarburet of hydrogen (διανθρακούχο
υδρογόνο), ονομασία που δηλώνει μια αναλογία ατόμων Η:
Μετά
από επίπονη εργαστηριακή εργασία λίγων ετών, ο Faraday ανακοίνωσε στις 16
Ιουλίου του 1825 στο Βασιλικό Ινστιτούτο του Λονδίνου, την ανακάλυψη στο
ελαιώδες συμπύκνωμα του "φορητού αερίου" μιας άγνωστης μέχρι τότε ένωσης
άνθρακα-υδρογόνου. Την ουσία αυτή ονόμασε bicarburet of hydrogen (διανθρακούχο
υδρογόνο), ονομασία που δηλώνει μια αναλογία ατόμων Η: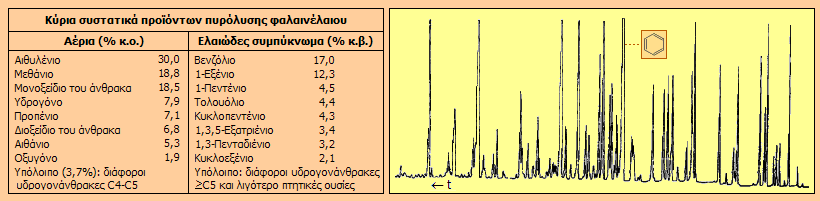
















 Γιατί
4
Γιατί
4




 Η υπόθεση ότι
το βενζόλιο μεταβολίζεται μέσω σχηματισμού του οξειδίου του βενζολίου είχε
διατυπωθεί από το 1968, αλλά επιβεβαιώθηκε σχεδόν 30 χρόνια αργότερα.
Η υπόθεση ότι
το βενζόλιο μεταβολίζεται μέσω σχηματισμού του οξειδίου του βενζολίου είχε
διατυπωθεί από το 1968, αλλά επιβεβαιώθηκε σχεδόν 30 χρόνια αργότερα.
