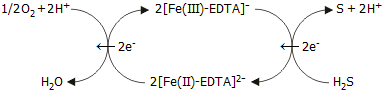Οι μέχρι σήμερα
Η χημική ένωση του
μήνα
[Μάρτιος 2009]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες
[Aναφ.
1α]:
Εμφάνιση: Λευκό κρυσταλλικό άοσμο στερεό.
Μοριακός τύπος:
C10H16N2O8
Σχετική μοριακή μάζα:
292,25
Σημείο τήξης
>
220ºC (υπό αποσύνθεση)
Πυκνότητα: 0,86 g/cm3
Μέτρια ισχυρό τετραπρωτικό οξύ (pK1
= 2,00, pK2
= 2,66, pK3
= 6,16, pK4
= 10,26 [Aναφ.
1β])
Διαλυτότητα στο Η2Ο: 0,50
g/L
(~
0,0017 M)
pH κορεσμ.
διαλύματος: 2,0 - 2,5
'Eνυδρο
δινάτριο άλας (πιο συνηθισμένη εμπορική μορφή του EDTA):
Μοριακός τύπος:
C10H14N2Na2O8·2H2O
Σχετική μοριακή μάζα:
372,24
Διαλυτότητα:
~ 10
g/100 g
H2O
[Αναφ. 2γ]
pH
διαλύματος 1%: 4,2 - 5,2
LD50:
2 g/kg (από το στόμα σε αρουραίους)
|
 |
|
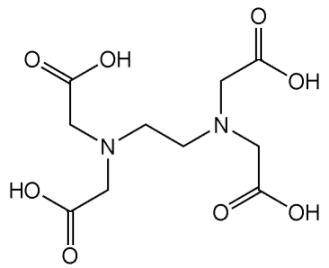
Αιθυλενοδιαμινοτετραοξικό οξύ
(EDTA)
και άλατά του
Ethylenediaminetetraacetic
acid (EDTA) |
 Ιστορία - Σύνθεση του
EDTA και των αλάτων του
Ιστορία - Σύνθεση του
EDTA και των αλάτων του
Το αιθυλενοδιαμινοτετραοξικό οξύ (εδετικό
οξύ, edetic acid ή απλά EDTA) είναι ο γνωστότερος και πλέον
τυπικός εκπρόσωπος μιας σειράς ενώσεων, οι οποίες γενικά ονομάζονται
αμινοπολυκαρβοξυλικά οξέα
και χαρακτηρίζονται από
μια εξαιρετικά έντονη συμπλεκτική ικανότητα ως προς τα περισσότερα μεταλλοϊόντα.
Το EDTA παρασκευάστηκε για πρώτη φορά
το 1935 από τον χημικό Ferdinand Munz της Γερμανικού βιομηχανικού
συγκροτήματος I. G. Farbenindustrie, σε μια προσπάθεια παρασκευής ενός
ισχυρού συμπλεκτικού αντιδραστηρίου των ιόντων ασβεστίου και άλλων μετάλλων. 'Ενα
συνθετικό ισχυρό συμπλεκτικό μέσο θα αντικαθιστούσε το ευρύτατα χρησιμοποιούμενο κιτρικό οξύ για την "αποσκλήρυνση" του ύδατος. Η Γερμανία
πραγματοποιούσε μέχρι τότε εισαγωγές μεγάλων ποσοτήτων κιτρικού οξέος που θα ήταν αδύνατον να
συνεχισθούν κατά τον επικείμενο πόλεμο.
Μια ισχυρά συμπλεκτική ουσία θα εύρισκε πολλές εφαρμογές στη βιομηχανία,
αλλά και σε διάφορα οικιακά προϊόντα (κυρίως απορρυπαντικά) για τη "χημική αποσκλήρυνση" του
ύδατος. Επιπλέον, εάν η τοξικότητα της ουσίας αυτής βρισκόταν μικρή, θα μπορούσε
να χρησιμοποιηθεί για ιατρικούς σκοπούς κυρίως ως αντίδοτο σε δηλητηριάσεις από βαρέα μέταλλα (π.χ.
Hg, Pb, Cu), αλλά και για την αντιμετώπιση παθολογικών καταστάσεων όπως η υπερασβεστιαιμία [Αναφ.
2].
Ο τρόπος σύνθεσης του EDTA, που χρησιμοποίησε ο Munz,
ήταν ιδιαίτερα απλός και βασιζόταν στην άμεση αντίδραση αιθυλενοδιαμίνης με μονοχλωροξικό οξύ
σε αλκαλικό περιβάλλον [Αναφ. 2]:
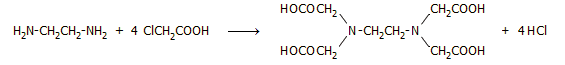
Μετά τη διαπίστωση της εξαιρετικής συμπλεκτικής
ικανότητας του EDTA αναζητήθηκαν και άλλες συνθετικές οδοί παρασκευής του σε μεγάλες ποσότητες και με χαμηλό κόστος. Σήμερα το EDTA παρασκευάζεται βιομηχανικά με βάση την ακόλουθη
αντίδραση της αιθυλενοδιαμίνης
με φορμαλδεΰδη και κυανιούχο νάτριο:
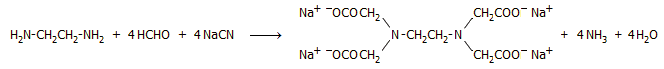
Η παραγόμενη αμμωνία απομακρύνεται για
να περιορισθεί ο σχηματισμός ως παραπροϊόντος ενός άλλου αμινοπολυκαρβοξυλικού οξέος, του νιτριλοτριοξικού οξέος (ΝΤΑ) με τύπο N(CH2COOH)3,
που αποτελεί την κυριότερη πρόσμιξη του EDTA. Με οξίνιση του μίγματος το EDTA
καθιζάνει ως σχετικά δυσδιάλυτο ελεύθερο
οξύ, ενώ το περισσότερο διαλυτό NTA παραμένει στο
διάλυμα.
Η αιθυλενοδιαμίνη αποτελεί βιομηχανική
πρώτη ύλη για την παρασκευή πλήθους χημικών προϊόντων. Η ετήσια παραγωγή
της φθάνει τους 500.000 μετρικούς τόνους (στοιχεία 1998). Παρασκευάζεται
βιομηχανικά με αντίδραση του 1,2-διχλωροαιθανίου με αμμωνία, είτε από
αιθυλενοξείδιο με καταλυτική αμμωνίωση με βάση τις ακόλουθες αντιδράσεις
[Αναφ. 3]:
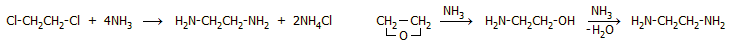
Χημικές ιδιότητες του
EDTA
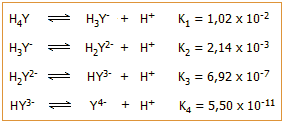 Το
EDTA ως οξύ: Το EDTA
συμπεριφέρεται ως τετραπρωτικό οξύ. Είναι ένα μέτρια ισχυρό οξύ
(τουλάχιστον ως προς τα δύο πρώτα στάδια διάστασής του) και συνήθως παριστάνεται
ως Η4EDTA
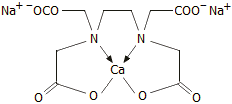
και τα διάφορα άλατά του ως π.χ. Νa2H2EDTA,
Na4EDTA,
Na2CaEDTA.
Επίσης συνηθίζεται ο απλούστερος
συμβολισμός του ως Η4Υ.
Οι ισορροπίες διάστασης του EDTA
και οι αντίστοιχες σταθερές διάστασης παρουσιάζονται παραπλεύρως.
Το
EDTA ως οξύ: Το EDTA
συμπεριφέρεται ως τετραπρωτικό οξύ. Είναι ένα μέτρια ισχυρό οξύ
(τουλάχιστον ως προς τα δύο πρώτα στάδια διάστασής του) και συνήθως παριστάνεται
ως Η4EDTA
και τα διάφορα άλατά του ως π.χ. Νa2H2EDTA,
Na4EDTA,
Na2CaEDTA.
Επίσης συνηθίζεται ο απλούστερος
συμβολισμός του ως Η4Υ.
Οι ισορροπίες διάστασης του EDTA
και οι αντίστοιχες σταθερές διάστασης παρουσιάζονται παραπλεύρως.
Θα πρέπει να σημειωθεί ότι το
EDTA συχνά αναφέρεται και ως εξαπρωτικό οξύ θεωρώντας τις πρωτονιωμένες
μορφές του (με πρωτονίωση των αμινοομάδων) ως αρχικές μορφές. 'Ετσι, η πλήρως
πρωτονιωμένη μορφή του, Η6Υ2+,
διίσταται προς Η5Υ+,
αυτή προς Η4Υ
κ.ο.κ. Οι πρωτονιωμένες μορφές υφίστανται μόνο σε ισχυρώς όξινα διαλύματα (pH<1),
όπου το EDTA δεν διαθέτει καμία συμπλεκτική ικανότητα
[Αναφ. 4α].
Οι δύο πρώτες σταθερές διάστασης είναι περίπου της
ίδιας τάξης μεγέθους. Αυτό υποδηλώνει ότι τα δύο υδρογονοκατιόντα αποσπώνται από
τις δύο άκρες του μορίου και όχι από την ίδια άκρη. Λόγω της σχετικά μεγάλης
απόστασης μεταξύ των δύο καρβοξυλίων, το αρνητικό φορτίο που δημιουργείται στο
ένα άκρο κατά την πρώτη διάσταση, δεν δυσχεραίνει ιδιαίτερα τη δεύτερη διάσταση
λόγω κουλομβικών έλξεων. Δεν ισχύει όμως το ίδιο για την τρίτη και τέταρτη
διάσταση που πραγματοποιούνται πλέον πολύ πιο δύσκολα
[Αναφ. 4β].
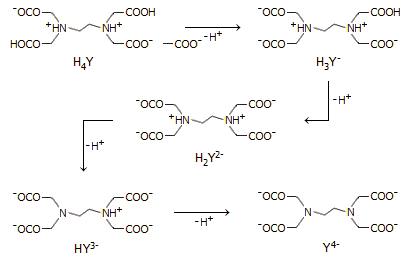
Διιόντα EDTA:
'Οταν το EDTA διαλύεται στο
νερό συμπεριφέρεται όπως τα αμινοξέα σχηματίζοντας
διιόντα (zwitterions),
δηλαδή ουδέτερα σωματίδια με θέσεις αντίθετου ηλεκτρικού φορτίου. Πρωτόνια
αποσπώνται από τις καρβοξυλικές ομάδες και δεσμεύονται από τις αμινοομάδες. Οι
πρώτες φορτίζονται αρνητικά και οι δεύτερες θετικά. Αυτό συμβαίνει και στα δύο
άκρα του μορίου που αποτελεί έτσι ένα "διπλό διιόν".
'Ετσι, στο μόριο του EDTA (H4Y)
υπάρχουν τέσσερις φορτισμένες θέσεις, δύο με θετικό και δύο με αρνητικό φορτίο
και επομένως το συνολικό φορτίο του παραμένει
μηδενικό.
Κατά τα δύο πρώτα στάδια διάστασης EDTA αποσπώνται
διαδοχικώς υδρογονοκατιόντα από τις πλήρεις καρβοξυλικές ομάδες και κατά τα δύο
τελευταία στάδια αποσπώνται τα υδρογονοκατιόντα από τις πρωτονιωμένες
αμινοομάδες. Προφανώς ότι η σωματιδιακή σύσταση ενός υδατικού διαλύματος
EDTA εξαρτάται από το pH. 'Οσο αλκαλικότερο
καθίσταται το διάλυμα (π.χ. με προσθήκη ισχυρής βάσης), τόσο διευκολύνεται η
διάσταση του οξέος και επικρατούν οι ανιοντικές μορφές, που διαθέτουν και τη
μεγαλύτερη συμπλεκτική ικανότητα. Παρακάτω δείχνονται οι
πραγματικές μορφές του EDTA
και των ιοντικών σωματιδίων του, όπως και η κατανομή των επιμέρους
σωματιδιακών μορφών του EDTA ως προς το pH του
υδατικού διαλύματος.
 |
 |
|
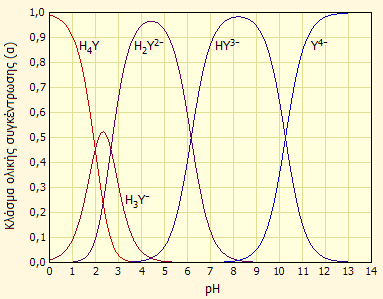
Σωματιδιακές μορφές του EDTA. |
Κατανομή των σωματιδίων του EDTA ως προς
το
pH του υδατικού διαλύματος. |
Από το διάγραμμα κατανομής φαίνεται ότι μόνο σε
ισχυρώς όξινο (pH<0) ή αλκαλικό (pH>12) περιβάλλον υφίσταται ουσιαστικά μία και
μόνη μορφή του
EDTA (Η4Υ
και Υ4-, αντιστοίχως). Σε ενδιάμεσες τιμές
pH επικρατούν 2 ή 3 ιοντικές μορφές σε ισορροπία.
Στην περιοχή pH 3 έως 6 επικρατεί το η μορφή Η2Υ2-
και στην περιοχή 7 έως 10 επικρατεί η μορφή
HY3-. Περισσότερα για τα διαγράμματα
κατανομής πολυπρωτικών οξέων και στο πώς υπολογίζονται τα διαγράμματα αυτά, όπως
και μια απλή μικροεφαρμογή (applet)
που διευκολύνει τη σχεδίασή τους, μπορούν να αναζητηθούν στην
[Αναφ. 5].
Σχηματισμός συμπλόκων μεταλλοϊόντων με το
EDTA:
Το EDTA σχηματίζει σταθερά σύμπλοκα σχεδόν με το
σύνολο των μεταλλικών κατιόντων. Η σταθερότητα των συμπλόκων αυτών οφείλεται
στις πολλές θέσεις σύνδεσης του μορίου του EDTA (μονήρη
ζεύγη ηλεκτρονίων ατόμων αζώτου και οξυγόνου), το οποίο είναι ένας τυπικός
πολυσχιδής (ή
πολυδοντικός) υποκαταστάτης (multidentate ligand).
Το μόριο του EDTA περιβάλλει σαν "κλωβός" το
μεταλλικό ιόν. Τα σύμπλοκα των μετάλλων με
πολυσχιδείς υποκαταστάτες,
χαρακτηριστικά ονομάζονται χηλωτές ενώσεις (chelates)
από την ελληνική λέξη "χηλή"
(δαγκάνα). Το EDTA είναι χηλωτικός εξασχιδής
υποκαταστάτης (hexadental chelant ή chelator) διαθέτοντας 2 θέσεις σύνδεσης
από τις αμινομάδες και 4 θέσεις σύνδεσης από τις καρβοξυλομάδες.
Παρατήρηση: Συχνότερα εμφανίζονται στη ελληνική βιβλιογραφία ως αποδόσεις
των όρων chelate, chelant ή chelator οι όροι
χηλική ένωση, χηλιωτικά μέσα κ.λπ. Ωστόσο, ορθότερες είναι οι
αποδόσεις χηλωτές ενώσεις, χηλωτικά μέσα, ως προερχόμενες από το
ρήμα χηλώ -όω (ή χηλώνω στη νέα Ελληνική). Λόγω καθιέρωσης, ο όρος
χηλική ένωση μπορεί να διατηρηθεί (βλ.
Ελληνική Εταιρεία Ορολογίας, Ορόγραμμα, 143,
Μάρτιος-Απρίλιος 2017)
[Ιούλιος 2017]
|
 |
 |
 |
|
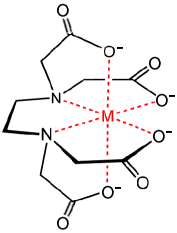
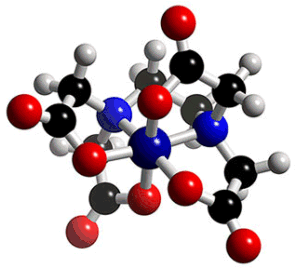
Σύμπλοκο μετάλλου Μ
με το ΕDTA. Αριστερά: θέσεις σύνδεσης. Τα σύμπλοκα αυτά είναι
"χειρόμορφα" και ορισμένα έχουν διαχωρισθεί στις εναντιομερείς
μορφές τους. Μέσον: Τυπικό μοριακό μοντέλο χηλωτής ένωσης
(chelate),
σύμπλοκο μετάλλου-EDTA. Δεξιά:
Η ονομασία προέρχεται από την ελληνική λέξη χηλή (δαγκάνα,
π.χ. ενός αστακού). |
Στα σύμπλοκά του, η μοριακή αναλογία
EDTA:μεταλλοϊόντος είναι
πάντοτε 1:1
ανεξάρτητα από το φορτίο του ιόντος του μετάλλου
και η δραστική μορφή του
EDTA είναι τετραφορτισμένο ιόν Υ4-. Το
ηλεκτρικό φορτίο του προκύπτοντος σύμπλοκου ιόντος MY
εξαρτάται από το φορτίο του μεταλλικού κατιόντος, π.χ.
Ag+
+ Y4-
 AgY3-
Ca2+
+ Y4-
AgY3-
Ca2+
+ Y4-
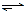 CaY2-
Al3+
+ Y4-
CaY2-
Al3+
+ Y4-
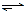 AlY-
Th4+
+ Y4-
AlY-
Th4+
+ Y4-
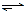 ThY0
ThY0
 Ως
σταθερά σχηματισμού (formation constant) των
συμπλόκων (ΚΜΥ)
ορίζεται η σταθερά ισορροπίας της γενικής αντίδρασης σύμπλεξης:
Ως
σταθερά σχηματισμού (formation constant) των
συμπλόκων (ΚΜΥ)
ορίζεται η σταθερά ισορροπίας της γενικής αντίδρασης σύμπλεξης:
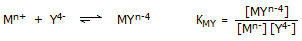
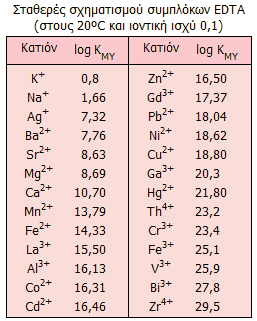
Ασταθέστερα είναι τα σύμπλοκα του
EDTA με μονοφορτισμένα κατιόντα (π.χ.
Ag+, Tl+), ενώ ουσιαστικά δεν
υφίστανται σύμπλοκα EDTA με ιόντα των αλκαλίων.
Η αποκατάσταση της ισορροπίας σύμπλεξης
μπορεί να θεωρηθεί ως ακαριαία, ωστόσο υπάρχουν ορισμένες αξιοσημείωτες
εξαιρέσεις. 'Ετσι, ο σχηματισμός των συμπλόκων του EDTA με ορισμένα
τριφορτισμένα κατιόντα (Al3+, Cr3+),
είναι βραδύς και μπορεί να χρειασθούν λίγα λεπτά ή και ώρες σε συνήθεις
θερμοκρασίες για την αποκατάσταση της ισορροπίας. Αυτό οφείλεται στο ότι σε
ουδέτερα έως και ελαφρώς όξινα διαλύματα τα κατιόντα αυτά βρίσκονται υπό
τη μορφή έντονα εφυδατωμένων πολυμερών υδροξυσυμπλόκων.
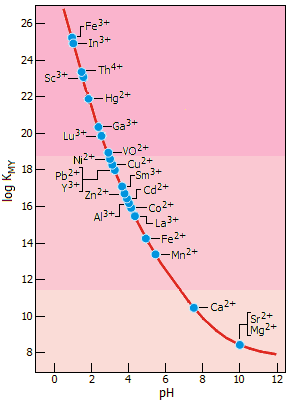
Στον παραπλεύρως πίνακα δείχνονται
ενδεικτικές τιμές των σταθερών σχηματισμού ΚΜΥ
συμπλόκων διαφόρων κατιόντων με το EDTA
[Αναφ. 4α].
|
 |
 |
|
Ελάχιστο pH επίτευξης
ικανοποιητικής ογκομέτρησης διαφόρων κατιόντων με EDTA. |
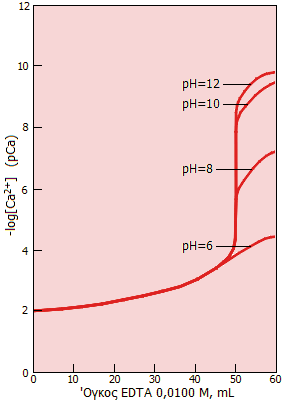
Επίδραση του pH στην ογκομέτρηση
50,0 mL διαλύματος Ca2+
0,0100 M με διάλυμα EDTA 0,0100 M. |
Συμπλοκομετρικοί
προσδιορισμοί μεταλλοϊόντων με EDTA. Η δυνατότητα του EDTA να
σχηματίζει σταθερά σύμπλοκα με τα κατιόντα μετάλλων το ανέδειξε ως
εξαιρετικά πολύτιμο αντιδραστήριο στην ποσοτική ανάλυση και ειδικά για τον
προσδιορισμό μεταλλικών ιόντων με τις ονομαζόμενες συμπλοκομετρικές
ογκομετρήσεις (complexometric titrations).
Κύριο πλεονέκτημα του EDTA είναι ο
σχηματισμός, όπως προαναφέρθηκε, "καθαρών" συμπλόκων 1:1. 'Ετσι οι καμπύλες
ογκομέτρησης εμφανίζονται "απότομες" στην περιοχή του ισοδυνάμου σημείου.
'Αλλα συμπλεκτικά αντιδραστήρια, παρόλο που σχηματίζουν σταθερά σύμπλοκα με
μεταλλοϊόντα, είναι ακατάλληλα για τις ογκομετρήσεις τους.
Αυτό οφείλεται στον διαδοχικό σχηματισμό συμπλόκων με αυξανόμενη μοριακή
αναλογία υποκαταστάτη:μεταλλοϊόντος. Για παράδειγμα, η ογκομέτρηση Cd2+
με
CN-, θα έδινε διαδοχικά τα σύμπλοκα
CdCN+, Cd(CN)20,
Cd(CN)3-,
Cd(CN)42-
με αποτέλεσμα τη σταδιακή σύμπλεξη των
ιόντων Cd2+ και την απουσία σαφούς
"ισοδυνάμου σημείου" κατά την ογκομέτρηση.
'Ενα ακόμη σημαντικό πλεονέκτημά του
EDTA είναι η διάθεση στο εμπόριο του εξαιρετικά καθαρού άλατός του Na2H2EDTA·2H2O
(κάποιες από τις εμπορικές ονομασίες του άλατος αναλυτικής ποιότητας είναι
Titriplex III και Complexone III). Αυτό το "δινάτριο" άλας του EDTA μπορεί
να ξηρανθεί στους 80ºC, οπότε τυχόν
περίσσεια ύδατος (υγρασίας) απομακρύνεται, ενώ δεν απομακρύνονται τα 2 μόρια
ύδατος εφυδάτωσης. Το
Na2H2EDTA·2H2O μπορεί να
χρησιμοποιηθεί ως πρωτογενές πρότυπο (με καθαρότητα 99,8-100,2%) για την
άμεση παρασκευή πρότυπου διαλύματός του.
Η δυνατότητα
ογκομετρικού προσδιορισμού ενός μεταλλοϊόντος με EDTA εξαρτάται από τη
σταθερότητα του σχηματιζόμενου συμπλόκου. Η
δραστική μορφή του
EDTA, το τετραφορτισμένο ιόν
Υ4-, επικρατεί στις υψηλές τιμές pH, επομένως όσο αλκαλικότερο
είναι το ογκομετρούμενο διάλυμα, τόσο "σαφέστερο" θα είναι το ισοδύναμο
σημείο. Ωστόσο, αύξηση του pH του ογκομετρούμενου διαλύματος μπορεί να
προκαλέσει καθίζηση του μεταλλοϊόντος ως π.χ. δυσδιάλυτου υδροξειδίου. Για
τον λόγο αυτό η ογκομέτρηση εκτελείται σε τιμή pH που συμβιβάζει τις
προηγούμενες απαιτήσεις.
Το pH των ογκομετρούμενων διαλυμάτων
ρυθμίζεται με ρυθμιστικά συστήματα που συμπλέκουν ελαφρά τα μεταλλικά ιόντα
και δεν προκαλούν καθίζηση δυσδιάλυτων ενώσεων των μετάλλων. Κατάλληλο
ρυθμιστικό διάλυμα είναι π.χ. το σύστημα ΝΗ3-NH4Cl,
όχι όμως συστήματα φωσφορικών ή ανθρακικών αλάτων που θα οδηγούσαν σε
καθίζηση δυσδιάλυτων φωσφορικών ή ανθρακικών αλάτων των μετρούμενων
μεταλλοϊόντων.
Στα παραπλεύρως διαγράμματα δείχνεται η
επίδραση του pH στις ογκομετρήσεις με EDTA.
Αριστερά δείχνεται το ελάχιστο pH αποτελεσματικής ογκομέτρησης για διάφορα
μεταλλοϊόντα. Το pH αυτό είναι μικρό για μεταλλοϊόντα που σχηματίζουν
σταθερά σύμπλοκα (π.χ. Fe3+, Hg2+,
Pb2+) και αρκετά υψηλό για ιόντα που
σχηματίζουν λιγότερο σταθερά σύμπλοκα (π.χ. Ca2+, Mg2+).
Δεξιά δείχνεται η καμπύλη ογκομέτρησης ιόντων ασβεστίου σε διαφορετικά pH.
Είναι προφανές ότι σε pH 6 το ισοδύναμο σημείο δεν είναι σαφές, ενώ η
ογκομέτρηση μπορεί να εκτελεστεί από pH 8
και πάνω.
Το EDTA
είναι "γενικό" συμπλεκτικό αντιδραστήριο, ωστόσο
σε πολλές περιπτώσεις μπορεί να χρησιμοποιηθεί για τον ογκομετρικό
προσδιορισμό πολλών μεταλλοϊόντων στο ίδιο διάλυμα. Η επίτευξη της
επιλεκτικότητας βασίζεται στην επίδραση που ασκεί το
pH στην ογκομέτρηση ως και η παρουσία άλλων ανταγωνιστικών
συμπλεκτικών μέσων. Για παράδειγμα, κατά την ογκομέτρηση μίγματος
Zn2+
και Mg2+
σε pH 7 ογκομετρούνται μόνο τα ιόντα
Zn2+. Εάν στο ίδιο μίγμα προστεθεί
περίσσεια CN- και το
pH του ρυθμιστεί στην περιοχή του 12
μπορούν να ογκομετρηθούν μόνο τα ιόντα Mg2+.
Αυτό οφείλεται στο ότι τα κυανιούχα ιόντα δρουν ως επικαλυπτικό μέσο
(masking agent) των ιόντων
Zn2+, αφού
μόνο αυτά σχηματίζουν σταθερά κυανιούχα σύμπλοκα. Ανάλογα, ιόντα Mg2+
μπορούν να ογκομετρηθούν επιλεκτικά παρουσία ιόντων Al3+,
αν προστεθεί περίσσεια ιόντων F-, τα
οποία δεσμεύουν μόνο τα ιόντα Al3+
προς σταθερά φθοριοσύμπλοκα.
|
Χημική "επικάλυψη" και
"αποκάλυψη"
 Ως
επικάλυψη (masking) ορίζεται η διεργασία κατά την οποία μια ουσία,
χωρίς φυσικό διαχωρισμό της ίδιας ή των προϊόντων αντίδρασής της,
μετατρέπεται σε μια άλλη που δεν υπεισέρχεται σε μια δεδόμενη αντίδραση.
Ως αποκάλυψη (demasking) ορίζεται η διεργασία κατά την οποία μια
ουσία που έχει υποστεί επικάλυψη, επαναποκτά τη δυνατότητα συμμετοχής
της σε
μια δεδομένη αντίδραση. Τυπικό παράδειγμα αποτελεί η χρήση κυανιούχων ως
επικαλυπτικού μέσου (masking agent) των ιόντων ψευδαργύρου (και πολλών
άλλων μετάλλων) κατά τις ογκομετρήσεις με EDTA: Ως
επικάλυψη (masking) ορίζεται η διεργασία κατά την οποία μια ουσία,
χωρίς φυσικό διαχωρισμό της ίδιας ή των προϊόντων αντίδρασής της,
μετατρέπεται σε μια άλλη που δεν υπεισέρχεται σε μια δεδόμενη αντίδραση.
Ως αποκάλυψη (demasking) ορίζεται η διεργασία κατά την οποία μια
ουσία που έχει υποστεί επικάλυψη, επαναποκτά τη δυνατότητα συμμετοχής
της σε
μια δεδομένη αντίδραση. Τυπικό παράδειγμα αποτελεί η χρήση κυανιούχων ως
επικαλυπτικού μέσου (masking agent) των ιόντων ψευδαργύρου (και πολλών
άλλων μετάλλων) κατά τις ογκομετρήσεις με EDTA:
|
Κάλυψη ιόντων ψευδαργύρου:
Zn2+ + 4 CN-
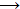 [Zn(CN)4]2-
[Zn(CN)4]2-
|
Τα ιόντα ψευδαργύρου μπορούν
να αποκαλυφθούν, εάν στη συνέχεια προστεθεί περίσσεια φορμαλδεΰδης η
οποία δρα ως
αποκαλυπτικό μέσο (demasking agent) σύμφωνα με την αντίδραση:
|
Αποκάλυψη ιόντων ψευδαργύρου:
[Zn(CN)4]2-
+ 4 HCHO + 4H+
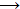 Zn2+
+ 4 HOCH2CN
Zn2+
+ 4 HOCH2CN
|
|
Στις συμπλοκομετρικές ογκομετρήσεις το
ισοδύναμο σημείο εντοπίζεται συνήθως οπτικά με τους ονομαζόμενους
μεταλλοχρωμικούς δείκτες ή ποτενσιομετρικά, με καταγραφή του δυναμικού
ενδεικτικού ηλεκτροδίου (π.χ. εκλεκτικό ηλεκτρόδιο ή ηλεκτρόδιο 1ου είδους)
αποκρινόμενου στην ενεργότητα του ογκομετρούμενου κατιόντος. Τα πρότυπα
διαλύματα EDTA πρέπει να φυλάσσονται σε πλαστικές φιάλες, επειδή σε υάλινες
φιάλες ο τίτλος τους υφίσταται μια αργή αλλά συνεχή μείωση λόγω απόσπασης
ιόντων (κυρίως) ασβεστίου από την ύαλο. Περισσότερα για τις συμπλοκομετρικές
ογκομετρήσεις με EDTA μπορούν να αναζητηθούν
στα συγγράμματα της [Αναφ. 4].
|
Μεταλλοχρωμικοί δείκτες
Οι μεταλλοχρωμικοί δείκτες
(metallochromic indicators) είναι οργανικές
χρωστικές ουσίες που σχηματίζουν χηλωτές ενώσεις με μεταλλικά ιόντα. Με
τους μεταλλοχρωμικούς δείκτες εντοπίζεται εύκολα το ισοδύναμο σημείο των
συμπλοκομετρικών ογκομετρήσεων με EDTA.
Οι σχηματιζόμενες χηλωτές ενώσεις έχουν χρώμα διαφορετικό από εκείνο του
ελεύθερου δείκτη. H σταθερότητα των χηλωτών ενώσεων μεταλλοϊόντος-δείκτη
πρέπει είναι κατά πολύ μικρότερη από τη σταθερότητα των χηλωτών ενώσεων
των μεταλλοϊόντων-EDTA, αρκετή όμως για να
συμπλεχθεί ποσοτικά με το ογκομετρούμενο μεταλλοϊόν πριν ξεκινήσει η
ογκομέτρηση.
Μικρή ποσότητα μεταλλοχρωμικού δείκτη
προστίθεται στο υπό ογκομέτρηση διάλυμα του μεταλλοϊόντος, οπότε το
διάλυμα αποκτά το χρώμα του συμπλόκου μεταλλοϊόντος-δείκτη και στη
συνέχεια αρχίζει η προσθήκη του πρότυπου διαλύματος
EDTA. Η πρώτη περίσσεια EDTA αποσπά το
μεταλλοϊόν από το σύμπλοκό του με τον δείκτη και το διάλυμα αποκτά το
χρώμα του ελεύθερου μεταλλοχρωμικού δείκτη, σηματοδοτώντας το τελικό
σημείο της ογκομέτρησης.
 |
 |
 |
 |
|
Gerold Karl
Schwarzenbach
(1904-1978) |
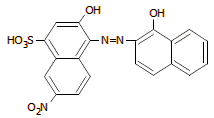
Μέλαν Εριόχρωμα Τ
(ΕΒΤ) |
Αριστερά: χρώμα
διαλύματος συμπλόκου ΕΒΤ-μεταλλοϊόντος. Δεξιά: χρώμα διαλύματος
ελεύθερου EBT. |
Η
ανακάλυψη των μεταλλοχρωμικών δεικτών υπήρξε αποτέλεσμα παρατήρησης
της αλλαγής χρώματος διαλύματος EBT, όταν αναμίχθηκε με νερό της
βρύσης σε νιπτήρα.
|
Το Mέλαν
Eριόχρωμα Τ (Eriochrome
Black T, EBT) αποτελεί τυπικό παράδειγμα μεταλλοχρωμικού δείκτη.
Διάλυμα ελεύθερου EBT
έχει
γαλάζιο
χρώμα, ενώ τα σύμπλοκά του με μεταλλοϊόντα
έχουν ένα οινέρυθρο χρώμα. 'Ετσι η τυπική αλληλουχία αντιδράσεων κατά
την ογκομέτρηση μεταλλοϊόντων (π.χ. ψευδαργύρου)
με EDTA
παρουσία EBT έχει ως εξής
[Αναφ. 6]:
|
Αντίδραση δείκτη:
Zn2+ (άχρωμο) +
ΕΒΤ (γαλάζιο)
 [Zn2+-
ΕΒΤ] (οινέρυθρο)
[Zn2+-
ΕΒΤ] (οινέρυθρο)
Κύρια ογκομέτρηση:
Zn2+ (άχρωμο)
+
EDTA (άχρωμο)
 [Zn2+-
EDTA]
(άχρωμο)
[Zn2+-
EDTA]
(άχρωμο)
Τελικό σημείο:
[Zn2+-
ΕΒΤ] (οινέρυθρο)
+
EDTA (άχρωμο)
 [Zn2+-
EDTA]
(άχρωμο) + ΕΒΤ (γαλάζιο)
[Zn2+-
EDTA]
(άχρωμο) + ΕΒΤ (γαλάζιο)
|
'Εχουν εξετασθεί τουλάχιστον
200 διαφορετικές οργανικές ενώσεις ως μεταλλοχρωμικοί δείκτες για
ογκομετρήσεις με EDTA και ανάλογες ενώσεις.
Πρωτοπόρος στην έρευνα πάνω στις αναλυτικές εφαρμογές του
EDTA υπήρξε ο
Ελβετός χημικός
Gerold Karl Schwarzenbach,
Καθηγητής Ανόργανης και Αναλυτικής Χημείας στο Πανεπιστήμιο της Ζυρίχης
(ΕΤΗ) [Schwarzenbach G, Biedermann W, Helv. Chim. Acta, 31:687, 1948].
|
'Αλλα αμινοπολυκαρβοξυλικά οξέα στη χημική ανάλυση. Στο εμπόριο
διατίθεται μια σειρά αμινοπολυκαρβοξυλικών οξέων με παρόμοιες δραστικές
ομάδες με εκείνες του EDTA. Παρακάτω παρουσιάζονται οι τύποι των κυριότερων
αμινοπολυκαρβοξυλικών οξέων που έχουν εξετασθεί ως χηλωτικοί υποκαταστάτες για
συμπλοκομετρικές ογκομετρήσεις διαφόρων μεταλλοϊόντων.
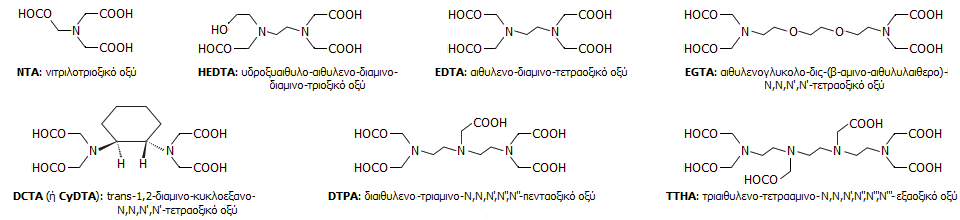
Το NTA
είναι τετρασχιδής υποκαταστάτης, το HEDTA είναι
πεντασχιδής,
τα EDTA και DCTA εξασχιδείς,
το DTPA και το EGTA είναι οκτασχιδείς
υποκαταστάτες (τα αιθερικά οξυγόνα στο EGTA διαθέτουν ζεύγη ηλεκτρονίων, οπότε μπορούν να δράσουν ως θέσεις
σύνδεσης) και το ΤΤΗΑ μπορεί να δράσει ως δεκασχιδής υποκαταστάτης. 'Ολα τα
παραπάνω αμινοπολυκαρβοξυλικά οξέα σχηματίζουν σύμπλοκα με μοριακή αναλογία υποκαταστάτη:μεταλλοϊόντος 1:1, εκτός από το ΝΤΑ το οποίο σχηματίζει σύμπλοκα με
μοριακή αναλογία υποκαταστάτη:μεταλλοϊόντος 2:1.
Καθένα από αυτά τα παραπάνω
αμινοπολυκαρβοξυλικά οξέα παρουσιάζει
κάποια ιδιαίτερα χαρακτηριστικά, π.χ. το EGTA, σε
αντίθεση με το EDTA, σχηματίζει πολύ σταθερότερο
σύμπλοκο με το ασβέστιο (logKCa-EGTA
= 11,0) παρά με το μαγνήσιο
(logKMg-EGTA
= 5,2), οπότε χρησιμοποιείται για την επιλεκτική
ογκομέτρηση ιόντων Ca2+ παρουσία ιόντων
Mg2+, π.χ. στον ορό αίματος
[Αναφ. 4δ].
Εφαρμογές του EDTA
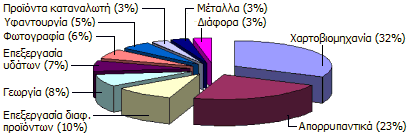 Η
ετήσια παραγωγή του EDTA
είναι περίπου 100.000 μετρικοί τόνοι, από τους οποίους 35.000 τόνοι
παράγονται στην Ευρώπη. Προσφέρεται στο εμπόριο με διάφορα εμπορικά ονόματα (Celon
A, Gluma cleanser, Nervanaid B acid, Trilon BS, Versene,
Vinkei 1000, YD-30, Dissolvine Z). Στο παραπλεύρως διάγραμμα
παρουσιάζονται οι κυριότερες χρήσεις των αμινοπολυκαρβοξυλικών οξέων
[Αναφ. 7]. Σχεδόν σε όλες τις περιπτώσεις το EDTA
χρησιμοποιείται για τη δέσμευση μεταλλικών ιόντων που κατά τον ένα ή άλλο τρόπο
θα δημιουργούσαν κάποιο πρόβλημα. Μια γενική παρουσίαση των εφαρμογών του EDTA
παρέχεται στην
[Αναφ. 8].
Η
ετήσια παραγωγή του EDTA
είναι περίπου 100.000 μετρικοί τόνοι, από τους οποίους 35.000 τόνοι
παράγονται στην Ευρώπη. Προσφέρεται στο εμπόριο με διάφορα εμπορικά ονόματα (Celon
A, Gluma cleanser, Nervanaid B acid, Trilon BS, Versene,
Vinkei 1000, YD-30, Dissolvine Z). Στο παραπλεύρως διάγραμμα
παρουσιάζονται οι κυριότερες χρήσεις των αμινοπολυκαρβοξυλικών οξέων
[Αναφ. 7]. Σχεδόν σε όλες τις περιπτώσεις το EDTA
χρησιμοποιείται για τη δέσμευση μεταλλικών ιόντων που κατά τον ένα ή άλλο τρόπο
θα δημιουργούσαν κάποιο πρόβλημα. Μια γενική παρουσίαση των εφαρμογών του EDTA
παρέχεται στην
[Αναφ. 8].
Χαρτοβιομηχανία: Οι μεγαλύτερες ποσότητες του EDTA χρησιμοποιούνται
στις βιομηχανίες χαρτοπολτού και χάρτου. Το EDTA (μαζί
με το DTPA) δεσμεύει μικροποσότητες μεταλλοϊόντων, τα οποία αν παραμείνουν στον
χαρτοπολτό δυσχεραίνουν τη διαδικασία λεύκανσής του με H2O2,
προκαλώντας την καταλυτική του διάσπαση. Σημειώνεται ότι ο αποχρωματισμός του
χαρτοπολτού με Η2Ο2
αντικαθιστά την παλαιότερη μέθοδο αποχρωματισμού με χλώριο, όπου τα μεταλλοϊόντα
δεν αποτελούσαν πρόβλημα [Αναφ. 9].
Απορρυπαντικά:
Μεγάλες ποσότητες EDTA χρησιμοποιούνται στην παραγωγή απορρυπαντικών
βιομηχανικής, οικιακής και νοσοκομειακής χρήσης, όπως και στα καθαριστικά
αυτοκινήτων. Ο ρόλος του EDTA είναι πολλαπλός: δεσμεύει τα ιόντα Ca2+
και Mg2+ από τα "σκληρά" φυσικά ύδατα, τα οποία αντιδρώντας με τα
ανιοντικά απορρυπαντικά θα εξουδετέρωναν την απορρυπαντική τους δράση, επιπλέον
σταθεροποιεί τα υπερβορικά άλατα (λευκαντικοί παράγοντες) δεσμεύοντας μεταλλικά
ιχνοστοιχεία που θα κατέλυαν τη διάσπασή τους. Ακόμη αποτρέπει το σχηματισμό
ασβεστούχων αποθέσεων (scales), που θα καταστρέφανε μηχανικά συστήματα
(πλυντήρια) ή θα απέφρασαν σωληνώσεις και θα αχρήστευαν εναλλάκτες θερμότητας σε
βιομηχανικές εγκαταστάσεις.
|
EDDS |
'Ιδια δράση με το
EDTA παρέχουν και τα πολυφωσφορικά άλατα, αλλά για να αποφευχθούν τα
φαινόμενα ευτροφισμού από απόβλητα πλούσια σε φωσφορικά,
καταβάλλεται προσπάθεια αντικατάστασής τους με άλατα αμινοπολυκαρβοξυλικών
οξέων. Η σχετικά μικρή ταχύτητα διάσπασης του EDTA στο περιβάλλον σε συνδυασμό
με την ικανότητά του να αποσπά τοξικά μέταλλα που είχαν παγιδευτεί σε ιζήματα
και να τα επαναφέρει στο περιβάλλον, έχει οδηγήσει σε απαγορεύσεις της χρήσης
του και στην αντικατάστασή του (τουλάχιστον στα απορρυπαντικά βιομηχανικής
χρήσης) με άλλες ταχύτερα διασπώμενες συμπλεκτικές ενώσεις, όπως το
αιθυλενοδιαμινο-Ν,Ν'-διηλεκτρικό οξύ (ethylene diamino-N,N'-disuccinic acid,
EDDS) [Αναφ. 10].
Τρόφιμα - Φάρμακα -
Γεωργικά προϊόντα: Το
EDTA έχει εγκριθεί από την Υπηρεσία Τροφίμων και Φαρμάκων των ΗΠΑ (Food
and Drug Administration,
FDA) ως συντηρητικό σε πακεταρισμένα τρόφιμα, σε βιταμίνες και σε
παιδικές τροφές. Προστίθεται ως σταθεροποιητής, για να προλάβει την αλλοίωσή
τους λόγω οξειδωτικών αλλοιώσεων που καταλύονται από ελεύθερα μεταλλικά ιόντα.
'Ετσι το πρόσθετο (Ε-ουσία) Ε385 είναι το άλας Na2CaEDTA
και το Ε386 είναι το Na2H2EDTA.
Τυπικά αυτές οι Ε-ουσίες χαρακτηρίζονται ως "συμπλεκτικά μέσα" (sequestrants,
to sequester: αποσπώ, διαχωρίζω).
|

Ιχνοστοιχεία ως σύμπλοκα
με EDTA διατίθενται σε μορφή υδατοδιαλυτής
σκόνης και χρησιμοποιούνται για τη θεραπεία τροφοπενιών ή και
προληπτικά σε φυτοκαλλιέργειες. |
EDTA προστίθεται στα καλλυντικά για να βελτιώσει
τη σταθερότητά τους. Στα προϊόντα καταναλωτή (τρόφιμα και φαρμακευτικά
σκευάσματα), όπως και στα καθαριστικά διαλύματα φακών επαφής για να αποφευχθεί η
θόλωση των φακών από αποθέσεις αλάτων του ασβεστίου. Στη βιομηχανία προϊόντων
γάλακτος και μπύρας χρησιμοποιείται για τον καθαρισμό κηλίδων από τις φιάλες
γάλακτος και μπύρας.
Το EDTA
προστίθεται σε αναψυκτικά που περιέχουν ασκορβικό οξύ και βενζοϊκό νάτριο (ως
συντηρητικό) για να δεσμεύσει ιχνοποσότητες ιόντων Cu2+. 'Εχει
αναφερθεί ότι τα ιόντα Cu2+ καταλύουν την αποκαρβοξυλίωση των
βενζοϊκών από το ασκορβικό με σχηματισμό ιχνοποσοτήτων καρκινογόνου βενζολίου (C6H5COOH
 C6H6
+ CO2)
[Αναφ. 11].
C6H6
+ CO2)
[Αναφ. 11].
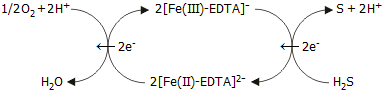 Στη γεωργία το EDTA χρησιμοποιείται για την εισαγωγή συμπληρωμάτων στοιχείων και
ιχνοστοιχείων στα λιπάσματα με τη μορφή υδατοδιαλυτών σταθερών και καλύτερα
προσλαμβανόμενων συμπλόκων. Ιχνοστοιχεία στη μορφή συμπλόκων με EDTA μπορούν να
προσληφθούν εύκολα μέσω του φυλλώματος του φυτού [Αναφ.
12].
Στη γεωργία το EDTA χρησιμοποιείται για την εισαγωγή συμπληρωμάτων στοιχείων και
ιχνοστοιχείων στα λιπάσματα με τη μορφή υδατοδιαλυτών σταθερών και καλύτερα
προσλαμβανόμενων συμπλόκων. Ιχνοστοιχεία στη μορφή συμπλόκων με EDTA μπορούν να
προσληφθούν εύκολα μέσω του φυλλώματος του φυτού [Αναφ.
12].
Διάφορες
βιομηχανικές εφαρμογές. Ενδιαφέρον παρουσιάζει το σύστημα
Fe(II)-EDTA/Fe(III)-EDTA. Το σύμπλοκο Fe(III)-EDTA
δρα ως "αναγεννώμενο" και "περιβαλλοντικά φιλικό" ήπιο οξειδωτικό μέσο.
Ουσιαστικά δρα ως καταλύτης οξείδωσης πολλών χημικών ρύπων από το ατμοσφαιρικό
οξυγόνο. 'Ετσι, π.χ. χρησιμοποιείται για την απαλλαγή βιομηχανικών απαερίων από
το υδρόθειο αναγόμενο προς Fe(II)-EDTA, το οποίο εύκολα επανοξειδώνεται προς
Fe(III)-EDTA από το οξυγόνο του αέρα, σύμφωνα με τον παραπλεύρως κύκλο. Η
διαδικασία πραγματοποιείται σε ουδέτερο έως ελαφρά αλκαλικό περιβάλλον. Το
σύστημα απλών αλάτων Fe(III)/Fe(II) δεν θα παρείχε ικανοποιητικά αποτελέσματα,
λόγω καθίζησης του σιδήρου ως Fe(OH)3
και FeS. Το σύμπλοκο Fe(III)-EDTA
χρησιμοποιείται για την οξειδωτική διαλυτοποίηση των κόκκων αργύρου από τα
φωτογραφικά φιλμ. Ανάλογο σύστημα χρησιμοποιείται σε βιοκαθαρισμούς και για την
απομάκρυνση των οξειδίων αζώτου (ΝΟx) κατά τον
καθαρισμό απαερίων (καυσαερίων, flue gases)
[Αναφ. 13].
 Στη βιομηχανία πετρελαίου, προστίθεται στο σημείο
της εξόρυξης για να παρεμποδίσει αποθέσεις στις σωληνώσεις. Εκτιμάται ότι σε μια
πλατφόρμα εξόρυξης πετρελαίου χρησιμοποιείται ένας τόνος
EDTA την ημέρα για τους σχετικούς καθαρισμούς [Αναφ.
8].
Στη βιομηχανία πετρελαίου, προστίθεται στο σημείο
της εξόρυξης για να παρεμποδίσει αποθέσεις στις σωληνώσεις. Εκτιμάται ότι σε μια
πλατφόρμα εξόρυξης πετρελαίου χρησιμοποιείται ένας τόνος
EDTA την ημέρα για τους σχετικούς καθαρισμούς [Αναφ.
8].
Στην υφαντουργία χρησιμοποιείται για δέσμευση του ασβεστίου από το νερό
επιτρέποντας στα διάφορα "στερεωτικά" χρωμάτων ή προστύμματα (mordants)
να δράσουν ομαλά χωρίς να δημιουργούν τοπικές κηλίδες χρωμάτων κατά τη βαφή
[Αναφ. 14].
Το
EDTA στην ιατρική: To EDTA έχει χρησιμοποιηθεί με επιτυχία σε
περιπτώσεις δηλητηριάσεων από βαρέα μέταλλα. Ενώ τα ελεύθερα ιόντα των βαρέων
μετάλλων έχουν καταστρεπτικές ιδιότητες συνδεόμενα με πρωτεΐνες, αναστέλλοντας
τη λειτουργία τους ή καταστρέφοντάς τις, έχει διαπιστωθεί ότι χάρις στην
εξαιρετική σταθερότητά τους, τα σύμπλοκά τους με το EDTA έχουν περιορισμένη έως
και μηδενική τοξικότητα και μπορούν να απομακρυνθούν από το αίμα μέσω των
νεφρών.
 |
 |
|
Παρασκευάσματα με EDTA για χρήση σε
ενδοδοντικές θεραπείες |
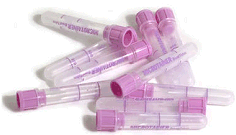
Φιαλίδια αιμοληψίας
250-500 μL με
0,8 mg K2H2EDTA. |
Η χορήγηση EDTA σε
περιπτώσεις δηλητηριάσεων
από βαρέα μέταλλα (κυρίως Pb και Hg) είναι μια γνωστή και επιτυχημένη
ιατρική πρακτική. Στους ασθενείς χορηγείται ενδοφλεβίως διάλυμα της χηλωτής
ένωσης του EDTA
με ασβέστιο (Na2CaEDTA)
για να αποφευχθεί η απασβεστίωση του
οργανισμού, που θα προέκυπτε εάν χορηγούταν το απλό άλας του
EDTA με νάτριο (Na2H2EDTA).
'Ετσι, στον οργανισμό
πραγματοποιείται αντίδραση αντικατάστασης (π.χ. CaEDTA2-
+ Pb2+
 PbEDTA2- + Ca2+) και το βαρύ μέταλλο (λόγω
μεγαλύτερης σταθεράς σχηματισμού ΚΜΥ)
αντικαθιστά το ασβέστιο στο σύμπλοκο και απομακρύνεται από τον οργανισμό ως
αβλαβές σταθερό σύμπλοκο [Αναφ.
15].
PbEDTA2- + Ca2+) και το βαρύ μέταλλο (λόγω
μεγαλύτερης σταθεράς σχηματισμού ΚΜΥ)
αντικαθιστά το ασβέστιο στο σύμπλοκο και απομακρύνεται από τον οργανισμό ως
αβλαβές σταθερό σύμπλοκο [Αναφ.
15].
Πέραν της γενικά αποδεκτής χρήσης του EDTA για την
αποτοξίνωση του οργανισμού από βαρέα μέταλλα, έχει προταθεί από πολλούς (από το
1960) η ονομαζόμενη θεραπεία χήλωσης (chelation therapy). Πρόκειται για
μια συντηρητική θεραπεία κατά την οποία χορηγούνται σε τακτά διαστήματα μικρές
ποσότητες ελεύθερου EDTA με σκοπό την απομάκρυνση αποθέσεων ασβεστίου από τις
αρτηρίες, ώστε να προληφθεί η αρτηριοσκλήρωση, αλλά και τοξικών μεταλλοϊόντων
που έχουν τάση συσσώρευσης στον οργανισμό προκαλώντας ποικιλία προβλημάτων. Τα
αποτελέσματα της θεραπείας αυτής έχουν αμφισβητηθεί από την ευρύτερη ιατρική
επιστημονική κοινότητα και η θεραπεία αυτή έχει ενταχθεί στις ονομαζόμενες
εναλλακτικές ιατρικές μεθόδους (ομοιοπαθητική, βελονισμός κ.α.), που ωστόσο
διαθέτουν πολλούς οπαδούς [Αναφ. 15γ].
Στην οδοντιατρική χρησιμοποιούνται πυκνά διαλύματα
EDTA (μέχρι και 17-18% σε ουδέτερο ρυθμιστικό διάλυμα) ή σε μορφή ζελέ, για τον
καθαρισμό του οδοντικού ριζικού σωλήνα (root canal) κατά τις ενδοδοντικές
θεραπείες [Αναφ. 15δ].
Το σύμπλοκο με EDTA του
γ-ραδιενεργού ισοτόπου Cr-51 (χρόνος υποδιπλασιασμού: 27,8 ημέρες), χρησιμοποιείται για
την εκτίμηση της σπειραματικής διήθησης των νεφρών (glomerular
filtration rate) [Αναφ. 16].
Στα βιοχημικά εργαστήρια χρησιμοποιείται ως
αντιπηκτικός παράγοντας (anticoagulant)
(εμποδίζει τη θρόμβωση) σε δείγματα αίματος όπως και σε αναλυτικά όργανα
εξέτασης αίματος. Η δράση του βασίζεται στη δέσμευση των ιόντων ασβεστίου που
εμπλέκονται στον μηχανισμό πήξης του αίματος. Συνήθως, οι σωλήνες αιμοληψίας
περιέχουν μικρή ποσότητα στερεού άλατος EDTA (K2H2EDTA,
K3HEDTA,
Na2H2EDTA).
Ποτέ όμως δεν χορηγείται EDTA ως αντιθρομβωτικό φάρμακο
[Αναφ. 17].
|
Εμπλοκή του EDTA σε μια διάσημη δικαστική διαμάχη: Υπόθεση O.J. Simpson
[Αναφ. 18]
|

Orenthal James "O.J." Simpson |
O O.J. Simpson, διάσημος Αμερικανός πρώην παίκτης αμερικανικού
ποδοσφαίρου και ηθοποιός, κατηγορήθηκε για τον φόνο της πρώην συζύγου
του Nicole Brown
Simpson και του φίλου της
Ronald Lyle Goldman
τον Ιούνιο του 1994. Η δίκη
που ακολούθησε έμελλε να είναι μια από τις πιο πολύπλοκες και διάσημες
δικαστικές διαμάχες στα δικαστικά χρονικά των ΗΠΑ. Η δίκη διήρκεσε
περισσότερο από οκτώ μήνες (25/1/1995 έως 3/10/1995) και προκάλεσε
παγκόσμιο ενδιαφέρον. Κατά τη διάρκεια της δίκης παρουσιάστηκαν πολλά
εγκληματολογικά ευρύματα και κατέθεσαν πολλοί ειδικοί επιστήμονες σε
θέματα ιατροδικαστικής χημείας.
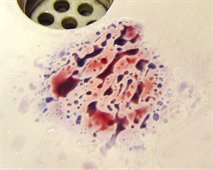
'Ενα από τα κύρια
ενοχοποιητικά στοιχεία ήταν κηλίδες αίματος που συλλέχθηκαν από τον τόπο
του εγκλήματος. Με τεχνικές DNA, που μόλις τότε είχαν αρχίσει να
χρησιμοποιούνται στα εγκληματολογικά εργαστήρια, το αίμα πιστοποιήθηκε
ότι ανήκε στον Simpson και επομένως αποδείκνυε τη φυσική παρουσία του
στον τόπο του εγκλήματος κατά την ημέρα του φόνου. Ωστόσο τα πράγματα
πήραν μια περίεργη τροπή.
Χημική ανάλυση των
ενοχοποιητικών δειγμάτων αίματος (με την τεχνική LC/MS/MS) έδειξε την
παρουσία σε αυτά μικρών ποσοτήτων EDTA. Το EDTA
δεν αποτελεί φυσικό συστατικό του αίματος,
αλλά συνήθως προστίθεται σε δείγματα αίματος μετά την αιμοληψία
για να προληφθεί η πήξη του.
Την παρουσία EDTA στα
δείγματα αίματος αξιοποίησε αμέσως η υπεράσπιση του Simpson. Οι
συνήγοροί του ισχυρίστηκαν ότι αυτά τα δείγματα αίματος προέρχονταν από
την αιμοληψία που είχε γίνει από τις ιατροδικαστικές αρχές στον Simpson.
Ισχυρίστηκαν πως ποσότητα αίματος από τα δείγματα είχε υποκλαπεί από
τους αστυνομικούς και σκόπιμα "φυτεύτηκε" στον τόπο του εγκλήματος για
να χρησιμοποιηθεί ως ενοχοποιητικό στοιχείο κατά του Simpson.
Γεγονός είναι ότι η
συγκέντρωση του EDTA στο ενοχοποιητικό δείγμα αίματος ήταν κατά πολύ
χαμηλότερη από εκείνη που θα αναμενόταν αν είχε προστεθεί ως
αντιπηκτικό. Οι κατήγοροι αντέτειναν ότι το EDTA αυτό μπορεί να
προερχόταν από την κατανάλωση τροφών (που περιείχαν EDTA ως
συντηρητικό), είτε από απορρυπαντικά τα οποία είχαν χρησιμοποιηθεί για τα
ρούχα που φορούσε ο Simpson την ημέρα του διπλού φόνου. Οι ισχυρισμοί
των κατηγόρων δεν έγιναν δεκτοί και το γεγονός αυτό σε συνδυασμό με
άλλες καταστάσεις, που αξιοποίησε με επιτυχία η υπεράσπιση, είχαν ως αποτέλεσμα την αθώωση του Simpson,
παρά τις άλλες ενδείξεις σε βάρος του.
Εκ των υστέρων, οι χημικοί
του FBI διετύπωσαν την άποψη ότι τα ίχνη EDTA, τα οποία συνέβαλλαν στην
αθώωση του O.J. Simpson, οφείλονταν σε επιμόλυνση εκ μεταφοράς (carry
over) του χρησιμοποιηθέντος οργάνου LC/MS/MS
[Αναφ. 18δ]. |
Τοξικότητα του EDTA
Τοξικολογικές έρευνες έδειξαν ότι το
EDTA
δρα ως κυτταροτοξική (cytotoxic)
και ασθενώς γονοτοξική (mutagenic) ουσία σε
πειραματόζωα, όχι όμως ως καρκινογόνο. Η λήψη EDTA
από το στόμα έχει αποδειχθεί ότι
προκαλεί αναπαραγωγικά και αναπτυξιακά προβλήματα,
ως
αποτέλεσμα της σύμπλεξης μετάλλων χρήσιμων για τον ανθρώπινο οργανισμό. Το πρώτο
μέταλλο που συμπλέκεται είναι το ασβέστιο και κατά πάσα πιθανότητα ακολουθεί ο
ψευδάργυρος. Για το δινάτριο άλας του EDTA (Na2H2EDTA)
αναφέρονται τιμές LD50
2000-2300 mg/kg για αρουραίους και κουνέλια (λήψη από το στόμα)
[Αναφ. 19]. Η μέγιστη αποδεκτή ημερήσια λήψη του συμπλόκου Na2CaEDTA έχει καθοριστεί στα 2,5 mg/kg (FAO/WHO
1974) και του συμπλόκου NaFe(III)EDTA στα 0,8 mg/kg (FAO/WHO 2000)
[Αναφ. 19γ].
Γενικά το EDTA και τα άλατά του δεν θεωρούνται ως επικίνδυνες τοξικές ουσίες και
δεν απαιτούν ιδιαίτερες προφυλάξεις κατά την κανονική χρήση τους. Τα προβλήματα
τοξικότητας μπορεί να προκύψουν μόνο μετά από μακροχρόνιες εκθέσεις σε μεγάλες
ποσότητες στο εργασιακό περιβάλλον, όπως π.χ. στις βιομηχανίες παρασκευής
EDTA. Αντίθετα το EDTA έχει
πολλές φαρμακευτικές εφαρμογές, προστίθεται στα καλλυντικά, όπως και
στα τρόφιμα (ως NaFe(III)EDTA), επειδή αυξάνει τη
βιοδιαθεσιμότητα του σιδήρου, ειδικά για άτομα με αναιμία ή έλλειψη σιδήρου. To
NaFe(III)EDTA έχει προταθεί για ενίσχυση (fortification)
του
άρτου και των δημητριακών που καταναλώνονται ως πρωϊνή τροφή (cereals). Η χρήση EDTA
σε καλλυντικά σε χαμηλές συγκεντρώσεις έχει αποδειχθεί ασφαλής
[Αναφ. 20].
Περιβαλλοντική ρύπανση και συμπεριφορά του
EDTA
στο περιβάλλον
Η μεγάλη χρήση του
EDTA σε διάφορες εφαρμογές και η αργή απομάκρυνσή του
κάτω από ορισμένες περιβαλλοντικές συνθήκες έχει δημιουργήσει προβλήματα
ρύπανσης του περιβάλλοντος και ιδιαίτερα των επιφανειακών νερών στις Ευρωπαϊκές
χώρες. Σε ποταμούς της Ευρώπης έχουν μετρηθεί συγκεντρώσεις
EDTA της τάξης των 10-100 μg/L,
ενώ σε λίμνες 1-10 μg/L. Στις
ΗΠΑ, σε υπόγεια νερά που δέχονται υγρά απόβλητα έχουν αναφερθεί συγκεντρώσεις
EDTA 1-72 μg/L.
Το EDTA
δεν διασπάται σε συνήθεις συνθήκες και δεν απομακρύνεται κατά την τυπική
κατεργασία υγρών αποβλήτων. Ωστόσο, με κατάλληλη ρύθμιση του
pH των αποβλήτων και της λάσπης και του χρόνου παραμονής τους, το
EDTA μετατρέπεται σχεδόν εξ ολοκλήρου σε ανόργανες ουσίες (mineralization).
Φαίνεται ότι διασπάται από κάποιους μικροοργανισμούς που βρίσκονται στα
απόβλητα, το έδαφος και τη λυματολάσπη.
|
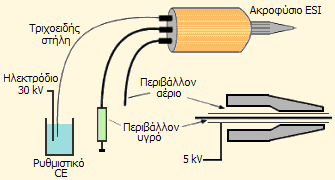
Σύζευξη ηλεκτροφόρησης σε
τριχοειδές (capillary elctrophoresis, CE) με την πηγή ιοντισμού με
ηλεκτροψεκασμό (elctrosparay ionization, ESI) φασμοτομέτρου μαζών
(mass spectrometer, MS)/font> |
Το κυριότερο πρόβλημα που προκαλεί η παρουσία
EDTA και ανάλογων ενώσεων στα φυσικά νερά και γενικά
στο περιβάλλον είναι επαναδιάλυση (λόγω σύμπλεξης) ιζηματοποιημένων τοξικών
μετάλλων και η μεταφορά τους σε άλλες περιοχές. Επιπλέον, χαμηλή συγκέντρωση
χηλωτών ενώσεων μπορεί να ενεργοποιήσει αλλά και να μειώσει την ανάπτυξη του
πλαγκτόν και των φυκών.
Γενικά, τα αμινοπολυκαρβοξυλικά οξέα δεν προκαλούν
οξείες δηλητηριάσεις σε ζωικούς οργανισμούς, αν αυτοί εκτεθούν σε σχετικά
μεγάλες συγκεντρώσεις τους για σύντομα χρονικά διαστήματα, ωστόσο δεν είναι
γνωστές οι επιπτώσεις μακροχρόνιων εκθέσεων των οργανισμών σε μικρές
συγκεντρώσεις. Το EDTA σε υψηλές συγκεντρώσεις είναι
τοξικό στα βακτήρια λόγω της σύμπλεξης των μετάλλων στις εξωτερικές μεμβράνες,
ενώ στα θηλαστικά μπορεί να προκαλέσει αλλαγές στην αποβολή των μετάλλων και στη
διαπερατότητα των μεμβρανών από μεταλλικά ιόντα [Αναφ.
20γ].
Το EDTA χρησιμοποιείται
και για την απομάκρυνση βαρέων μετάλλων από εδάφη και θαλάσσια νερά, αλλά και η
παραμονή του σε υψηλές συγκεντρώσεις στα υδατικά διαμερίσματα είναι τοξικολογικά
επικίνδυνο για τους υδρόβιους οργανισμούς. Σε αρκετές βιομηχανικές χώρες (π.χ.
Γερμανία) στα ποτάμια, λίμνες και παραθαλάσσιες περιοχές παρακολουθούνται
συστηματικά οι συγκεντρώσεις EDTA και άλλων παρόμοιων
ενώσεων, επειδή θεωρούνται σημαντικοί ρύποι [Αναφ.
21].
Προσδιορισμός πολύ χαμηλών
συγκεντρώσεων EDTA: Με απλή υγροχρωματογραφία
υψηλής απόδοσης (HPLC) μπορεί να μετρηθεί EDTA σε μη αλκοολούχα ποτά με
όριο ανίχνευσης 0,6 μg/mL
και όριο ποστικοποίησης 2,0 μg/mL.
Σε περιβαλλοντικά δείγματα μπορεί το EDTA να μετρηθεί με συνδυασμένη
αεριοχρωματογραφία/φασματομετρία μαζών (GC/MS) μετά τη μετατροπή του σε
τετραμεθυλικό εστέρα με αναφέρομενο όριο ποσοτικοποίησης τα 4 ng/mL
[Αναφ. 22].
Η πλέον ευαίσθητη μέθοδος προσδιορισμού
EDTA σε βιολογικά
δείγματα είναι η ηλεκτροφόρηση σε τριχοειδές σε συνδυασμό με
διαδοχική φασματομετρία μαζών
με παρακολούθηση επιλεγμένων αντιδράσεων (selected-reaction-monitoring-electrophoresis
mass-spectrometry, SRM-CE-MS/ΜS)
με όριο ανίχνευσης 7,3 ng/mL,
στο πλάσμα του αίματος και όριο ποσοτικοποίησης
15 ng/mL.
Η συγκέντρωση αυτή είναι σχεδόν πέντε τάξεις μεγέθους χαμηλότερη από εκείνη σε
δείγμα αίματος στο οποίο έχει προστεθεί EDTA για συντήρηση (4,5 mM ή 1,3 mg/mL)
[Αναφ. 18δ]. Περισσότερα για τη συνδυασμένη
τεχνική CE/MS μπορούν να αναζητηθούν στην [Αναφ.
23].
Βιβλιογραφία - Πηγές από το Διαδίκτυο
1. (α) The Merck
Index (12th ed., 1996). (β) Christian GD: "Analytical Chemistry", Wiley
International, 6th ed., p. 298. (γ) Mallinckrodt Backer Inc.: "Material
Data Safety Sheet (MSDS): EDTA disodium salt" (4/2007).
2.
(α) Sinex SA: "The
Molecule of the Month: EDTA" (University of Bristol, Dep. of Chemistry).
(β). Chaitow L: "The
history of EDTA" (Health World, 1990).
3. (α) Wikipedia: "Etheylenediamine".
(β) "Production
of ethylenediamine from monoethanolamine and ammonia"
United States Patent 4918233.
4. (α)
Harris DC: "Quantitative Chemical Analysis", Freeman and Co., 4th
ed. (1996), p. 315-326. (β)
Skoog DA, West DM, Holler FJ: "Fundamentals of Analytical
Chemistry", Saunders, 7th ed., p. 279-283. (γ) Χατζηιωάννου ΘΠ, Καλοκαιρινός ΑΚ, Τιμοθέου-Ποταμιά Μ: "Ποσοτική Αναλυτική
Χημεία", Πανεπιστήμιο Αθηνών, 1998, σελ. 328-358. (δ) McAllister,
Jr. HC, Yarbro CL: "A rapid complexometric titration of serum
calcium", Clinical Chemistry, 6(1):52-56, 1960 (αρχείο
PDF, 400 KB).
5.
Ευσταθίου ΚΗ: "Διαγράμματα
κατανομής πολυπρωτικών οξέων" (Τμήμα Χημείας, Πανεπ. Αθηνών).
6. (α) Ευσταθίου
ΚΗ: "Εργαστηριακές Ασκήσεις Ενόργανης Ανάλυσης Ι: Εκχύλιση ψευδαργύρου με μίγμα
κ-εξανίου - φωσφορικού τριβουτυλεστέρα", Τμήμα Χημείας Πανεπιστημίου Αθηνών (αρχείο
PDF 490 ΚΒ). (β) CHE 226 Experiment 3: "Complexometric
titration of Zn(II) with EDTA"
(Chem. Department, University of Kentucky), Aug. 2003.
7. Oviedo C,
Rodríguez J: "EDTA:
the chelating agent under environmental scrutiny",
Quím. Nova, 26(6): 901-905,
2003.
Dow Chemicals: "Product
Safety Assessment (PSA): Salts of
Ethylenediaminetetraacetic Acid (EDTA)".
8. European
Commission: "Edetic Acid: Summary Risk Assessment Report", Institute for Health
and Consumer Protection, European Chemicals Bureau, I-21020 Ispra (VA) Italy (αρχείο
PDF, 695 KB).
9.
(α)
"US
Patent 6123809 - Method for bleaching paper pulp".
(β) PaperOnWeb.com: "Chemicals
used in pulp & paper maunfacturing and coating".
(γ)
Audette H: "Chelants
help to meet challenges of alkaline bleaching conversion", Pulp & Paper,
1994.
10. (α) "Detergent
Ingredients Glossary". (β) Eco-forum: "Complexing
Agents".
11. (α) Gardner LK,
Lawrence GD: "Benzene production from decarboxylation of benzoic acid in the
presence of ascorbic acid and a transition-metal catalyst", J Agric. Food Chem.,
41(5): 693-695, 1993
(Abstract).
(β) "Production of benzene from ascorbic acid and sodium benzoate", A White
Paper Produced by AIB International (αρχείο
PDF, 112 KB). (γ) US Food and
Drug Administration: "Questions
and answers on the occurrence
of benzene in soft
drinks and other
beverages".
12.
FAO, Fertilizer and Plant Nutrition Bulletin 16: "Plant nutrition for food
security" (αρχείο
PDF, 2,73 MB).
13. (α) Martell AE,
Motekaitis RJ, Chen D, Hancock RD, Derek McManus D: "Selection of new
Fe(lll)/Fe(ll) chelating agents as catalysts for the oxidation of hydrogen
sulfide to sulfur by air", Can. J. Chem. 74:1872-1879 1996 (αρχείο
PDF, 380 KB).(β) Kumaraswamy R, van Dongen U, Kuenen JG, Abma W, van
Loosdrecht MC, Muyzer G: "Characterization
of microbial communities removing nitrogen oxides from flue gas: the BioDeNOx
process", Appl Environ
Microbiol. 71(10):6345-6352, 2005. (γ) Cheng F (University of
Idaho): "The many wanders of FeEDTA: Room temperature incineration of
pollutants, an a model for biological oxidations" (παρουσίαση
PowerPoint, 5,79 ΜΒ).
14. US Patent
5490865: "Method
of treating and dyeing animal fibers".
15.
(α)
Wikipedia: "Chelation
Therapy". (β) Blanusa M, Varnai VM, Piasek M, Kostial K:
"Chelators as antidotes of metal toxicity: therapeutic and experimental
aspects",
Curr Med Chem. 12(23):2771-2794,
2005
(Abstract).
(γ) Americal Heart Association: "Questions
and answers about chelation therapy".
(δ)
Hülsmann M, Heckendorff M, Lennon A:
"Chelating agents in root canal
treatment: mode of action and indications for their use",
Int Endod J. 36(12):810-30, 2003 (PubMed).
16.
(α) Hornum
M, Christopher BM, Iversen M, Hovind P,
Hilsted L, Feldt-Rasmussen B:
"Decline
in 51-Cr-labelled EDTA measured glomerular filtration rate following lung
transplantation", Nephrology Dialysis Transplantation", 22(12):3616-3622,
2007.
(β)
www.nephros.gr: "Βασικές
αρχές της σπειραματικής διήθησης".
17.
(α) Wikipedia: "Anticoagulant".
(β) Global
Oneness: "EDTA
- Use as an anticoagulant".
(γ) Lam NYL, Rainer TH, Chiu
RWK, Dennis Lo YM: "EDTA
is a better anticoagulant than heparin or citrate for delayed blood processing
for plasma DNA analysis",
Clinical
Chemistry 50:256-257, 2004.
18. (α) Wikipedia: "O.
J. Simpson murder case". (β)
CourtTVnews: "O.J.
Simpson: Week-by-week:
Week 27, July 24-28, 1995".
(γ) Thompson WC (Department
of Criminology, Law & Society, University of California, Irvine, California):
"Proving
the case: DNA evidence in the O.J. Simpson trial". (δ) "Determining
EDTA in blood" (Referenced from:
Sheppard RL, Henion J:
"Determining EDTA in blood",
Analytical Chemistry 69:477A-480A, 1997).
19.
(α) FAO Nutrition Meetings: "Toxicological
evaluation of some antimicrobials, antioxidants, emulsifiers, stabilizer,
flour-treatment agents, acids and bases: Calcium disodium
ethylenediaminetetraacetate"
(Report Series No. 40A,B,C,
WHO/Food Add./67.29). (β)
FAO Nutrition Meetings: "Toxicological
evaluation of some antimicrobials, antioxidants, emulsifiers, stabilizer,
flour-treatment agents, acids and bases:
Disodium ethylenediaminetetraacetate"
(Report Series No. 40A,B,C,
WHO/Food Add./67.29). (γ)
Shackleford B (EPA): "Memorandum:
Tolerance
reassessment decisions completed by the lower toxicity pesticide chemical focus
group" (Jan. 28, 2004) (αρχείο
PDF, 163 KB).
20.
(α)
Lanigan RS, Yamarik TA: "Final report on the safety
assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA,
disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA,
HEDTA, and trisodium HEDTA", International J of Toxicology 21(Suppl. 2):95-142,
2002 (Abstract).
(β)
Whittaker P,
Vanderveen JE,
Dinovi MJ,
Kuznesof PM,
Dunkel VC: "Toxicological
profile,
current use,
and regulatory issues on EDTA compounds for assessing use of
sodium iron EDTA for food fortification",
Regul Toxicol. Pharmacol.
18:419-427, 1993
(MedLine).
(γ) Molecular station: "EDTA".
21. (α) Sillanpää M:
"Environmental fate of EDTA and
DTPA", Rev. Environ. Contam. Toxicol. 152:85-111,
1997 (PubMed).
(β) Bucheli-Witschel M, Egli T: "Environmental fate and
microbial degradation of aminopolycarboxylic acids", FEMS Microbiol. Rev.
25:69-106, 2001 (PubMed).
(γ) Schmidt CK, Fleig M, Sacher F, Brauch HJ: "Occurrence of
aminopolycarboxylates in the aquatic environment of Germany", Environ. Pollut.
131:107-124, 2004 (PubMed).
(δ)
Zou Z, Qiu R, Zhang W, Dong H, Zhao Z, Zhang T, Wei X, Xinde Cai X:
"The study of operating variables
in soil washing with EDTA", Environmental Pollution 157(1):229-236, 2009
(Abstract).
22.
(α) Nishikawa Υ, Okumura Τ: "Determination of nitrilotriacetic acid and
ethylenediaminetetraacetic acid in environmental samples as their methyl ester
derivatives by gas chromatography-mass spectrometry",
Journal of Chromatography A, 690(1):109-118,
1995 (Abstract).
(β)
Sheppard RL, Henion J:
"Determining EDTA in blood",
Analytical Chemistry 69:477A-480A, 1997.
23. (α) de Hoffmann E,
Stroobant V: "Mass Spectrometry: Principles
and Applications", Wiley-Interscience, 2007
(GoogleBooks).
(β) Θωμαΐδης Ν: "3ο μάθημα: Φασματομετρία μαζών - Β' μέρος" (Σημειώσεις
Μαθήματος: "Σύγχρονες Αναλυτικές Τεχνικές") (αρχείο
PDF, 761 KB).
Ενδιαφέρουσες ιστοσελίδες για το EDTA στα
Ελληνικά
- Αντωνάκου Τ (17ο Λύκειο Θεσ/νίκης): "Η
Χημεία στη δαγκάνα ενός κάβουρα".
- Κλούρας N (Τμ. Χημείας, Πανεπιστήμιο Πατρών):
"Σκληρότητα νερού" (αρχείο
PDF, 503 KB).
|
Αποποίηση
ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η
ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο
έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν
αναλαμβάνουν τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή
ανακριβείς πληροφορίες. Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την
ορθότητα των αναφερόμενων σε εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω
συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα
Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό
τους. |

 Ιστορία - Σύνθεση του
Ιστορία - Σύνθεση του
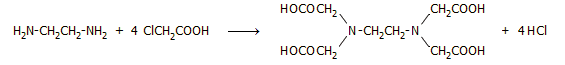
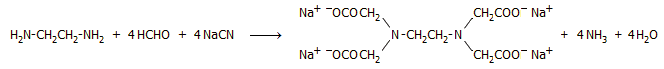
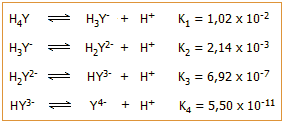 Το
Το





 Ως
σταθερά σχηματισμού (
Ως
σταθερά σχηματισμού (

 Ως
επικάλυψη (masking) ορίζεται η διεργασία κατά την οποία μια ουσία,
χωρίς φυσικό διαχωρισμό της ίδιας ή των προϊόντων αντίδρασής της,
μετατρέπεται σε μια άλλη που δεν υπεισέρχεται σε μια δεδόμενη αντίδραση.
Ως αποκάλυψη (demasking) ορίζεται η διεργασία κατά την οποία μια
ουσία που έχει υποστεί επικάλυψη, επαναποκτά τη δυνατότητα συμμετοχής
της σε
μια δεδομένη αντίδραση. Τυπικό παράδειγμα αποτελεί η χρήση κυανιούχων ως
επικαλυπτικού μέσου (masking agent) των ιόντων ψευδαργύρου (και πολλών
άλλων μετάλλων) κατά τις ογκομετρήσεις με EDTA:
Ως
επικάλυψη (masking) ορίζεται η διεργασία κατά την οποία μια ουσία,
χωρίς φυσικό διαχωρισμό της ίδιας ή των προϊόντων αντίδρασής της,
μετατρέπεται σε μια άλλη που δεν υπεισέρχεται σε μια δεδόμενη αντίδραση.
Ως αποκάλυψη (demasking) ορίζεται η διεργασία κατά την οποία μια
ουσία που έχει υποστεί επικάλυψη, επαναποκτά τη δυνατότητα συμμετοχής
της σε
μια δεδομένη αντίδραση. Τυπικό παράδειγμα αποτελεί η χρήση κυανιούχων ως
επικαλυπτικού μέσου (masking agent) των ιόντων ψευδαργύρου (και πολλών
άλλων μετάλλων) κατά τις ογκομετρήσεις με EDTA: 




 Η
ετήσια παραγωγή του
Η
ετήσια παραγωγή του