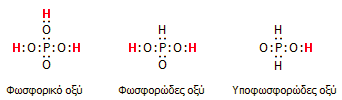Οι μέχρι σήμερα
Η χημική ένωση του
μήνα
[Αύγουστος
2008]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες:
Εμφάνιση: 'Αχρωμο, άοσμο και
άγευστο υγρό
Μοριακός τύπος: D2O
Σχετική μοριακή μάζα:
20,04
Σημείο τήξης:
3,82ºC
Σημείο βρασμού:
101,4ºC
Πυκνότητα (στους 20ºC):
1,1056 g/mL
Πυκνότητα (στο σημείο
τήξης):
1,0177
g/mL,
Ιξώδες
(στους 25ºC): 0,00125 mPa·s
Διπολική ροπή: 1,87 D
[από την
Αναφ. 1α, βλ. κείμενο για περισσότερα
φυσικοχημικά χαρακτηριστικά και σύγκρισή τους με το φυσικό ύδωρ]
|
 |
|
Βαρύ
ύδωρ (οξείδιο του δευτερίου)
Heavy water (deuterium oxide, water d2) |
|

Αναμνηστική πλάκα στο
Penn State University (Πανεπιστήμιο της Πενσυλαβανίας) προς τιμήν
του φυσικού Ferdinand Brickwedde,
ενός από τους επιστήμονες που συνέβαλαν στην ανακάλυψη του δευτερίου.
|
Τι είναι το βαρύ
ύδωρ
Ισοτοπική αφθονία υδρογόνου:
Το υδρογόνο στη φύση βρίσκεται κυρίως ως το ισότοπο πρώτιο (protium,
¹Η ή απλά
Η) και δευτερευόντως ως το ισότοπο δευτέριο
(deuterium,
²H
ή
D). Η φυσική αφθονία του δευτερίου είναι πολύ μικρή, στα 6.400 άτομα φυσικού υδρογόνου
μόνο 1 άτομο είναι δευτέριο. Δηλαδή, το δευτέριο, σε βάση αριθμού ατόμων, αποτελεί
το: (1/6400) x 100 = 0,0156%, ενώ σε βάση μάζας και επειδή έχει ουσιαστικά διπλάσια μάζα από
το πρώτιο, το ποσοστό αυτό είναι διπλάσιο του προηγουμένου: (2/6400) x
100 = 0,0312%.
Ακόμη υπάρχει σε απειροελάχιστη αναλογία
(μόλις 1 άτομο στα 1018
άτομα υδρογόνου) το ισότοπο τρίτιο
(tritium
³Η
ή Τ). Το τρίτιο, σε αντίθεση με τα άλλα δύο, είναι ασταθές (ραδιενεργό) ισότοπο και στη φύση
παράγεται ως αποτέλεσμα πυρηνικών αντιδράσεων στην ανώτερη ατμόσφαιρα,
επαγόμενων από σωματίδια της κοσμικής ακτινοβολίας. Το τρίτιο είναι β-ραδιενεργό
και έχει χρόνο ημιζωής
4500±8 ημέρες (12,3
έτη) και διασπάται σύμφωνα με την αντίδραση:
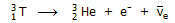
Το δευτέριο στο
ύδωρ: Είναι γνωστό ότι στο νερό, λόγω της έστω και μικρής σε έκταση
διάστασης του μορίου του, τα άτομα υδρογόνου είναι ευκίνητα, δηλαδή το άτομο υδρογόνου
ενός μορίου ύδατος
(ανεξάρτητα αν πρόκειται για H ή D)
μπορεί να
βρεθεί στη θέση του υδρογόνου ενός άλλου μορίου κ.ο.κ., ως αποτέλεσμα αυτής της διάστασης και επομένως τα άτομα D είναι στατιστικώς
κατανεμημένα. 'Ετσι,
το φυσικό ύδωρ αποτελείται κυρίως από μόρια Η2Ο
(οξείδιο του πρωτίου), ακολουθούν σε συχνότητα εμφάνισης τα μόρια του
ημιβαρέος ύδατος (semiheavy
water, με τύπο HDO), με πιθανότητα
παρουσίας 1 μορίου HDO στα
3.200 μόρια ύδατος (1 D στα 2 x
3200 υδρογόνα) και τέλος, ελάχιστα σε αναλογία αναμένεται
να είναι τα μόρια
βαρέος ύδατος (heavy water, με τύπο D2O), με πιθανότητα
παρουσίας 1 μορίου D2O
στα 6.400²
(»
41 εκατομμύρια) μόρια ύδατος. Απειροελάχιστα σε αναλογία είναι
τα μόρια ύδατος που περιέχουν τρίτιο σε κάθε δυνατό συνδυασμό με πρώτιο και δευτέριο
[Αναφ. 1α].
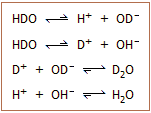 Το βαρύ ύδωρ μπορεί να ληφθεί
σε καθαρή κατάσταση και έτσι μπορούν να μελετηθούν με χρονική
άνεση οι φυσικοχημικές του ιδιότητες. Αντίθετα, είναι αδύνατη η απομόνωση
καθαρού ημιβαρέος ύδατος για αντίστοιχες μελέτες. Εάν υποθετικά
διαθέταμε καθαρό ημιβαρύ
ύδωρ, τούτο στατιστικά αναμένεται να καταλήξει σε μίγμα 50% HDO, 25% H2O
και 25% D2O, με όλα τα μόρια
σε δυναμική ισορροπία μεταξύ τους. Δεξιά δίνονται οι χημικές
ισορροπίες διάστασης του ημιβαρέος ύδατος και φαίνεται πως η ανασύνδεση των ιόντων
οδηγούν σε
σχηματισμό Η2Ο και D2O.
Το βαρύ ύδωρ μπορεί να ληφθεί
σε καθαρή κατάσταση και έτσι μπορούν να μελετηθούν με χρονική
άνεση οι φυσικοχημικές του ιδιότητες. Αντίθετα, είναι αδύνατη η απομόνωση
καθαρού ημιβαρέος ύδατος για αντίστοιχες μελέτες. Εάν υποθετικά
διαθέταμε καθαρό ημιβαρύ
ύδωρ, τούτο στατιστικά αναμένεται να καταλήξει σε μίγμα 50% HDO, 25% H2O
και 25% D2O, με όλα τα μόρια
σε δυναμική ισορροπία μεταξύ τους. Δεξιά δίνονται οι χημικές
ισορροπίες διάστασης του ημιβαρέος ύδατος και φαίνεται πως η ανασύνδεση των ιόντων
οδηγούν σε
σχηματισμό Η2Ο και D2O.
Eάν με κάποιο τρόπο αρχίσει η σταδιακή απομάκρυνση του πρωτίου
(Η) από το φυσικό ύδωρ, τότε το ύδωρ θα εμπλουτίζεται σε
HDO, το οποίο επαναποκαθιστά τις ισορροπίες του με το Η2Ο
και το D2O.
Το ποσοστό του τελευταίου σταδιακά θα αυξάνεται
και τελικά, μετά την ολική απομάκρυνση του H,
προφανώς θα απομείνει καθαρό D2O.
Οι διαδικασίες διαχωρισμού δεν είναι ούτε ποσοτικές, ούτε απλές. Μαζί με το πρώτιο
απομακρύνεται και σημαντικό ποσοστό του δευτερίου. 'Ετσι, ενώ με βάση
την ισοτοπική περιεκτικότητα του φυσικού υδρογόνου σε δευτέριο, 1 g καθαρού D2O
θα μπορούσε να ληφθεί από 5,8 kg φυσικού ύδατος, στην
πράξη απαιτείται πολύ μεγαλύτερη ποσότητα φυσικού ύδατος.
|
Φυσικές
διακυμάνσεις της περιεκτικότητας του υδρογόνου σε δευτέριο
Το 1913, στο Πανεπιστήμιο της
Νέας Υόρκης,
οι Arthur Lamb και Richard Lee επιχειρούσαν να προσδιορίσουν την
πυκνότητα του ύδατος με τη μέγιστη δυνατή ακρίβεια. Ως στόχο είχαν μια ακρίβεια
της τάξης των 0,2 ppm (μέρη στο εκατομμύριο). Ωστόσο, διαπίστωσαν ότι φυσικά
νερά από διαφορετικές περιοχές παρουσίαζαν ανεξήγητες διαφορές πυκνότητας μεταξύ τους της
τάξης των 0,8 ppm. Δεν γνώριζαν βέβαια ότι οι διαφοροποιήσεις αυτές οφείλονταν
στην ελαφρά διαφορετική περιεκτικότητα σε δευτέριο των υδάτων από διαφορετική
προέλευση [Αναφ. 1β]. 'Ετσι, ενώ
στο νερό των ωκεανών το δευτέριο αποτελεί το 0,0155% των ατόμων υδρογόνου, στο
νερό του ποταμού Νείλου αποτελεί το 0,0162% (ως αποτέλεσμα μιας φυσικής
διεργασίας κλασματικής απόσταξης), ενώ στα επιφανειακά ύδατα του Αρκτικού
ωκεανού αποτελεί το 0,0130%. Οι διαφορές από την ισοτοπική περιεκτικότητα σε δευτέριο του υδρογόνου άλλων πλανητών είναι
ακόμη μεγαλύτερες, έτσι στον 'Αρη το δευτέριο αποτελεί το 0,1% των ατόμων
υδρογόνου και στην Αφροδίτη το εντυπωσιακό ποσοστό 2,2%
[Αναφ. 11].
|
|

Harold Clayton Urey
(1893-1981) |

Gilbert Newton Lewis
(1875-1946) |
Το ιστορικό της ανακάλυψης του
δευτερίου και του βαρέος ύδατος
[Αναφ. 1]
Μέχρι το 1929, τόσο οι φυσικές
(που βασίζονταν σε μετρήσεις με φασματοσκοπία μαζών), όσο και οι χημικές μετρήσεις των ατομικών βαρών
(ΑΒ) των στοιχείων ως βάση είχαν το μέχρι τότε θεωρούμενο ως μοναδικό ισότοπο του οξυγόνου,
το 16Ο, στο
οποίο είχε αποδοθεί το ΑΒ = 16 (ακριβώς). Οι "φυσικές" τιμές, αναφέρονταν ως
τιμές Aston, αφού είχαν προσδιοριστεί με τον πρώτο
φασματογράφο μάζα που είχε κατασκευάσει ο διάσημος Francis W.
Aston
(βραβείο Nobel 1922) και λειτουργούσε στο εργαστήριο
Cavendich του Cambridge.
Το 1929 οι
W. Giauque
και Η. Johnston
διαπίστωσαν την ύπαρξη άλλων δύο ισοτόπων του οξυγόνου, το 17Ο και το 18Ο.
Το δεύτερο μάλιστα είχε εκτιμηθεί στη σχετικά σημαντική ισοτοπική αναλογία 16Ο:18Ο
= 630:1 (σημερινές τιμές ισοτοπικής αφθονίας: 99,76% 16Ο, 0,039% 17Ο, 0,201% 18Ο).
'Ετσι, ενώ οι "φυσικές" τιμές των ΑΒ
βασίζονταν στο 16Ο, δηλ. σε ΑΒ ακριβώς 16, οι "χημικές" τιμές ΑΒ των
στοιχείων στην πραγματικότητα βασίζονταν σε ΑΒ οξυγόνου λίγο μεγαλύτερο από το
16.
|
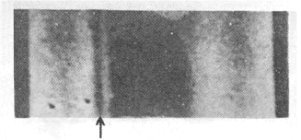
Η πρώτη ένδειξη ύπαρξης
του δευτερίου: Αριστερά από μια έντονη φασματική γραμμή Balmer του Η, διακρίνεται η ασθενής γραμμή
(πάνω από το βέλος) του D σε δείγμα φυσικού
υδρογόνου ελαφρά εμπλουτισμένου σε D, που προέκυψε μετά από
βραδεία εξάτμιση του υγροποιημένου αερίου (από την Aναφ.
8). |
Το 1931, οι R. T. Birge και D.
H. Menzel υπολόγισαν ότι για να εναρμονιστούν "φυσικές" και
"χημικές" τιμές, θα έπρεπε οι "φυσικές" να διαιρεθούν με τον αριθμό 1,00022. Μέχρι τότε
η
"χημική" τιμή ΑΒ του υδρογόνου είχε βρεθεί 1,00777 ± 0,00002 και συμφωνούσε καλά με τη
"φυσική" τιμή 1,00778 ± 0,00015 (όρια σφάλματος), εδραιώνοντας την άποψη του Aston ότι το υδρογόνο
διαθέτει ένα και μόνο
ισότοπο. Ωστόσο, με τη διόρθωση η "φυσική" τιμή του
ΑΒ του υδρογόνου γινόταν 1,00756, που ήταν εκτός των ορίων των προαναφερθέντος
σφάλματος. Οι δύο ερευνητές εκτίμησαν ότι η διαφορά αυτή είναι πλέον στατιστικώς
σημαντική και θα μπορούσε να αιτιολογηθεί μόνο με την παραδοχή ύπαρξης
βαρύτερων ισοτόπων του υδρογόνου, τα οποία δεν είχε λάβει υπόψη η "φυσική" τιμή
ΑΒ. Ακόμη εκτίμησαν ότι εάν το μόνο βαρύτερο ισότοπο ήταν το
²Η,
τότε η σχετική ισοτοπική αναλογία
¹Η/²Η θα ήταν περίπου ίση προς 4.500:1. Επιπλέον, προέβλεψαν
ότι θα ήταν δύσκολη αλλά δυνατή η φασματοσκοπική ανίχνευση του βαρύτερου
ισοτόπου [Αναφ. 1γ].
Την ίδια χρονιά ο
Harold Urey
στο Πανεπιστήμιο Columbia,
είχε
παρουσιάσει ένα διάγραμμα των μέχρι τότε γνωστών ισοτόπων, στο οποίο άφηνε κενές θέσεις για τα μέχρι τότε άγνωστα βαρύτερα ισότοπα του υδρογόνου (2Η, 3Η),
ως και του ηλίου (5Ηe). Ήταν
επομένως φυσικό να του κινήσει το ενδιαφέρον το άρθρο των Birge και Menzel και
να αρχίσει, με τους συνεργάτες του
G. M.
Murphy
και F. Brickwedde (του NBS και ειδικός στα θέματα υγροποιημένων αερίων), να αναζητά
πειραματικές αποδείξεις της ύπαρξης βαρύτερων ισοτόπων του υδρογόνου
[Αναφ. 1ε].
Εάν πράγματι υπήρχε το ισότοπο
²Η, θα έπρεπε στο φάσμα εκπομπής του
υδρογόνου να υπάρχει μια δεύτερη ασθενής και ελαφρά
μετατοπισμένη γραμμή (κορυφή) πολύ κοντά σε κάθε γραμμή Balmer
[Αναφ. 2]. 'Ετσι, η εντονότερη από αυτές, η α-γραμμή (ερυθρά) (ή α-Η) στα 656,3 nm θα
έπρεπε να συνοδεύεται από μια ασθενή δεύτερη γραμμή μετατοπισμένη μόλις κατά 0,18 nm.
Πράγματι, οι ερευνητές διαπίστωσαν αδύναμα ίχνη αυτής της γραμμής και ανησυχώντας μήπως αυτή η
γραμμή ήταν "γραμμή-φάντασμα", λόγω κάποιας κατασκευαστικής ατέλειας του
στοιχείου ανάλυσης (φράγμα περίθλασης) του φασματοσκόπιου, άρχισαν να αποστάζουν υγρό
υδρογόνο εκτιμώντας σωστά ότι το βαρύτερο ισότοπο (αν υπήρχε) θα ήταν λιγότερο
πτητικό και θα συγκεντρωνόταν στο υπόλειμμα.
Στο
σημείο αυτό οι ερευνητές υπήρξαν και λίγο άτυχοι. Το υγρό υδρογόνο που χρησιμοποιούσαν
είχε παρασκευασθεί ηλεκτρολυτικά, δηλαδή ήταν ήδη αρκετά απεμπλουτισμένο ως προς το δευτέριο. Παρ' όλα αυτά
τελικά διαπίστωσαν
μια αύξηση της έντασης της δεύτερης γραμμής Balmer (ή α-D) στα 656,5 nm, γεγονός
που επιβεβαίωνε την αυθεντικότητα της γραμμής. Επιπλέον, ο
Urey
με τον συνεργάτη του E. W.
Washburn
διαπίστωσαν την ίδια αύξηση και στο υπόλειμμα
της ηλεκτρόλυσης του φυσικού ύδατος. 'Ολα αυτά τεκμηρίωναν πλέον πειραματικά την ύπαρξη του δευτερίου. Η ανακάλυψη αυτή οδήγησε στη βράβευση του Urey με
το βραβείο Nobel Χημείας του έτους 1934.
|
Ανακάλυψη από
λανθασμένα δεδομένα
"... Η ιστορία
είχε μια περίεργη συνέχεια. Το 1935, αποδείχθηκε ότι το ατομικό βάρος του
υδρογόνου στη φυσική κλίμακα είχε ένα μικρό σφάλμα και αναθεωρήθηκε λιγάκι προς
τα πάνω από τον Aston, αρκετά όμως για αναδειχθεί η
πραγματική διαφορά μεταξύ των δύο τιμών (ατομικού βάρους) του υδρογόνου. Η
ιστορία όμως δεν τελειώνει εδώ. Αποδείχθηκε και ότι η χημική τιμή του ατομικού
βάρους του υδρογόνου ήταν επίσης λανθασμένη, όταν διαπιστώθηκε ότι τα ισότοπα
του υδρογόνου μπορούσαν να διαχωριστούν με ηλεκτρόλυση ή απόσταξη. 'Ετσι, η
ανακάλυψη του βαρέος υδρογόνου ήρθε τυχαία βασιζόμενη λίγο-πολύ σε δύο
λανθασμένες τιμές ατομικού βάρους του υδρογόνου. Η κωμωδία των σφαλμάτων βέβαια
δεν μειώνει το επίτευγμα του Urey. 'Οπως ο ίδιος
σημείωσε στα δοκίμια της ομιλίας του κατά την απονομή σ'αυτόν του βραβείου
Nobel το 1934 (όταν πληροφορήθηκε για τη διόρθωση του
Aston), η πρόβλεψη των Birge
και Menzel -βασιζόμενη σε σωστά ή λάθος στοιχεία-
ήταν εκείνη που κίνησε τον μηχανισμό αναζήτησης του ισοτόπου, το οποίο θα
μπορούσε να είχε παραμείνει απαρατήρητο για αρκετό ακόμη καιρό."
(Απόσπασμα από το
βιβλίο του Per F Dahl: "Heavy
Water and the Wartime Race for Nuclear Energy"
)
Πρέπει να σημειωθεί ότι το
"κομφούζιο" των διπλών κλιμάκων των ατομικών βαρών έληξε το 1961, όταν φυσικοί
και χημικοί συμφώνησαν να χρησιμοποιείται εφεξής μία και μοναδική κλίμακα,
εκείνη η οποία βασίζεται στο ισότοπο του άνθρακα
¹²C,
στο οποίο αποδίδεται κατά συνθήκη ατομικό βάρος ακριβώς 12 (βλ. IUPAC: "Atomic
Weight - The name, its history, definition and units").
|
Το 1934 ο Gilbert Lewis, που ήταν ο
επιβλέπων
καθηγητής του Urey κατά την εκπόνηση του διδακτορικού του (1921-23) στο Πανεπιστήμιο της Καλιφόρνιας, ήταν ο πρώτος που απομόνωσε ηλεκτρολυτικά την πρώτη
ποσότητα καθαρού βαρέος ύδατος
[Αναφ. 3]. Πρέπει να σημειωθεί ότι ο Lewis
είναι περισσότερο γνωστός στο κόσμο της Χημείας για τη διατύπωση της "κατά Lewis"
θεωρίας οξέων-βάσεων και του χημικού δεσμού μέσω κοινού ζεύγους ηλεκτρονίων.
Αλλά και ο Urey είναι γνωστός για το περίφημο πείραμα Miller-Urey,
που δεν έχει καμία σχέση με το δευτέριο.
 |
 |
|
O Stanley
Miller
(1930-2007)
και η περίφημη πειραματική διάταξη προσομοίωσης της
αρχέγονης ατμόσφαιρας της Γης. |
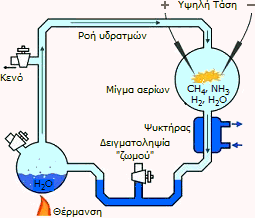
Το περίφημο πείραμα
Miller-Urey
Ο Urey
είναι γνωστός από ένα εξαιρετικά σημαντικό πείραμα, που πρότεινε στο μαθητή του
Stanley Miller
το 1953, στα πλαίσια εκπόνησης του διδακτορικού του τελευταίου στο Πανεπιστήμιο του Σικάγου.
Το πείραμα Miller-Urey (όπως έμεινε στην ιστορία της Επιστήμης και
αναφέρεται σχεδόν σε όλα τα διδακτικά βιβλία Βιοχημείας) εξέταζε τη δυνατότητα
σχηματισμού σύνθετων οργανικών μορίων απαραίτητων για την ανάπτυξη ζωής, όταν σε κλειστή φιάλη με
μίγμα αερίων υδρογόνου, μεθανίου, αμμωνίας και υδρατμών (που προσομοίαζε την
αρχέγονη ατμόσφαιρα της Γης) δεχόταν ηλεκτρικούς σπινθήρες (που προσομοίαζαν
τους κεραυνούς). Το πείραμα πράγματι έδειξε τον σχηματισμό μορίων που αποτελούν
τη βάση της ζωής (απλά αμινοξέα, σάκχαρα, λιπίδια, όχι όμως βάσεις του DNA και RNA
-τουλάχιστον στο συγκεκριμένο πείραμα-)
[Αναφ.
4].
|
Σύγκριση φυσικοχημικών ιδιοτήτων του βαρέος και
του φυσικού ύδατος
Στον επόμενο πίνακα δίνεται συγκριτικά μια συλλογή
από τιμές διαφόρων φυσικοχημικών ιδιοτήτων μεταξύ του H2O
και το D2O.
Πέραν από τις διαφορές στα σημεία τήξης, στις πυκνότητες (σε υγρή και στερεή
μορφή) και στο ιξώδες, θα μπορούσαν οι διαφορές να θεωρηθούν μικρές. Οι αναφερόμενες ως ιδιότητες του Η2Ο
(εκτός από εκείνες που χαρακτηρίζουν τη δομή των μορίων) ουσιαστικά είναι οι
ιδιότητες του φυσικού ύδατος, αφού το οξείδιο του πρωτίου κυριαρχεί στο φυσικό
ύδωρ.
|
Συγκριτικός πίνακας τιμών
ορισμένων φυσικών και χημικών ιδιοτήτων των H2O
και D2O [Αναφ. 5]
|
|
Φυσική ή Χημική ιδιότητα |
Η2Ο |
D2O |
|
Ενέργεια δεσμού (kJ/mol για κάθε
δεσμό, στους 0 Κ) |
(H-O-H
 2H + O) 458,9
2H + O) 458,9 |
(D-O-D
 2D + O) 466,4
2D + O) 466,4 |
|
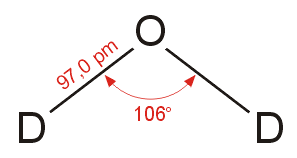
Μήκος δεσμού (υγρό, ab initio, σε
pm) |
(Ο-Η) 91,0 |
(O-D) 97,0 |
|
Γωνία δεσμών (υγρό, ab initio) |
105,5° |
106° |
|
Ενθαλπία σχηματισμού (kJ/mol, στους
25°C) |
-285,85 |
-294,6 |
| |
|
|
|
Σημείο βρασμού (°C, σε πίεση 101,325
kPa) |
100,00 |
101,42 |
|
Σημείο τήξης (°C, σε πίεση 101,325
kPa) |
0,00 |
3,82 |
|
Πυκνότητα (kg/m3, στους
25°C) |
997,05 |
1104,36 |
|
Πυκνότητα πάγου (kg/m3,
στο σημείο τήξης) |
916,72 |
1017,5 |
| |
|
|
|
Θερμοκρασία στο τριπλό σημείο (°C) |
0,01 |
3,80 |
|
Πίεση στο τριπλό σημείο (Pa) |
611,657 |
660,096 |
|
Θερμοκρασία στο κρίσιμο σημείο (K)
|
647,096 |
643,847 |
|
Πίεση στο κρίσιμο σημείο (MPa)
|
22,064 |
21,671 |
|
Τάση ατμών (kPa,
στους 25°C) |
3,165 |
2,734 |
| |
|
|
|
Γραμμομοριακή μάζα (g/mol) |
18,015268 |
20,027508 |
|
Γραμμομοριακότητα κατά μάζα (mol/kg) |
55,508472 |
49,931324 |
| |
|
|
|
Σταθερά διάστασης K = [H+][OH-]/[H2O]
(mol/L, στους 25°C) |
1,821 x 10-16
|
3,54 x 10-17
|
|
pH ή pD (στους 25°C) |
6,9996 |
7,43 |
|
pKw (στους 25°C) |
13,9991 |
14,87 |
| |
|
|
|
Ταχύτητα ήχου (m/s, στους 25°C) |
1496,7 |
1399,2 |
|
Δυναμικό ιξώδες (mPa s, τους 25°C) |
0,8909 |
1,095 |
|
Κινηματικό ιξώδες (m2/s,
στους 25°C) |
0,8935 x 10-6
|
0,9915 x 10-6
|
|

Επάνω:
Πάγος φυσικού ύδατος επιπλέει σε φυσικό ύδωρ.
Κάτω: Πάγος βαρέος
ύδατος βυθίζεται σε φυσικό ύδωρ (από την
[Αναφ. 6]). |
Κάποιες από τις χαρακτηριστικότερες διαφορές
Πυκνότητα στερεών μορφών
(πάγων): Είναι ιδιαίτερα
χαρακτηριστική η διαφορά στις πυκνότητες των στερεών μορφών τους. Πάγος βαρέος ύδατος, σε αντίθεση με τον πάγο του φυσικού υδατος, βυθίζεται στο φυσικό
νερό, ενώ επιπλέει στο ίδιο το βαρύ ύδωρ.
Διαφορετικές σταθερές ισορροπίας
διάστασης (Kw):
'Αλλη χαρακτηριστική διαφορά μεταξύ του D2O
και του H2O είναι ότι το pH
(για την ακρίβεια το pD) του καθαρού βαρέος ύδατος είναι 7,43, αφού το βαρύ ύδωρ
διίσταται σε μικρότερο βαθμό από το φυσικό ύδωρ (pKw
= 14,87). Μια αρκετά εύλογη ερμηνεία αυτής διαφοράς μπορεί να αναζητηθεί
εδώ.
Παραγωγή βαρέος
ύδατος
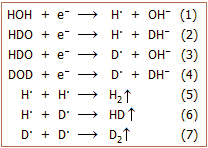 Η παραγωγή βαρέος
ύδατος σε μεγάλες ποσότητες είναι αρκετά δαπανηρή. Δεν πρόκειται βέβαια για παρασκευή βαρέος ύδατος (υπάρχει άφθονο στη φύση), αλλά για
την απομόνωσή του από το φυσικό
νερό, η οποία θα πρέπει να βασιστεί στις μικροδιαφορές των τιμών ορισμένων από τις φυσικοχημικές ιδιότητες
των Η2Ο
και
D2O.
Η παραγωγή βαρέος
ύδατος σε μεγάλες ποσότητες είναι αρκετά δαπανηρή. Δεν πρόκειται βέβαια για παρασκευή βαρέος ύδατος (υπάρχει άφθονο στη φύση), αλλά για
την απομόνωσή του από το φυσικό
νερό, η οποία θα πρέπει να βασιστεί στις μικροδιαφορές των τιμών ορισμένων από τις φυσικοχημικές ιδιότητες
των Η2Ο
και
D2O.
Κατ' αρχήν θα μπορούσε να
διαχωριστεί το βαρύ ύδωρ από το φυσικό νερό ή το δευτέριο από το φυσικό υδρογόνο
με απόσταξη, αξιοποιώντας τις μικρές διαφορές στα σημεία βρασμού (το βαρύ ύδωρ
ζέει στους 101,4ºC,
ενώ το φυσικό νερό στους 100,0ºC και το υγρό δευτέριο ζέει
στους -249,7ºC, ενώ το υγρό υδρογόνο στους
-252,5ºC)
[Αναφ. 7α].
Στην περίπτωση του υγρού υδρογόνου, ο χειρισμός μεγάλων ποσοτήτων του είναι
δυσχερής, λόγω του εξαιρετικά χαμηλού σημείου βρασμού του, ενώ στην περίπτωση
του ύδατος, λόγω της μεγάλης θερμότητας εξάτμισής του, είναι προφανές ότι θα χρειάζονταν άφθονες ποσότητες καυσίμων ή
ηλεκτρικής ενέργειας.
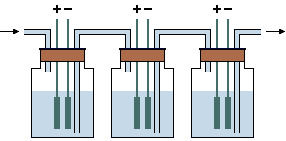 Ο ηλεκτρολυτικός εμπλουτισμός του φυσικού ύδατος σε
δευτέριο βασίζεται στη μεγαλύτερη ταχύτητα αναγωγής του πρωτίου Η(+1) προς H2
στην κάθοδο ηλεκτρολυτικού στοιχείου σε σχέση με την αναγωγή του δευτερίου D(+1) προς D2
ή/και προς HD. Αυτή η διαφορά προφανώς σχετίζεται με την ελαφρώς μεγαλύτερη
ευκινησία των μορίων H2O
σε σχέση με τα μόρια HDO ή D2O.
'Ετσι, στο εκλυόμενο κατά την ηλεκτρόλυση υδρογόνο η αναλογία H/D είναι 4 έως 8
φορές μεγαλύτερη από εκείνη του υδρογόνου του ηλεκτρολυόμενου διαλύματος και
επομένως το τελευταίο εμπλουτίζεται σε δευτέριο.
Ο ηλεκτρολυτικός εμπλουτισμός του φυσικού ύδατος σε
δευτέριο βασίζεται στη μεγαλύτερη ταχύτητα αναγωγής του πρωτίου Η(+1) προς H2
στην κάθοδο ηλεκτρολυτικού στοιχείου σε σχέση με την αναγωγή του δευτερίου D(+1) προς D2
ή/και προς HD. Αυτή η διαφορά προφανώς σχετίζεται με την ελαφρώς μεγαλύτερη
ευκινησία των μορίων H2O
σε σχέση με τα μόρια HDO ή D2O.
'Ετσι, στο εκλυόμενο κατά την ηλεκτρόλυση υδρογόνο η αναλογία H/D είναι 4 έως 8
φορές μεγαλύτερη από εκείνη του υδρογόνου του ηλεκτρολυόμενου διαλύματος και
επομένως το τελευταίο εμπλουτίζεται σε δευτέριο.
Η ηλεκτρόλυση πραγματοποιείται σε υδατικά διαλύματα
ισχυρών βάσεων και οι αντιδράσεις στις καθόδους αφορούν αναγωγές των μορίων H2O,
ΗDO, D2O,
που θα μπορούσαν να παρασταθούν από τις ημιαντιδράσεις (1) - (4). Οι
ανασυνδέσεις των αρχικά σχηματιζόμενων ριζών Η· και D·, οδηγούν στην
έκλυση των αερίων H2,
HD και D2.
Η ημιαντίδραση (1) πραγματοποιείται με κάπως μεγαλύτερη ταχύτητα από τις ημιαντιδράσεις (2)-(4).
Σταδιακά το ηλεκτρολυόμενο διάλυμα εμπλουτίζεται σε δευτέριο,
δεδομένου όμως ότι και οι άλλες ημιαντιδράσεις προχωρούν, θα υπάρχει και απώλεια
σημαντικού κλάσματος του δευτερίου. Θα πρέπει να σημειωθεί ότι η ηλεκτρόλυση
2700 L φυσικού ύδατος μέχρι να ληφθεί 1 L ύδατος, θα επιφέρει εμπλουτισμό σε
βαρύ ύδωρ μόνο κατά 10 φορές!
Η όλη
διαδικασία είναι εξαιρετικά ηλεκτροβόρα. Για να αυξηθεί η απόδοση της όλης
διαδικασίας, η ηλεκτρόλυση εκτελείται σε διαδοχικά ηλεκτρολυτικά στοιχεία (cascaded
cells), όπου σταδιακά το ηλεκτρολυόμενο διάλυμα του ενός στοιχείου
αντικαθιστά το ηλεκτρολυόμενο διάλυμα του επόμενου.
Ακόμη είναι τελείως απαραίτητο το υδρογόνο, το οποίο εκλύεται στα τελευταία σε σειρά
στοιχεία και περιέχει δευτέριο σε πολύ μεγαλύτερη ισοτοπική αναλογία απ'
ό,τι το φυσικό υδρογόνο,
να συλλέγεται, να "καίγεται" και το πλουσιότερο σε δευτέριο νερό που σχηματίζεται, να προστίθεται στα πρώτα σε σειρά
ηλεκτρολυτικά στοιχεία.
|

(α) |

(β) |

(γ) |
|
Από τις πρώτες μονάδες
παραγωγής βαρέος ύδατος στις ΗΠΑ, ήταν εκείνη του Πανεπιστημίου του Ohio (1935): (α) Κύριο τμήμα: 1000 υδρόψυκτα ηλεκτρολυτικά
στοιχεία μετέτρεπαν 100 γαλόνια (3785 L) αραιού βαρέος ύδατος
(0,05%) από
εμπορικά στοιχεία σε 11 L D2O
1%. Κάθε ηλεκτρολυτικό στοιχείο ήταν μια ευρύστομη σφαιρική φιάλη
των 500 mL εφοδιασμένη με δύο ηλεκτρόδια από σίδηρο και σωληνώσεις
επικοινωνίας με την προηγούμενη και την επόμενη. (β) Ενδιάμεσο
τμήμα: Ηλεκτρολυτικά στοιχεία υψηλού ρεύματος,
όπου το προϊόν του προηγούμενου τμήματος συμπυκνωνόταν σε D2O
10%. Το πλούσιο σε D υδρογόνο που παραγόταν κατά την
ηλεκτρόλυση δεν έπρεπε να χαθεί, οπότε "καιγόταν",
οι παραγόμενοι ατμοί ύδατος συμπυκνώνονταν και το πλούσιο σε D νερό συλλεγόταν και επέστρεφε
στα ηλεκτρολυτικά στοιχεία του πρώτου τμήματος. (γ) Τελικό τμήμα: Τελικό στάδιο συμπύκνωσης, όπου το προϊόν του
προηγουμένου τμήματος συμπυκνωνόταν σε D2O
99%. Η παραγωγή ήταν περίπου 50 g εβδομαδιαίως, με κόστος λίγο
μεγαλύτερο από 2 $/g
[Αναφ. 8]. |
|
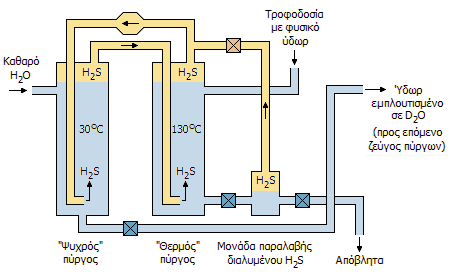
Μονάδα ζεύγους "ψυχρού/θερμού"
πύργου για εμπλουτισμό του φυσικού ύδατος
με βαρύ ύδωρ σύμφωνα με τη
μέθοδο Girdler-θειούχων (αρχή). |
Παραγωγή βαρέος ύδατος με τη μέθοδο Girdler-θειούχων. Σήμερα η παραγωγή βαρέος ύδατος σε βιομηχανική
κλίμακα δεκάδων και εκατοντάδων τόννων πραγματοποιείται σχεδόν αποκλειστικά με
μεθόδους που βασίζονται σε αντιδράσεις ισοτοπικής ανταλλαγής.
Στις αντιδράσεις
ισοτοπικής ανταλλαγής έρχονται σε επαφή δύο υδρογονούχες ενώσεις (Α και Β,
συνήθως η μία αέρια και η άλλη υγρή) και υπάρχει μια
ελαφρά προτίμηση του δευτερίου της Α να αντικαταστήσει το πρώτιο της Β, με
αποτέλεσμα η Α να "απεμπλουτίζεται" και η Β να "εμπλουτίζεται" σε δευτέριο.
Η γνωστότερη από τις μεθόδους αυτές είναι η μέθοδος Girdler-θειούχων (Girdler-Sulfide process)
γνωστή και ως μέθοδος Geib-Spevack (GS). Οι Geib και Spevack την
ανεκάλυψαν το 1940 και εφαρμόστηκε για πρώτη φορά στη βιομηχανία Girdler
[Αναφ. 7]. Η αρχή της μεθόδου, που ανήκει στις διθερμικές
(bithermal processes) για λόγους που θα φανούν στη συνέχεια, είναι η ακόλουθη:
Σε χαμηλές θερμοκρασίες (στους 30ºC)
ευνοείται η μεταπήδηση του δευτερίου από το
υδρόθειο (π.χ. από το ημιβαρύ υδρόθειο HDS, που θα βρίσκεται και σε μεγαλύτερη
αναλογία στο φυσικό υδρόθειο, όπως και το
HDO στο φυσικό νερό) στο
νερό, ενώ σε υψηλότερες θερμοκρασίες (στους 130ºC) η προηγούμενη ισορροπία
μετατοπίζεται σε κάποιο βαθμό προς τα αντιδρώντα, δηλ.
ευνοείται η μεταπήδηση του δευτερίου από το
ημιβαρύ ύδωρ προς το υδρόθειο. Οι σχετικές
ισορροπίες δείχνονται στις παρακάτω αντιδράσεις ισοτοπικής ανταλλαγής.

Σε σύστημα δύο αντιδραστήρων-πύργων (τον "ψυχρό"
και τον "θερμό") κυκλοφορεί αέριο υδρόθειο σε κλειστό βρόχο. Απιοντισμένο και
αποξυγονωμένο νερό εισέρχεται στον "ψυχρό πύργο", όπου το δευτέριο από το
υδρόθειο αντικαθιστά (πάντοτε εν μέρει) το πρώτιο του νερού. Το υδρόθειο στη συνέχεια περνάει στον "θερμό" πύργο,
όπου επανεμπλουτίζεται σε δευτέριο από το θερμό νερό. Το απεμπλουτισμένο νερό
του θερμού πύργου διοχετεύεται στα απόβλητα, αφού προηγουμένως παραληφθεί το
διαλυμένο σ' αυτό υδρόθειο και αντικαθίσταται με νέο φυσικό νερό. Παράλληλα, ποσότητες
του εμπλουτισμένου σε δευτέριο νερού του "ψυχρού" πύργου οδηγείται στο επόμενο
ζεύγος ψυχρού/θερμού πύργου, κ.ο.κ.
'Ετσι, το πρώτο ζεύγος (που χειρίζεται τις μεγαλύτερες
ποσότητες ύδατος και υδροθείου) εμπλουτίζει το νερό, αυξάνοντας την
ισοτοπική περιεκτικότητα από τη φυσική τιμή 0,015% στα περίπου 0,07%, το δεύτερο ζεύγος
την αυξάνει στα 0,35%, ενώ το τρίτο την αυξάνει στην περιοχή 10-30%. Ο τελικός εμπλουτισμός/καθαρισμός πραγματοποιείται
με διαδοχικές αποστάξεις υπό κενό, που παρέχουν βαρύ ύδωρ με ισοτοπική
καθαρότητα μεγαλύτερη από 99%, όπως π.χ. βαρύ ύδωρ με ισοτοπική καθαρότητα
99,75%, που αναφέρεται ως "ποιότητας αντιδραστήρων" (reactor grade).
Ενώ η αρχή της μεθόδου Girdler-θειούχων είναι απλή,
στην πράξη απαιτείται πολύ λεπτός έλεγχος θερμοκρασιών, ροών και πολλών παραμέτρων για να
μεγιστοποιηθεί η παραγωγή με τη μικρότερη δυνατή κατανάλωση ενέργειας και
φυσικού ύδατος.
'Οσο μεγαλύτερη είναι απαιτούμενη
"ισοτοπική καθαρότητα", τόσο περισσότερες διαδοχικές αποστάξεις απαιτούνται και
το κόστος του βαρέος ύδατος ανεβαίνει θεαματικά. Ενδεικτικά, οι τιμές που
αναφέρονται στον τιμοκατάλογο της εταιρείας Aldrich (2007-08) για συσκευασίες
(αμπούλες) 10 g βαρέος ύδατος
ισοτοπικής καθαρότητας 99,9%, 99,96%, 99,990% και 99,996% είναι αντίστοιχα:
20,8, 41,4, 103,5 και 152,0 ευρώ. Σε μεγαλύτερες συσκευασίες βέβαια το κόστος
μειώνεται σημαντικά (π.χ. 1 kg D2O,
99,96% κοστίζει 1.350 ευρώ).
Βιομηχανιές βαρέος ύδατος
Το 1953 οι ΗΠΑ άρχισαν να χρησιμοποιούν
βαρύ ύδωρ για την παραγωγή πλουτωνίου και τριτίου, που χρειάζονταν για το πυρηνικό
τους οπλοστάσιο (Savannah River Site). Δεν είναι
γνωστή η παραγωγή βαρέος ύδατος από τις ΗΠΑ.
Ο Καναδάς συνέβαλε στο Σχέδιο
Manhattan για την κατασκευή της πρώτης ατομικής βόμβας,
έχοντας εργοστάσια ηλεκτρολυτικής παρασκευής βαρέος ύδατος με δυναμικότητα 6
τόννων κατ' έτος (στο Trail
της Βρετανικής Κολομβίας), τα οποία άρχισαν να λειτουργούν το 1943.
Το εργοστάσιο Bruce
Heavy Water Plant (Ontario) ξεκίνησε το 1979
και υπήρξε το μεγαλύτερο στον κόσμο με ετήσια παραγωγή 700 τόννων.
Χρησιμοποιούσε τη μέθοδο Girdler-θειούχων και χρειαζόταν τροφοδοσία 340.000
τόννων νερού για την παραγωγή 1 τόννου βαρέος ύδατος.
Το εργοστάσιο
έκλεισε το
1997, τόσο για οικονομικούς, όσο και για περιβαλλοντικούς λόγους, αφού δεν
έλλειψαν και περιστατικά διαρροής υδροθείου [Αναφ.
9].
Η Υπηρεσία Ατομικής Ενέργειας στον Καναδά διερευνά άλλες μεθόδους παραγωγής βαρέος ύδατος, ειδικά για τους αντιδραστήρες νέας γενιάς
CANDU (CANadian Deuterium
Uranium) όπου το 20%
του κεφαλαίου του πυρηνικού αντιδραστήρα αφορά την προμήθεια του βαρέος ύδατος, που θα αποτελούσε το
κύριο μέσο επιβραδυντή και ψύκτη του αντιδραστήρα
[Αναφ. 10].
Η Ινδία είναι ο δεύτερος
μεγαλύτερος παραγωγός βαρέος ύδατος (Heavy Water Board,
http://www.heavywaterboard.org).
Το Ιράν, με φιλόδοξα σχέδια για πυρηνικούς σταθμούς, ξεκίνησε την
επέκταση του σταθμού παραγωγής βαρέος ύδατος στο Arak.
'Αλλες χώρες που παράγουν βαρύ ύδωρ είναι η Αργεντινή, η Ρουμανία, το
Πακιστάν, η Γαλλία και η Ρωσία, αλλά δεν υπάρχουν πληροφορίες για τις ποσότητες
που παράγουν.
|
Σύγκριση βιομηχανικών
μεθόδων παρασκευής βαρέος ύδατος
Οι δυνατότητες χρήσης αντιδράσεων ισοτοπικής
ανταλλαγής για τον εμπλουτισμό του ύδατος σε βαρύ ύδωρ και τελικά την παρασκευή
καθαρού βαρέος ύδατος δεν περιορίζονται μόνο στη μέθοδο Girdler-θειούχων
(ισοτοπική ανταλλαγή μεταξύ των H2S/H2O).
Υπάρχουν πολλές αντιδράσεις ισοτοπικής ανταλλαγής, που αξιοποιούνται για
τον ίδιο σκοπό,
όπως π.χ. τα συστήματα ανταλλαγής ΝΗ3/Η2,
CH3NH2/H2,
H2O/H2.
Μια σύγκριση από κάθε άποψη των τεχνικών αυτών, περιλαμβανομένων και των
μεθόδων απόσταξης, ηλεκτρόλυσης αλλά και ισοτοπικού διαχωρισμού με τη χρήση laser,
πραγματοποιείται στο εξαιρετικά πληροφοριακό άρθρο του Alister I. Miller με
τίτλο "Heavy Water: A Manufacturers' Guide for the Hydrogen Century"
[Αναφ. 11].
|
Επιβράδυνση νετρονίων
|

Τυπική μορφή ράβδων
πυρηνικών καυσίμων.
Για περισσότερα
πάνω στα πυρηνικά καύσιμα, βλ. "Χημική ένωση του μήνα:
Εξαφθοριούχο ουράνιο". |
Η
χρησιμότητα του βαρέος ύδατος στους πυρηνικούς αντιδραστήρες οφείλεται στην
ικανότητά του να δρα ως επιβραδυντής (moderator)
των νετρονίων. Τα βραδέα ή θερμικά νετρόνια (με ενέργειες
0,01-0,10 eV) είναι πιο πιθανό να
προκαλέσουν σχάση σε ασταθείς πυρήνες (όπως π.χ. του U-235). Ωστόσο, τα
νετρόνια τα οποία παράγονται κατά τη σχάση έχουν εξαιρετικά μεγαλύτερες ταχύτητες και
αναφέρονται ως ταχέα νετρόνια (με ενέργειες 0,10-2,0
MeV). Για να
συντηρηθεί η αλυσιδωτή πυρηνική αντίδραση, θα πρέπει τα "ταχέα" νετρόνια να επιβραδυνθούν
σε "θερμικά".
Οι αντιδραστήρες που απαιτούν επιβραδυντές
ονομάζονται θερμικοί αντιδραστήρες (thermal reactors)
[Αναφ. 12].
Η
παρεμβολή ενός επιβραδυντή νετρονίων μεταξύ των ράβδων με
πυρηνικά καύσιμα, είναι κοινό γνώρισμα του πυρήνα όλων των
θερμικών αντιδραστήρων. Τα περισσότερα από τα παραγόμενα κατά τη σχάση του
καυσίμου νετρόνια διαφεύγουν από τις ράβδους και συγκρούονται με τα άτομα του
επιβραδυντή, πριν "χτυπήσουν" άλλες ράβδους καυσίμου. Με τις συγκρούσεις αυτές
μέρος της κινητικής τους ενέργειας μεταφέρεται στα άτομα του επιβραδυντή. Αυτό
θερμαίνει τον επιβραδυντή, αλλά τα αργά πλέον νετρόνια εισέρχονται στις ράβδους
και είναι σε θέση να προκαλέσουν σχάση στο πυρηνικό καύσιμο.
Ως επιβραδυντές στους πυρηνικούς αντιδραστήρες
θα μπορούσαν να χρησιμοποιηθούν ουσίες, όπως ο άνθρακας (ως γραφίτης εξαιρετικής καθαρότητας), το φυσικό νερό,
τα βαρύ ύδωρ και το βηρύλλιο. Το φυσικό νερό είναι ο δραστικότερος επιβραδυντής,
αλλά παρουσιάζει το φαινόμενο όχι απλώς να τα επιβραδύνει τα νετρόνια, αλλά και να τα "συλλαμβάνει" (neutron capture)
σύμφωνα με την αντίδραση
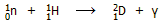
με
αποτέλεσμα να είναι αδύνατη η διατήρηση της αλυσιδωτής πυρηνικής αντίδρασης, εάν
ως "καύσιμο" χρησιμοποιείται φυσικό ουράνιο με περιεκτικότητα σε U-235 0,71%.
Για να χρησιμοποιηθεί φυσικό νερό θα πρέπει το "καύσιμο" να είναι εμπλουτισμένο
ουράνιο με περιεκτικότητα σε U-235 τουλάχιστον 2,5%.
|
Οι επιλογές για να
συντηρηθεί η πυρηνική αντίδραση είναι:
α) Καύσιμο: φυσικό
ουράνιο (0,71% σε U-235),
επιβραδυντής: βαρύ ύδωρ (>99,5% σε D).
β) Καύσιμο: εμπλουτισμένο
ουράνιο
(2,5-3,5% σε U-235) , επιβραδυντής: φυσικό νερό.
|
Το βαρύ ύδωρ συνδυάζει πολλά επιθυμητά
χαρακτηριστικά. Παρουσιάζει μικρότερη πιθανότητα "σύλληψης" των νετρονίων σε
σχέση με το φυσικό νερό και μπορεί να χρησιμοποιηθεί ως επιβραδυντής σε
αντιδραστήρες που ως καύσιμο χρησιμοποιούν φυσικό ουράνιο. Ακόμη ως υγρό, σε
σχέση με τους στερεούς επιβραδυντές (π.χ. τον γραφίτη), έχει τη δυνατότητα κυκλοφορίας και μπορεί να δράσει ως
μέσο ψύξης και μεταφοράς θερμότητας σε κλειστό βρόχο, από τον πυρήνα
του αντιδραστήρα σε γεννήτριες παραγωγής ηλεκτρικής ενέργειας.
Σήμερα, στους περισσότερους πυρηνικούς αντιδραστήρες παραγωγής ενέργειας,
χρησιμοποιείται φυσικό νερό, αφού έγινε εφικτή η παραγωγή εμπλουτισμένου ουρανίου
(βλ. "Χημική ένωση του μήνα:
Εξαφθοριούχο ουράνιο").
|

Η εποποιία του βαρέος ύδατος στη Νορβηγία κατά τον 2ο Παγκόσμιο Πόλεμο
αποτέλεσε τη βάση του
σεναρίου της κινηματογραφικής παραγωγής
του 1965
"Οι ήρωες του Τέλεμαρκ".
|
Το βαρύ ύδωρ κατά
τον Δεύτερο Παγκόσμιο Πόλεμο
[Αναφ.
13]
Ένα από τα πρώτα εργοστάσια παραγωγής βαρέος ύδατος
υπήρξε η μονάδα
Vemork της υδροηλεκτρικής εταιρείας Norsk Hydro
της Νορβηγίας κοντά στην πόλη Rjukan,
της κομητείας Telemark. Το εργοστάσιο κτίστηκε το 1934
με σκοπό την παραγωγή ηλεκτρικής ενέργειας και αμμωνίας για λιπάσματα. Η επιτόπια
παραγωγή φθηνής ηλεκτρικής ενέργειας από τις άφθονες υδατοπτώσεις επέτρεπε
την ηλεκτρολυτική παρασκευή υδρογόνου για τη σύνθεση της αμμωνίας με τη μέθοδο Haber-Bosch.
Σύντομα διαπιστώθηκε από τους Νορβηγούς
επιστήμονες
Leif
Tronstad
(Καθηγητής του Τεχνολογικού Ινστιτούτου του Trodheim)
και Jomar Brun
(Χημικός, τότε επικεφαλής αρχιμηχανικός της μονάδας ηλεκτρόλυσης) ότι το εργοστάσιο
Vemork πληρούσε κάθε
προϋπόθεση παραγωγής βαρέος ύδατος, αφού ούτως ή άλλως καθημερινά
ηλεκτρολύονταν μεγάλες ποσότητες φυσικού ύδατος. 'Ετσι, οργάνωσαν στο
εργοστάσιο μια μονάδα
παραγωγής και καθαρισμού βαρέος ύδατος. Η πρώτη ποσότητα βαρέος ύδατος, με ισοτοπική
καθαρότητα 99%, ήταν έτοιμη τον Ιανουάριο του 1935 με κόστος μόλις 50 cent/g, περίπου
το 1/10 της τότε τιμής του βαρέος ύδατος που παραγόταν στις ΗΠΑ
[Αναφ. 1β].
 |
 |
|
Δύο από τους ήρωες του
Telemark. Οι Καθηγητές Χημείας
του Τεχνολογικού Ινστιτούτου
του Trodheim:
(αριστερά) ο Leif Tronstad
(1903-1945), (δεξιά) ο Jomar Brun (1904-1993). Οργάνωσαν τη
μονάδα παραγωγής βαρέος ύδατος στο Εργαστάσιο Vemork, αλλά
οι ίδιοι ήσαν που βοήθησαν στην καταστροφή της για να μη
χρησιμοποιηθεί από τις κατοχικές δυνάμεις. |
Στη Γερμανία της εποχής εκείνης υπήρχαν
διάσημοι επιστήμονες όπως οι
Werner Heisenberg,
Walter Bothe,
Paul Harteck και
o Klaus Clusius
που γνώριζαν την αξία του βαρέος ύδατος
και είχαν ήδη πειραματισθεί με το υλικό.
Για να
μπορέσουν να συνεχίσουν τα πειράματα σχάσης με φυσικό ουράνιο θα έπρεπε να χρησιμοποιηθεί ως επιβραδυντής
νετρονίων βαρύ ύδωρ ή υπερκαθαρός γραφίτης, που ήταν εξαιρετικά δαπανηρός και δυσεύρετος σε καιρό
πολέμου.
Οι
Γερμανοί, μετά την κατάληψη της Νορβηγίας, συνέχισαν ακόμη πιο εντατικά την παραγωγή του βαρέος
ύδατος στο Vemork με σκοπό την αποστολή του
παραγόμενου βαρέος ύδατος στα εργαστήρια πυρηνικών ερευνών στη Γερμανία και
αύξησαν την ετήσια παραγωγή βαρέος ύδατος της
μονάδας από 20 L σε 1 τόννο
[Αναφ. 1β].
Οι Σύμμαχοι γνώριζαν το γεγονός αυτό, όπως επίσης
και τη σημασία του βαρέος ύδατος για το πυρηνικό πρόγραμμα των
Γερμανών, το οποίο απέβλεπε προφανώς στην κατασκευή πυρηνικών όπλων.
Το Νοέμβριο
του 1942 μια ομάδα κομάντος των συμμάχων
επιχείρησε να καταστρέψει το εργοστάσιο παραγωγής βαρέος ύδατος, αλλά απέτυχε
τραγικά.
Το αεροσκάφος τους συνετρίβη και όσοι επέζησαν εκτελέστηκαν από τις κατοχικές
δυνάμεις.
Στις 28 Φεβρουαρίου 1943, με τη βοήθεια ανταρτών της Νορβηγικής αντίστασης και
καθοδηγούμενοι από τους ίδιους Νορβηγούς επιστήμονες, οι οποίοι το 1933
σχεδίασαν την ηλεκτρολυτική μονάδα του εργαστασίου Vemork,
τους
Tronstad και Brun, ανατίναξαν τη μονάδα
τελικής συμπύκνωσης του βαρέος ύδατος μαζί με το περιεχόμενό της, δηλ. περίπου
500 κιλά βαρέος ύδατος.
Η επέτειος αυτής της αντιστασιακής ενέργειας εορτάζεται κάθε χρόνο στη Νορβηγία και ιδιαίτερα στην περιοχή του εργοστασίου.
Παρ' όλα αυτά το εργοστάσιο Vemork επισκευάσθηκε και από τον Μάιο του 1943,
ξανάρχισε την παραγωγή βαρέος ύδατος.Τελικά το εργοστάσιο δέχτηκε βομβαρδισμό από
συμμαχικά αεροπλάνα στις 16 Νοεμβρίου 1943, με αρκετές απώλειες εργατών
και κατοίκων της περιοχής. Οι κατοχικές δυνάμεις δεν επιχείρησαν ανακατασκευή
του Vemork, προτιμώντας να συγκροτήσουν μονάδα παραγωγής βαρέος ύδατος στη Γερμανία.
Στις 20 Φεβρουαρίου 1944, το τελευταίο φορτίο βαρέος
ύδατος για τη Γερμανία χάθηκε, όταν το πλοίο (το φέρυ HYDRO) βυθίστηκε από
Νορβηγούς σαμποτέρ. Το τελικό πλήγμα στα σχέδια του 'Αξονα για πυρηνικά όπλα,
επέφεραν οι συμμαχικοί βομβαρδισμοί του 1944, που κατέστρεψαν τα
εργαστήρια όπου γίνονταν πειράματα με βαρύ ύδωρ,
στο Βερολίνο και στο Αμβούργο.
 |
 |
 |
|
Το υδροηλεκτρικό
εργαστάσιο Vemork, όπως είναι
σήμερα που λειτουργεί ως
βιομηχανικό μουσείο. |
Συστοιχία
συλλογέων βαρέος ύδατος της μονάδας ηλεκτρολυτικής παραγωγής του εργοστασίου Vemork. |
Το υδροηλεκτρικό
εργαστάσιο Vemork κατά τον βομβαρδισμό του από την αεροπορία
των συμμάχων τον Νοέμβριο του 1943. |
|
Βαρύ ύδωρ : επιπτώσεις στα
βιολογικά συστήματα
Αν και τα ισότοπα διαφόρων στοιχείων είναι
ελαφρώς διαφορετικά στα χημικά και φυσικά χαρακτηριστικά τους, το δευτέριο και το
τρίτιο διαφέρουν σημαντικά από το πρώτιο γιατί οι ενέργειες
των δεσμών με άλλα άτομα, όπως με το οξυγόνο στο νερό, είναι αρκετά διαφορετικές. Το βαρύ ύδωρ έχει
βρεθεί ότι επηρεάζει τους βιοχημικούς μηχανισμούς λειτουργίας και τους
κιρκαδικούς ρυθμούς (circadian
oscillation), δηλ. κύκλους με περίοδο σχεδόν 24 ωρών στις βιοχημικές,
φυσιολογικές και συμπεριφορικές διεργασίες κάθε είδους ζώντος οργανισμού. Επίσης
επηρεάζονται τα ένζυμα, ο καταλυτικός μηχανισμών των οποίων επηρεάζεται από το
σύνολο των δεσμών-υδρογόνου, τόσο στο ενεργό κέντρο όσο και στο υπόστρωμα
[Αναφ. 1α].
Επειδή η δεσμός υδρογόνου την περίπτωση του
δευτερίου είναι ελαφρά ισχυρότερος από αυτόν του
πρωτίου, σε δευτεριωμένο υδατικό περιβάλλον, οι λειτουργίες των κυττάρων επηρεάζονται. Σε
περιβάλλον βαρέος ύδατος επηρεάζεται ιδιαίτερα η διαίρεση των κυττάρων με μίτωση. Τα φυτά δεν αναπτύσσονται και οι σπόροι δεν φυτρώνουν σε βαρύ ύδωρ.
Το βαρύ ύδωρ δεν είναι τοξικό για τον άνθρωπο και
βέβαια δεν είναι ραδιενεργό. Το σώμα του ανθρώπου πάντοτε περιέχει μια μικρή ποσότητα βαρέος ύδατος, π.χ. το σώμα ανθρώπου 70 kg, περιέχει 45 χιλιόγραμμα
ύδατος και επομένως περιέχει δευτέριο που ισοδυναμεί με περίπου 7,6 γραμμάρια βαρέος ύδατος.
Για να αρχίσουν να φαίνονται οι τοξικές επιπτώσεις
του βαρέος ύδατος στον ανθρώπινο οργανισμό θα πρέπει η περιεκτικότητά του να φθάσει
το 20-30% στο νερό του οργανισμού. 'Οταν η περιεκτικότητα του βαρέος ύδατος φθάσει το 50% επέρχεται ο
θάνατος. 'Ετσι, εκτιμάται ότι ένα άτομο βάρους 70 kg θα πρέπει να πίνει
καθημερινά 3 λίτρα καθαρού βαρέος ύδατος επί 5 και 11 ημέρες για να φτάσει σε ποσοστό δευτερίωσης
25% και 50%, αντίστοιχα. Δηλαδή, θα χρειαστεί περίπου μία εβδομάδα για να
αρχίσει μην αισθάνεται καλά και 10 ημέρες έως 2 εβδομάδες για να πεθάνει λόγω
της τοξικότητάς του. Το όλο σενάριο είναι βέβαια εξαιρετικά απίθανο να συμβεί.
Ανασκόπηση των βιοτεχνολογικών εφαρμογών του βαρέος
ύδατος και των δευτεριωμένων ενώσεων, όπως επίσης και περισσότερες λεπτομέρειες
πάνω στην επίδραση του βαρέος ύδατος σε μικροοργανισμούς μπορούν να αναζητηθούν
στην [Αναφ. 14].
Αντιδράσεις ανταλλαγης Η με D στο βαρύ ύδωρ
|
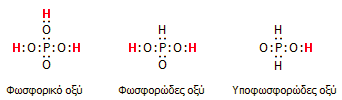
Τα τρία οξυοξέα του
φωσφόρου. Με κόκκινο χρώμα συμβολίζονται τα ευκίνητα άτομα υδρογόνου,
που μπορούν να αντικατασταθούν με δευτέριο κατά τη διάλυση των οξέων
σε βαρύ ύδωρ. |
Από νωρίς διαπιστώθηκε ότι το βαρύ ύδωρ μπορεί να
χρησιμεύσει στην εξακρίβωση δομών χημικών ενώσεων και μηχανισμών χημικών
αντιδράσεων. Για να καταστεί δυνατή η ανταλλαγή ενός ατόμου
Η μιας χημικής ένωσης με D, όταν αυτή διαλυθεί στο νερό, είναι προφανές ότι το
άτομο αυτό θα πρέπει να είναι ευκίνητο (labile), δηλ. να συμμετέχει,
αποσπώμενο από το μόριο, σε μια ισορροπία. Το γεγονός αυτό επιτρέπει μάλιστα χαρακτηρισμό του
δεσμού σύνδεσης του Η σε μια
ένωση.
|
Ανταλλαγή υδρογόνων οργανικών
ενώσεων - βαρέος ύδατος |
|
'Ενωση |
Παρατήρηση |
|
CH3COONa |
Καμία ανταλλαγή |
|
CH3COOΗ |
1 άτομο υδρογόνου
ανταλλάσσεται ταχύτατα |
|
C6H6 |
Καμία ανταλλαγή |
|
CH3CHO |
1 άτομο υδρογόνου
ανταλλάσσεται αργά |
|
HCHO |
2 άτομα υδρογόνου ανταλλάσσονται
αργά |
|
CH3COCH3 |
Aργή
ανταλλαγή σε ουδέτερο διάλυμα, ταχύτερη σε όξινο, ταχύτατη
ανταλλαγή όλων των υδρογόνων σε αλκαλικό |
|
CH3COCH2COCH3 |
'Ολα τα υδρογόνα
ανταλλάσσονται |
|
C2H2 |
Ανταλλαγή σε
αλκαλικό διάλυμα |
|
Γλυκόζη και σακχαρόζη |
Ανταλλάσσονται
αμέσως όλα τα υδρογόνα των υδροξυλίων |
|
HOCH2CH2OH |
2 άτομα υδρογόνου ανταλλάσσονται
αμέσως |
|
Αλβουμίνη αυγού |
'Ολα τα υδρογόνα
των αμινοομάδων ανταλλάσσονται |
|
Κυτταρίνη |
Ανταλλάσσονται
όλα τα υδρογόνα των υδροξυλίων |
|
Τυπικό παράδειγμα αποτελούν τα τρία οξυοξέα του φωσφόρου:
Φωσφορικό οξύ
(Η3PO4),
φωσφορώδες (ή φωσφονικό) οξύ (H3PO3)
και υποφωσφορώδες (ή φωσφινικό) οξύ (Η3PO2).
Διάλυση των οξέων αυτών σε βαρύ ύδωρ, παρέχει ως προϊόντα τα D3PO4,
D2HPO3
και DH2PO2,
αφού στο φωσφορικό οξύ όλα τα άτομα Η είναι ευκίνητα (υπόκεινται σε διάσταση),
ενώ τα ευκίνητα άτομα Η στο φωσφορώδες και στο υποφωσφορώδες οξύ είναι 2 και 1
αντίστοιχα, όπως πράγματι δικαιολογείται από τη δομή τους.
Ανάλογα, διάλυση του οξικού οξέος σε βαρύ ύδωρ
αναμένεται να δώσει ως τελικό προϊόν το δευτεριωμένο οξικό οξύ στο ευκίνητο
υδρογόνο του καρβοξυλίου (CH3COOD),
χωρίς να ανταλλαχθεί κανένα υδρογόνο του μεθυλίου. Αντίθετα, διάλυμα ακετόνης
σε βαρύ ύδωρ θα δώσει δευτεριωμένη στο μεθύλιο ακετόνη, λόγω της υφιστάμενης
ισορροπίας κετονικής - ενολικής μορφής κατά την οποία άτομο υδρογόνου από το
μεθύλιο μεταπηδά στο υδροξύλιο της ενολικής μορφής, το οποίο υπόκειται σε
διάσταση (έστω και περιορισμένη). Οι ισορροπίες έχουν ως εξής:

Oι ισορροπίες αυτές θα συνεχισθούν και στη
δευτεριωμένη μορφή της ακετόνης για να ληφθεί δι-δευτεριωμένη, τρι-δευτεριωμένη
κ.ο.κ., μέχρι τελικά να ανταλλαχθούν όλα τα άτομα υδρογόνου της ακετόνης από
δευτέριο και να προκύψει ως τελικό προϊόν η πλήρως δευτεριωμένη (εξα-δευτεριωμένη) ακετόνη, CD3COCD3.
Είναι προφανές ότι οι ανταλλαγές Η/D θα είναι ταχύτερες σε συνθήκες που ευνοούν
τη διάσταση των εξεταζόμενων μορίων. 'Ετσι στην περίπτωση της ακετόνης η
ανταλλαγή είναι ταχύτατη σε αλκαλικά διαλύματα, όπου ευνοείται η διάσταση της
ενολικής μορφής
[Αναφ. 8].
Στον παραπλεύρως πίνακα δίνονται οι πρώτες
παρατηρήσεις που αναφέρονται στη βιβλιογραφία ανταλλαγής υδρογόνων με άτομα δευτερίου
κατά τη διάλυση ή επίδραση περίσσειας βαρέος ύδατος σε ορισμένες οργανικές ενώσεις (από άρθρο
ανασκόπησης των Urey και Teal
[Αναφ. 15]
).
Το βαρύ ύδωρ στη φασματοσκοπία NMR.
Το βαρύ ύδωρ χρησιμοποιείται ευρύτατα στις δομικές μελέτες χημικών ενώσεων με
φασματοσκοπία NMR, όταν το νουκλίδιο ενδιαφέροντος είναι το υδρογόνο και
απαιτείται νερό ως διαλύτης. Το φυσικό νερό θα παρεμπόδιζε ισχυρά το σήμα και
στη θέση του χρησιμοποιείται βαρύ ύδωρ εξαιρετικής ισοτοπικής καθαρότητας
(τυπικά >99,99%). Δεδομένου ότι το δευτέριο έχει διαφορετική μαγνητική
ροπή από το πρώτιο, το βαρύ ύδωρ δεν θα συνεισφέρει στις συχνότητες συντονισμού
του υδρογόνου.
Βιβλιογραφία -
Πηγές από το Διαδίκτυο
1. (α)
Wikipedia: "Heavy
water". (β)
Waltman C (Department
of Physics and Astronomy, University of British Columbia, 2002):
"An
Early History of Heavy Water" (αρχείο
PDF, 227 KB). (γ) Birge RT,
Menzel DH:
"The relative
abundance of the oxygen isotopes, and the basis of the atomic wight system", Physical Review
37:1669-1670, 1931. (δ)
Urey HC,
Brickwedde FG, Murphy GM:
"A hydrogen isotope mass 2", Physical Review
39:164-165, 1932. (ε) Hamer
WJ, Peiser SH (National
Institute of Standards and Technology, NIST:
A Chronicle of Selected NBS/NIST Publications, 1901-2000):
"A Hydrogen Isotope of Mass 2" (αρχείο
PDF, 77 KB). (στ) Urey H
(Encyclopoedia Britanica): "Deuterium".
2. (α) Nave CR: (Georgia State University,
2006): "HyperPhysics:
Hydrogen Spectrum". (β) Rice University, Physics, 332: "Spectroscpy of
Hydrogen Isotopes" (αρχείο
PDF, 101 KB).
3. (α) Lewis GN, MacDonald RT: "The
isotope of hydrogen", J. Amer. Chem. Soc. 55:1297, 1933. (β) Chemistry
Explained (foundations and applications): "Lewis
Gilber N.".
4. (α) Miller
S: "Production of
amino acids under possible primitive Earth conditions",
Science
117: 528-530, 1953 (αρχείο
PDF, 869 KB). (β) Miller SL, Urey HC:
"Organic
compound synthesis on the primitive Earth", Science 130:245-247,
1959.
(γ)
Wikipedia: "Miller-Urey
experiment".
5. Chaplin M (London Southbank University):
"Water Structure
and Science:
Water Properties (including heavy water data)".
6. Chemistry comes alive! (Journal of
Chemical Education): "Isotopes:
Heavy water ice cubes".
7.
(α) Federation of American
Scientists, Special Weapon Primer: "Heavy
Water Production". (β) Weapons of Mass Destruction (WMD): "Kota
25° 10' N 75° 50' E", (γ) Wikipedia: "Girdler
sulfide process".
8.
Johnston HL.: "Deuterium as a Research Tool in the
Physical and Biological Sciences", The Ohio Journal of Science, 35(5):362-387,
1935. (αρχείο
PDF, 4,06 MB)
9.
Toronto Star (April 2004): "Sickness,
depression and a smell of rotten eggs: Family made ill by gas emissions blame
the Bruce Heavy Water plant".
10. Whitlock D (Canadian
Nuclear FAQ): "A.
CANDU Nuclear Power Technology"
11. Miller ΑΙ: "Heavy
Water: A Manufacturers' Guide for the Hydrogen Century", Canadian Nuclear
Society Bulletin, 22(1):1-14, 2001. (αρχείο
PDF 331 KB)
12. (α) Hyperphysics (Georgia
State University): "Water
as Moderator". (β) Wikipedia: "Neutron
temperature".
13.
(α) Norges
Teknisk-Naturvitenskapelige Universitet: "Leif
Tronstad: Chemistry professor in Trondheim and WWII hero of Telemark".
(β) Jaksic MM: "In Memoriam: Jomar Brun", Int. J. Hydrogen Energy,
20(4):263-264, 1995. (γ)
Bellows A: "Heavy
water and the Norwegians" (June 2007). (δ) Wikipedia: "Vemork".
14. Kushner DJ, Baker A,
Dunstall TG: "Biotechnological
potential of heavy water and deuterated compounds".
15.
Urey HC, Teal GK: "The hydrogen isotope of atomic weight two", Rev. Mod.
Physics, 7:34-94, 1935.
|
Αποποίηση
ευθυνών:
Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των
πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την
επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη
νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες.
Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε
εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα
Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό
τους. |


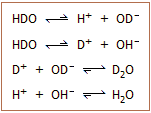






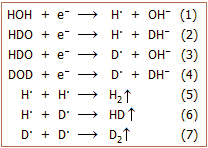 Η παραγωγή βαρέος
ύδατος σε μεγάλες ποσότητες είναι αρκετά δαπανηρή. Δεν πρόκειται βέβαια για παρασκευή βαρέος ύδατος (υπάρχει άφθονο στη φύση), αλλά για
την απομόνωσή του από το φυσικό
νερό, η οποία θα πρέπει να βασιστεί στις μικροδιαφορές των τιμών ορισμένων από τις φυσικοχημικές ιδιότητες
των Η2Ο
και
Η παραγωγή βαρέος
ύδατος σε μεγάλες ποσότητες είναι αρκετά δαπανηρή. Δεν πρόκειται βέβαια για παρασκευή βαρέος ύδατος (υπάρχει άφθονο στη φύση), αλλά για
την απομόνωσή του από το φυσικό
νερό, η οποία θα πρέπει να βασιστεί στις μικροδιαφορές των τιμών ορισμένων από τις φυσικοχημικές ιδιότητες
των Η2Ο
και  Ο ηλεκτρολυτικός εμπλουτισμός του φυσικού ύδατος σε
δευτέριο βασίζεται στη μεγαλύτερη ταχύτητα αναγωγής του πρωτίου Η(+1) προς H2
στην κάθοδο ηλεκτρολυτικού στοιχείου σε σχέση με την αναγωγή του δευτερίου D(+1) προς D2
ή/και προς HD. Αυτή η διαφορά προφανώς σχετίζεται με την ελαφρώς μεγαλύτερη
ευκινησία των μορίων
Ο ηλεκτρολυτικός εμπλουτισμός του φυσικού ύδατος σε
δευτέριο βασίζεται στη μεγαλύτερη ταχύτητα αναγωγής του πρωτίου Η(+1) προς H2
στην κάθοδο ηλεκτρολυτικού στοιχείου σε σχέση με την αναγωγή του δευτερίου D(+1) προς D2
ή/και προς HD. Αυτή η διαφορά προφανώς σχετίζεται με την ελαφρώς μεγαλύτερη
ευκινησία των μορίων