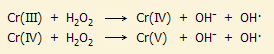Οι μέχρι σήμερα
Η χημική ένωση του
μήνα
[Νοέμβριος
2007]
Επιμέλεια σελίδας:
Νίκος Θωμαΐδης,
Καθηγητής -
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Εμφάνιση: Το χρωμικά
άλατα είναι κρυσταλλικά στερεά με κίτρινο (π.χ. K2CrO4) έως βαθύ ερυθρό χρώμα (π.χ.
Ag2CrO4). Τα διχρωμικά άλατα έχουν
κατά κανόνα πορτοκαλί χρώμα. Διαφορετικό χρώμα μπορεί να έχουν χρωμικά και
διχρωμικά άλατα εγχρώμων κατιόντων.
Διαλυτότητα:
Τα χρωμικά άλατα των μετάλλων είναι
δυσδιάλυτα στο νερό με εξαίρεση τα χρωμικά άλατα των αλκαλίων, του
αμμωνίου, όπως επίσης και του μαγνησίου και ασβεστίου.
Σταθερότητα: Σε υψηλές θερμοκρασίες διασπώνται με έκλυση
οξυγόνου προς οξείδια των μετάλλων και Cr2O3.
Επικινδυνότητα:
Οι ενώσεις του
Cr(VI) χαρακτηρίζονται ως: Ισχυρά τοξικές (Highly toxic), καρκινογόνοι (Carc. Cat. 1), μεταλλαξιγόνοι (Muta. Cat. 2), βλαπτικές ως προς την
αναπαραγωγή (Repr. Cat. 2), οξειδωτικές και ως επικίνδυνες
για το περιβάλλον. |
 |
|
Εξασθενές
χρώμιο, Cr(VI), (ενώσεις του)
Hexavalent chromium compounds
|
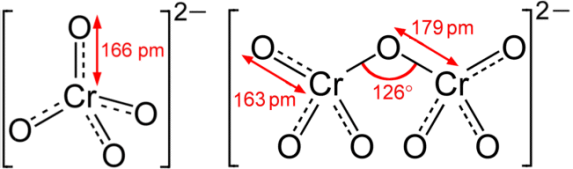
Γενικά για το εξασθενές χρώμιο και τη χημεία του
'Ισως δεν υπάρχει άλλο χημικό στοιχείο στο
οποίο ταιριάζει τόσο επάξια αυτό το
όνομα. Τα χρώματα των ενώσεων του χρωμίου και των διαλυμάτων τους ουσιαστικά καλύπτουν όλο το ορατό
φάσμα: από το ιώδες (άλατα του Cr(ΙIΙ)) έως το βαθύ
κόκκινο (ορισμένες ενώσεις του Cr(VI)). Είναι γνωστές ενώσεις του χρωμίου με
αριθμούς οξείδωσης από -1 έως +6, ωστόσο οι πιο συνήθεις είναι οι
ενώσεις του δισθενούς χρωμίου Cr(II) (ισχυρό αναγωγικό, ασταθές παρουσία οξυγόνου), του
τρισθενούς χρωμίου Cr(III) (οι πλέον σταθερές ενώσεις του χρωμίου) και του
εξασθενούς
χρωμίου Cr(VI) (χρωμικά και διχρωμικά άλατα: σταθερές ενώσεις αλλά και σχετικώς
ισχυρά οξειδωτικά). Το χρώμιο βρίσκεται στη φύση κυρίως ως τρισθενές, με
κυριότερο ορυκτό τον χρωμίτη Fe(Mg)Cr2O4, που αποτελεί το βασικό μετάλλευμα
χρωμίου. Υπάρχουν και ορισμένα σπάνια ορυκτά όπου το χρώμιο είναι εξασθενές από τα οποία το γνωστότερο είναι ο κροκοΐτης, με χημικό τύπο
PbCrO4 (χρωμικός
μόλυβδος).
 |
|
 |
|
 |
|
Μεταλλικό χρώμιο |
|
Δείγμα χρωμίτη, Fe(Mg)Cr2O4
(ορυκτό τρισθενούς χρωμίου) |
|
Δείγμα κροκοΐτη, PbCrO4
(ορυκτό εξασθενούς
χρωμίου) |
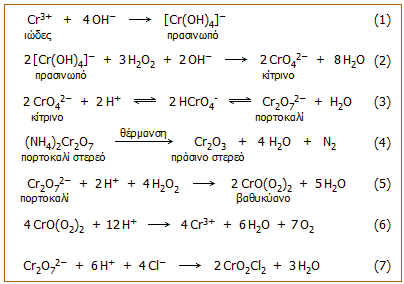 Τα άλατα του σχετικά ισχυρού χρωμικού οξέος του
Η2CrO4
(pK1 = 1,0,
pK2 = 6,5), παρασκευάζονται εύκολα με οξείδωση του Cr(III) με ήπια οξειδωτικά
μέσα σε αλκαλικό περιβάλλον. 'Ετσι π.χ. σε αλκαλικά διαλύματα το Cr(III) παρέχει
διαλυτά υδροξυσύμπλοκα, τα οποία στη συνέχεια οξειδώνονται προς χρωμικά άλατα με
υπεροξείδιο του υδρογόνου (αντιδράσεις 1 και 2). Βιομηχανικά τα χρωμικά άλατα παρασκευάζονται με σύντηξη χρωμίτη με
Na2O2 (υπεροξείδιο του νατρίου).
Τα άλατα του σχετικά ισχυρού χρωμικού οξέος του
Η2CrO4
(pK1 = 1,0,
pK2 = 6,5), παρασκευάζονται εύκολα με οξείδωση του Cr(III) με ήπια οξειδωτικά
μέσα σε αλκαλικό περιβάλλον. 'Ετσι π.χ. σε αλκαλικά διαλύματα το Cr(III) παρέχει
διαλυτά υδροξυσύμπλοκα, τα οποία στη συνέχεια οξειδώνονται προς χρωμικά άλατα με
υπεροξείδιο του υδρογόνου (αντιδράσεις 1 και 2). Βιομηχανικά τα χρωμικά άλατα παρασκευάζονται με σύντηξη χρωμίτη με
Na2O2 (υπεροξείδιο του νατρίου).
Τα κίτρινα
χρωμικά ιόντα με οξύνιση μετατρέπονται αντιστρεπτά σε πορτοκαλόχρωμα διχρωμικά
ιόντα (αντίδραση 3). Η ισορροπία χρωμικών - διχρωμικών είναι μια από τις πιο
χαρακτηριστικές αντιδράσεις του Cr(VI).
Τo
Cr(VI), ως διχρωμικό ιόν, είναι σχετικώς ισχυρό οξειδωτικό σε όξινα διαλύματα και παρέχει αντιδράσεις οξειδοαναγωγής με ανόργανες αναγωγικές ουσίες όπως π.χ. Fe(II), SO2,
όπως και με οργανικές ενώσεις (π.χ. οξείδωση της αιθανόλης προς ακεταλδεΰδη) κατά τις οποίες το Cr(VI) ανάγεται προς Cr(III).
Εντυπωσιακή είναι η αντίδραση αυτοοξειδοαναγωγής του διχρωμικού
αμμωνίου (αντίδραση 4), που χρησιμοποιείται συχνά σε επιδείξεις χημικών πειραμάτων και είναι
γνωστή ως χημικό ηφαίστειο (chemical volcano) (βλέπε
βίντεο).
Τελείως χαρακτηριστική είναι αντίδραση των διχρωμικών ιόντων με υπεροξείδιο του
υδρογόνου σε όξινο διάλυμα. Κατά
την αντίδραση αυτή παράγεται μια έντονα κυανή υπεροξειδική ένωση του χρωμίου με πιθανό τύπο
CrO(O2)2
(αντίδραση 5). Το CrO(O2)2
διασπάται ταχύτατα σε
υδατικά διαλύματα (αντίδραση 6), αλλά μπορεί να εκχυλισθεί με οξυγονούχους
οργανικούς διαλύτες, όπως διαιθυλαιθέρα ή αμυλική αλκοόλη, όπου είναι σταθερότερη. Η αντίδραση σχηματισμού CrO(O2)2 χρησιμοποιείται για την
ποιοτική ανίχνευση τόσο των διχρωμικών ιόντων, όσο και του υπεροξειδίου του υδρογόνου σε
πολύ αραιά υδατικά διαλύματα.
'Αλλη ένωση του Cr(VI) είναι το τριοξείδιο του χρωμίου (ανυδρίτης
του χρωμικού οξέος, CrO3) το οποίο διαλύεται εύκολα στο νερό παρέχοντας χρωμικό οξύ.
Το CrO3 είναι εξαιρετικά ισχυρή οξειδωτική ένωση και απαιτείται
ιδιαίτερη προσοχή κατά τη χρήση της γιατί σε επαφή με οργανικά υλικά προκαλεί
ανάφλεξή τους.
Ενδιαφέρουσα ένωση του Cr(VI) είναι
το χλωριούχο χρωμύλιο (CrO2Cl2), μια εξαιρετικά επικίνδυνη ένωση λόγω της πτητικότητάς της.
Πρόκειται για ένα έντονα
κόκκινο υγρό με σημείο βρασμού 117οC, πυκνότητα 1,91 g/mL, το οποίο σε
εμφάνιση θυμίζει το υγρό βρώμιο. Αντιδρά έντονα με το νερό, όπου υδρολύεται παρέχοντας χρωμικό
οξύ και αέριο HCl. Παρασκευάζεται με απ'ευθείας επίδραση
πυκνού θειικού οξέος σε στερεό μίγμα NaCl και K2Cr2O7 (αντίδραση 7). Η
αντίδραση αυτή έχει χρησιμοποιηθεί για την ανίχνευση χλωριούχων αλάτων σε στερεή
κατάσταση από τους παραγόμενους κόκκινους ατμούς. Ωστόσο, απαιτείται ιδιαίτερη
προσοχή λόγω της πιθανότητας εισπνοής των ατμών του χλωριούχου χρωμυλίου,
γεγονός το οποίο συνεπάγεται την απ'ευθείας μεταφορά του τοξικότατου Cr(VI) στους
πνεύμονες, που αποτελεί και τον πλέον επικίνδυνο για την υγεία τρόπο εισόδου Cr(VI) στον
οργανισμό. Καλό θα ήταν να αποφεύγεται κάθε πειραματισμός με αυτήν την ξεχωριστά
επικίνδυνη ένωση του Cr(VI).
|
Τυπικά παραδείγματα ενώσεων εξασθενούς
χρωμίου |
 |
 |
 |
 |
|
Χρωμικό κάλιο (K2CrO4) |
Διχρωμικό κάλιο (K2Cr2O7) |
Τριοξείδιο του χρωμίου ή
χρωμικός ανυδρίτης (CrO3) |
Χλωριούχο χρωμύλιο (CrO2Cl2) |
 Ιστοσελίδες με φωτογραφίες και βίντεο με
πειράματα σχετικά με τα προηγούμενα: (α) MPEG βίντεο (αρκετά μεγάλο
αρχείο: 8,06 MB) με χαρακτηριστικές αντιδράσεις [η αντίδραση 1, στη
συνέχεια οι αντιδράσεις 2, 3, 5 και τέλος εκχύλιση του
CrO(O2)2
με αμυλική αλκοόλη (C5H11OH) -από το Εργαστήριο Αναλυτικής Χημείας-]. (β) Μια
ωραία ιστοσελίδα με φωτογραφίες και βίντεο αντιδράσεων διχρωμικών
(σχηματισμός CrO2Cl2
και μια εντυπωσιακή αντίδραση των ατμών του με όξινο διάλυμα Η2Ο2). (γ) Βίντεο
με
το "χημικό ηφαίστειο" (θερμική διάσπαση (NH4)2Cr2O7, αντίδραση 4). Ιστοσελίδες με φωτογραφίες και βίντεο με
πειράματα σχετικά με τα προηγούμενα: (α) MPEG βίντεο (αρκετά μεγάλο
αρχείο: 8,06 MB) με χαρακτηριστικές αντιδράσεις [η αντίδραση 1, στη
συνέχεια οι αντιδράσεις 2, 3, 5 και τέλος εκχύλιση του
CrO(O2)2
με αμυλική αλκοόλη (C5H11OH) -από το Εργαστήριο Αναλυτικής Χημείας-]. (β) Μια
ωραία ιστοσελίδα με φωτογραφίες και βίντεο αντιδράσεων διχρωμικών
(σχηματισμός CrO2Cl2
και μια εντυπωσιακή αντίδραση των ατμών του με όξινο διάλυμα Η2Ο2). (γ) Βίντεο
με
το "χημικό ηφαίστειο" (θερμική διάσπαση (NH4)2Cr2O7, αντίδραση 4).
|
Χρήσεις του μεταλλικού χρωμίου
H μεγαλύτερη ποσότητα χρωμίου χρησιμοποιείται
στην παραγωγή ανοξείδωτου χάλυβα. Με προσθήκη χρωμίου σε ποσοστό 13% (κατ'
ελάχιστο), το οποίο μπορεί να αυξηθεί μέχρι 30%, οι χρωμιοχάλυβες εμφανίζουν μεγαλύτερη αντοχή σε σχέση με τον κοινό
χάλυβα στη διάβρωση και στην
οξείδωση σε φυσικό και αστικό περιβάλλον. Το χρώμιο
σχηματίζει μια αδρανή επικάλυψη Cr2O3, απρόσβλητη από το νερό και τον αέρα, αλλά
ταυτόχρονα εξαιρετικά λεπτή ώστε το κράμα να μην χάνει τη λάμψη του [Αναφ. 1].
 |
 |
|
Λουτρό
επιχρωμίωσης (chrome plating bath)
[από την Αναφ. 18] και
μια συλλογή από
διάφορα μηχανικά εξαρτήματα με προστατευτική επίστρωση χρωμικού ψευδαργύρου
|
Βιομηχανικές χρήσεις του εξασθενούς χρωμίου
Το Cr(VI) έχει πολλές βιομηχανικές
χρήσεις [Αναφ. 2]. Οι μεταλλοβιομηχανίες χρησιμοποιούν πολλές ενώσεις του Cr(VI) ως επιστρώσεις προστασίας
μεταλλικών επιφανειών από τη διάβρωση (anti-corrosion and conversion coatings) [Αναφ.
3-5]. Στη
συγκεκριμένη διεργασία, τμήμα της μεταλλικής επιφάνειας μετατρέπεται με χημικό ή
ηλεκτροχημικό τρόπο σε αδρανή επίστρωση.
Τυπική είναι διεργασία Cronak για επιφάνειες ψευδαργύρου ή καδμίου
κατά την οποία το αντικείμενο εμβαπτίζεται για 5-10 s σε διάλυμα 182 g Na2Cr2O7 2H2O/L και 6 mL πυκνού H2SO4/L [Αναφ. 3].
Πολλά χρωμικά και διχρωμικά άλατα
χρησιμοποιούνται ως παρεμποδιστές διάβρωσης (corrosion
inhibitors) [Αναφ. 6,7], αλλά η υψηλή
τους τοξικότητα έχει οδηγήσει τη βιομηχανία στην σταδιακή αντικατάσταση τους
[Αναφ. 8].
Η διεργασία επίστρωσης με χρωμικά (chromate
conversion coating, CCC) εφαρμόζεται για την
παθητικοποίηση (passivation) μεταλλικών
επιφανειών αλουμινίου, ψευδαργύρου, καδμίου, χαλκού, άργυρου, μαγνησίου,
κασσιτέρου και κραμάτων τους. Τα κυριότερα χρωμικά άλατα που χρησιμοποιούνται σε αυτή τη
διεργασία είναι το χρωμικό ασβέστιο, το χρωμικό στρόντιο και ο χρωμικός
ψευδάργυρος. Για την ίδια διεργασία χρησιμοποιείται και το τριοξείδιο του χρωμίου
[Αναφ.
9].
Τα χρωμικά συχνά χρησιμοποιούνται ως χρωστικές στη
φωτογραφία. Ο χρωμικός μόλυβδος (PbCrO4),
γνωστός ως κίτρινο του χρωμίου (Chrome Yellow) είναι μια εξαιρετικής
ποιότητας κίτρινη χρωστική, χρησιμοποιείται στο χρωματισμό του βινυλίου, του ελαστικού
(rubber) και του χαρτιού, αλλά λόγω της μεγάλης
τοξικότητάς του η χρήση του πλέον αποθαρρύνεται. Επίσης οι ενώσεις του Cr(VI)
χρησιμοποιούνται σε βαφές υφασμάτων και δέρματος, χρώματα και μελάνια. Εκτεταμένη χρήση των αλάτων
του Cr(VI) (κυρίως του χρωμικού
νατρίου και αμμωνίου) γίνεται στη βυρσοδεψία για την κατεργασία δερμάτων (δέψη,
leather tanning). Η δέψη με χρωμικά είναι ταχύτερη από
τη δέψη με φυτικές ταννίνες και τα δέρματα που παράγονται με αυτόν τον τρόπο
έχουν μεγαλύτερη αντοχή στην τάση και είναι ιδανικά για δερμάτινες τσάντες και
ρούχα.
|

Εκτιμάται ότι σε περίπου 80
διαφορετικές επαγγελματικές κατηγορίες, οι εργαζόμενοι εκτίθενται στo
τοξικό Cr(VI). Οι συγκολλητές είναι από τους περισσότερο εκτεθειμένους
σε οξέα περιστατικά εισπνοής (από την Αναφ. 19).
|
Ενώσεις του Cr(VI) χρησιμοποιούνται ως
συντηρητικά ξύλου. Το 1996, το 52% της παραγωγής των ενώσεων Cr
στις ΗΠΑ χρησιμοποιούνταν στην παρασκευή ενός συντηρητικού ξύλου, του
χρωμιωμένου αρσενικικού χαλκού
(chromated
copper arsenate, CCA). Το CCA είναι μίγμα
χρωμικών αλάτων, οξειδίου του χαλκού και οξειδίου του αρσενικού (As2O5) [Αναφ.
9].
Τα χρωμικά βασικά δρουν ως χημικά στερεωτικά μέσα (chemical fixing) του χαλκού και αρσενικού,
τα οποία δρουν ως μυκητοκτόνα/βακτηριοκτόνα και ως εντομοκτόνα, αντίστοιχα [Αναφ. 10].
'Ολες οι παραπάνω ενώσεις του εξασθενούς χρωμίου είναι τοξικότατες. Η Ευρωπαϊκή 'Ενωση αναγνωρίζοντας την επιβλαβή δράση του Cr(VI), ενέκρινε τον Φεβρουάριο του 2003
την Οδηγία 2002/95/EC, που θέτει περιορισμούς στη
βιομηχανική χρήση των εξής 6 εξαιρετικά επικίνδυνων χημικών: Pb, Cd, Hg,
Cr(VI), πολυβρωμιωμένα
διφαινύλια (polybrominated biphenyls, PBBs), πολυβρωμιωμένοι διφαινυλαιθέρες (polybrominated
diphenyl ether, PBDEs). Η οδηγία αυτή αναφέρεται ως
Οδηγία Περιορισμού Επικινδύνων Ουσιών (Restriction of
Hazardous Substances Directive, RoHS). Η μόνη εξαίρεση που
αναφέρεται στο Παράρτημα της οδηγίας αφορά στη χρήση του Cr(VI) ως
αντιδιαβρωτικού του ανθρακούχου χάλυβα των συστημάτων ψύξης που λειτουργούν με απορρόφηση
θερμότητας (βιομηχανικά ψυγεία με συμπιεστές που λειτουργούν με θερμική και όχι
ηλεκτρική ενέργεια) [Αναφ. 11].
Η οδηγία RoHS εφαρμόζεται στα κράτη-μέλη από τον Ιούλιο του 2006. 'Ετσι η βιομηχανία έχει στραφεί
σε εναλλακτικές επιστρώσεις όπως αυτές με Cr(III), Zn, Ni, κ.α., οι οποίες αν και
όχι τόσο αποτελεσματικές, είναι λιγότερο επιβλαβείς για το
περιβάλλον.
Εξασθενές χρώμιο στο
περιβάλλον
Α. Επίπεδα: Το χρώμιο είναι ευρέως
διαδεδομένο στη φύση με φυσική αφθονία στο φλοιό της Γης 100 ppm. Τα φυσιολογικά επίπεδά του στα μη ρυπασμένα επιφανειακά
ύδατα κυμαίνονται στην περιοχή 1 - 10 μg/L, ενώ στο πόσιμο νερό οι συγκεντρώσεις του βρίσκονται στην
περιοχή
0,4 - 8 μg/L. Στον αέρα
βρίσκεται σε συγκεντρώσεις
<0,1 μg/m3. Η περιεκτικότητα των περισσότερων πετρωμάτων
σε χρώμιο κυμαίνεται από 5 έως 1800 mg/kg.
Στα περισσότερα εδάφη υπάρχει σε χαμηλές περιεκτικότητες (2-60 mg/kg). Μόνο ένα πολύ μικρό ποσοστό
είναι διαθέσιμο στα φυτά (μέχρι 0,19 mg/kg) και δεν έχει διευκρινιστεί επαρκώς το κατά πόσο το χρώμιο είναι
γι' αυτά ένα απαραίτητο ιχνοστοιχείο [Αναφ. 2].
Σχεδόν όλο το χρώμιο στη φύση βρίσκεται ως τρισθενές χρώμιο,
Cr(III). Το εξασθενές
χρώμιο, Cr(VI), που συναντάται
στο περιβάλλον, είναι σχεδόν αποκλειστικά ανθρωπογενές (προέρχεται από δραστηριότητες
του ανθρώπου).
Διάφορες βιομηχανίες εκπέμπουν στον αέρα, στο νερό και στο έδαφος πλήθος ενώσεων
του Cr(VI). Το Cr(VI) είναι σταθερό στον αέρα και στο καθαρό νερό, αλλά ανάγεται
ταχύτατα προς Cr(III), όταν έρθει σε επαφή με οργανική ύλη στο νερό, στο
έδαφος και σε ζωντανούς οργανισμούς [Αναφ. 2,
12].
Στην περίπτωση διάθεσης
από βιομηχανίες ανεπεξέργαστων αποβλήτων που περιέχουν Cr(VI) σε υδάτινους αποδέκτες, τα επίπεδα του στα
ύδατα του αποδέκτη και στα υπόγεια ύδατα μπορεί να φτάσουν μερικές δεκάδες
μg/L, όπως πρόσφατα ανακοινώθηκε
στον ημερήσιο τύπο (Καθημερινή 4/9/07,
Ελευθεροτυπία 17/9/07) για τα νερά της
ευρύτερης περιοχής του Ασωπού. 'Εφτασε όμως και τα 580 μg/L, τα οποία μετρήθηκαν σε σημείο ελέγχου υπογείων υδάτων της πόλης Hinkley των ΗΠΑ (υπόθεση Erin
Brockovich, που μεταφέρθηκε στον κινηματογράφο το 2000
[Αναφ. 13]).
|
Υπόθεση Erin Brockovitch
[Από την
Αναφ. 19]
Τον Δεκέμβριο του 1987, η
εταιρεία Pacific Gas Company (PG&E), η παγκοσμίως μεγαλύτερη εταιρεία παροχής ηλεκτρικού ρεύματος και φυσικού αερίου, ενημέρωσε τις αρχές της Καλιφόρνιας, ότι ανίχνευσαν
εξασθενές χρώμιο σε επίπεδα 580 μg/L
[το
ανώτατο επιτρεπτό όριο για το ολικό χρώμιο που θέτει η πολιτεία είναι 50 μg/L] σε ένα σημείο ελέγχου των υπόγειων υδάτων. Το Cr(VI) χρησίμευε ως
αντιδιαβρωτικό σε ψυκτικούς πύργους του σταθμού συμπίεσης του φυσικού
αερίου της πόλης Hinkley στην έρημο Mojave.
Οι κάτοικοι του Hinkley
παρουσίαζαν μια σειρά από προβλήματα υγείας: ηπατικά, καρδιακά,
αναπνευστικά, αναπαραγωγικά, γυναικολογικούς καρκίνους, καρκίνους στον
εγκέφαλο, στα νεφρά, στο γαστρεντερικό σύστημα, ασθένεια Hodgkins,
αποβολές κ.ά. Η PG&E ισχυρίστηκε ότι τα προβλήματα αυτά δεν είχαν σχέση
με τα λύματα του σταθμού. Ωστόσο,
μέχρι το 1972 η PG&E εν γνώσει της είχε απορρίψει 370 εκατομμύρια
γαλόνια λυμάτων που περιείχαν Cr(VI) σε μη στεγανοποιημένες δεξαμενές με
αποτέλεσμα το τοξικό Cr(VI) να ρυπάνει τα υπόγεια ύδατα του Hinkley.
To 1993 οι κάτοικοι του
Hinkley κατέθεσαν μήνυση κατά της PG&E. Η μήνυση αυτή ήταν αποτέλεσμα μιας
μαζικής επικοινωνιακής προσπάθειας της
Erin Brockovich,
υπαλλήλου μιας δικηγορικής εταιρείας της περιοχής. Η Brockovich
απεκάλυψε την παρανομία της PG&E και ξεκίνησε μια προσωπική έρευνα η
οποία κατέληξε στο δαπανηρότερο δικαστικό διακανονισμό αστικής υπόθεσης. Η PG&E
κατέβαλε στους 648 μηνυτές το ποσό των 333 εκατομμυρίων
δολαρίων. Επιπλέον, η PG&E δέχτηκε να διακόψει τη χρήση Cr(VI) και να
εκτελέσει εργασίες απορρύπανσης.
Η υπόθεση δίχασε
τους ειδικούς σε θέματα τοξικότητας του χρωμίου, κυρίως επειδή η έκθεση στο Cr(VI)
έγινε μέσω του πόσιμου ύδατος. Πολλοί ισχυρίστηκαν ότι ο τρόπος αυτός έκθεσης
είναι λιγότερο επικίνδυνος σε σχέση με την εισπνοή, επειδή στο στομάχι
το Cr(VI) ανάγεται σε αδρανές Cr(III). Ακόμη ισχυρίστηκαν ότι οι
εκθέσεις ήταν πολύ μικρές και ότι τα στοιχεία που τις συνδέουν με τις
ασθένειες των κατοίκων του Hinkley ήταν
ανεπαρκή. Ωστόσο, άλλοι υποστήριξαν ότι υπάρχουν πολλά κενά στο θέμα της
τοξικότητας του χρωμίου και ότι η τοξική μορφή του χρωμίου μπορεί να
διεισδύσει σε κάθε τύπο κυττάρου και επομένως να προκαλέσει βλάβες σε
πολλά και διαφορετικά όργανα. 'Εως ότου γίνει γνωστό το πώς οι
διαφορετικές δόσεις και οι τρόποι έκθεσης σε Cr(VI) επιδρούν σε
διαφορετικούς πληθυσμούς, είναι πολύ νωρίς για να θεωρηθούν ακίνδυνες οι
εκθέσεις μέσω του πόσιμου ύδατος. |
Β. Νομοθετημένα όρια:
Στο πόσιμο νερό έχει
θεσπιστεί με την Οδηγία 98/83/EC ως ανώτατο επιτρεπτό όριο ολικού χρωμίου τα 50 μg/L
[Αναφ. 14]. Ωστόσο,
δεν υπάρχει ανώτατο επιτρεπτό όριο ειδικά για το εξασθενές χρώμιο.
Στις ΗΠΑ, η ΕΡΑ έχει θεσπίσει ως ανώτατο επιτρεπτό όριο ολικού χρωμίου στο
πόσιμο και υπόγειο νερό τα 100 μg/L, θεωρώντας αυτό το επίπεδο ασφαλές για την υγεία του
ανθρώπου [Αναφ. 15].
Στην Ελλάδα, με την ΚΥΑ 4859/726 ρυθμίζονται οι εκπομπές ολικού χρωμίου
από απόβλητα βιομηχανιών σε υδάτινους αποδέκτες, σε συγκεντρώσεις που
κυμαίνονται (ανάλογα με τον αποδέκτη) από 0,6 έως 3 mg/L [Αναφ.
16]. Οι εκπομπές ρύπων των βιομηχανιών στην Ελλάδα
(φυσικά και του εξασθενούς χρωμίου) μπορούν να καθοριστούν από τις Νομαρχιακές
Αυτοδιοικήσεις, κατά περίπτωση και κυμαίνονται για το Cr(VI) από 0,3 έως 1 mg/L στα υγρά απόβλητα. 'Οριο για το
έδαφος δεν έχει θεσπιστεί ακόμα.
Η
έκθεση σε Cr(VI) από τον αέρα
στον εργασιακό χώρο είναι πιο σημαντική και επικίνδυνη. Ο OSHA (Occupational Safety and Health
Administration) και ο NIOSH (National Institute for Occupational Safety and Health) των ΗΠΑ
έχουν θεσπίσει επιτρεπτά όρια έκθεσης (Permissible Exposure
Limits, PELs) και προτεινόμενα όρια έκθεσης
(Recommended Exposure Limits, RELs) για τους εργασιακούς χώρους. Το νέο PEL για το Cr(VI) στον αέρα εργασιακού χώρου όπου εκτελούνται συγκολλήσεις
μετάλλων (welding) κατά τη διάρκεια 8ώρου (για εβδομάδα
40ώρου) είναι 5 μg/m3, ενώ υπάρχουν δεκάδες ρυθμίσεις κατά περίπτωση [Αναφ.
17].
Το PEL για διάφορες καρκινογόνες ενώσεις του Cr(VI) στον αέρα εργασιακού χώρου
είναι ακόμα μικρότερο: μόλις 1 μg/m3 [Αναφ. 18,
19].
Γ.
Επιπτώσεις και η "μοίρα" του Cr(VI) στο περιβάλλον: Το Cr(VI) θεωρείται
ευκίνητο (labile) στο υδάτινο περιβάλλον, παραμένει στη διαλυτή φάση και είναι βιοδιαθέσιμο. Επίσης είναι ισχυρά τοξικό
και οι τιμές τοξικότητες LC50 (LC50: Lethal Concentration 50, η συγκέντρωση που θανατώνει το 50% του
πληθυσμού του εξεταζόμενου είδους) του Cr(VI) σε διάφορους μικροοργανισμούς κυμαίνονται από 0,032 - 6,4
mg/L [Αναφ.
12]. Αντίθετα το Cr(III) θεωρείται "μη ευκίνητο", καθώς
έχει τάση να προσροφάται στα αιωρούμενα σωματίδια και στο ίζημα και για τον λόγο αυτό θεωρείται
ως σχετικά αδρανές, λιγότερο βιοδιαθέσιμο και μειωμένης τοξικότητας ως προς τους υδρόβιους οργανισμούς.
|
 |
 |
|
Αριστερά: Ουσιαστικά
αποκλειστική πηγή εξασθενούς χρωμίου στο περιβάλλον είναι τα απόβλητα
βιομηχανιών και βιοτεχνιών [πηγή].
Δεξιά: Το χρώμιο του εδάφους σε αυτό
χώρο στάθμευσης ενός βιομηχανικού πάρκου του New Jersey έχει διαλυθεί σε
αυτά τα στάσιμα νερά. Επειδή το χρώμιο μπορεί να διαλυθεί και να
διαχυθεί μέσω του εδάφους, αυξημένες συγκεντρώσεις (λόγω εξάτμισης του
νερού) μπορεί να παρατηρηθούν μακριά από την αρχική περιοχή ρύπανσης
(από την Αναφ. 19) |
Είναι προφανές ότι ο προσδιορισμός του ολικού χρωμίου στα περιβαλλοντικά δείγματα ελάχιστες
πληροφορίες μπορεί να δώσει, ενώ επιβάλλεται ο προσδιορισμός των χημικών ειδών
του χρωμίου (speciation analysis)
[Αναφ. 20]. Ιδιαίτερη σημασία έχει ο προσδιορισμός του εξασθενούς
χρωμίου στα βιομηχανικά αλλά και στα αστικά υγρά απόβλητα, γιατί συχνά
ανιχνεύονται υψηλές συγκεντρώσεις του [Αναφ. 20β]. Οι υψηλές αυτές συγκεντρώσεις είναι δυνατό να επηρεάσουν
και τη βιολογική επεξεργασία τους (κυρίως τη νιτροποίηση), ειδικά σήμερα όπου
υπάρχει τάση συνεπεξεργασίας αστικών και βιομηχανικών αποβλήτων σε μονάδες
ενεργού ιλύος
(activated
sludge) [Αναφ. 21].
Ωστόσο, αποδείχθηκε ότι η μέθοδος ενεργού ιλύος είναι η πλέον
κατάλληλη για την επεξεργασία υγρών αποβλήτων επιβαρυμένων με Cr(VI), καθώς τούτο ανάγεται προς Cr(III), το οποίο
προσροφάται σχεδόν ποσοτικά στις βιοκροκίδες και συσσωρεύεται στη λυματολάσπη. 'Ετσι το τοξικό Cr(VI)
απομακρύνεται από τη διαλυτή φάση και προστατεύεται ο τελικός υδάτινος
αποδέκτης [Αναφ. 21β-γ].
Επιπτώσεις στην
ανθρώπινη υγεία
A.
Εργασιακό περιβάλλον-υψηλές εκθέσεις-πνευμονες-εισπνοή-κατάποση:
Το χρώμιο
εισέρχεται στον ανθρώπινο οργανισμό μέσω της αναπνοής και της κατανάλωσης
τροφής και ποτών που το περιέχουν. Το
τρισθενές χρώμιο, Cr(III),
θεωρείται απαραίτητο ιχνοστοιχείο για τον οργανισμό, αφού φαίνεται να συμμετέχει
στον παράγοντα ανοχής της γλυκόζης (Glucose Tolerance
Factor, GTF). O
παράγοντας GTF μαζί με την ινσουλίνη ρυθμίζουν
την ποσότητα της γλυκόζης στο αίμα. 'Ελλειψη χρωμίου, όπως παρατηρήθηκε σε
πειραματόζωα, προκαλεί αύξηση του σακχάρου στο αίμα και εμφάνιση γλυκόζης στα
ούρα [Αναφ. 2]. Ενδείκνυται η πρόσληψη 30
έως 50 μg Cr(III)
ημερησίως, ενώ ποσότητες μέχρι 200 μg δεν έχει
αναφερθεί ότι προκαλούν προβλήματα υγείας [Αναφ. 22].
Αντίθετα, το εξασθενές χρώμιο
έχει χαρακτηριστεί ως
αποδεδειγμένο καρκινογόνο
[Αναφ. 23].
Επιδημιολογικές μελέτες σε εργάτες παραγωγής χρωμικών, πιγμέντων και
μεταλλικών επιστρώσεων χρωμίου έδειξαν ότι εισπνοή σκόνης που περιέχει Cr(VI) προκαλεί καρκίνο
του πνεύμονα και της ρινικής κοιλότητας (sinonasal
cavity). Τα αποτελέσματα των
επιδημιολογικών μελετών έχουν επιβεβαιωθεί και σε εργαστηριακά πειράματα
(σε ζώα). Υπάρχουν αρκετά πειραματικά δεδομένα
ότι ενώσεις του Cr(VI)
καταστρέφουν το DNA και προκαλούν
μεταλλάξεις.
Επίσης, εισπνοή σωματιδίων που περιέχουν σχετικά υψηλές συγκεντρώσεις
Cr(VI) μπορεί να προκαλέσει
έλκος, αιμορραγία, κνησμό και φτέρνισμα. Κατάποση υψηλών ποσοτήτων Cr(VI) μπορεί να προκαλέσει καταστροφή
των νεφρών και του ήπατος, έλκος στομάχου και γαστρεντερικό ερεθισμό, ακόμα και
θάνατο.
Ακόμη, δερματική έκθεση σε ενώσεις του Cr(VI) προκαλεί δερματικά έλκη και
δριμείες αλλεργικές αντιδράσεις, ιδιαίτερα από ενδύματα και υποδήματα από δέρμα
που έχει κατεργαστεί με Cr(VI)
[Αναφ. 19, 24].
Β.
Χρώμιο στο πόσιμο νερό:
Μελέτες σε πειραματόζωα έδειξαν ότι η πόση νερού επιβαρυμένου με Cr(VI) μπορεί να προκαλέσει καρκίνο
του γαστρεντερικού συστήματος. Ωστόσο, δεν είναι σαφές αν τα επίπεδα που
προσδιορίζονται σε πόσιμα ύδατα είναι ικανά να προκαλέσουν καρκίνο. Σύμφωνα με
την IARC, το Cr(VI) που προσλαμβάνεται με το νερό μετατρέπεται σε μεγάλο
ποσοστό σε Cr(III) στο όξινο
περιβάλλον του στομάχου,
γεγονός που δεν επιτρέπει την περαιτέρω απορρόφηση του χρωμίου από τον
οργανισμό, καθώς το Cr(III) δεν
μπορεί να διαπεράσει την κυτταρική μεμβράνη.
Τελείως πρόσφατα
(Μάιος 2007) από το Εθνικό Ινστιτούτο Υγείας των ΗΠΑ (National Institute of Health,
NIH)
ανακοινώθηκε ότι κατόπιν αιτήματος μελών του κοινοβουλίου της Καλιφόρνιας και μετά από τις ανησυχίες που προκάλεσε η προβολή της
κινηματογραφικής ταινίας "Erin Brockovitch", πραγματοποιήθηκαν πειράματα
με ποντίκια και επίμυες στα οποία για δύο χρόνια δινόταν νερό με 14
έως 516 mg Na2Cr2O7.2H2O/L.
Φυσικά οι συγκεντρώσεις αυτές είναι πολύ μεγάλες. Η μικρότερη αντιστοιχεί σε συγκέντρωση Cr(VI)
περίπου δέκα φορές μεγαλύτερη από εκείνη του πλέον ρυπασμένου με Cr(VI)
νερού της Καλιφόρνιας, που θα μπορούσε να πιει ο άνθρωπος. Τα πειράματα
έδειξαν γαστρεντερική απορρόφηση του Cr(VI) και την ανάπτυξη καλοήθων
και κακοήθων όγκων σε σημεία και όργανα των πειραματόζωων, όπου πολύ σπάνια
εμφανίζονται όγκοι [Αναφ. 25α-β].
Χρώμιο και μηχανισμοί καρκινογένεσης
Το Cr(VI), ως χρωμικά ιόντα, λόγω δομικής ομοιότητας
με τα θειικά και τα φωσφορικά ιόντα, εισέρχεται σαν "Δούρειος 'Ιππος" στα κύτταρα μέσω της κυτταρικής μεμβράνης
χρησιμοποιώντας το φυσιολογικό σύστημα διακίνησης αυτών των ιόντων.
Στο εσωτερικό των κυττάρων
αντιδρά με τις αναγωγικές ουσίες που θα βρει εκεί και ανάγεται σε Cr(III) το
οποίο φαίνεται ότι είναι και ο "πραγματικός κίνδυνος"
[Αναφ. 19]. Αντίθετα, οι οκταεδρικής σύνταξης ενώσεις του Cr(III), λόγω του όγκου και της δυσδιαλυτότητας πολλών από αυτές, διαπερνούν
την κυτταρική μεμβράνη αργά ή και καθόλου [Αναφ. 26].
Γι'αυτό το λόγο το Cr(VI) είναι η επικίνδυνη μορφή του χρωμίου και όχι το Cr(III). Οι δημοσιεύσεις
Αναφ. 27 (α-δ)
αναφέρονται σε μηχανισμούς
δράσης του Cr(VI), όταν
εισέρχεται στο κύτταρο και του Cr(III), που παράγεται μέσα στο κύτταρο με αναγωγή του Cr(VI).
Η πορεία αναγωγής Cr(VI) σε Cr(III)
εντός του κυττάρου μπορεί να προκαλέσει καταστροφή του DNA, όπως οξειδωτικές βλάβες, θραύση των κλώνων του,
σχηματισμό ενώσεων προσθήκης Cr(III)-DNA, διακλωνικές συνδέσεις
και συνδέσεις πρωτεϊνών-DNA.
'Ερευνες έδειξαν ότι με την
είσοδο του
Cr(VI)
στο κύτταρο, αυτό ανάγεται από το πλήθος των αναγωγικών ουσιών και ενζύμων (όπως
η γλουταθειόνη) κατά στάδια σε χαμηλότερο επίπεδο σθένους. Τα ενδιάμεσα προϊόντα
αναγωγής του χρωμίου με το υπεροξειδίου του υδρογόνου (Η2Ο2),
ενός φυσικού συστατικού του κυτταροπλάσματος (σε πολύ μικρές βέβαια
συγκεντρώσεις), παράγουν δραστικές οξυγονούχες ρίζες (ιδιαίτερα τη ρίζα υδροξυλίου, ΟΗ·),
δηλαδή δημιουργούν δραστικά οξυγονούχα σωματίδια, τα γνωστά
ως
ROS
(Reactive Oxygen Species). Οι
έρευνες έδειξαν ότι το Cr(V),
Cr(IV)
και Cr(III)
με το Η2Ο2
μπορούν να δημιουργήσουν τις ρίζες ΟΗ· με αντιδράσεις τύπου
αντίδρασης Fenton
(αντίδραση Fe(II) με το
Η2Ο2)
όπως:
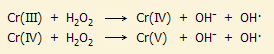
Οι ρίζες
OH·
είναι σε θέση να προκαλέσουν οξειδωτικές βλάβες στο DNA και συγκεκριμένα παρέχουν την οξειδωμένη
μορφή της γουανοσίνης, την 8-υδροξυδεοξυ-γουανοσίνη (8-OHdG).
Οι δημοσιεύσεις
Αναφ. 28 (α-στ), είναι ενδεικτικές μόνο από το πλήθος των δημοσιεύσεων για
πιθανούς μηχανισμούς επίδρασης του Cr(VI)
στο DNA.
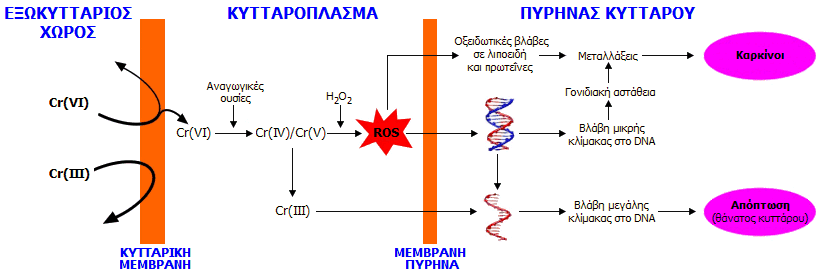
|
Συνοπτικός πιθανός μηχανισμός δράσης βιοχημικής δράσης του Cr(VI):
To Cr(VI) μπορεί να διαπεράσει την κυτταρική μεμβράνη σε αντίθεση με
το Cr(III), του οποίου η ισχυρή εφυδάτωση δεν επιτρέπει τη διέλευση
μέσω της κυτταρικής μεμβράνης. Στο κυτταρόπλασμα, διάφορες
αναγωγικές οργανικές ουσίες προκαλούν τη σταδιακή αναγωγή του Cr(VI)
προς Cr(III). Οι ενδιάμεσες οξειδωτικές καταστάσεις Cr(V) και Cr(VI)
αντιδρούν με το υπεροξείδιο του υδρογόνου που είναι προϊόν άλλων
βιοχημικών διεργασιών δημιουργώντας δραστικές οξυγονούχες ουσίες,
ROS, (κυρίως ρίζες
ΟΗ·) οι οποίες επιφέρουν οξειδωτικές
βλάβες σε λιποειδή και πρωτεΐνες και βλάβες μικρής κλίμακας στο DNA,
οι οποίες οδηγούν σε γονιδιακή αστάθεια, μεταλλάξεις και τελικά στον
καρκίνο. Ανάλογη δράση έχει το τελικό προϊόν αναγωγής, το Cr(III),
το οποίο μπορεί να συνδεθεί με το DNA προκαλώντας διάνοιξη και
θραύση των κλώνων του. |
Πρόσφατα, ερευνητές από το Πανεπιστήμιο Brown
ανακοίνωσαν ένα εκ πρώτης όψεως παράδοξο εύρημα. Διαπίστωσαν ότι η αναγωγή του Cr(VI) από
το ασκορβικό οξύ (βιταμίνη C) στο εσωτερικό των πνευμονικών κυττάρων προκαλεί
μαζικές βλάβες στο DNA. Μικρές δόσεις Cr(VI) σε συνδυασμό με τη βιταμίνη C
προκαλούν 15 φορές περισσότερες θραύσεις στα χρωμοσώματα και 10 φορές
περισσότερες μεταλλάξεις σε σχέση με τις αντίστοιχες βλάβες που προκαλεί το
Cr(VI) απουσία βιταμίνης C. 'Ετσι, σύμφωνα με τη μελέτη αυτή, η κατά τα άλλα
ευεργετική για την υγεία βιταμίνη C δρα ως ενισχυτής της τοξικής δράσης του Cr(VI)
[Αναφ. 29]. Από την εργασία αυτή, αλλά και
από πολλές άλλες ανάλογες, διαφαίνεται ότι οι επικίνδυνα δραστικές
μορφές του χρωμίου μπορεί να εμφανίζονται κατά την πορεία της αναγωγής του Cr(VI) προς
Cr(III).
4. Xia L,
Akiyama E, Frankel G,
McCreerya R:
"Storage and release of
soluble hexavalent chromium from chromate conversion coatings - Equilibrium
aspects of Cr-VI concentration", Journal of the Electrochemical Society, 147:2556-2562,
2000 (Abstract).
5. Xia L, McCreerya R:
"Chemistry of a chromate conversion coating on aluminum alloy AA2024-T3 probed
by vibrational spectroscopy", Journal of the Electrochemical Society, 145:3083-3089, 1998 (Abstract).
6.
Wikipedia: "Corrosion inhibitor".
7. Kendig MW, Buchheit
RG: "Corrosion inhibition of aluminum and aluminum alloys by
soluble chromates, chromate coatings, and chromate-free
coatings", Corrosion, 59:379-400,
2003 (Abstract).
8. Wikipedia:
"Chromate
conversion coating".
9.
National
Toxicology Program,
Report
on Carcinogens:
"Chromium
hexavalent compounds,
11th
Edition"
(PDF αρχείο, 151 KB).
10.
Wikipedia:
"Chromated copper arsenate".
11. European Parliament (2003):
"Directive on the Restriction of the Use of Certain Hazardous
Substances in Electrical and Electronic Equipment
(RoHS)".
12.
ΙPCS,
WHO, 1988,
E.
Merian (1991): "Metals and their compounds in
the environment: occurrence, analysis and biological relevance", VCH, Wenheim,
Germany.
13.
(α) Wikipedia:
"Erin
Brockovitch". (β) Internet Movie Data Base (IMDb):
"Erin Brockovich"
(η κινηματογραφική ταινία).
14.
Οδηγία 98/83/ΕΚ της 3/11/1998: "Σχετικά με την ποιότητα του νερού
ανθρώπινης κατανάλωσης", Επίσημη Εφημερίδα Ευρωπαϊκών Κοινοτήτων,
L330,
32-54, 5/12/98 (PDF
αρχείο, 327 KB).
15. US Environmental Protection Agency, Ground
Water & Drinking Water: "Consumer
Factsheet on: CHROMIUM".
16. Κοινή Υπουργική Απόφαση
(KYA) 4859/726:
"Μέτρα και περιορισμοί σχετικά με την προστασία υδατικού περιβάλλοντος από
απορρίψεις και ειδικότερα καθορισμός οριακών τιμών ορισμένων επικίνδυνων ουσιών
που υπάγονται στον Κατάλογο ΙΙ της Οδηγίας 76/464/EΟΚ", Εφημερίδα
Κυβερνήσεως,
Τευχ. Β',
Αρ.
Φυλλου 253,
σελ. 4847, 9/3/2001 (PDF
αρχείο 283 KB).
17. OSHA: (α) "Health effects of
hexavalent chromium" (αρχείο
PDF, 20 KB). (β) "Safety
and Health Topics: hexavalent chromium".
18. NIOSH Safety and Health Topic: "Hexavalent
Chromium".
19. Environmental
Health Perspectives (2000): "Focus: Reflections on Hexavalent
Chromium"
(αρχείο
PDF 129 KB).
20. (α) IPCS,
WHO,
1988. (β)
Stasinakis
SA, Thomaidis NS,
Lekkas TD: "Speciation
of chromium in wastewater and
sludge by extraction with
liquid anion exchanger Amberlite LA-2 and
electrothermal atomic absorption spectrometry", Αnal
Chim Acta, 478:119-127, 2003
(Abstract).
(γ)
V. Gomez,
M.P. Callao: "Chromium
determination and speciation since 2000", Trends Anal Chem, 25:1006-1015, 2006 (Abstract).
21.
(α) Stasinakis AS,
Mamais
D, Thomaidis
NS, Lekkas TD: "Effect of chromium(VI) on bacterial kinetics of heterotrophic
biomass",
Water Res., 36:3341-3349, 2002 (Abstract).
(β) Stasinakis
AS, Thomaidis NS,
Mamais
D,
Karivali
M, Lekkas TD: "Chromium species behaviour in the activated sludge process", Chemosphere 52:1059-1067,
2003 (Abstract).
(γ) Stasinakis
AS, Thomaidis NS,
Mamais
D, Lekkas
TD: "Investigation
of Cr(VI) reduction in continuous-flow activated sludge systems" Chemosphere 57:1069-1077,
2004 (Abstract).
22. (α) Food-Info Net: "Χρώμιο".
(β) Krejpcio Ζ: "Essentiality of chromium for human nutrition and health",
Polish J. of Environ. Studies, 10(6):399-404, 2001 (αρχείο
PDF, 228 KB)
23. WHO, International Agency for
Research on Cancer (1997):
"Monographs on the
evaluation
of carcinogenic risks to humans, vol. 49: chromium, nickel and welding" (αρχείο
PDF, 81 KB).
24.
Costa M: "Toxicity
and carcinogenicity of Cr(VI) in animal models and humans", Crit Rev Toxicol,
27:431-442, 1997 (Abstract).
25. (α) National Institute
of Health : "Hexavalent chromium in drinking water causes cancer in lab animals"
(NIH
News, May 2007). (β) National Toxicology Program: "TOX
72: NTP Report on sodium dichromate dihydrate (CAS No. 7789-12-0) administered
in drinking water to male and female F344/N rats and B6C3F1 mice and
male BALB/c and am3-C57BL/6 mice" (NTP
Studies Report, Jan. 2007).
26. (α) Fan
AM, Harding-Barlow J: "Chromium", in "Genotoxic and carcinogenic metals.
Environmental and occupational occurence exposure. Advances in modern
environmental toxicology", Vol. XI. eds. Fishbein et al., Princetown, Princetown
Scientific Publishing, 87-125,
1987.
(β) Wetterhahn KE, Hamilton
JW:
"Molecular
basis of hexavalent chromium carcinogenicity: effect on gene expression",
Sci Total Environ 86:113-129, 1989
(PubMed).
27. (α) Bridgewater LC, Manning FCR,
Woo ES, Patierno SR: "DNA polymerase
arrest by adducted trivalent chromium", Molecular Carcinogenesis, 9:122-133, 1994
(Abstract).
(β) Xu J, Bubley GJ, Detrick B, BIankenship
LJ, Patierno SR: "Chromium(VI) treatment of normal human lung
cells results in guanine-specific DNA polymerase arrest, DNA-DNA cross-links and
S-phase blockade of cell cycle", Carcinogenesis, 17:1511-1517,
1996
(Abstract).
(γ) De Flora S, Camoirano
A, Bagnasco M, Bennicelli C, Corbett GE, Kerger BD: "Estimates of the chromium(VI) reducing capacity in human
body compartments as a mechanism for attenuating its potential toxicity and
carcinogenicity", Carcinogenesis, 18:531-537, 1997 (Abstract).
(δ) Voitkun V, Zhitkovich A, Costa M: "Cr(III)-mediated crosslinks of glutathione or amino acids to the DNA
phosphate backbone are mutagenic in human cells", Nucleic Acids Research, 26:2024-2030, 1998
(αρχείο
PDF, 188 KB).
28. (α)
Molyneux MJ, Davies MJ:
"Direct
evidence for hydroxyl radical-induced damage to nucleic acids by chromium
(VI)-derived species: implications for chromium carcinogenesis",
Carcinogenesis,
16:875-882, 1995
(Abstract).
(β)
Shi X, Mao Y,
Knapton AD, Ding M, Rojanasakul Y,
Gannett PM, Dalal N, Liu K:
"Reaction
of Cr(VI) with ascorbate and hydrogen peroxide generates hydroxyl radicals and
causes DNA damage: role of Cr(IV)-mediated Fenton-like reaction",
Carcinogenesis,
15:2475-2478, 1994 (Abstract).
(γ)
Tsou TC, Chen CL, Liu TY, Yang JL:
"Induction
of 8-hydroxydeoxyguanosine in DNA by chromium(III) plus hydrogen peroxide and
its prevention by scavengers ",
Carcinogenesis,
17:103-108, 1996
(Abstract).
(δ) Qi W, Reiter RJ, Tan D-X, Garcia JJ, Manchester LC, Karbownik M, Calvo JR:
"Chromium(III)-induced
8-hydroxy-deoxyguanosine in DNA and its reduction by antioxidants: comparative
effects of melatonin, ascorbate, and vitamin E",
Environ Health Perspect,
108:399-412, 2000
(αρχείο
PDF, 1,58 MB). (ε)
Wang XF, Xing ML, Shen Y, Zhu X, Xu LH:
"Oral
administration of Cr(VI) induced oxidative stress, DNA damage and apoptotic cell
death in mice",
Toxicology,
228:16-23, 2006
(Abstract).
(στ)
Bagchi D, Stohs SJ, Downs BW, Bagchi M, Preuss HG:
"Cytotoxicity
and oxidative mechanisms of different forms of chromium",
Toxicology,
30:5-22, 2002 (Abstract).
29. (α) Brown University (Media
Relations): "Chromium
6: A killer compound with an improbable trigger"
(Μάρτιος 2007). (β)
Reynolds M,
Stoddard L,
Bespalov I,
Zhitkovich A:
"Ascorbate
acts as a highly potent inducer of chromate mutagenesis and clastogenesis:
linkage to DNA breaks in G2 phase by mismatch repair",
Nucleic Acids Res, 14:17169990, 2006.
'Αλλες χρήσιμες πηγές πληροφοριών για το εξασθενές
χρώμιο
1. California Department of Health Services, Hazard Evaluation System and Information Service:
"Hexavalent Chromium",
1992
2.
Australian
Government, Dept. Of the Environment and Water
Resources: "Chromium
(VI) compounds fact sheet".
3. U.S. DEPARTMENT OF HEALTH AND HUMAN SERVICES, Agency for
Toxic Substances and Disease Registry (ATSDR):
"CHROMIUM" (αρχείο
PDF, 86 KB).
|
Αποποίηση
ευθυνών:
Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των
πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την
επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη
νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες.
Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε
εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα
Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό
τους. |




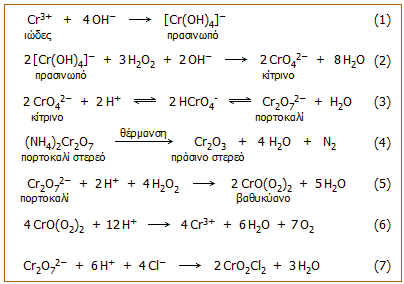 Τα άλατα του σχετικά ισχυρού χρωμικού οξέος του
Η2CrO4
(pK1 = 1,0,
pK2 = 6,5), παρασκευάζονται εύκολα με οξείδωση του Cr(III) με ήπια οξειδωτικά
μέσα σε αλκαλικό περιβάλλον. 'Ετσι π.χ. σε αλκαλικά διαλύματα το Cr(III) παρέχει
διαλυτά υδροξυσύμπλοκα, τα οποία στη συνέχεια οξειδώνονται προς χρωμικά άλατα με
υπεροξείδιο του υδρογόνου (αντιδράσεις 1 και 2). Βιομηχανικά τα χρωμικά άλατα παρασκευάζονται με σύντηξη χρωμίτη με
Τα άλατα του σχετικά ισχυρού χρωμικού οξέος του
Η2CrO4
(pK1 = 1,0,
pK2 = 6,5), παρασκευάζονται εύκολα με οξείδωση του Cr(III) με ήπια οξειδωτικά
μέσα σε αλκαλικό περιβάλλον. 'Ετσι π.χ. σε αλκαλικά διαλύματα το Cr(III) παρέχει
διαλυτά υδροξυσύμπλοκα, τα οποία στη συνέχεια οξειδώνονται προς χρωμικά άλατα με
υπεροξείδιο του υδρογόνου (αντιδράσεις 1 και 2). Βιομηχανικά τα χρωμικά άλατα παρασκευάζονται με σύντηξη χρωμίτη με