|
Φυσικoχημικές ιδιότητες [Αναφ. 1]: Εμφάνιση: Σχεδόν άχρωμο (όταν είναι καθαρή), βαρύ, ελαιώδες υγρό, ελαφρά πτητικό, ασταθές, εκρήγνυται αν αναταραχθεί βίαια. 'Εχει γλυκιά και καυστική γεύση. Μοριακός τύπος: C3H5N3O9 Σχετική μοριακή μάζα: 227,0865 Σημείο τήξεως: 14ºC Σημείο ζέσεως: Εκρήγνυται στους 218ºC Ειδικό βάρος: 1,59 g/mL (20ºC) Διαλυτότητα: Ελαφρά διαλυτή στο νερό (1 g διαλύεται σε 800-1000 mL ύδατος), διαλυτή σε οργανικούς διαλύτες (ακετόνη, αιθέρας, βενζόλιο κ.α.) log POW: 2,154 Τοξικότητα: Ισχυρά τοξική ουσία με έντονη και άμεση αγγειοδιασταλτική δράση, εισπνοή των ατμών της προκαλεί ισχυρή κεφαλαλγία. |
|
|
Νιτρογλυκερίνη Nitroglycerin |
Ιστορικά στοιχεία
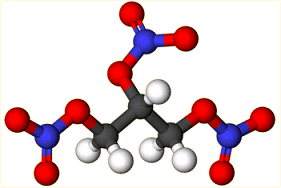 Η
νιτρογλυκερίνη ή τρινιτρογλυκερίνη (κατά IUPAC:
1,2,3-τρινιτροοξυ-προπάνιο,
άλλη ονομασία: τρινιτρική προπανο-1,2,3-τριόλη, τρινιτρική γλυκερίνη, τρινιτρίνη) είναι ένα
ειδικώς βαρύ ελαιώδες υγρό, εξαιρετικά εκρηκτικό και ιδιαίτερα επικίνδυνο στο
χειρισμό του. Αποτελεί το πρώτο συνθετικό εκρηκτικό υλικό που χρησιμοποιήθηκε
μετά την πυρίτιδα και χρησιμοποιείται ακόμη και σήμερα, κυρίως υπό την ασφαλέστερη σε
χρήση μορφή της δυναμίτιδας κυρίως για κατασκευαστικές εργασίες, σε ορυχεία,
λατομεία, σε χωματουργικά έργα
και σε κατεδαφίσεις παλαιών κτηρίων.
Επιπλέον,
η νιτρογλυκερίνη
χρησιμοποιείται για ιατρικούς σκοπούς ως πανίσχυρο και άμεσης δράσης αγγειοδιασταλτικό φάρμακο για
την αντιμετώπιση κάποιων καρδιακών προβλημάτων, όπως η
στηθάγχη.
Η
νιτρογλυκερίνη ή τρινιτρογλυκερίνη (κατά IUPAC:
1,2,3-τρινιτροοξυ-προπάνιο,
άλλη ονομασία: τρινιτρική προπανο-1,2,3-τριόλη, τρινιτρική γλυκερίνη, τρινιτρίνη) είναι ένα
ειδικώς βαρύ ελαιώδες υγρό, εξαιρετικά εκρηκτικό και ιδιαίτερα επικίνδυνο στο
χειρισμό του. Αποτελεί το πρώτο συνθετικό εκρηκτικό υλικό που χρησιμοποιήθηκε
μετά την πυρίτιδα και χρησιμοποιείται ακόμη και σήμερα, κυρίως υπό την ασφαλέστερη σε
χρήση μορφή της δυναμίτιδας κυρίως για κατασκευαστικές εργασίες, σε ορυχεία,
λατομεία, σε χωματουργικά έργα
και σε κατεδαφίσεις παλαιών κτηρίων.
Επιπλέον,
η νιτρογλυκερίνη
χρησιμοποιείται για ιατρικούς σκοπούς ως πανίσχυρο και άμεσης δράσης αγγειοδιασταλτικό φάρμακο για
την αντιμετώπιση κάποιων καρδιακών προβλημάτων, όπως η
στηθάγχη.
Η νιτρογλυκερίνη παρασκευάστηκε για πρώτη φορά το 1847 από τον Ιταλό Καθηγητή Χημείας Ascanio Sobrero (1812-1888), στο Πανεπιστήμιο του Τορίνο, με απλή διαδικασία νίτρωσης της γλυκερίνης, δηλαδή με σταδιακή προσθήκη γλυκερίνης σε ψυχόμενο μίγμα πυκνού θειικού και πυκνού νιτρικού οξέος. Αναφέρεται ότι ο Sobrero, λόγω της μεγάλης εκρηκτικής ισχύος και του ιδιαίτερα επικίνδυνου χαρακτήρα αυτής της νέας ουσίας την οποία είχε ονομάσει πυρογλυκερίνη, δίστασε για έναν χρόνο να ανακοινώσει την παρασκευή της και δεν συνιστούσε τη χρήση της ή τη σύνθεσή της. Γνωρίζοντας τις εκρηκτικές ιδιότητες και τις καταστροφές που μπορούσε να προκαλέσει, με γράμματα και άρθρα του σε εφημερίδες και περιοδικά, ο Sobrero προειδοποιούσε αδιάκοπα κατά της χρήσης της, δηλώνοντας ότι ήταν υπερβολικά επικίνδυνη και ότι ήταν ουσιαστικά αδύνατον να τη χειριστεί κανείς με κάποια ασφάλεια.
 |
 |
|
Ascanio Sobrero (1812-1888). Ο Ιταλός χημικός που συνέθεσε για πρώτη φορά τη νιτρογλυκερίνη το 1847. Προειδοποίησε κατά της χρήσης της λόγω της επικινδυνότητάς της. |
Alfred Bernhard Nobel (1833-1896). Ο Σουηδός χημικός και μηχανικός που κατάφερε να μετατρέψει την επικίνδυνη νιτρογλυκερίνη σε εύχρηστη εκρηκτική ύλη ως δυναμίτιδα. |
Παρά τις προειδοποιήσεις του Sobrero κατά της χρήσης της και για την επικινδυνότητά της, την εκρηκτική ισχύ της νιτρογλυκερίνης κατάφερε τελικά να "τιθασεύσει" ο Σουηδός μηχανικός και χημικός Alfred Bernhard Nobel (1833 - 1896), υπό τη μορφή της ασφαλέστερης και κατά πολύ πιο εύχρηστης δυναμίτιδας.
Δυναμίτιδα [Αναφ. 2]
Ο Alfred Bernhard Nobel (1833-1896) σε νεαρή ηλικία εργαζόταν στο Παρίσι στο ιδιωτικό εργαστήριο του διάσημου Γάλλου Καθηγητή της Χημείας Théophile-Jules Pelouze (1807-1867), ο οποίος υπήρξε καθηγητής του Sobrero στο Τορίνο και είχε ασχοληθεί με τη νίτρωση του χαρτιού και του βάμβακα. Εκεί, το 1850, ο Nobel γνώρισε τον Ascanio Sobrero, παλαιό φοιτητή του Pelouze, ο οποίος τρία χρόνια πριν είχε συνθέσει τη νιτρογλυκερίνη και από τον οποίο ενημερώθηκε για τη χημική δομή της ένωσης και τον τρόπο της παρασκευής της.
Κατά τη δεκαετία του 1850, όταν ο Nobel επέστρεψε στη Σουηδία και άρχισε να εργάζεται στην οικογενειακή βιομηχανία οπλικών συστημάτων. Εκεί, σε συνεργασία με τον πατέρα του τον μηχανικό και εφευρέτη Immanuel Nobel (1801-1872), άρχισε να πειραματίζεται με τη νιτρογλυκερίνη αναζητώντας ασφαλέστερους τρόπους χειρισμού αυτής της πανίσχυρης αλλά επικίνδυνης εκρηκτικής ουσίας.
Το 1864, ο νεότερος αδερφός του Alfred Nobel, o Emil (Emil Nobel, 1843-1864) και τέσσερις εργάτες σκοτώθηκαν σε μια έκρηξη νιτρογλυκερίνης στο εργοστάσιο όπλων των Nobel στο Helenborg, ένα προάστιο της Στοκχόλμης. Ο ίδιος γλύτωσε γιατί έτυχε να λείπει από το εργοστάσιο όταν συνέβη η έκρηξη. Μετά από αυτό το καταστροφικό ατύχημα, οι αρχές της Στοκχόλμης απαγόρευσαν στον Nobel τη συνέχιση των πειραμάτων στα ευρύτερα όρια της πόλης.
Παρά το καταστροφικό ατύχημα και τον θάνατο του αδελφού του, ο Nobel συνέχισε απτόητος τα πειράματά του σε νέα εργαστήρια, στο Vinterviken, σε έναν ερημικό κολπίσκο της λίμνης Mälaren νότια της Στοκχόλμης (σήμερα παραθεριστική περιοχή), αποφασισμένος να προχωρήσει στη μαζική παραγωγή νιτρογλυκερίνης. Aφού κατάφερε ο Nobel μετά από πολλές προσπάθειες να πάρει τις σχετικές άδειες και να εξασφαλίσει τραπεζική χρηματοδότηση, ξεκίνησε πάλι την παρασκευή νιτρογλυκερίνης αρχικά πάνω σε μια πλωτή εξέδρα και στη συνέχεια, σε νεόκτιστα κτήρια. Η παραγωγή νιτρογλυκερίνης και δυναμίτιδας στο Vinteviken συνεχίστηκε μέχρι το 1920.
Το 1865, ο Νομπέλ ίδρυσε την εταιρία "Alfred Nobel & Company" (σήμερα: Dynamit Actien Gesellschaft - Dynamit A/G) στη Γερμανία. Κοντά στην πόλη Geesthacht, 34 χλμ. νοτιοανατολικά του Αμβούργου, σε μια περιοχή στους λόφους Krümmel και μακριά από κατοικημένες περιοχές έκτισε ένα απομονωμένο εργοστάσιο. Η εταιρία του Nobel αρχικά παρήγαγε ένα εκρηκτικό υγρό που συνδύαζε τη νιτρογλυκερίνη με την πυρίτιδα, το οποίο ήταν γνωστό ως "Εκρηκτικό 'Eλαιο" (Blasting Οil). Ωστόσο, και αυτό το υγρό ήταν εξαιρετικά ασταθές και επικίνδυνο στη μεταφορά, όπως φάνηκε και από πολυάριθμες καταστροφές. Τα κτήρια του εργοστασίου στο Krümmel είχαν καταστραφή μάλιστα σε δύο περιπτώσεις.
Από το Krümmel και κατά το διάστημα 1865 έως το 1873, η εταιρία Alfred Nobel & Co έστελνε συνεχώς αυξανόμενες ποσότητες εκρηκτικών με βάση τη νιτρογλυκερίνη, όχι μόνο στη Γερμανία, αλλά και σε άλλες Ευρωπαϊκές χώρες, όπως επίσης και στην Αμερική. Η διαδικασία αποστολής αυτού του εξαιρετικά επικίνδυνου φορτίου γινόταν κατά τρόπο που σήμερα δεν θα επιτρεπόταν σε καμία περίπτωση.
 |
 |
|
Αριστερά: Ζωγραφικός πίνακας που απεικονίζει την πλωτή κατασκευαστική μονάδα που χρησιμοποίησε αρχικά ο Nobel στη λίμνη Mälaren στην περιοχή Vinterviken (σήμερα παραθεριστική περιοχή στα νότια της Στοκχόλμης) για την παρασκευή νιτρογλυκερίνης [πηγή]. Δεξιά: 'Ενα από τα λίγα κτήρια (μονάδα παραγωγής θειικού οξέος) της βιομηχανίας εκρηκτικών της οικογένειας Nobel που απέμειναν, στην περιοχή Vinterviken. Σήμερα, τουριστικό αξιοθέατο [πηγή]. |
|
|
|
|
|
Τον Απρίλιο του 1866, τρία κιβώτια νιτρογλυκερίνης (χωρίς κάποια ένδειξη για το περιεχόμενό τους!) στάλθηκαν στην Καλιφόρνια, όπου η εταιρία σιδηροδρόμων "Central Pacific Railroad" ήθελε να τη δοκιμάσει ως εκρηκτικό για εκβραχισμούς, ώστε να επιταχύνει την κατασκευή μιας σήραγγας μήκους 506 μέτρων στην οροσειρά Σιέρα Νεβάδα. Σε ένα από τα κιβώτια αυτά παρατηρήθηκε διαρροή ενός υγρού (προφανώς νιτρογλυκερίνης) και κρατήθηκε για προσωρινή φύλαξη στις αποθήκες της γνωστής μεταφορικής εταιρίας Wells Fargo στο Σαν Φρανσίσκο [Αναφ. 2ε]. Εκεί εξερράγη προκαλώντας τον θάνατο σε 15 άτομα, τραυματίζοντας πολύ περισσότερα, ενώ διέλυσε τις αποθήκες και σχεδόν όλα γειτονικά κτήρια.
Το γεγονός αυτό οδήγησε στη γενική απαγόρευση της μεταφοράς υγρής νιτρογλυκερίνης στην Καλιφόρνια. Αυτή η απαγόρευση κατέστησε αναγκαία την επιτόπια παρασκευή νιτρογλυκερίνης, καθώς ήταν απαραίτητη για τη διάνοιξη της σήραγγας, που είχε απομείνει για την ολοκλήρωση του πρώτου αμερικανικού διηπειρωτικού σιδηροδρόμου. Τα πολύνεκρα ατυχήματα δεν έλειψαν, συχνά λόγω του πρόχειρου τρόπου παρασκευής και αποθήκευσης της εκρηκτικής ένωσης.
Η νιτρογλυκερίνη στην υγρή της μορφή και σε κάθε περίπτωση ήταν εξαιρετικά επικίνδυνη. H παραμικρή ανατάραξη μπορούσε να προκαλέσει την έκρηξή της. Μια σταγόνα της αν πέσει από κάποιο ύψος στο πάτωμα εκρήγνυται. Για να καταστήσει ασφαλέστερο τον χειρισμό της νιτρογλυκερίνης ο Alfred Nobel πειραματίστηκε με διαφορετικές προσθήκες αδρανών υλικών με μεγάλη προσροφητική ικανότητα.
Μετά την πρώτη έκρηξη στο εργοστάσιο της Γερμανίας, ο Nobel συνέχισε τα πειράματά του σε ένα πρόχειρο, προσωρινό εργαστήριο που είχε στήσει σε μια μεγάλη σχεδία στον ποταμό 'Ελβα. Προσπαθούσε να βελτιώσει την ασφάλεια της νιτρογλυκερίνης αναμιγνύοντάς την με σταθεροποιητικά αδρανή υλικά, όπως καρβουνόσκονη, τσιμέντο, πριονίδια κ.α. Τελικά βρήκε την τέλεια λύση στους αμμόλοφους του Krümmel.
To 1867, o Nobel διαπίστωσε ότι αναμιγνύοντας τη νιτρογλυκερίνη με γη διατόμων (diatomaceous earth, γερμανικά: kieselgur) μια σκόνη σχεδόν καθαρής πυριτίας (SiO2), ένα υλικό που υπήρχε σε αφθονία στους αμμόλοφους του Krümmel, μετέτρεπε την υγρή νιτρογλυκερίνη σε ένα υλικό σαν το ζυμάρι, τη δυναμίτιδα, υλικό ασφαλές τόσο στον χειρισμό, όσο και στην αποθήκευση. Εκτός από τη γη των διατόμων προσέθεταν μικρές ποσότητες CaCO3 ή Na2CO3 για να προληφθεί η συσσώρευση όξινων ακαθαρσιών (π.χ. από υδρόλυση της νιτρογλυκερίνης) που θα καθιστούσαν τη δυναμίτιδα επισφαλή. Η δυναμίτιδα δεν εκρήγνυται παρά μόνο με χρήση πυροκροτητή.
|
Μια μέρα, ενώ ο Nobel πειραματιζόταν στο εργαστήριό του, ένα φιαλίδιο με μια μικρή ποσότητα νιτρογλυκερίνης, γλίστρησε από το χέρι του και βλέποντάς το να πέφτει στο πάτωμα περίμενε να ακολουθήσει μια καταστροφική έκρηξη. Ωστόσο, το φιαλίδιο έπεσε σε ένα στρώμα από λεπτό πριονίδι, που απορρόφησε τη νιτρογλυκερίνη χωρίς να συμβεί κάτι. Στη συνέχεια δοκίμασε τις εκρηκτικές ιδιότητες της πάστας πριονιδιού - νιτρογλυκερίνης και διαπίστωσε ότι ήταν εξαιρετικά σταθερή. Αμέσως ο Nobel κατάλαβε ότι η ανάμιξη της νιτρογλυκερίνης με μια αδρανή προσροφητική ουσία ήταν το κλειδί για τη σταθεροποίηση της επικίνδυνης νιτρογλυκερίνης. Δοκίμασε κάθε προσροφητική ουσία που μπορούσε να σκεφτεί: καρβουνόσκονη, μαύρη πυρίτιδα, ξυλάλευρο, τσιμέντο. Τελικά διαπίστωσε ένα είδος άμμου που αφθονούσε στην περιοχή του Krümmel ήταν το καταλληλότερο υλικό. Το υλικό αυτό ήταν γη διατόμων, δηλαδή σκελετοί μικροσκοπικών θαλάσσιων οργανισμών σχεδόν από καθαρό SiO2. 'Αλλοι τρόποι απευαισθητοποίησης της νιτρογλυκερίνης βρέθηκαν πως είναι η βαθιά κατάψυξη, όπως και η προσθήκη σ' αυτήν οργανικών διαλυτών (ακετόνη ή αιθανόλη) σε αναλογία 10 έως 20%. Ωστόσο, στη δεύτερη περίπτωση, διαπιστώθηκε ότι η νιτρογλυκερίνη έχανε σημαντικό ποσοστό από την εκρηκτική της ισχύ και επιβαλλόταν η απομάκρυνση του διαλύτη πριν από τη χρήση, μια ιδιαίτερα επικίνδυνη εργασία. |
 |
 |
 |
 |
|
1η εικόνα: Φιάλη με υγρή νιτρογλυκερίνη. 2η εικόνα: Τυπική μορφή γης διατόμων, ενός έντονα προσροφητικού λευκού έως γκρίζου υλικού, αποτελούμενο σχεδόν αποκλειστικά από SiO2 ((80-90% SiO2, 2-4% Al2O3, 0,5-2% Fe2O3), προερχόμενο από τους σκελετούς μικροσκοπικών (10-200 μm) θαλάσσιων οργανισμών, των διατόμων, που έχουν συγκεντρωθεί σχηματίζοντας ολόκληρα κοιτάσματα. 3η εικόνα: Μικροφωτογραφίες διάφορων διατόμων, στη δομή των οποίων (μεγάλος λόγος επιφάνεια/μάζα) οφείλεται η μεγάλη προσροφητική ικανότητα της γης διατόμων [πηγή]. 4η εικόνα: Τυπική εμφάνιση ράβδων (φύσιγγες) δυναμίτιδας. Παρασκευάζονται με ανάμιξη γης διατόμων με υγρή νιτρογλυκερίνη. |
|||
 |
 |
 |
 |
| Φωτογραφίες του 1915 από το Krümmel [πηγή]. 1η εικόνα: Μονάδες του συγκροτήματος χωρισμένες μεταξύ τους κάθε μία μέσα σε μια τάφρο με επικλινή τοιχώματα, έτσι ώστε σε περίπτωση έκρηξης το εκρηκτικό κύμα να κατευθυνθεί προς τα πάνω χωρίς να προκαλέσει ζημιά στις άλλες μονάδες. 2η εικόνα: Φόρτωση εκρηκτικών. 3η εικόνα: Το προσωπικό εργαστήριο του Alfred Nobel. 4η εικόνα: Η κατοικία του Alfred Nobel κοντά στο εργοστάσιο. | |||
|
Τυπική μορφή σύγχρονου πυροκροτητή. |
Η δυναμίτιδα συσκευάζεται σε κυλινδρικές ράβδους (φύσιγγες δυναμίτη) που ήταν τυλιγμένοι με κηρόχαρτο. Το μέγεθος ήταν όσο χρειαζόταν για την τοποθέτησή τους σε τρύπες που διανοίγονταν π.χ. σε βράχους. Οι ράβδοι αυτοί είναι γνωστοί ως δυναμίτες (dynamites) και η βασική χρήση τους είναι η πραγματοποίηση εκρήξεων σε εκβραχισμούς, διάφορα χωματουργικά έργα και σε ορυχεία. Ο Nobel κατοχύρωσε το σχετικό δίπλωμα ευρεσιτεχνίας γεγονός που του προσέφερε τεράστια περιουσία.
Για να πυροδοτήσει σειρές δυναμιτών, ο Nobel εφεύρε τον πυροκροτητή (detonator, blasting cap) ο οποίος μπορούσε να εκραγή μέσω μιας θρυαλλίδας (φυτίλι) ή μέσω μιας ηλεκτρικώς θερμαινόμενης αντίστασης. Ο πυροκρατητής του Nobel ως δραστική ουσία είχε τον κροτικό υδράργυρο (mercury fulminate, Hg(CNO)2). Ο πυροκροτητής δημιουργεί μια μικρή έκρηξη μέσα στον δυναμίτη (ή άλλο εκρηκτικό υλικό), το σοκ της οποίας προκαλεί την κυρίως έκρηξη.
Αυτές οι εφευρέσεις μείωσαν το κόστος ανατίναξης πετρωμάτων σε ορυχεία και λατομεία, στις διανοίξεις σηράγγων, στις κατασκευές καναλιών και σε πολλές άλλες σχετικές εργασίες (για περισσότερα σε σχέση με τους πυροκροτητές, βλ. Χημική ένωση του μήνα: Υδραζωτικό οξύ και άλατά του).
Υπάρχουν διάφοροι τύποι δυναμίτη που διαφέρουν μεταξύ τους ως προς την εκρηκτική τους ισχύ, την ασφάλεια χρήσης, τον χρόνο ζωής και τον τρόπο αποθήκευσης. Για παράδειγμα δυναμίτες που περιέχουν και νιτροκυτταρίνη (αυξάνει τη σκληρότητα του "ζυμαριού" δυναμίτη-γης διατόμων) και νιτρικά άλατα είναι γνωστοί ως ζελατινοδυναμίτες (gelignite, gel dynamites). Ο ζελατινοδυναμίτης δεν παρουσίαζε το πρόβλημα του "ιδρώτα" που εμφάνιζε κατά την παραμονή του ο δυναμίτης. Ο "ιδρώτας" δεν ήταν παρά καθαρή υγρή νιτρογλυκερίνη, αποτέλεσμα μερικής εκρόφησης της νιτρογλυκερίνης από τη γη διατόμων, γεγονός που καθιστούσε επικίνδυνους τους δυναμίτες αυτούς κατά την αποθήκευση, αλλά και κατά τη χρήση. Οι ζελατινοδυναμίτες εκρήγνυται μόνο με πυροκροτητή. Είναι χαρακτηριστικό ότι με την επίδραση γυμνής φλόγας οι ζελατινοδυναμίτες μπορούν να καούν αργά χωρίς να εκραγούν.
Σήμερα, αν και η χρήση της δυναμίτιδας συνεχίζεται, έχουν κατασκευαστεί νέες συνθετικές εκρηκτικές ύλες ακόμη μεγαλύτερης ισχύος και κατά πολύ ασφαλέστερες σε σχέση με την νιτρογλυκερίνη (βλ. Χημική ένωση του μήνα: οκτανιτροκυβάνιο).
|
|
ΠΡΟΣΟΧΗ ! ! Οι επιμελητές της ιστοσελίδας αυτής προειδοποιούν ότι κάθε απόπειρα σύνθεσης της νιτρογλυκερίνης, σε οποιαδήποτε ποσότητα (ακόμη και της τάξης λίγων mg) μπορεί να αποβεί μοιραία για τη σωματική ακεραιότητα και τη ζωή όσων θα επιχειρούσαν κάτι τέτοιο. |
|
|
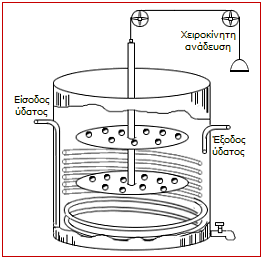
Αντιδραστήρας παρασκευής νιτρογλυκερίνης στις εγκαταστάσεις του Krümmel, γνωστός ως nitrator [πηγή]. |
Βιομηχανική παραγωγή νιτρογλυκλερίνης
Για τη βιομηχανική παραγωγή νιτρογλυκερίνης χρησιμοποιείται ένα μίγμα 1+1 πυκνού θειϊκού οξέος και πυκνού νιτρικού οξέος. Συνήθως χρησιμοποιούνται καθαρά οξέα για να αποφευχθεί η παρουσία ατμών οξειδίων του αζώτου ή άλλων προσμίξεων που μπορεί να επιδράσουν στην πορεία και την ταχύτητα της αντίδρασης.
Θα πρέπει εδώ να σημειωθεί ότι εμπορικώς διαθέσιμα είναι το "πυκνό" νιτρικό οξύ (περιέχει περίπου 70% ΗΝΟ3) και το "ατμίζον" νιτρικό οξύ (περιέχει περίπου 90% ΗΝΟ3). Το "καθαρό" νιτρικό οξύ (98-99% σε ΗΝΟ3) είναι πολύ ακριβότερο, δεν βρίσκεται εύκολα στο εμπόριο και έχει περιορισμένο χρόνο αποθήκευσης (σύντομα κοκκινίζει από τη διάσπασή του προς ΝΟ2). 'Οσο λιγότερο νερό περιέχει το μίγμα θειικού και νιτρικού οξέος, τόσο ευκολότερη είναι η διαδικασία της νίτρωσης. Για τον λόγο αυτό συχνά χρησιμοποιείται "καπνίζον" θειικό οξύ (γνωστό ως oleum ή fuming sulfuric acid), που είναι διάλυμα 20-40% SO3 (θειικού ανυδρίτη) σε θειικό οξύ. Κατά την ανάμιξη αυτού του θειικού οξέος με ατμίζον νιτρικό οξύ, το SO3 δεσμεύει το νερό από το πυκνό νιτρικό οξύ, μηδενίζοντας πρακτικά την περιεκτικότητα του μίγματος νίτρωσης σε νερό.
Στην αρχή το π.
H2SO4
προκαλεί πρωτονίωση του π. HNO3
(HNO3
+ H2SO4
![]() Η2ΝΟ3+
+ HSO4-).
Με απόσπαση ύδατος από το πρωτονιωμένο οξύ ΗΝΟ3
δημιουργείται το ισχυρά ηλεκτρονιόφιλο κατιόν νιτρωνίου
(ΝΟ2+),
το οποίο προσβάλλει το ασύζευκτο ζεύγος ηλεκτρονίων του οξυγόνου κάθε υδροξυλίου
της γλυκερίνης (R-ΟΗ + ΝΟ2+
Η2ΝΟ3+
+ HSO4-).
Με απόσπαση ύδατος από το πρωτονιωμένο οξύ ΗΝΟ3
δημιουργείται το ισχυρά ηλεκτρονιόφιλο κατιόν νιτρωνίου
(ΝΟ2+),
το οποίο προσβάλλει το ασύζευκτο ζεύγος ηλεκτρονίων του οξυγόνου κάθε υδροξυλίου
της γλυκερίνης (R-ΟΗ + ΝΟ2+
![]() R-Ο-ΝΟ2
+ Η+), ενώ το πρωτόνιο δεσμεύεται από το ανιόν HSO4-
με αναγέννηση του Η2SO4
(H+ + HSO4-
R-Ο-ΝΟ2
+ Η+), ενώ το πρωτόνιο δεσμεύεται από το ανιόν HSO4-
με αναγέννηση του Η2SO4
(H+ + HSO4-
![]() H2SO4).
'Eτσι η νιτρο-ομάδα του νιτρικού οξέος προστίθεται αντικαθιστώντας το Η του
υδροξυλίου σχηματίζοντας νιτρικό εστέρα με ταυτόχρονη παραγωγή ύδατος.
Από τα προηγούμενα είναι σαφές ότι το θειικό οξύ δεν δρα αποκλειστικά ως "αφυδατικό μέσο", όπως πίστευαν παλαιότερα,
αλλά και ως καταλύτης.
H2SO4).
'Eτσι η νιτρο-ομάδα του νιτρικού οξέος προστίθεται αντικαθιστώντας το Η του
υδροξυλίου σχηματίζοντας νιτρικό εστέρα με ταυτόχρονη παραγωγή ύδατος.
Από τα προηγούμενα είναι σαφές ότι το θειικό οξύ δεν δρα αποκλειστικά ως "αφυδατικό μέσο", όπως πίστευαν παλαιότερα,
αλλά και ως καταλύτης.
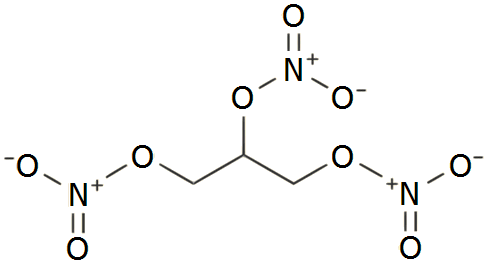
Σε αντίθεση με τις νιτροενώσεις και τα αντίστοιχα εκρηκτικά (όπως π.χ. το τρινιτροτολουόλιο, ΤΝΤ), η νιτρογλυκερίνη δεν αποτελεί νιτροένωση (δεσμός: C-NO2), αλλά εστέρας του νιτρικού οξέος (δεσμός: C-O-NO2) και επομένως πλουσιότερη σε οξυγόνο ένωση. Η αντίδραση σχηματισμού της νιτρογλυκερίνης διαφέρει ουσιαστικά από την αρωματική νίτρωση (π.χ. σύνθεση νιτροβενζολίου) όπου το ισχυρά ηλεκτρονιόφιλο ιόν νιτρωνίου (ΝΟ2+) αποτελεί το δραστικό σωματίδιο και οδηγείται σε ηλεκτρονιόφιλη προσβολή του αρωματικού δακτυλίου, οπότε σχηματίζεται δεσμός C-NO2.

Η αντίδραση (αντίδραση 1) είναι ισχυρώς εξώθερμη. Η επιθυμητή θερμοκρασία είναι χαμηλή (ενδεικτικά: στην περιοχή 10ºC - 15ºC), ανάλογα τις καθαρότητες των άλλων υλικών. Εάν η θερμοκρασία αφεθεί να ανέλθει, τότε η αντίδραση εκτρέπεται (κατάσταση "runaway") με αποτέλεσμα η νίτρωση να ακολουθηθεί από μια εκρηκτική πλήρη οξείδωση της γλυκερίνης και με την απελευθέρωση τοξικών ατμών διοξειδίου του αζώτου (π.χ. αντίδραση 2). Για τον λόγο αυτό η γλυκερίνη προστίθεται στο μίγμα των οξέων αργά και το δοχείο ψύχεται ισχυρά και η εστεροποίηση πραγματοποιείται με σχετικά αργό αλλά ελεγχόμενο ρυθμό. Χαμηλότερες θερμοκρασίες καθιστούν την αντίδραση ιδιαίτερα αργή.
Το δοχείο αντίδρασης (nitrator) είναι κατασκευασμένο με εσωτερικό μεταλλικό περίβλημα σιδήρου ή μολύβδου και η ανάδευση πραγματοποιείται με διαβίβαση πεπιεσμένου αέρα. Το όλο σύστημα διατηρείται σε χαμηλές θερμοκρασίες. Φυσικά λαμβάνονται μέτρα υψίστης ασφάλειας και προστασίας από πιθανές εκρήξεις. Σε περίπτωση ανόδου της θερμοκρασίας πέραν από ένα σημείο, ανοίγουν στρόφιγγες ασφάλειας που αμέσως εκκενώνουν τον αντιδραστήρα ρίχνοντας το περιεχόμενό του σε άφθονο ψυχρό νερό.
|
|
Μετά τη διαδικασία της νίτρωσης το περιεχόμενο του αντιδραστήρα αδειάζεται σε νερό και η χαμηλότερη στιβάδα της νιτρογλυκερίνης, παραλαμβάνεται και εκπλένεται με διάλυμα όξινου ανθρακικού νατρίου για να απαλλαγεί από όξινες προσμίξεις που καθιστούν τη νιτρογλυκερίνη ιδιαίτερα ασταθή.
 |
 |
 |
|
Αριστερά: Αντιδραστήρας σύνθεσης νιτρογλυκερίνης γνωστός ως "nitrator" (τέλη 19ου αιώνα). Ο εργάτης παρακολουθεί συνεχώς ένα θερμόμετρο και χειρίζεται τις βαλβίδες του νερού ψύξης για να διατηρεί το αντιδρών μίγμα στην επιθυμητή θερμοκρασία. Κάθεται σε σκαμνί με ένα πόδι(!) μη τυχόν και αποκοιμηθεί και να βρίσκεται έτσι σε συνεχή εγρήγορση. Κέντρο: Εργάτριες "ζυμώνουν" τη νιτρογλυκερίνη με γη διατόμων για την παρασκευή δυναμίτιδας. Αξίζει να παρατηρηθεί το πριονίδι στο πάτωμα ως μέτρο ασφάλειας, αφού είχε παρατηρηθεί ότι σταγόνες νιτρογλυκερίνης που πέφτουν στο πριονίδι δεν εκρήγνυνται [πηγή]. Δεξιά: Κάπως πιο σύγχρονος αντιδραστήρας σύνθεσης νιτρογλυκερίνης (δεκαετία 1950) [πηγή]. |
||
Κατηγορίες αζωτούχων εκρηκτικών υλών
Ανάλογα με τον τρόπο σύνδεσης του αζώτου με το υπόλοιπο μόριο τα εκρηκτικά αυτά διακρίνονται στις ακόλουθες τέσσερις κατηγορίες κατά σειρά μειούμενης ενέργειας διάστασης δεσμού και επομένως μειούμενης σταθερότητας (για περισσότερες πληροφορίες βλ. Χημική ένωση του μήνα: οκτανιτροκυβάνιο):

1) Νιτροπαράγωγα με κύριο εκπρόσωπο το TNT. Είναι τα ανθεκτικότερα σε κρούση εκρηκτικά και θεωρούνται "βράχοι" σταθερότητας σε σχέση με τους νιτρικούς εστέρες.
2) Νιτραμίνες, με κυριότερους εκπρόσωπους τα RDX (κυκλωνίτης) και HMX. Αποτελούν τα πλέον σύγχρονα εκρηκτικά.
3) Νιτρώδεις εστέρες. Η χρήση εκρηκτικών αυτής της κατηγορίας είναι περιορισμένη.
4) Νιτρικοί εστέρες, με κυριότερο εκπρόσωπο τη νιτρογλυκερίνη. Είναι τα πλέον ευαίσθητα και ασταθέστερα εκρηκτικά.
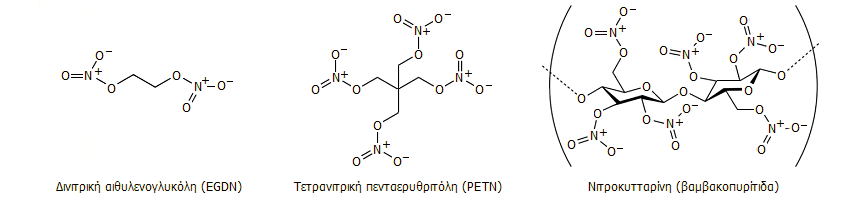
Από την κατηγορία των νιτρικών εστέρων, τα πιο συνηθισμένα εκρηκτικά είναι: (α) η δινιτρική αιθυλενογλυκόλη, η οποία προστίθεται σε μικρές αναλογίες στη νιτρογλυκερίνη για να υποβιβάσει το σημείο τήξεως και να αποφευχθεί η στερεοποίηση της τελευταίας σε χαμηλές θερμοκρασίας γεγονός που θα την καθιστούσε ιδιαίτερα επικίνδυνη στους κραδασμούς, (β) η τετρανιτρική πενταερυθριτόλη (PETN), στερεή ένωση ασφαλέστερη στη χρήση σε σχέση με τη νιτρογλυκερίνη και (γ) η παλαιότερη απ' όλες η νιτροκυτταρίνη, γνωστή και ως βαμβακοπυρίτιδα.
Αντιδράσεις της νιτρογλυκερίνης [Αναφ. 3]
Παρά την επικινδυνότητα της νιτρογλυκερίνης, έχουν εξετασθεί ορισμένες αντιδράσεις της. 'Ετσι, διάλυμα της νιτρογλυκερίνης σε πυκνό θειικό οξύ, όταν χυθεί σε νερό παρέχει μερικώς υδρολυμένη γλυκερίνη: τη δινιτρο-γλυκερίνη και τη μονο-νιτρογλυκερίνη (την κάθε μία στα δύο δυνατά ισομερή). Τα διαλύματά της σε πυκνά οξέα σταδιακά αποσυντίθενται εκλύοντας νιτρικό οξύ (χωρίς η αντίδραση αυτή να είναι κατ' ανάγκη εκρηκτική).
Με πυκνά διαλύματα ισχυρών βάσεων υδρολύεται, με μια ισχυρώς εξώθερμη αντίδραση παρέχοντας κυρίως νιτρικά, αλλά και νιτρώδη άλατα, ενώ από την παραγόμενη γλυκερίνη ελάχιστη παραμένει ως έχει και η υπόλοιπη οξειδώνεται προς οξαλικό οξύ. Με αλκοολικά διαλύματα βάσεων παρέχει νιτρώδη, μυρμηκικά και οξικά άλατα. Με αναγωγικά μέσα (θειούχα άλατα ασβεστίου, καλίου) ανάγεται πλήρως προς γλυκερίνη, όπως επίσης και με υδροϊώδιο παρέχει γλυκερίνη και οξείδιο του αζώτου. Η νιτρογλυκερίνη δρα και ως νιτρωτικό μέσο, έτσι με ανιλίνη και ανάλογες αρωματικές βάσεις αντιδρά παρέχοντας νιτροπαράγωγά τους.
|
Video (παραγωγής BBC) που δείχνει την εκρηκτική ισχύ μικροποσότητας νιτρογλυκερίνης. |
Εκρηκτική ισχύς της νιτρογλυκερίνης
Με κρούση, με ταχεία θέρμανση ή με ανατάραξη η νιτρογλυκερίνη εκρήγνυται. Πολλές φορές όταν δεν έχει καθαριστεί καλά μπορεί να εκραγεί και κατά την ηρεμία. Κατά την έκρηξη παράγει αέρια προϊόντα που περιγράφει η αντίδραση:
4 C3H5(ONO2)3
![]() 6 N2 + 12 CO2 +
O2 + 10 H2O
6 N2 + 12 CO2 +
O2 + 10 H2O
Η εκρηκτική δύναμη της νιτρογλυκερίνης είναι αποτέλεσμα της απότομης απελευθέρωσης ενέργειας από την έκρηξη. Κάθε mol νιτρογλυκερίνης κατά τη διάσπασή της παρέχει 1,5 MJ ενέργειας. Η νιτρογλυκερίνη έχει θετικό ισοζύγιο οξυγόνου (oxygen balance, OB, ΟΒ%), δηλαδή περιέχει επιπλέον οξυγόνο από το απαιτούμενο για την ολοκληρωτική οξείδωση του περιεχόμενου υδρογόνου και άνθρακα, όπως επίσης και σχετικά μεγάλο ειδικό βάρος, που αποτελεί παράγοντα επαύξησης της εκρηκτικής ισχύος (για περισσότερες πληροφορίες πάνω στα "χαρακτηριστικά ποιότητας" των εκρηκτικών βλ. Χημική ένωση του μήνα: οκτανιτροκυβάνιο).
Με βάση την προηγούμενη αντίδραση 1 mol νιτρογλυκερίνης (227 g) παράγει 29/4 mol αερίων (το νερό στη θερμοκρασία της έκρηξης θα είναι αέριο) ή 1 mL νιτρογλυκερίνης (1,59 g) παράγει 1138 mL (θεωρητικώς) αερίων (υπό ΚΣ), που στη θερμοκρασία της έκρηξης θα ξεπερνούν τα 5000 mL. Θα πρέπει να σημειωθεί όμως, ότι καμία εκρηκτική ύλη δεν εκρήγνυται παρέχοντας αποκλειστικώς τα "καθαρά" προϊόντα της παραπάνω αντίδρασης και η παρουσία οξειδίων του αζώτου και μονοξειδίου του άνθρακα είναι πάντοτε πιθανή.
Οι πιέσεις που αναπτύσσονται κατά την έκρηξη της νιτρογλυκερίνη φτάνουν τις 250 χιλιάδες ατμόσφαιρες, οι οποίες είναι ικανές να θρυμματίσουν και τους πιο συμπαγείς βράχους. 'Ενα πλεονέκτημα της νιτρογλυκερίνης είναι ότι κατά την έκρηξή της δεν παράγεται καπνός (από την ίδια) σε αντίθεση, π.χ. με την πυρίτιδα και αυτό οφείλεται κυρίως στο θετικό ισοζύγιο οξυγόνου.
 |
 |
 |
 |
|
Τυπικές εφαρμογές της νιτρογλυκερίνη στη μορφή δυναμίτιδας. Εκρήξεις για τη διάνοιξη οδών (εκβραχισμοί), τοποθέτηση και εκρήξεις δυναμιτών σε ορυχεία και κατεδαφίσεις παλαιών κτηρίων. |
|||
Εφαρμογές της νιτρογλυκερίνης
 |
 |
 |
|
|
Αριστερά και κέντρο: Κατάσβεση πυρκαγιών πετρελαιοπηγών. Παλαιότερα πραγματοποιούσαν μια έκρηξη πάνω από την πηγή για να σβήσει η φωτιά πριν αντικατασταθεί η βαλβίδα. Σήμερα σπάνια πλέον χρησιμοποιείται η τεχνική αυτή και η αντικατάσταση της βαλβίδας γίνεται άμεσα [πηγή]. Δεξιά: Paul Neal (Red) Adair (1915-2004), ο οποίος υπήρξε ένας από τους διασημότερους διεθνώς σπεσιαλίστες στις κατασβέσεις πυρκαγιών πετρελαιοπηγών. |
|||
Κύρια εφαρμογή της νιτρογλυκερίνης είναι η παρασκευή δυναμίτιδας και παρεμφερών εκρηκτικών υλών, που χρησιμοποιούνται πλέον για ανατινάξεις βράχων (εκβραχισμοί), σε ορυχεία και λατομεία, για χωματουργικές εργασίες και κατεδαφίσεις. Η χρησιμοποίηση νιτρογλυκερίνης για στρατιωτική χρήση είναι πλέον περιορισμένη μετά την εισαγωγή πλέον εξελιγμένων και πολύ πιο εύχρηστων εκρηκτικών υλών.
Κατάσβεση πυρκαγιών πετρελαιοπηγών. Μια από τις σχετικά περιορισμένες εφαρμογές της υγρής νιτρογλυκερίνης υπήρξε η κατάσβεση πυρκαγιών σε πετρελαιοπηγές. Οι πυρκαγιές αυτές είναι από τις πιο δύσκολες και πιο δαπανηρές στην κατάσβεση πυρκαγιές και αναφέρονται ως "πυρκαγιές της κόλασης", hellfires. Τα ειδικευμένα συνεργεία τεχνικών που αναλαμβάνουν το έργο της κατάσβεσης, είναι γνωστά ως "μαχητές της κόλασης"(hellfighters)
Παλαιότερα, η κατάσβεση των πυρκαγιών αυτών βασιζόταν στην έκρηξη μεγάλης ποσότητας εκρηκτικής ύλης στο στόμιο της γεώτρησης. Η έκρηξη αυτή στερεί για σύντομο χρονικό διάστημα και τοπικά το οξυγόνο που σε συνδυασμό με το δημιουργούμενο ωστικό κύμα συμβάλλει αποτελεσματικά στο σβήσιμο της πυρκαγιάς. Πριν από την έκρηξη προηγείται απομάκρυνση κάθε κινητού πυρακτωμένου μεταλλικού αντικειμένου, που θα μπορούσε να προκαλέσει εκ νέου ανάφλεξη στο εκτινασσόμενο πετρέλαιο. Αμέσως μετά την έκρηξη, οι ειδικευμένοι τεχνικοί έσπευδαν να αντικαταστήσουν την κατεστραμμένη βαλβίδα (wellhead) της πετρελαιοπηγής, σε συνθήκες καταιονισμού από ακάθαρτο πετρέλαιο και νερό, που εκτοξεύεται για να αποφευχθεί κάποια νέα ανάφλεξη από τα πυρακτωμένα μέταλλα.
Σήμερα, σπάνια πλέον χρησιμοποιείται η τεχνική αυτή και η κατάσβεση πραγματοποιείται με άμεση αντικατάσταση της βαλβίδας αφού ληφθεί κάθε προφύλαξη για τους τεχνικούς από τις φλόγες με αδιάκοπους καταιονισμούς με νερό και ειδικούς πυροσβεστικούς αφρούς, όπως και με χρήση γερανών και άλλων βαριών μηχανημάτων. Ωστόσο, υγρή νιτρογλυκερίνη εξακολουθεί να χρησιμοποιείται ακόμη σε περιπτώσεις που απαιτείται η απόφραξη του φρέατος μιας πετρελαιοπηγής.
 |
 |
 |
 |
 |
|
|
Μια αριστουργηματική ταινία του 1953 με τίτλο "Το μεροκάματο του τρόμου" (The wages of fear) που βασιζόταν στην ομώνυμη νουβέλα του Georges Arnaud. Στην ταινία περιγράφεται ο αγώνας και η αγωνία των πληρωμάτων δύο φορτηγών να μεταφέρουν διασχίζοντας πανάθλιους δρόμους μέσα από τη ζούγκλα χώρας της Κεντρικής Αμερικής, φορτία υγρής νιτρογλυκερίνης, που προορίζονταν για την κατάσβεση πυρκαγιών σε πετρελαιοπηγές. Κατά την πορεία τους τα φορτηγά έπρεπε να κινούνται με αργή ταχύτητα και να απέχουν μεταξύ τους λίγα χιλιόμετρα, ώστε έκρηξη στο ένα από αυτά, να μην προκαλούσε έκρηξη και στο άλλο. |
||
|
Ο Nobel ως επιχειρηματίας και φιλάνθρωπος - Βραβεία Nobel [Αναφ. 4]
Ο Nobel εκτός από τον τεράστιο πλούτο που απέκτησε, ενδιαφερόταν σε μεγάλο βαθμό και για τα κοινωνικά θέματα, όπως και για θέματα που σχετίζονταν με την ειρήνη μεταξύ των λαών. Τα ενδιαφέροντά του αυτά ίσως αποτελούσαν αντίβαρο στο ότι γνώριζε πολύ καλά ότι η καταστροφική ικανότητα της νιτρογλυκερίνης δεν θα περιοριζόταν μόνο σε ειρηνικά κατασκευαστικά έργα, αλλά αναπόφευκτα θα γινόταν ευρύτατη χρήση της και για στρατιωτικούς σκοπούς. Για την εποχή του, είχε ριζοσπαστικές απόψεις και ξεκίνησε μια μεγάλη εκστρατεία προσφορών και διάθεσης χρημάτων για τους σκοπούς αυτούς. Το πιο ονομαστό και διεθνώς γνωστό φιλανθρωπικό του έργο είναι η καθιέρωση των βραβείων Nobel, τα οποία αποτελούν τη σημαντικότερη διάκριση για κάθε επιστήμονα και λογοτέχνη που επιτελεί αξιοσημείωτο έργο (βλ. κείμενο διαθήκης του Nobel). Τα βραβεία Nobel συνοδεύονται από ένα σημαντικό χρηματικό ποσό το οποίο διανέμεται σε εκείνους, οι οποίοι την προηγούμενη χρονιά συνεισέφεραν περισσότερο στην πρόοδο της επιστήμης και μέσω αυτής στην ανθρωπότητα. Αναφέρεται ότι ο Nobel αποφάσισε την καθιέρωση του θεσμού των βραβείων Nobel το 1888, όταν πληροφορήθηκε πως μια γαλλική εφημερίδα δημοσίευσε νεκρολογία κατά λάθος γι αυτόν (ενώ είχε πεθάνει ένας αδελφός του). Στη νεκρολογία αναφερόταν ότι "ο έμπορος του θανάτου είναι νεκρός" και ότι η εκρηκτική ύλη που είχε εφεύρει είχε στοιχίσει τη ζωή σε πολλούς ανθρώπους. Ο Nobel απογοητεύτηκε διαβάζοντας αυτόν το λίβελο εναντίον του και αποφάσισε να αφιερώσει το μεγαλύτερο τμήμα της περιουσίας του στην καθιέρωση των βραβείων Nobel, για να αφήσει πίσω του μια καλύτερη φήμη [Αναφ. 4γ]. Τα βραβεία Nobel απονέμονται για επιτεύγματα: στη Φυσική, τη Χημεία, τη Φυσιολογία ή Ιατρική και τη Λογοτεχνία. Βραβείο επίσης απονέμεται στο άτομο το οποίο κατάφερε σημαντικά να βελτιώσει και να συσφίξει τις σχέσεις μεταξύ των κρατών, δηλαδή το βραβείο Νόμπελ Ειρήνης. Από το 1969 το 'Ιδρυμα Nobel καθιέρωσε και ένα βραβείο για τις Οικονομικές Επιστήμες. Τα βραβεία Nobel απονέμονται ως εξής: (1) Βραβείο Nobel Χημείας, από τη Σουηδική Βασιλική Ακαδημία των Επιστημών. (2) Βραβείο Nobel Φυσικής, από τη Σουηδική Βασιλική Ακαδημία των Επιστημών. (3) Βραβείο Nobel Ιατρικής, από το Σουηδικό Ινστιτούτο Καρολίνσκα. (4) Βραβείο Nobel Λογοτεχνίας, άπό τη Σουηδική Ακαδημία. (5) Βραβείο Nobel Ειρήνης, από τη Νορβηγική Επιτροπή Nobel που ορίζεται από το Νορβηγικό κοινοβούλιο (το Storting). (6) Βραβείο Nobel Οικονομικών Επιστημών, από την Τράπεζα της Σουηδίας. Η απονομή των βραβείων Nobel ξεκίνησε από το 1901. |
|
William Murrell (1853-1912). Ο Βρετανός ιατρός που πρότεινε τη νιτρογλυκερίνη για την αντιμετώπιση της στηθάγχης |
Ιατρική χρήση της νιτρογλυκερίνης [Αναφ. 5]
'Οταν ο Sobrero συνέθεσε τη νιτρογλυκερίνη θέλησε να δοκιμάσει τη γεύση της βάζοντας στη γλώσσα του ένα μικρό κλάσμα σταγόνας της νέας ένωσης. Σχεδόν αμέσως ένοιωσε μια έντονη ταχυπαλμία, που την ακολούθησε πονοκέφαλος. Τα συμπτώματα αυτά οφείλονται στην έντονη αγγειοδιασταλτική δράση της νιτρογλυκερίνης. Οι εργάτες της βιομηχανίας εκρηκτικών του Nobel ήταν οι πρώτοι που αισθάνθηκαν τη θεραπευτική δράση του φαρμάκου. 'Οταν έφθαναν κάθε πρωί, εκείνοι που είχαν καρδιολογικά προβλήματα, ένοιωθαν να καταπραΰνονται οι πόνοι στο στήθος, αν και σχεδόν όλοι μετά από λίγη ώρα αισθάνονταν δυνατούς πονοκέφαλους.
Μετά την ανακάλυψη ότι το νιτρώδες αμύλιο (amyl nitrite, C5H11ONO) βοηθά στην ανακούφιση του πόνου στο στήθος, ο Βρετανός γιατρός William Murrell (1853-1912) δοκίμασε τη νιτρογλυκερίνη για την καταπράϋνση της στηθάγχης (angina pectoris), όπως για τη μείωση της αρτηριακής πίεσης. Η στηθάγχη οφείλεται στη μειωμένη παροχή αίματος και οξυγόνου στον καρδιακό μυ, κατάσταση που διορθώνεται σχεδόν αμέσως με χορήγηση νιτρωδών και νιτρικών εστέρων λόγω της έντονης αγγειοδιασταλτικής δράσης τους.
Ο Murrell άρχισε να χορηγεί μικρές δόσεις νιτρογλυκερίνης σε ασθενείς το 1878 και αυτή η μέθοδός του υιοθετήθηκε ευρέως από την ιατρική κοινότητα, μετά τη δημοσίευση των αποτελεσμάτων του στο ιατρικό περιοδικό "The Lancet" το 1879. Στην εργασία του "Nitro-glycerine as a Remedy for Angina Pectoris", μεταξύ άλλων περιγράφει τι ένοιωσε ο ίδιος όταν ακούμπησε στη γλώσσα του τον φελλό από ένα φιαλίδιο με αλκοολικό διάλυμα νιτρογλυκερίνης 1%: "Οι σφυγμοί μου αυξήθηκαν ταχύτατα και έγιναν τόσο δυνατοί, που κάθε παλμός της καρδιάς μου τάραζε ολόκληρο το σώμα μου... Η πένα που κρατούσα τιναζόταν βίαια με κάθε μου παλμό".
Επειδή ο κόσμος γνώριζε ότι η νιτρογλυκερίνη είναι μια επικίνδυνη εκρηκτική ουσία, κάτι που ίσως θα έκανε κάποιους ασθενείς διστακτικούς στη χρήση αυτής της ουσίας, οι γιατροί για να την περιγράψουν ως φάρμακο χρησιμοποιούσαν ονόματα όπως "τρινιτρική γλυκερόλη" ή "τρινιτρίνη". Σήμερα, η νιτρογλυκερίνη χρησιμοποιείται ευρύτατα από τους πάσχοντες από διάφορα είδη καρδιακής ανεπάρκειας, οι οποίοι στην καθημερινή τους ζωή έχουν πάντοτε μαζί τους υπογλώσσια δισκία για την άμεση αντιμετώπιση κάποιας ξαφνικής αδιαθεσίας.
Οι ποσότητες νιτρογλυκερίνης σε κάθε δόση του φαρμάκου δεν ξεπερνούν το 1 mg. Η νιτρογλυκερίνη είναι αραιωμένη σε κατάλληλο διαλύτη ή με διάφορα έκδοχα και φυσικά δεν υπάρχει ο παραμικρός κίνδυνος έκρηξης. Η νιτρογλυκερίνη χορηγείται υπό τη μορφή υπογλώσσιων δισκίων (sublingual tablets με 0,3-0,6 mg/δισκίο), σπρέι, ενέσιμου διαλύματος και εμπλάστρων (patches) που επιτρέπουν τη βαθμιαία διαδερμική χορήγησή της με ελεγχόμενο ρυθμό (0,1-0,8 mg/h).
Μετά από 130 χρόνια ευρύτατης χρήσης της νιτρογλυκερίνης, μόλις το 2002 διαπιστώθηκε ότι η δράση αυτή της νιτρογλυκερίνης, οφείλεται στην ταχύτατη μετατροπή της σε μονοξείδιο του αζώτου (ΝΟ) από τη μιτοχονδριακή αλδεϋδική αφυδρογονάση. Το ΝΟ είναι μια φυσική αγγειοδιασταλτική ουσία. Παρενέργειες της νιτρογλυκερίνης είναι πονοκέφαλοι, αυξημένες εντερικές κινήσεις, μείωση της γενετήσιας ορμής και επώδυνη διούρηση.
Η νιτρογλυκερίνη έχει θεωρηθεί ως συμπληρωματικό φάρμακο για τη θεραπεία του καρκίνου του προστάτη και κλινικές μελέτες έδειξαν ότι αυξημένα επίπεδα NO κατά πάσα πιθανότητα καταστέλλουν την αντοχή των καρκινικών κυττάρων του προστάτη έναντι της φυσιολογικής ανοσολογικής άμυνας του οργανισμού.
 |
 |
 |
 |
 |
|
Διάφορα εμπορικώς διαθέσιμα φαρμακευτικά σκευάσματα νιτρογλυκερίνης (υπογλώσσια δισκία, σπρέι, ενέσιμα, έμπλαστρα). |
||||
Βιβλιογραφία - Πηγές από το Διαδίκτυο
1. (α) Wikipedia: "Nitroglycerin". (β) International Program for Chemical Safety (ICHEM): "Nitroglycerin". (γ) United States Department of Labor: Occupational Safety and Health Guideline for Nitroglycerin. (δ) Bristol University, Dept. of Chemistry, Cotton S: "Molecule of the month: Nitroglycerin".
2. (α) Lemmel B: "Alfred Nobel's Industrial Activities in Vinterviken" (NobelPrize.org). (β) Lemmel B: "Alfred Nobel in Krümmel" (NobelPrize.org). (γ) Technology in Australia 1788-1988: "Explosives", Australian Academy of Technological Sciences and Engineering, 2000. (δ) Clements J: "Ardeer Factory: The Factory near Stevenston". (ε) J. Graves GJ: "Nitroglycerine!", Central Pacific Railroad Photographic History Museum. (στ) Transcontinental Railroad Home (Linda Hall Library): "The Use of Black Powder and Nitroglycerine on the Transcontinental Railroad".
3. On Line Encyclopedia: "C3H NITROGLYCERIN".
4. (α) Wikipedia "Nobel
Prize". (β)
NobelPrize.org: "Alfred Nobel's Will".
(γ) National
Science, Technology,
Engineering and Math (STEM) Center: "Birthday
of Alfred Nobel (21st October 1833)".
5. (α) Medpedia "Nitroglycerin". (β) Smith E, Hart D: "William Murrell,
Physician and Practical Therapist", British Medical Journal 3:632-633, 1971
(αρχείο
PDF, 469 KB). (γ) Bruce Fye W: "Profiles in Cardiology: William Murrell",
Clin. Cardiol. 18:426-427, 1995 (αρχείο
PDF, 235 KB). (δ) Bauer JA, Fung H-L: "Arterial
Versus Venous Metabolism of Nitroglycerin to Nitric Oxide: A Possible
Explanation of Organic Nitrate Venoselectivity", Journal of Cardiovascular
Pharmacology 28(3):371-374, 1996. (ε) Hagan P:
"How
dynamite could help destroy prostate cancer", Daily Mail, February 22, 2010.
(στ) EmaxHealth.com, Mitchell D: "Could
Nitroglycerin Stop Prostate Cancer?", February 2010.

 Μια
τυχαία ανακάλυψη
Μια
τυχαία ανακάλυψη


 ΠΡΟΣΟΧΗ ! !
Να σημειωθεί ότι σχεδόν στο
σύνολό τους οι αντιδράσεις ολοκληρωτικής ή σχεδόν ολοκληρωτικής οξείδωσης οργανικών ενώσεων με πυκνό νιτρικό
οξύ χαρακτηρίζονται από ένα σχετικά μεγάλο χρόνο εκκόλαψης και συχνά
επιφυλάσσουν άσχημες εκπλήξεις. Αρχικά
φαίνεται ότι δεν πραγματοποιείται καμία αντίδραση, γεγονός που μπορεί
"ξεγελάσει" τον άπειρο χειριστή, ο οποίος μπορεί να κάνει το σφάλμα να
προσθέσει επιπλέον οργανική ουσία ή να προσπαθήσει να θερμάνει ελαφρά το
αντιδρών μίγμα. Ωστόσο,
μόλις η αντίδραση αρχίσει, εκλύεται θερμότητα που ανυψώνει τη
θερμοκρασία του αντιδρώντος μίγματος, γεγονός που επιταχύνει ακόμη
περισσότερο την αντίδραση. 'Ετσι, αν δεν ληφθούν μέτρα ψύξης του
αντιδρώντος μίγματος, η ταχύτητα της αντίδρασης θα αυξηθεί εκθετικά, θα
είναι μάταιη πλέον κάθε απόπειρα ψύξης, θα
αρχίσει να εκλύεται άφθονο ΝΟ2
(πορτοκαλόχρωμο, τοξικό αέριο) και είναι πιθανότατο το ενδεχόμενο έκρηξης.
ΠΡΟΣΟΧΗ ! !
Να σημειωθεί ότι σχεδόν στο
σύνολό τους οι αντιδράσεις ολοκληρωτικής ή σχεδόν ολοκληρωτικής οξείδωσης οργανικών ενώσεων με πυκνό νιτρικό
οξύ χαρακτηρίζονται από ένα σχετικά μεγάλο χρόνο εκκόλαψης και συχνά
επιφυλάσσουν άσχημες εκπλήξεις. Αρχικά
φαίνεται ότι δεν πραγματοποιείται καμία αντίδραση, γεγονός που μπορεί
"ξεγελάσει" τον άπειρο χειριστή, ο οποίος μπορεί να κάνει το σφάλμα να
προσθέσει επιπλέον οργανική ουσία ή να προσπαθήσει να θερμάνει ελαφρά το
αντιδρών μίγμα. Ωστόσο,
μόλις η αντίδραση αρχίσει, εκλύεται θερμότητα που ανυψώνει τη
θερμοκρασία του αντιδρώντος μίγματος, γεγονός που επιταχύνει ακόμη
περισσότερο την αντίδραση. 'Ετσι, αν δεν ληφθούν μέτρα ψύξης του
αντιδρώντος μίγματος, η ταχύτητα της αντίδρασης θα αυξηθεί εκθετικά, θα
είναι μάταιη πλέον κάθε απόπειρα ψύξης, θα
αρχίσει να εκλύεται άφθονο ΝΟ2
(πορτοκαλόχρωμο, τοξικό αέριο) και είναι πιθανότατο το ενδεχόμενο έκρηξης.
 O
Alfred Nobel εστίασε το επιστημονικό και επιχειρηματικό του ενδιαφέρον
κυρίως στην ανάπτυξη της τεχνολογίας των εκρηκτικών. Ωστόσο, ασχολήθηκε
και με
άλλα θέματα χημικής τεχνολογίας και έκανε διάφορες εφευρέσεις πάνω στην
παρασκευή συνθετικής γόμας, στις ειδικές κατεργασίες δερμάτων, όπως και στην παρασκευή τεχνητής μετάξης. Μέχρι το 1896
που πέθανε είχε καταθέσει 355 πατέντες ευρεσιτεχνιών. Η υπεροχή του Alfred Nobel ως πρακτικού επιστήμονα στηρίχθηκε στην
ιδιαίτερη ικανότητά του να
συνδυάζει τις επιστημονικές γνώσεις με την άμεση πρακτική
εφαρμογή και την εκμετάλλευση για εμπορικούς σκοπούς.
O
Alfred Nobel εστίασε το επιστημονικό και επιχειρηματικό του ενδιαφέρον
κυρίως στην ανάπτυξη της τεχνολογίας των εκρηκτικών. Ωστόσο, ασχολήθηκε
και με
άλλα θέματα χημικής τεχνολογίας και έκανε διάφορες εφευρέσεις πάνω στην
παρασκευή συνθετικής γόμας, στις ειδικές κατεργασίες δερμάτων, όπως και στην παρασκευή τεχνητής μετάξης. Μέχρι το 1896
που πέθανε είχε καταθέσει 355 πατέντες ευρεσιτεχνιών. Η υπεροχή του Alfred Nobel ως πρακτικού επιστήμονα στηρίχθηκε στην
ιδιαίτερη ικανότητά του να
συνδυάζει τις επιστημονικές γνώσεις με την άμεση πρακτική
εφαρμογή και την εκμετάλλευση για εμπορικούς σκοπούς.