|
Το υδροκυάνιο, ένα από τα πλέον κεραυνοβόλα δηλητήρια, φαίνεται πως διεδραμάτισε πρωταγωνιστικό ρόλο στη δημιουργία ζωής στη Γη. |
Εισαγωγικά
 Το υδροκυάνιο, όπως και τα κυανιούχα
άλατα ή κυανίδια (cyanides), είναι από τις γνωστότερες
στο ευρύτερο κοινό δηλητηριώδεις ουσίες. Υπήρξαν στην ιστορία γνωστές
φρικτές περιπτώσεις χρήσης τους για εκτελέσεις, δολοφονίες, μαζικές θανατώσεις
και αυτοκτονίες. Χαρακτηρίζονται ως σφοδρά και
κεραυνοβόλα δηλητήρια ακόμη και σε ποσότητες λίγων mg,
δηλαδή ως τοξικές ουσίες άμεσης δράσης, οι οποίες δεν αφήνουν χρονικά
περιθώρια ιατρικής βοήθειας και χορήγησης αντιδότων.
Το υδροκυάνιο, όπως και τα κυανιούχα
άλατα ή κυανίδια (cyanides), είναι από τις γνωστότερες
στο ευρύτερο κοινό δηλητηριώδεις ουσίες. Υπήρξαν στην ιστορία γνωστές
φρικτές περιπτώσεις χρήσης τους για εκτελέσεις, δολοφονίες, μαζικές θανατώσεις
και αυτοκτονίες. Χαρακτηρίζονται ως σφοδρά και
κεραυνοβόλα δηλητήρια ακόμη και σε ποσότητες λίγων mg,
δηλαδή ως τοξικές ουσίες άμεσης δράσης, οι οποίες δεν αφήνουν χρονικά
περιθώρια ιατρικής βοήθειας και χορήγησης αντιδότων.
Παρά τη μεγάλη τοξικότητα και επικινδυνότητάς τους το υδροκυάνιο και τα κυανιούχα άλατα παρασκευάζονται παγκοσμίως σε ποσότητες εκατομμυρίων τόνων ετησίως, αφού είναι πολύτιμες και αναντικατάστατες χημικές ουσίες, οι οποίες χρησιμοποιούνται ως πρώτες ύλες για την παρασκευή πλήθους άλλων χημικών προϊόντων, όπως πολυμερών υλικών ευρύτατης χρήσης και φαρμακευτικών προϊόντων.
 Από χημική άποψη το υδροκυάνιο είναι μια
απλούστατη χημική ένωση με τριατομικό μόριο (HCN), η
οποία από άποψη κατάταξης είναι οργανική ένωση και μπορεί να θεωρηθεί ως το
απλούστερο νιτρίλιο (methanonitrile), ωστόσο βρίσκεται στο μεταίχμιο μεταξύ
οργανικών και ανόργανων ενώσεων. Υδατικά διαλύματα υδροκυανίου διαθέτουν
ιδιότητες ασθενέστατου οξέος, ενώ υδατικά διαλύματα των κυανιούχων αλάτων,
λόγω της εντονότατης υδρόλυσης δρουν σχεδόν ως ασθενείς βάσεις (όσο περίπου
η ΝΗ3).
Από χημική άποψη το υδροκυάνιο είναι μια
απλούστατη χημική ένωση με τριατομικό μόριο (HCN), η
οποία από άποψη κατάταξης είναι οργανική ένωση και μπορεί να θεωρηθεί ως το
απλούστερο νιτρίλιο (methanonitrile), ωστόσο βρίσκεται στο μεταίχμιο μεταξύ
οργανικών και ανόργανων ενώσεων. Υδατικά διαλύματα υδροκυανίου διαθέτουν
ιδιότητες ασθενέστατου οξέος, ενώ υδατικά διαλύματα των κυανιούχων αλάτων,
λόγω της εντονότατης υδρόλυσης δρουν σχεδόν ως ασθενείς βάσεις (όσο περίπου
η ΝΗ3).
Τα κυανιούχα ιόντα παρέχουν εξαιρετικώς σταθερά σύμπλοκα με πολλά μεταλλοϊόντα. Η ιδιότητα αυτή καθιστά τα κυανιούχα άλατα ιδιαιτέρως πολύτιμα σε ηλεκτρολυτικές επιμεταλλώσεις, αλλά και χρήσιμα για την παραλαβή του χρυσού και αργύρου από μεταλλεύματά τους.
Το υδροκυάνιο και τα κυανιούχα ιόντα έχουν έντονη παρουσία στη φύση. Στο φυτικό βασίλειο το υδροκυάνιο αποτελεί προϊόν υδρόλυσης μιας κατηγορίας γλυκοζιτών και συναντάται σε χυμούς φρούτων και διάφορων καρπών, κατά κανόνα σε ακίνδυνες μικροποσότητες. Επιπλέον, ίχνη του εκλύονται από διάφορες βακτηριακές ζυμώσεις, ενώ στο ζωικό βασίλειο βρίσκεται σε ορισμένα αρθρόποδα, όπως και σε ορισμένα λεπιδόπτερα του δάσους, τα οποία χρησιμοποιούν το υδροκυάνιο ως αμυντικό μέσο. Επιπλέον, μικρές συγκεντρώσεις υδροκυανίου έχουν βρεθεί σε αέρια ηφαιστειακών εκρήξεων.
Το υδροκυάνιο είναι ένα από τα μόρια που συνέθεταν στην αρχέγονη ατμόσφαιρα της Γης και εικάζεται πως συνέβαλε στον σχηματισμό της ζωής, ενώ έχει ανιχνευθεί η παρουσία του σε πολλές περιοχές του διαστρικού χώρου, όπως και στην επιφάνεια δορυφόρων πλανητών του ηλιακού συστήματος.
Υδροκυάνιο παράγεται, σε μικρές ποσότητες κατά την καύση οργανικής ύλης, έχει βρεθεί στον καπνό του τσιγάρου, ωστόσο συχνά εκλύεται σε επικίνδυνες ποσότητες σε πυρκαγιές κατά την ατελή καύση ορισμένων πλαστικών υλικών που περιέχουν άζωτο, όπως είναι οι πολυουρεθάνες και τα πολυακρυλονιτρίλια.
Ιστορία του υδροκυανίου και των ενώσεών του [Αναφ. 1, 2]
 |
 |
 |
 |
|
(1718-1784) |
(1742-1786) |
(1748-1822) |
(1778-1850) |
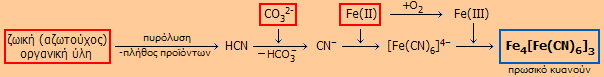
Η ιστορία του υδροκυανίου και των κυανιούχων αλάτων συνδέεται άμεσα με μια χρωστική ουσία, γνωστή από το 1704 με το όνομα κυανό της Πρωσίας (prussian blue) ή κυανό του Βερολίνου (Berlin bue). Η χρωστική αυτή έχει ένα βαθυκύανο χρώμα και ανακαλύφθηκε τυχαία στις αρχές του 18ου αιώνα. Υπήρξε μεγάλη εμπορική επιτυχία της εποχής και ο τρόπος παρασκευής της αποτελούσε ένα πολύτιμο εμπορικό μυστικό. Η ακριβής χημική δομή του κυανού της Πρωσίας χρειάστηκε σχεδόν δύο αιώνες για να διευκρινισθεί.
Το 1752, ο Γάλλος χημικός Pierre-Joseph Macquer (1718-1784) διαπίστωσε ότι με θέρμανση του κυανού της Πρωσίας με αραιό θειικό οξύ μετατρεπόταν σε οξείδια και άλατα σιδήρου και σε μια άγνωστη μέχρι τότε πτητική ουσία με ιδιότητες ασθενούς οξέος και χαρακτηριστική οσμή πικραμυγδάλου. Η ουσία αυτή αργότερα ονομάσθηκε πρωσικό οξύ (prussic acid).
Το 1783, ο διάσημος χημικός και φαρμακοποιός Carl Wilhelm Scheele (1742-1786), με την καθοδήγηση του Macquer, παρασκεύασε υδροκυάνιο από το κυανό της Πρωσίας σε καθαρή μορφή και του έδωσε το όνομα κυανό οξύ (στα γερμανικά: blausäure) από την πρώτη ύλη που χρησιμοποίησε. Από τότε συνδέθηκε η ελληνική λέξη "κυανός" με τις τοξικότατες χημικές ενώσεις, τα "κυανιούχα άλατα" και το "υδροκυάνιο". Να σημειωθεί ότι ο Scheele είχε παρασκευάσει πλήθος χημικών ενώσεων μεταξύ των οποίων και πολλά άλατα βαρέων μετάλλων και θεωρούσε επιστημονικό καθήκον του να καταγράφει με ακρίβεια την οσμή και τη γεύση κάθε χημικής ένωσης που παρασκεύαζε. Η συνήθειά του αυτή είχε ως σωρευτικό αποτέλεσμα την καταστροφή των νεφρών του, που τελικά τον οδήγησε σε πρόωρο θάνατο. Πάντως, φαίνεται πως με κάποιο τρόπο είχε αναγνωρίσει την ιδιαίτερη τοξικότητα του υδροκυανίου και πρέπει να ήταν ιδιαίτερα προσεκτικός κατά τα πειράματά του με τις κυανιούχες ενώσεις.
Το 1787, ο Γάλλος χημικός Claude Louis Berthollet (1748-1822) έδειξε ότι το υδροκυάνιο δεν περιέχει οξυγόνο. Το γεγονός αυτό επέφερε το πρώτο ρήγμα στη μέχρι τότε επικρατούσα θεωρία του Lavoisier, σύμφωνα με την οποία κάθε οξύ θα έπρεπε να περιέχει οξυγόνο. Τέλος, το 1815, ο φυσικός και χημικός Joseph Louis Gay-Lussac (1778-1850) προσδιόρισε τον χημικό τύπο του υδροκυανίου ως HCN. Από τότε καθιερώθηκε η ελληνικής ρίζας ονομασία υδροκυάνιο (hydrogen cyanide) και κυανιούχα ή κυανίδια (cyanides) για τα άλατά του.
|
Το κυανό της Πρωσίας που έδωσε το όνομά του στο υδροκυάνιο και τα κυανιούχα άλατα [Αναφ. 3] Το κυανό της Πρωσίας (Prussian blue), γνωστό και ως κυανό του Βερολίνου (Berlin blue), ανακαλύφθηκε τυχαία στο εργαστήριο του αλχημιστή Johann Conrad Dippel (1673-1734), που βρισκόταν στο Βερολίνο, πρωτεύουσα του τότε βασιλείου της Πρωσίας. Κατά το 1706, ο Ελβετός χρωματοποιός Johann Jacob Diesbach εργαζόταν στο εργαστήριο του Dippel και προσπαθούσε να παρασκευάσει το πολύτιμο ερυθρό χρώμα καρμίνιο από αποξηραμένα και κονιοποιημένα έντομα που ζουν παρασιτικά σε ένα είδος κάκτων, τις κοχινεάλες (cochineal).
Σε κάποιο στάδιο της διαδικασίας ο Diesbach έπρεπε να αναμίξει το παρασκεύασμά του με θειικό σίδηρο(ΙΙ), στυπτηρία Κ-Al και ποτάσα (ανθρακικό κάλιο). Ωστόσο, χρησιμοποίησε μια ακάθαρτη ποτάσα, η οποία είχε αναμιχθεί με ζωικό έλαιο (animal oil), ένα σκουρόχρωμο, πηχτό και δυσώδες παρασκεύασμα του Dippel πλούσιο σε αζωτούχες ενώσεις, το οποίο ελάμβανε με καταστροφική απόσταξη αίματος και οστών. Ο Diesbach διαπίστωσε τον βραδύ σχηματισμό ενός βαθυκύανου ιζήματος, το οποίο μπορούσε να χρησιμοποιηθεί ως χρωστική στη ζωγραφική, στην τυπογραφία και κυρίως για τη βαφή υφασμάτων. Προφανώς, το μίγμα ποτάσας και ζωικού ελαίου του Dippel περιείχε και κυανιούχα άλατα, τα οποία σε συνδυασμό με τα ιόντα του σιδήρου(ΙΙ) σχημάτισε σιδηροκυανιούχα ιόντα (ή εξακυανοσιδηρικά(ΙΙ) ιόντα). Τα τελευταία αντέδρασαν με τον Fe(III), ο οποίος σταδιακά σχηματιζόταν με οξείδωση του Fe(II) και έδωσαν τελικά κυανό της Πρωσίας. Επομένως, το τελευταίο μπορεί να θεωρηθεί ως μικτό κυανιούχο σύμπλοκο δισθενούς και τρισθενούς σιδήρου. Ο σχηματισμός του κυανού της Πρωσίας μπορεί να αποδοθεί στην ακόλουθη σειρά αντιδράσεων:
Το κυανό της Πρωσίας υπήρξε μεγάλη εμπορική επιτυχία και οι παραγωγοί του έκαναν μεγάλες περιουσίες. Διέθετε πολύ καλύτερες ιδιότητες (π.χ. σταθερότερο, φθηνότερο) σε σχέση με τις άλλες κυανές βαφές που χρησιμοποιούσαν εκείνη την εποχή, όπως π.χ. εκείνες που βασίζονταν στα άλατα χαλκού ή στα εισαγόμενα από την Ασία πανάκριβα χρώματα λουλάκι (ultramarine) και ινδικό (indigo), βαφές ορυκτής και φυτικής προέλευσης, αντιστοίχως. Είναι ένα σταθερό χρώμα, το οποίο μόνο ισχυρώς αλκαλικά διαλύματα μπορούν να το καταστρέψουν και επιπλέον δεν είναι καθόλου τοξικό παρά το ότι περιέχει ιόντα κυανίου, τα οποία όμως είναι ισχυρότατα δεσμευμένα από τον σίδηρο(ΙΙ). Ακόμη και σήμερα παράγονται ετησίως περίπου 12 χιλιάδες τόνοι κυανού της Πρωσίας, που βρίσκει μεγάλη ποικιλία χρήσεων, όπως στη βαφή υφασμάτων, λαδομπογιές, έγχρωμα κραγιόνια, τυπογραφικά μελάνια, κυανοτυπίες (blueprints) τεχνικών σχεδίων, ακόμη και ως "λουλάκι" στην πλύση λευκών υφασμάτων (laundry bluing), κ.α.
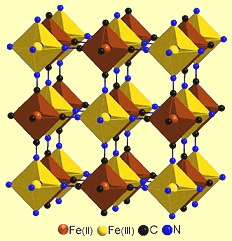
Χημική δομή του κυανού της Πρωσίας. Από τις πλέον κλασικές αντιδράσεις ανίχνευσης ιόντων Fe(II) και Fe(III) είναι ο σχηματισμός κυανού ιζήματος κατά την αντίδραση με σιδηρικυανιούχα ιόντα (ή κυανοσιδηρικά(ΙΙΙ) ιόντα) τα πρώτα και με σιδηροκυανιούχα ιόντα (ή κυανοσιδηρικά(ΙΙ) ιόντα) τα δεύτερα. Και στις δύο περιπτώσεις λαμβάνεται ακριβώς η ίδια ένωση.
Η αντίδραση των ιόντων του Fe(III) με σιδηροκυανιούχα ιόντα οδηγεί απευθείας σε κυανό της Πρωσίας:
4Fe3+
+ 3[Fe(CN)6]4-
Η αντίδραση των ιόντων του Fe(II) με σιδηρικυανιούχα ιόντα παλαιότερα αποδιδόταν με την αντίστοιχη αντίδραση:
3Fe2+
+ 2[Fe(CN)6]3-
Στο προϊόν, αν και έμοιαζε στο χρώμα με το κυανό της Πρωσίας, του απέδιδαν διαφορετική σύνθεση (Fe5(CN)12 σε αντίθεση με τη σύνθεση Fe7(CN)18 του πρωσικού κυανού) και επιπλέον του είχε δοθεί διαφορετικό όνομα: Κυανό του Turnbull. Ωστόσο, νεότερες έρευνες έδειξαν ότι και η δεύτερη αντίδραση οδηγεί σε κυανό της Πρωσίας. Αυτό οφείλεται στο ότι η αντίδραση πραγματοποιείται ουσιαστικώς σε δύο στάδια. Κατά το πρώτο πραγματοποιείται η οξειδοαναγωγική:
Fe2+
+ [Fe(CN)6]3-
και ακολουθεί η αντίδραση μεταξύ των προϊόντων του οξειδοαναγωγικού σταδίου. Η συνολική αντίδραση μπορεί να αποδοθεί ως εξής:
4Fe2+
+ 4Fe(CN)63-
Επομένως το κυανό του Turnbull ταυτίζεται με το κυανό της Πρωσίας, όπου η αναλογία Fe(III):Fe(II) είναι ίση προς 4:3 (Fe(III)4[Fe(II)(CN)6]3). Η ταύτιση των προϊόντων των δύο διαφορετικών αντιδράσεων επαληθεύτηκε με μελέτη των κρυσταλλικών ιζημάτων με ακτίνες Χ. Το μικτοσθενές αυτό άλας συχνά αναφέρεται ως σιδηροσιδηρικυανίδιο (ferroferricyanide). Το κυανό της Πρωσίας είναι ένυδρο άλας με γενικό χημικό τύπο Fe7(CN)18 · xH2O (x = 14 - 16), αναφέρεται ως αδιάλυτο κυανό της Πρωσίας (insoluble prussian blue) και λαμβάνεται όταν χρησιμοποιείται περίσσεια αλάτων σιδήρου. Εάν οι παραπάνω αντιδράσεις πραγματοποιηθούν με περίσσεια των σιδηρο- ή σιδηρι-κυανιούχων αλάτων, λαμβάνεται μια κολλοειδής μορφή κυανού της Πρωσίας που περιέχει κάλιο, το οποίο αναφέρεται, αν και αδιάλυτη ουσία, ως διαλυτό κυανό της Πρωσίας (soluble prussian blue). Οι σχετικές αντιδράσεις μπορούν να αποδοθούν ως εξής:
Fe2+
+ Κ+ + [Fe(CN)6]3+
Και στις δύο περιπτώσεις λαμβάνεται το ίδιο προϊόν, όπου ο δισθενής σίδηρος βρίσκεται υπό τη μορφή κυανοσυμπλόκου, ενώ ο τρισθενής αποτελεί το αντισταθμιστικό κατιόν. Το χρώμα του κολλοειδούς κυανού της Πρωσίας είναι κάπως ανοικτότερο σε σχέση με εκείνο του αδιάλυτου κυανού της Πρωσίας. Να σημειωθεί πάντως ότι οι παραπάνω αποδιδόμενοι χημικοί τύποι στο αδιάλυτο και στο διαλυτό κυανό της Πρωσίας είναι σε κάποιο βαθμό εξιδανικευμένοι και γενικά οι ουσίες αυτές θεωρούνται ως μη στοιχειομετρικές χημικές ενώσεις, στην ουσία δηλ. είναι μίγματα ενώσεων παραπλήσιας σύστασης. Γιατί είναι τόσο έντονο το χρώμα του κυανού της Πρωσίας. Η στενή γειτνίαση μοριακών τροχιακών των διαφορετικών μοριακών τροχιακών του Fe(II) και Fe(III) στο κρυσταλλικό πλέγμα της ένωσης, αυξάνει σημαντικά την πιθανότητα μεταφοράς ηλεκτρονίων μεταξύ τους με αποτέλεσμα, όταν προσπίπτει φως στους κρυστάλλους της ένωσης να απορροφούνται εύκολα φωτόνια πορτοκαλόχρωμης ακτινοβολίας και να γίνεται μεταπήδηση ηλεκτρονίου από τον Fe(II) στον Fe(III), με αποτέλεσμα τον έντονο χρωματισμό των κρυστάλλων με το συμπληρωματικό χρώμα. Ο έντονος χρωματισμός είναι κοινό χαρακτηριστικό όλων των χημικών ενώσεων, όπου πληρούνται οι προϋποθέσεις μεταφοράς φορτίου (charge transfer).
Το κυανό της Πρωσίας ως αντίδοτο δηλητηριάσεων. Από τη δεκαετία του 1960 είχε διαπιστωθεί μια αξιοσημείωτη ικανότητα δέσμευσης μονοσθενών κατιόντων από το αδιάλυτο κυανό της Πρωσίας. Η ιδιότητα αυτή καθιστούσε την ένωση εξαιρετικό αντίδοτο δηλητηριάσεων από άλατα του τοξικότατου θαλλίου(Ι), όπως επίσης κατάλληλο για την ταχύτερη απομάκρυνση από τον οργανισμό των ραδιενεργών ισοτόπων καισίου-134 και καισίου-137 σε περιπτώσεις πυρηνικών ατυχημάτων. Η δράση αυτή οφείλεται στην προσρόφηση, στη μηχανική παγίδευση στο κρυσταλλικό πλέγμα του κυανού της Πρωσίας και σε αντιδράσεις ιοντοανταλλαγής, όπως η επόμενη:
3Μ+
+
Fe4[Fe(CN)6]3
Η δέσμευση του θαλλίου και των ραδιενεργών ισοτόπων του καισίου, μειώνει σημαντικά (περίπου στο 1/3) τον βιολογικό χρόνο υποδιπλασιασμού τους στον οργανισμό του ανθρώπου, αφού η δέσμευση αυτή παρεμποδίζει την εντεροηπατική κυκλοφορία και διευκολύνει την αποβολή τους μέσω της εντερικής οδού. Το "αδιάλυτο" κυανό της Πρωσίας χορηγείται σε κάψουλες των 500 mg και έχει αποδειχθεί ότι ο ανθρώπινος οργανισμός μπορεί να δεχθεί μέχρι και 10 g κυανού της Πρωσίας την ημέρα χωρίς κάποια τοξικά αποτελέσματα. |
|||||||||||||
Δομή και γενικές χημικές ιδιότητες του υδροκυανίου και των κυανιούχων αλάτων [Αναφ. 4]
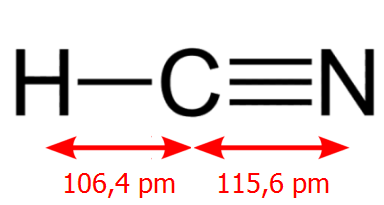
Το μόριο του υδροκυανίου (hydrogen cyanide) είναι ευθύγραμμο με τον άνθρακα στο κέντρο. Οι αποστάσεις H-C και C-N είναι 106,4 pm και 115,6 pm, αντιστοίχως. Το 1971, διαπιστώθηκε η ύπαρξη στον διαστρικό χώρο μιας ταυτομερούς και ενεργειακώς πλουσιότερης και συνεπώς ασταθέστερης μορφής του υδροκυανίου, του υδροϊσοκυανίου (hydrogen isocyanide). Στο υδροϊσοκυάνιο το άζωτο βρίσκεται στη μέση. Ο λόγος [ΗΝC]/[HCN] εξαρτάται σημαντικά από τη θερμοκρασία και στις συνήθεις θερμοκρασίες είναι πρακτικά μηδενικός, ενώ φαίνεται πως αφθονεί στο περιβάλλον του διαστρικού χώρου, όπου τροφοδοτείται ενεργειακά από της συγκρούσεις με μόρια υδρογόνου και συμμετέχει σε αντιδράσεις με προϊόντα μόρια βιολογικού ενδιαφέροντος.
Το υδροκυάνιο είναι ένα τοξικότατο, εξαιρετικά πτητικό υγρό (σ.ζ.=25,6ºC) με ελαφρά κυανό χρώμα αισθητό για σχετικώς μεγάλη διαδρομή του φωτός μέσω του υγρού. Σε καθαρή μορφή το HCN είναι σταθερή ένωση, αλλά πολυμερίζεται εύκολα παρουσία αλκαλικών ακαθαρσιών (π.χ. NH3, NaCN). Χαρακτηριστική και όχι δυσάρεστη είναι η οσμή πικραμυγδάλων, αντιληπτή συχνά και σε συγκέντρωση 1 mg HCN/m3 στον αέρα. Ωστόσο, ορισμένα άτομα έχουν πολύ μειωμένη ευαισθησία στην οσμή του για γενετικούς λόγους.
Το υδροκυάνιο χαρακτηρίζεται από μεγάλη διπολική ροπή ίση προς 2,98 Debye (διπολική ροπή ύδατος: 1,84 Debye), γεγονός που θα το καθιστούσε εξαιρετικό διαλύτη ετεροπολικών ενώσεων, αν δεν είχε τόσο χαμηλό σημείο ζέσεως και φυσικά δεν ήταν τόσο τοξική ουσία. Το ότι το υδροκυάνιο είναι υγρό και όχι αέριο στη θερμοκρασία δωματίου, οφείλεται στους δεσμούς υδρογόνου που υφίστανται μεταξύ των μορίων του.
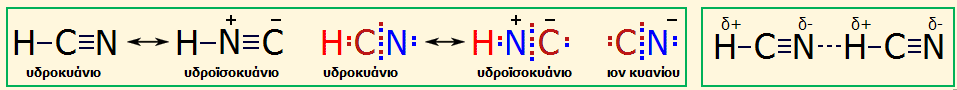
|
Αριστερά: Ταυτομερείς μορφές υδροκυανίου/υδροϊσοκυανίου και οι κατά Lewis τύποι τους, όπως και του ιόντος κυανίου (τα χρώματα στα ηλεκτρόνια των κατά Lewis τύπων βοηθούν μόνο στην παρακολούθηση των ηλεκτρονίων που προσφέρει ή δέχεται το κάθε άτομο του μορίου. Βέβαια, τα ηλεκτρόνια εναλλάσσονται μεταξύ τους και δεν διακρίνονται πλέον σε ηλεκτρόνια του ενός ή του άλλου ατόμου. Δεξιά: Οι δεσμοί υδρογόνου στο υγρό υδροκυάνιο ανεβάζουν το σημείο ζέσεώς του σε θερμοκρασία δωματίου (25,6ºC). |
|
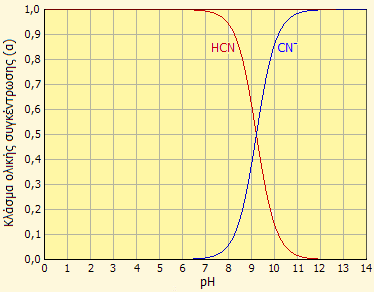
Διάγραμμα κατανομής των σωματιδίων σε υδατικό διάλυμα υδροκυανίου. |
Υδροκυανικό οξύ. Το υδροκυάνιο σε υδατικό διάλυμα δρα ως ασθενέστατο οξύ (υδροκυανικό οξυ) με pK=9,21, τιμή από την οποία φαίνεται πως είναι ασθενέστερο από το ανθρακικό οξύ (pK1 -φαινομενικό-= 6,4, βλ. Χημική ένωση του μήνα: Διοξείδιο του άνθρακα) σχεδόν κατά τρεις τάξεις μεγέθους. Παραπλεύρως, δείχνεται διάγραμμα κατανομής των σωματιδίων HCN και CN-, το οποίο δείχνει ότι σε υδατικά διαλύματα με pH μικρότερο από 7, το υδροκυάνιο βρίσκεται πρακτικώς στο σύνολό του στην αδιάστατη μορφή. Προφανώς, τα υδατικά διαλύματα των αλάτων υδροκυανικού οξέος με ισχυρές βάσεις υπόκεινται σε έντονη υδρόλυση. Για παράδειγμα, διάλυμα KCN 0,10 M έχει pH 11,1.
Τα στερεά κυανιούχα άλατα, όπως και τα διαλύματα των κυανιούχων αλάτων έχουν ήδη ελαφριά οσμή πικραμυγδάλου. Το γεγονός αυτό οφείλεται αφενός μεν στον μεγάλο βαθμό υδρόλυσης (διάλυμα KCN 0,10 Μ, λόγω υδρόλυσης περιέχει ήδη ελεύθερο HCN σε συγκέντρωση περίπου 0,0012 Μ), αφετέρου δε στην επίδραση του ατμοσφαιρικού CO2. Οι αντιδράσεις αυτές οδεύουν συνεχώς προς τα δεξιά, όσο δίνεται περιθώριο απομάκρυνσης του παραγόμενου πτητικού HCN.
CN-
+ H2O
![]() HCN + OH-
CN- + CO2 + H2O
HCN + OH-
CN- + CO2 + H2O
![]() HCO3- + HCN
HCO3- + HCN
Το υδροκυάνιο υδρολύεται σταδιακά προς μυρμηκικό οξύ σε όξινα διαλύματα σύμφωνα με την ακόλουθη σειρά αντιδράσεων:
![]()
 Τα ιόντα κυανίου και
τα κυανιούχα άλατα.
Το ιόν του κυανίου (CN-) δρα ως μονοσχιδής και σπανιότερα ως δισχιδής
υποκαταστάτης. 'Οταν δρα ως μονοσχιδής, είναι δύσκολο να εξακριβωθεί
ποιο από τα δύο άτομα είναι ο δότης ζεύγους ηλεκτρονίων, λόγω της ίδιας ηλεκτρονιακής πυκνότητας του C και
του N. Ωστόσο, σε όλες τις
περιπτώσεις που έχουν εξετασθεί με ειδικές μεθόδους (περίθλαση νετρονίων), ο δότης είναι το
άτομο του άνθρακα.
Τα ιόντα κυανίου και
τα κυανιούχα άλατα.
Το ιόν του κυανίου (CN-) δρα ως μονοσχιδής και σπανιότερα ως δισχιδής
υποκαταστάτης. 'Οταν δρα ως μονοσχιδής, είναι δύσκολο να εξακριβωθεί
ποιο από τα δύο άτομα είναι ο δότης ζεύγους ηλεκτρονίων, λόγω της ίδιας ηλεκτρονιακής πυκνότητας του C και
του N. Ωστόσο, σε όλες τις
περιπτώσεις που έχουν εξετασθεί με ειδικές μεθόδους (περίθλαση νετρονίων), ο δότης είναι το
άτομο του άνθρακα.
Το ιόν του κυανίου δρα ως δισχιδής υποκαταστάτης γεφύρωσης (bridging ligand) στις περιπτώσεις δυσδιάλυτων αλάτων, όπως είναι τα AuCN και AgCN, όπου σχηματίζεται μια πολυμερής αλυσίδα του τύπου Μ-CN-M-CN...-M-CN. Ανάλογη δράση παρατηρείται και στην περίπτωση του κυανού της Πρωσίας: NC-Fe(II)-CN-Fe(III)-NC-...-Fe(II)-CN (βλ. κρυσταλλικό πλέγμα).
Τα κυανιούχα άλατα αλκαλίων και γαιαλκαλίων, όπως και του Hg(II), είναι ευδιάλυτα, ενώ τα δυσδιάλυτα κυανιούχα άλατα των άλλων μετάλλων είτε υπόκεινται σε έντονη υδρόλυση κατά την προσθήκη τους στο νερό, είτε είναι ευδιάλυτα σε περίσσεια διαλύματος κυανιούχων ιόντων λόγω σχηματισμού σταθερών συμπλόκων. Τυπικό παράδειγμα αποτελεί η περίπτωση του δυσδιάλυτου AgCN. Ακόμη και το δυσδιαλυτότερο αλογονίδιο του Ag, ο AgI, διαλύεται σε διαλύματα κυανιούχων αλάτων:
Ag+ + CN-
![]() AgCN
AgCN + CN-
AgCN
AgCN + CN-
![]() [Ag(CN)2]-
AgΙ + 2CN-
[Ag(CN)2]-
AgΙ + 2CN-
![]() [Ag(CN)2]-
+ Ι-
[Ag(CN)2]-
+ Ι-
Τα πλέον συνήθη κυανιούχα σύμπλοκα διακρίνονται σε: (α) Δικυανιούχα, του τύπου: [M(CN)2]- (με γραμμική διάταξη), όπου Μ: Cu, Ag, Au, (β) Τετρακυανιούχα, του τύπου: [M(CN)4] (με τετραγωνική επίπεδη διάταξη), όπου Μ: Ni, Pd, Pt, (γ) Εξακυανιούχα, του τύπου: [M(CN)6]n- (με οκταεδρική διάταξη), όπου n = 2 ή 3 και Μ: Ti, V, Cr, Mn, Fe, Co.
Αν και τα κυανιούχα σχηματίζουν σταθερότατα σύμπλοκα με πολλά μεταλλοϊόντα σε σχέση με τα αντίστοιχα σύμπλοκα με άλλους υποκαταστάτες, μεταξύ τους τα σύμπλοκα αυτά (κυανοσύμπλοκα) διακρίνονται σε "ασθενώς" ή "μετρίως" σταθερά, τα οποία διασπώνται σε ελαφρώς όξινα διαλύματα (λόγω απόσπασης των CN- με σχηματισμό μοριακού HCN), και σε "ισχυρώς" σταθερά, τα οποία διασπώνται μόνο σε ισχυρώς όξινα διαλύματα.
| Ασθενώς ή μετρίως σταθερά κυανοσύμπλοκα (διασπώνται σε περιοχή pH 3-6): | Zn(CN)42-, Cd(CN)3-, Cd(CN)42-, Cu(CN)2-, Cu(CN)32-, Ni(CN)42-, Ag(CN)2- |
| Ισχυρώς σταθερά κυανοσύμπλοκα (διασπώνται σε ισχυρώς όξινα διαλύματα): | Co(CN)63-, Au(CN)2-, Fe(CN)64-, Hg(CN)42- |
Με ήπια οξείδωση των κυανιούχων (π.χ. με Cu(II)) λαμβάνεται δικυάνιο (cyanogen):
2Cu2+ + 6CN-
![]() 2[Cu(CN)2]- + (CN)2
2[Cu(CN)2]- + (CN)2
Το δικυάνιο είναι είναι ένα τυπικό ψευδοαλογόνο (pseudohalogen). Πρόκειται για ένα τοξικότατο αέριο (σ.τ.=-28ºC, σ.ζ.=-21,1ºC) το οποίο αντιδρά με διαλύματα βάσεων σχηματίζοντας κυανιούχα και κυανικά ιόντα, ενώ υδρολυόμενο παρέχει οξαλικό οξύ:
(CN)2 + 2OH-
![]() CNO- + CN- + H2O
(CN)2 + 4Η2O
+ 2Η+
CNO- + CN- + H2O
(CN)2 + 4Η2O
+ 2Η+
![]() HOCO-COOH + 2NH4+
HOCO-COOH + 2NH4+
Εφαρμογές των κυανιούχων ιόντων στην κλασική χημική ανάλυση. Ο σχηματισμός σταθερών κυανιούχων συμπλόκων πολλών ιόντων μετάλλων αξιοποιείται σε πολλές περιπτώσεις. Στην ποιοτική ανάλυση, τυπικό παράδειγμα αποτελεί ο διαχωρισμός των εξαιρετικά δυσδιάλυτων θειούχων αλάτων χαλκού (CuS) και καδμίου (CdS). Ο διαχωρισμός βασίζεται στη διαλυτοποίηση μόνο του πρώτου λόγω της αντίδρασης:
2CuS + 6CN-
![]() 2[Cu(CN)2]- + 2S2- +
(CN)2
2[Cu(CN)2]- + 2S2- +
(CN)2
Στην (κλασική) ποσοτική ανάλυση τα κυανιούχα ιόντα αξιοποιούνται ως επικαλυπτικό αντιδραστήριο (masking reagent). Τυπικό παράδειγμα αποτελεί ο συμπλοκομετρικός προσδιορισμός (ογκομέτρηση με EDTA, βλ. Χημική ένωση του μήνα: EDTA) μίγματος ιοντών Zn(ΙΙ) και Mg(ΙΙ), ο οποίος βασίζεται στην ισχυρότατη σύμπλεξη των πρώτων με τα κυανιούχα, σε αντίθεση με τα ιόντα Mg(II) τα οποία δεν σχηματίζουν κυανοσύμπλοκα. Με προσθήκη περίσσειας διαλύματος κυανιούχων στο υπό ανάλυση δείγμα συμπλέκονται ("επικαλύπτονται") τα ιόντα ψευδαργύρου και ογκομετρούνται αποκλειστικώς τα ιόντα Mg(II). Στη συνέχεια, τα ιόντα Zn(II) αποκαλύπτονται με διάσπαση του κυανοσυμπλόκου με περίσσεια φορμαλδεΰδης, η οποία δρα ως αποκαλυπτικό αντιδραστήριο (demasking reagent) και ακολουθεί η ογκομέτρησή τους. Οι σχετικές αντιδράσεις είναι:
Επικάλυψη ιόντων Zn(II): Zn2+
+ 4CN-
![]() [Zn(CN)4]2-
Αποκάλυψη ιόντων Zn(II): [Zn(CN)4]2-
+ 4HCHO + 4H+
[Zn(CN)4]2-
Αποκάλυψη ιόντων Zn(II): [Zn(CN)4]2-
+ 4HCHO + 4H+
![]() 4HOCH2CN + Zn2+
4HOCH2CN + Zn2+
|
Χρήση των κυανιούχων αλάτων στην εξόρυξη χρυσού [Αναφ. 5]
Ο χρυσός στα μεταλλεύματά του βρίσκεται σχεδόν πάντοτε σε ελεύθερη (μεταλλική) κατάσταση, ανομοιογενώς κατανεμημένος και σε πολύ μικρές αναλογίες. Παλαιότερα, η παραλαβή του βασιζόταν στην ιδιότητα του υδραργύρου να διαλυτοποιεί τον χρυσό σχηματίζοντας αμάλγαμα. Το κονιοποιημένο ορυκτό επεξεργαζόταν με υδράργυρο και ακολουθούσε απόσταξη του υδραργύρου, που άφηνε ως κατάλοιπο το χρυσό. Στην ουσία, ο χρυσός του μεταλλεύματος "εκχυλιζόταν" με υδράργυρο. Η επεξεργασία αυτή είχε πολλά μειονεκτήματα. Σχετικώς μεγάλες ποσότητες του χρυσού δεν παραλαμβάνονταν και επιπλέον η εργασία με υδράργυρο και η απόσταξή του ήταν μια εξαιρετικά επικίνδυνη, επιβλαβής για την υγεία και δαπανηρή διαδικασία. Σήμερα, η παραλαβή χρυσού από μεταλλεύματα χαμηλής περιεκτικότητας σε χρυσό (low-grade ore, τυπική περιεκτικότητα: 1 έως 4 g Au / τόνο μεταλλεύματος) πραγματοποιείται με τη μέθοδο της κυανίωσης ή κυανιδίωση (cyanidation). Η μέθοδος αναπτύχθηκε το 1887 από τον Σκώτο χημικό John Stewart MacArthur (1856-1920) και αντικατέστησε ολοκληρωτικά τη μέθοδο υδραργύρου. Η μέθοδος της κυανίωσης βασίζεται στην εκχύλιση του χρυσού από το λεπτοκονιοποιημένο και εμπλουτισμένο (π.χ. με επίπλευση) χρυσοφόρο μετάλλευμα, με αραιό διάλυμα κυανιούχου άλατος (τυπικά 0,01-0,05% ή 100-500 ppm NaCN ) υπό συνεχή διαβίβαση αέρα ή και καθαρού οξυγόνου. Ο χρυσός (ως Au(I)) σχηματίζει εξαιρετικά σταθερό σύμπλοκο με τα κυανιούχα, οπότε η παρουσία κυανιούχων υποβιβάζει το δυναμικό οξείδωσής του, σε σημείο που καθίσταται δυνατή πλέον η οξείδωσή του και από το ατμοσφαιρικό οξυγόνο, η οποία θα ήταν αδιανόητη απουσία του συμπλεκτικού μέσου. Στο μίγμα προστίθεται Ca(OH)2 έτσι ώστε το μίγμα να διατηρείται αλκαλικό και να αποφευχθεί η απώλεια κυανιούχων υπό τη μορφή πτητικού υδροκυανίου. Η συνολικώς πραγματοποιούμενη αντίδραση (γνωστή ως αντίδραση Elsner) είναι η ακόλουθη:
4Au + 8CN-
+ O2 + 2H2O
Στη συνέχεια το διάλυμα του κυανοσυμπλόκου του χρυσού(Ι) μπορεί να υποστεί μια ποικιλία διαδικασιών που αποβλέπουν στον διαχωρισμό και δέσμευση του κυανοσυμπλόκου ή την απευθείας παραλαβή του χρυσού. Η συνηθέστερη μέθοδος πραγματοποιείται με ενεργό άνθρακα, ο οποίος έχει την ιδιότητα να προσροφά τα κυανοσύμπλοκα του χρυσού και άλλων μετάλλων (μέθοδος γνωστή ως Carbon In Pulp, CIP). Από τον ενεργό άνθρακα το κυανοσύμπλοκο μπορεί να αποπροσροφηθεί με αύξηση του pH και της θερμοκρασίας ή με προσθήκη αλκοόλης. 'Αλλη μέθοδος παραλαβής του χρυσού είναι η απευθείας ηλεκτρόλυση του εκχυλίσματος ή η επεξεργασία του με σκόνη μεταλλικού ψευδαργύρου. Οι αντιδράσεις παραλαβής μπορούν να αποδοθούν από τις ακόλουθες:
Κάθοδος: [Au(CN)2]-
+ e-
Ως κάθοδος του ηλεκτρολυτικού στοιχείου συνήθως χρησιμοποιείται χαλυβοβάμβακας (wire-wool), που εξασφαλίζει μεγάλη επιφάνεια επαφής. Στη συνέχεια η κάθοδος (ή η σκόνη Zn) διαλυτοποιείται με νιτρικό οξύ ή θειικό οξύ, οπότε όλα τα μέταλλα που σχηματίζουν αντίστοιχα κυανιούχα σύμπλοκα (Cu, Cd) διαλύονται, ενώ παραμένει ως μόνο αδιάλυτο μέταλλο ο χρυσός, ο οποίος παραλαμβάνεται και μπορεί να υποστεί επιπλέον στάδια καθαρισμού. Το κύριο μειονέκτημα της μεθόδου της κυανίωσης είναι η χρήση των τοξικότατων κυανιούχων αλάτων και το ενδεχόμενο ρύπανσης του περιβάλλοντος σε περίπτωση ατυχήματος. Στο σημείο αυτό πρέπει να σημειωθεί ότι σχεδόν το 1/5 της παραγωγής κυανιούχων αλάτων χρησιμοποιείται για την εξόρυξη χρυσού. 'Αλλες μέθοδοι παραλαβής του χρυσού που δοκιμάστηκαν (π.χ. με οξείδωσή του με Cl2 ή Br2) δεν αποδείχθηκαν εξίσου αποτελεσματικές. Τα εκχυλίσματα, μετά την αφαίρεση από αυτά του χρυσού (εξαντλημένα εκχυλίσματα, barren extracts) πριν από την απόρριψή τους στους αποδέκτες (θάλασσα, ποταμοί) πρέπει να απαλλαγούν από τα κυανιούχα. Η απαλλαγή των εξαντλημένων εκχυλισμάτων από τα κυανιούχα πραγματοποιείται με οξείδωση των κυανιούχων προς κυανικά ιόντα τα οποία αφενός μεν είναι πολύ λιγότερο τοξικά, αφετέρου υδρολύονται παρέχοντας τελείως αβλαβή προϊόντα, σύμφωνα με τις αντιδράσεις:
CN-
+ [O]
Σε μια οξειδωτική διεργασία απαλλαγής των αποβλήτων από κυανιούχα χρησιμοποιείται χρησιμοποιείται το οξύ του Caro (H2SO5, βλ. Χημική ένωση του μήνα: Θειικό οξύ), με το οποίο πετυχαίνεται μείωση των κυανιούχων αρκετά κάτω από το ανώτατο επιτρεπτό όριο των 50 mg/L. Πρέπει να σημειωθεί ότι η απόδοση της μεθόδου της κυανίωσης εξαρτάται από το είδος του χρυσοφόρου μεταλλεύματος. Για παράδειγμα, η παραλαβή χρυσού από θειούχα μεταλλεύματα είναι δύσκολη, επειδή τα κυανιούχα αντιδρούν με το θείο μετατρεπόμενα στα αναποτελεσματικά θειοκυανικά ιόντα. Επίσης, αν περιέχουν μεγάλες ποσότητες χαλκού το κόστος της μεθόδου αυξάνει και απαιτούνται μεγαλύτερες συγκεντρώσεις κυανιούχων, εφόσον ο χαλκός δεσμεύει μεγάλο μέρος από αυτά. |
|||||
Σύνθεση υδροκυανίου και κυανιούχων αλάτων [Αναφ. 6]
Παλαιές μέθοδοι. Κατά τη δεκαετία του 1890, για να καλυφθεί η ζήτηση κυανιούχων αλάτων για την εξόρυξη αργύρου και χρυσού, αναπτύχθηκε μια μέθοδος παρασκευής υδροκυανίου, που βασιζόταν στη διαβίβαση αμμωνίας υπεράνω ερυθροπυρακτωμένου άνθρακα (μέθοδος Beilby):
C + NH3
![]() HCN + H2
HCN + H2
Το 1894, ανακαλύφθηκε μια άλλη μέθοδος, που σταδιακά αντικατέστησε τη μέθοδο Beilby. Η νέα μέθοδος έγινε οικονομικώς συμφέρουσα χάρις στην ανάπτυξη φθηνού τρόπου ηλεκτρολυτικής παραγωγής μεταλλικού νατρίου σε μεγάλες ποσότητες (μέθοδος Castner). Η νέα μέθοδος βασιζόταν στην παρασκευή κυανιούχου νατρίου με διαβίβαση αέριας αμμωνίας υπεράνω ισχυρώς θερμαινόμενου μίγματος μεταλλικού νατρίου και άνθρακα, με τον ενδιάμεσο σχηματισμό νατραμιδίου (NaNH2), μέθοδος γνωστή και αυτή ως μέθοδος Castner (Hamilton Castner, 1858-1899). Η σειρά των αντιδράσεων είχε ως εξής:
Na + NH3
![]() NaNH2 + 1/2H2
NaNH2 + C
NaNH2 + 1/2H2
NaNH2 + C
![]() NaCN + H2
NaCN + H2SO4
NaCN + H2
NaCN + H2SO4
![]() NaHSO4 + HCN
NaHSO4 + HCN
Η μέθοδος Castner χρησιμοποιήθηκε μέχρι τη δεκαετία του 1960. Στις σύγχρονες μεθόδους παρασκευής υδροκυανίου ως πρώτη ύλη χρησιμοποιείται πλέον το φυσικό αέριο, γεγονός το οποίο μείωσε σημαντικά το κόστος του υδροκυανίου και των κυανιούχων αλάτων. Πολλοί συνδυασμοί υδρογονανθράκων, αμμωνίας και οξυγόνου σε υψηλές θερμοκρασίες και παρουσία διαφόρων καταλυτών παρέχουν υδροκυάνιο ως πρωτεύον ή δευτερεύον προϊόν. Από αυτές η μέθοδος Andrussow είναι η πλέον οικονομικώς συμφέρουσα.
 |
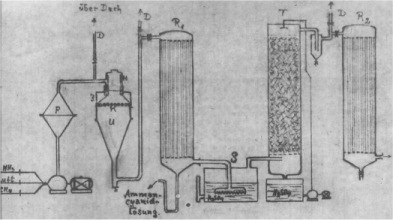 |
 |
|
Αριστερά: Ο Γερμανός χημικός μηχανικός Leonid Andrussow (1896-1988), ο οποίος το 1927 ανακάλυψε τη μέθοδο παρασκευής υδροκυανίου μέσω της καταλυτικής οξείδωσης μίγματος μεθανίου-αμμωνίας. Κέντρο: Σχέδιο (1931) εγκατάστασης για παραγωγή υδροκυανίου με τη μέθοδο Andrussow [πηγή]. Δεξιά: Ο καταλύτης (πλέγμα Pt-Rh) πριν και μετά 1000 ώρες συνεχούς λειτουργίας, οπότε παρατηρείται απόθεση άνθρακα και το πλέγμα καθίσταται κάπως εύθραυστο [πηγή]. |
||
Μέθοδος Andrussow. Η μέθοδος Andrussow (ανακαλύφθηκε το 1927) αποτελεί σήμερα την κυριότερη μέθοδο παρασκευής υδροκυανίου και βασίζεται στην εξώθερμη (-474 kJ/mol) αντίδραση αερίου μίγματος μεθανίου, αμμωνίας και αέρα στους 1200ºC, παρουσία λευκοχρύσου/ροδίου ως καταλύτη:
![]()
Η αντίδραση αυτή παρέχει αρκετά παραπροϊόντα (άζωτο και οξείδιά του, CO, CO2, H2) και απαιτεί στάδια καθαρισμού του λαμβανόμενου προϊόντος και απαλλαγής του κυρίως από την περίσσεια αμμωνίας (απομακρύνεται με διαβίβαση των προϊόντων μέσω διαλύματος H2SO4). Η απόδοση της αντίδρασης αυξάνει και τα παραπροϊόντα περιορίζονται με σύντομη έκθεση του αντιδρώντος μίγματος στον καταλύτη, για τον οποίον -λαμβανομένου υπόψη και του μεγάλου κόστους του- λαμβάνονται ειδικά μέτρα ώστε να περιορίζεται η φθορά του.
|
Βαγόνι - βυτίο μεταφοράς υγρού υδροκυανίου [Αναφ. 6ε]. |
Μέθοδος Degussa. [Degussa AG: Παλαιά, από τα μέσα του 19ου αιώνα, μεγάλη Γερμανική βιομηχανία παραγωγής και εφαρμογών πολύτιμων μετάλλων (Ag, Au, Pt, Ir και άλλων ευγενών μετάλλων), από το 2007 γνωστή ως Evonic Industries] Η μέθοδος Degussa ή μέθοδος ΒΜΑ [Blausäure (υδροκυάνιο) from Methan (μεθάνιο) and Ammoniak] βασίζεται στην αντίδραση αντίδρασης μεθανίου και αμμωνίας απουσία οξυγόνου:
![]()
|
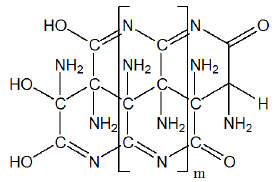
Εικαζόμενος τύπος του τελικού προϊόντος πολυμερισμού του υγρού υδροκυανίου. Πρόκειται για σκουρόχρωμο στερεό διασπώμενο εκρηκτικά στους 100 oC [Αναφ. 6ε]. |
Η αντίδραση είναι ισχυρώς ενδόθερμη (+251 kJ/mol) και πραγματοποιείται σε εξωτερικά θερμαινόμενους σωλήνες επικαλυμμένους με λευκόχρυσο. Το προκύπτον μίγμα (23% v/v HCN + 72% v/v H2) διαβιβάζεται μέσω υδατικού διαλύματος ΝΗ3 που δεσμεύει το HCN ως NH4CN, από το οποίο το HCN λαμβάνεται με οξίνιση. Η μέθοδος μειονεκτεί ως προς τη μέθοδο Andrussow λόγω του ενδόθερμου χαρακτήρα.
Δεδομένης της μεγάλης πτητικότητας και επικινδυνότητας του υγρού υδροκυανίου, όπως και της πιθανότητας ιδιαιτέρως εξώθερμου και σχεδόν εκρηκτικού πολυμερισμού του (βλ. παρακάτω) από διάφορες ακαθαρσίες (κυρίως βασικού χαρακτήρα), σπανίως αποθηκεύεται ως έχει σε δεξαμενές ή μεταφέρεται σε άλλες βιομηχανίες, αν και παράγεται σε ποσότητες χιλιάδων τόνων ετησίως.
Συνήθως το υγρό υδροκυάνιο που πρόκειται να αποθηκευθεί σε δεξαμενές ή να διακινηθεί με βαγόνια-βυτία (με εξαιρετική θερμομόνωση) σταθεροποιείται με την προσθήκη μικρών ποσοτήτων H2SO4 (τυπικά 500 ppm). Κατά κανόνα το υδροκυάνιο, σε υγρή ή αέρια μορφή, είτε χρησιμοποιείται επί τόπου (π.χ. για την παραγωγή πολυμερών), είτε μετατρέπεται σε κυανιούχα άλατα, και ειδικότερα σε NaCN, KCN και Ca(CN)2, τα οποία ως στερεά ή ως πυκνά υδατικά υδατικά διαλύματα είναι κατά πολύ ασφαλέστερα τόσο στην αποθήκευση, όσο και στη μεταφορά.
Στο χημικό εργαστήριο.
Στο χημικό εργαστήριο σπάνια μπορεί να χρειασθεί άνυδρο υδροκυάνιο, ωστόσο
αυτό μπορεί απλά να παραχθεί με επίδραση ισχυρού οξέος
σε ένα κυανιούχο άλας (CN- + H+
![]() HCN).
Η παρασκευή αυτή είναι ΙΔΙΑΙΤΕΡΩΣ ΕΠΙΚΙΝΔΥΝΗ και πρέπει να πραγματοποιείται μόνο σε πολύ
μικρή κλίμακα και σε εργαστηριακό απαγωγό ελεγμένης ικανότητας απαγωγής
αερίων. Επιπλέον, ο χημικός πρέπει να φέρει αντιασφυξιογόνο μάσκα, να έχει αμέσως διαθέσιμα τα αντίδοτα
(βλ. παρακάτω) για την περίπτωση
εισπνοής των τοξικότατων ατμών του και να μην δουλεύει μόνος του.
HCN).
Η παρασκευή αυτή είναι ΙΔΙΑΙΤΕΡΩΣ ΕΠΙΚΙΝΔΥΝΗ και πρέπει να πραγματοποιείται μόνο σε πολύ
μικρή κλίμακα και σε εργαστηριακό απαγωγό ελεγμένης ικανότητας απαγωγής
αερίων. Επιπλέον, ο χημικός πρέπει να φέρει αντιασφυξιογόνο μάσκα, να έχει αμέσως διαθέσιμα τα αντίδοτα
(βλ. παρακάτω) για την περίπτωση
εισπνοής των τοξικότατων ατμών του και να μην δουλεύει μόνος του.
Το υδροκυάνιο στην οργανική και βιομηχανική σύνθεση [Αναφ. 7]
Το υδροκυάνιο και τα κυανιούχα άλατα βρίσκουν πλήθος εφαρμογών στην οργανική σύνθεση σε εργαστηριακή και βιομηχανική κλίμακα. 'Ισως οι χαρακτηριστικότερες αντιδράσεις του υδροκυανίου είναι οι αντιδράσεις προσθήκης με καρβονυλικές ενώσεις (αλδεΰδες και κετόνες) με προϊόν κυανυδρίνες, οι οποίες με υδρόλυση παρέχουν α-υδροξυοξέα, με βάση τα γενικά σχήματα:
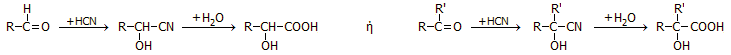
Οι αντιδράσεις αυτές απαιτούν της χρήση υδροκυανίου, ωστόσο λόγω της επικινδυνότητάς (συνδυασμός πτητικότητας και τοξικότητας), χρησιμοποιούνται κυανιούχα άλατα (π.χ. NaCN) και στο αντιδρών μίγμα προστίθενται σταδιακά σταγόνες θειικού οξέος για την επιτόπου παραγωγή υδροκυανίου. Μία από τις κλασικές εφαρμογές της ονομαζόμενης κυανυδρινικής σύνθεσης είναι η επιμήκυνση της ανθρακικής αλυσίδας των αλδοζών, γνωστή ως σύνθεση Fischer-Kiliani (βλ. Χημική ένωση του μήνα: Γλυκόζη).
Τα κυανιούχα άλατα αντιδρούν με αλογονίδια παρέχοντας τα αντίστοιχα νιτρίλια (σύνθεση νιτριλίων κατά Kolbe), τα οποία μπορούν να αναχθούν (π.χ. με αμάλγαμα Na ή LiAlH4) παρέχοντας τις αντίστοιχες αμίνες. Η σύνθεση αυτή συνιστά έναν κλασικό και απλό τρόπο επιμήκυνσης της ανθρακικής αλυσίδας κατά ένα άτομο άνθρακα:
![]()
Αντιδράσεις βιομηχανικής σημασίας. Από την κυανυδρίνη της ακετόνης παράγεται μέσω της ακόλουθης σειράς αντιδράσεων ο μεθακρυλικός μεθυλεστέρας, πρώτη ύλη για την παρασκευή του πολυ(μεθακρυλικού μεθυλεστέρα) [poly(methyl methacrylate), PMMA], του γνωστού διαφανούς πολυμερούς με τα εμπορικά ονόματα Plexiglas, Lucite, and Perspex:
|
|
|
Το υδροκυάνιο αποτελεί πρώτη ύλη για την παραγωγή του του διαφανούς πολυμερούς Plexiglas (επάνω), όπως και του Nylon 66 (κάτω). |
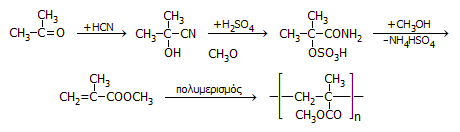
Μια παλαιά μέθοδος παρασκευής ακρυλονιτριλίου (acrylonitrile) και από αυτό του πολυακρυλονιτριλίου (polyacrylnitrile, PAN) βασιζόταν στην αντίδραση προσθήκης υδροκυανίου (καταλυόμενη από άλατα του Cu(I)) στο ακετυλένιο:
![]()
'Αλλη μέθοδος σύνθεσης ακρυλονιτριλίου βασίζεται στην αντίδραση του υδροκυανίου με αιθυλενοξείδιο προς τον ενδιάμεσο σχηματισμό κυανυδρίνης, η οποία υπόκειται σε καταλυτική αφυδάτωση παρέχοντας ακρυλονιτρίλιο
![]()
Σήμερα, σχεδόν αποκλειστική μέθοδος παρασκευής ακρυλονιτριλίου βασίζεται στην αντίδραση προπυλενίου, αμμωνίας και
οξυγόνου, όπου δεν γίνεται πλέον χρήση υδροκυανίου (διεργασία
SOHIO: 2CH3-CH=CH2
+ 2NH3
+ 3O2
![]() 2CH2=CH-CN
+ 6H2O).
2CH2=CH-CN
+ 6H2O).
'Ενα ακόμη προϊόν μεγάλης βιομηχανικής σημασίας είναι εξαμεθυλενοδιαμίνη (1,6-εξανοδιαμίνη). Η σύνθεσή της ξεκινά με την προσθήκη του υδροκυανίου στο 1,3-βουταδιένιο (μέθοδος Du Pont). Περίπου 1 εκατομμύριο τόνοι εξαμεθυλενοδιαμίνης παράγονται ετησίως με βάση την ακόλουθη σειρά αντιδράσεων:
![]()
Περίπου 1 εκατομμύριο τόνοι εξαμεθυλενοδιαμίνης παράγονται ετησίως με βάση την προηγούμενη σειρά αντιδράσεων. Η εξαμεθυλενοδιαμίνη αντιδρά με αδιπικό οξύ (1,6-εξανοδιοϊκό οξύ) παρέχοντας το ευρύτατης χρήσης πολυαμιδικό πολυμερές Nylon 66 (66: 6 άνθρακες στη διαμίνη, 6 άνθρακες στο δικαρβονικό οξύ):
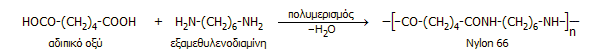
Να σημειωθεί ότι το το αδιπικό οξύ μπορεί να ληφθεί με υδρόλυση του αδιπονιτριλίου, ωστόσο αυτό παράγεται με φθηνότερη μέθοδο (οξείδωση κυκλοεξανόνης ή κυκλοεξανόλης ή μίγματός τους με νιτρικό οξύ).
Μια επιπλέον χρήση του HCN (ως κυανιούχο άλας) αφορά τη βιομηχανική παραγωγή αμινοπολυκαρβοξυλικών οξέων (αποσκληρυντικά μέσα, φυτοφάρμακα, αναλυτικά αντιδραστήρια) με συμπύκνωση του με φορμαλδεΰδη και την κατάλληλη αμίνη. Για παράδειγμα, για την παραγωγή EDTA (βλ. Χημική ένωση του μήνα: EDTA) χρησιμοποιείται η αιθυλενοδιαμίνη και η συνολική αντίδραση είναι η ακόλουθη:
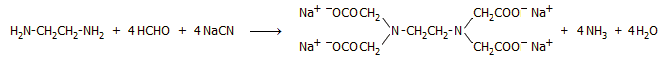
Το υδροκυάνιο στο φυτικό βασίλειο [Αναφ. 8]
Το υδροκυάνιο σε μικρές ποσότητες βρίσκεται σε πολλά φρούτα και καρπούς και ειδικότερα στους πυρήνες (κουκούτσια) τους. Το υδροκυάνιο βρίσκεται υπό τη μορφή των ονομαζόμενων κυανογόνων γλυκοζιτών (cyanogenic glycosides) και πολύ σπάνια ελεύθερο. Εκτιμάται πως στη φύση υπάρχουν τουλάχιστον 2500 διαφορετικοί κυανογόνοι γλυκοζίτες. Οι γλυκοζίτες αυτοί είναι αποτέλεσμα της εξέλιξης των φυτικών οργανισμών και χρησιμεύουν ως αμυντικά όπλα τους κατά των φυτοφάγων ζώων.
Οι κυανογόνοι γλυκοζίτες από χημική άποψη είναι γλυκοζίτες των οποίων το άγλυκο τμήμα είναι μια κυανυδρίνη και το σάκχαρο είναι συνήθως γλυκόζη. Μπορούν να υποστούν ενζυμική υδρόλυση και να απελευθερώσουν την κυανυδρίνη, η οποία στη συνέχεια υδρολύεται (επιταχύνεται η υδρόλυση από το ένζυμο υδροξυνιτριλάση) παρέχοντας καρβονυλική ένωση (αλδεΰδη ή κετόνη) και υδροκυάνιο, σύμφωνα με το γενικό σχήμα:
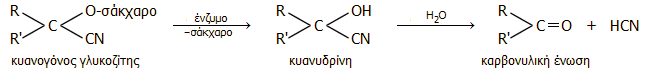
Ο πλέον γνωστός κυανογόνος γλυκοζίτης είναι η αμυγδαλίνη (amygdalin), όπου το σάκχαρο είναι η γεντιοβιόζη (gentiobiose, ένας δισακχαρίτης αποτελούμενος από δύο μονάδες D-γλυκόζης) και η καρβονυλική ένωση είναι η βενζαλδεΰδη (C6H5CHO) (δηλ. στην προηγούμενη γενική αντίδραση: R = C6H5, R' = H). Η αμυγδαλίνη βρίσκεται στα πικραμύγδαλα, απ' όπου απομονώθηκε για πρώτη φορά το 1830, ενώ λίγα χρόνια αργότερα, το 1837, οι Friedrich Wöhler (1800-1882) και Justus von Liebig (1803-1873) διαπίστωσαν την παρουσία βενζαλδεΰδης και υδροκυανίου στα προϊόντα υδρολυτικής διάσπασής της. Αμυγδαλίνη βρίσκεται στους πυρήνες (kernel, κουκούτσια) πολλών φρούτων και καρπών (μήλα, βερίκοκα, ροδάκινα, δαμάσκηνα) σε αναλογίες 2,5 έως 8% και κυρίως σε αυτήν οφείλεται η πικρή γεύση τους.
Η αμυγδαλίνη υδρολύεται αργά ή ταχύτερα υπό την επίδραση της εμουλσίνης (emulsin), ενός μίγματος υδρολυτικών ενζύμων (γλυκοζιδάσες). Στον άνθρωπο, η υδρόλυση αυτή πραγματοποιείται από τις γλυκοζιτάσες του εντέρου, απ' όπου γίνεται και η απορρόφηση του τοξικού υδροκυανίου. Η αντίδραση υδρόλυσης της αμυγδαλίνης έχει ως εξής:
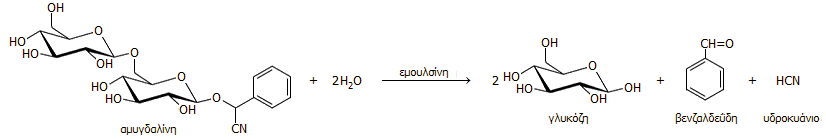
Είναι παράδοξο το γεγονός ότι δύο χημικώς τελείως διαφορετικά προϊόντα της ίδιας αντίδρασης, η βενζαλδεΰδη και το υδροκυάνιο συμπτωματικά έχουν περίπου την ίδια χαρακτηριστική οσμή πικραμυγδάλων.
Τα κοινά "ήμερα" (ή "γλυκά") αμύγδαλα δεν διαθέτουν αμυγδαλίνη σε σημαντικές ποσότητες, αλλά τα πικραμύγδαλα, μια γενετική παραλλαγή των αμυγδάλων, περιέχουν περίπου 5% αμυγδαλίνη. Συχνά, και στα κοινά αμύγδαλα συναντώνται πικραμύγδαλα, τα οποία δεν διαφέρουν σε εμφάνιση, αλλά χαρακτηρίζονται από μια εντονότατη πικρή γεύση. Η περιπτωσιακή βρώση ενός πικραμύγδαλου συνεπάγεται την εισαγωγή στον οργανισμό περίπου 4-6 mg υδροκυανίου χωρίς κάποιο δυσάρεστο αποτέλεσμα (πέραν της εντονότατης πικρής γεύσης), ωστόσο η ενδεχόμενη αποκλειστική βρώση 10-12 πικραμυγδάλων (ή λιγότερων για μικρά παιδιά) μπορεί να προκαλέσει τον θάνατο.
 |
 |
 |
 |
|
Βρώσιμοι καρποί που συχνά περιέχουν μεγάλες έως επικίνδυνες ποσότητες κυανογόνων γλυκοζιτών. Από αριστερά προς τα δεξιά: (α) Πικραμύγδαλα (almonds), συναντώνται συχνά και μεταξύ των συνηθισμένων (γλυκών) αμυγδάλων (10-12 πυρήνες πικραμύγδαλων μπορούν να επιφέρουν τον θάνατο). (β) Κασσάβα (cassava, γνωστή και ως "μανιόκα" ή "γιούκα" ή "ψωμί των τροπικών"), ένα είδος γεώμηλου με βρώσιμη αμυλούχο ρίζα, στην οποία η περιεκτικότητα σε κυανογόνους γλυκοζίτες μπορεί να φθάσει σε επικίνδυνα επίπεδα. Σε ποικιλίες με αυξημένους κυανογόνους γλυκοζίτες, συνηθίζεται πριν από το μαγείρεμα, τα κομμάτια κασσάβας να ξεπλένονται για αρκετή ώρα σε νερό για την απομάκρυνση των επικίνδυνων κυανογόνων γλυκοζιτών. (γ) Σόργο (sorghum), αμυλούχα σπέρματα παρόμοια με εκείνα του αραβόσιτου, τα οποία χρησιμοποιούνται κυρίως ως ζωοτροφές, αλλά και για διατροφή στις αναπτυσσόμενες χώρες. (δ) Φασόλια Λίμας (Lima beans), γνωστά και ως "φασόλια βουτύρου", μια εύγευστη ποικιλία φασολιών τα οποία δεν πρέπει ποτέ να τρώγονται ωμά, επειδή κατά κανόνα περιέχουν μεγάλες ποσότητες ενός κυανογόνων γλυκοζιτών. |
|||
|
|
Αυξημένες συγκεντρώσεις υδροκυανίου υπό τη μορφή διάφορων κυανογόνων γλυκοζιτών συναντούνται σε ορισμένους καρπούς, οι οποίοι σε πολλές υπό ανάπτυξη χώρες (Ν. Αμερικής, Αφρικής, Ασίας) αποτελούν συνήθη τροφή. Στον παραπλεύρως πίνακα συνοψίζονται οι κύριοι κυανογόνοι γλυκοζίτες και η ισοδύναμη περιεκτικότητά τους σε ορισμένα φυτικά τρόφιμα και πυρήνες καρπών.
 Αμφιλεγόμενα φάρμακα. Πρέπει να σημειωθεί ότι από ορισμένα κυρίως διαδικτυακά καταστήματα
διατροφικών συμπληρωμάτων
διατίθενται σκευάσματα αμυγδαλίνης ή πολτοποιημένοι πυρήνες φρούτων, που
περιέχουν αμυγδαλίνη.
Αυτά τα σκευάσματα διαφημίζονται ως διεγερτικά του ανοσολογικού
συστήματος με αντικαρκινική δράση ή ως ουσίες των οποίων η λήψη
προλαμβάνει τον καρκίνο.
Αμφιλεγόμενα φάρμακα. Πρέπει να σημειωθεί ότι από ορισμένα κυρίως διαδικτυακά καταστήματα
διατροφικών συμπληρωμάτων
διατίθενται σκευάσματα αμυγδαλίνης ή πολτοποιημένοι πυρήνες φρούτων, που
περιέχουν αμυγδαλίνη.
Αυτά τα σκευάσματα διαφημίζονται ως διεγερτικά του ανοσολογικού
συστήματος με αντικαρκινική δράση ή ως ουσίες των οποίων η λήψη
προλαμβάνει τον καρκίνο.
Χαρακτηριστική υπήρξε η περίπτωση του Laetrile. Κατά τη δεκαετία του 1960, άρχισε να κυκλοφορεί σκεύασμα χημικώς τροποποιημένης αμυγδαλίνης (οξειδωμένης στο τμήμα του σακχάρου) γνωστό με την εμπορική ονομασία Laetrile.
Η κυκλοφορία του Laetrile δημιούργησε σοβαρό πρόβλημα στους καρκινοπαθείς, αφού πολλοί εγκατέλειπαν τα εγκεκριμένα θεραπευτικά σχήματα, προσδοκώντας αποτελεσματικότερη θεραπεία από το "θαυματουργό φάρμακο". Ωστόσο, πολλές μελέτες που διεξήχθησαν στη συνέχεια από επιστημονικές ομάδες, έδειξαν την απουσία κάθε αντικαρκινικής δράσης του σκευάσματος. Μια μελέτη, που διεξήχθη σε 178 καρκινοπαθείς υπό την εποπτεία του Εθνικού Ινστιτούτου Καρκίνου των ΗΠΑ (National Cancer Institute, NCI), έδειξε ότι όχι μόνο δεν υπήρξε έστω και μια περίπτωση θεραπείας, αλλά ούτε καν κάποια σταθεροποίηση της κατάστασής τους. Στη συνέχεια, η κυκλοφορία του Laetrile απαγορεύθηκε σε πολλές πολιτείες των ΗΠΑ, παρ' όλα αυτά το "φάρμακο" εξακολουθεί να διατίθεται με διάφορα εμπορικά ονόματα (μεταξύ των οποίων και ως βιταμίνη Β17) μέσω του διαδικτυακού εμπορίου. Η ενδιαφέρουσα ιστορία του Laetrile, σε κάθε λεπτομέρειά της, παρουσιάζεται από τον Benjamin Wilson σε άρθρο του στον ιστότοπο quackwatch.org (quack: τσαρλατάνος) με τίτλο: "The Rise and Fall of Laetrile".
Οι διάφοροι εθνικοί οργανισμοί φαρμάκων εκδίδουν συχνά προειδοποιητικές ανακοινώσεις προς το κοινό, να είναι ιδιαίτερα προσεκτικό κατά την κατανάλωση αυτών των συμπληρωμάτων, δεδομένης της μεγάλης διαφήμισης που γίνεται για αυτά στο διαδίκτυο και της μεγάλης πιθανότητας δηλητηριάσεων από το υδροκυάνιο που παράγουν στον οργανισμό κατά τη λήψη τους.
|
ΠΡΟΣΟΧΗ Στο διαδίκτυο υπάρχουν αβάσιμες πληροφορίες και συμβουλές, όπως "… να τρώτε τρία αμύγδαλα την ημέρα και δεν θα πάθετε ποτέ καρκίνο" ή "...το μυστικό του αιώνα. Γιατί το αμυγδαλέλαιο περιέχει βιταμίνες Α, Ε, Β, κ.λπ., και αμυγδαλίνη…". Στο διαδικτυακό εμπόριο πωλούνται αιθέρια έλαια αμυγδάλων, βερίκοκων και άλλων φρούτων με διάφορες διαφημιζόμενες θεραπευτικές ιδιότητες, όπως "οφέλη για το ανοσοποιητικό σύστημα", "αντιοξειδωτική δράση". Αν και υπάρχει νομοθεσία που αφορά τη διάθεση φυτικών προϊόντων, όπως, αιθέρια έλαια, κονιοποιημένοι πυρήνες και άλλες φυσικές ουσίες, ορισμένες μικροεπιχειρήσεις εκμεταλλεύονται τα κενά του ελέγχου και προβάλλουν θεραπευτικές ιδιότητες που δεν στηρίζονται σε έγκυρα επιστημονικά δεδομένα. |
Το υδροκυάνιο και η χημεία της προέλευσης της ζωής στον πλανήτη μας [Αναφ. 9, 10]
|
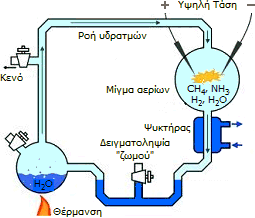
Σχηματική απεικόνιση της συσκευής του διάσημου πειράματος των Miller - Urey. |
Οργανικές ενώσεις μικρού μοριακού βάρους θεωρείται βέβαιο ότι υπήρχαν σε υδάτινους όγκους και στην αρχέγονη ατμόσφαιρα της Γης. Μεθάνιο, ακετυλένιο, υδροκυάνιο, υδρόθειο, μονοξείδιο και διοξείδιο του άνθρακα, αμμωνία και νερό θεωρούνται ως οι πρόδρομες ενώσεις, οι οποίες με την επίδραση διάφορων ακτινοβολιών (UV, ραδιενεργές ακτινοβολίες), ηλεκτρικών εκκενώσεων (κεραυνοί), των υψηλών θερμοκρασιών ηφαιστειακών περιοχών και αναβλυσμάτων, του υπέρθερμου περιβάλλοντος θαλάσσιων υδροθερμικών ρωγμών, οδήγησαν στη σύνθεση αμινοξέων, όπως και νουκλεϊνικών βάσεων, που αποτελούν το επόμενο στάδιο εξέλιξης των μορίων της ζωής. Ο κλάδος της χημείας που εξετάζει τις σχετικές αντιδράσεις, δηλ. το πώς από απλά μόρια, συντίθενται σύνθετα χημικά ή βιοχημικά συστήματα, είναι γνωστός ως Προβιοτική Χημεία (Prebiotic Chemistry).
Η σύνθεση των αμινοξέων κάτω υπό συνθήκες "τεχνητής" αρχέγονης ατμόσφαιρας επιβεβαιώθηκε με τα διάσημα πειράματα των Miller - Urey και σειρά ανάλογων πειραμάτων που διεξήχθησαν τις τελευταίες δεκαετίες. Η αρχικές αντιδράσεις, που θεωρείται ότι πως πραγματοποιήθηκαν στην αρχέγονη ατμόσφαιρα, δημιούργησαν ένα μίγμα ενδιάμεσων ενώσεων, μεταξύ και αυτών και το HCN, οδήγησαν στη σύνθεση του αμινοξέος γλυκίνη (για περισσότερες λεπτομέρειες, βλ. Χημική ένωση του μήνα: Γλυκίνη). Η σειρά αυτή των αντιδράσεων έχει ως εξής:
CH4 + H2O
![]() CO + 3H2 CO + H2O
CO + 3H2 CO + H2O
![]() CO2 + H2
CO2
CO2 + H2
CO2
![]() CO + [O] CH4 + 2[O]
CO + [O] CH4 + 2[O]
![]() CH2O + H2O
CH2O + H2O
CO + NH3
![]() HCN + H2O CH4 + NH3
HCN + H2O CH4 + NH3
![]() HCN + 3H2
CH2O + HCN
HCN + 3H2
CH2O + HCN
![]() ΗΟCH2CN
ΗΟCH2CN
HOCH2CN + NH3 ![]() Η2NCH2CN + H2O (αλληλουχία
σύνθεσης Strecker)
Η2NCH2CN + H2O (αλληλουχία
σύνθεσης Strecker)
NH2CH2CN + 2H2O
![]() NH3 + Η2NCH2COOH (γλυκίνη)
NH3 + Η2NCH2COOH (γλυκίνη)
Αν και είναι δύσκολο να επιβεβαιωθεί, φαίνεται ότι το υδροκυάνιο διαδραμάτισε σημαντικό ρόλο στη σύνθεση σημαντικών βιοχημικών ουσιών, δεδομένου του ότι η ουσία αυτή είναι ένας από τους χημικώς δραστικότερους δομικούς φορείς αζώτου. Αρκετές από αυτές τις χημικές αντιδράσεις που πραγματοποιήθηκαν πριν πολλά δισεκατομμύρια χρόνια έχουν αναπαραχθεί σε εργαστηριακές συνθήκες. Για ορισμένες ουσίες βιοχημικής σημασίας οι οποίες βρέθηκαν σε μετεωρίτες, διαπιστώθηκε ότι πράγματι είναι εφικτή η σύνθεσή τους στο εργαστήριο σε συνθήκες τεχνητής αρχέγονης ατμόσφαιρας, με πειραματικές διατάξεις ανάλογες με εκείνες των πειραμάτων των Miller - Urey. Πολλές ερευνητικές ομάδες εξέτασαν τη δυνατότητα δημιουργίας μιας ποικιλίας οργανικών ουσιών βιολογικής σημασία ξεκινώντας από πολύ απλά μόρια. Συνοπτικά, ορισμένα από τα αποτελέσματα αυτά δείχνονται στη συνέχεια:
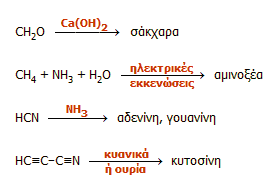 |
|
 |
| Αριστερά: Συνοπτική παρουσίαση σύνθεσης ορισμένων ενώσεων και τάξεων ενώσεων βιοχημικής σημασίας από απλές ενώσεις στην αρχέγονη Γη. Κέντρο: Σταδιακή επιμήκυνση της ανθρακικής αλυσίδας υδατανθράκων μέσω μιας φωτοοξειδοαναγωγικής αντίδρασης του υδροκυανίου, όπου ως καταλύτης δρα το σύστημα κυανιούχων συμπλόκων των Cu(I)/Cu(II) [Αναφ. 10ζ]. Δεξιά: Ο Ισπανός βιοχημικός Joan Oró (1924-2004), ο οποίος εστίασε την προσοχή του στον κεντρικό ρόλο που διαδραμάτισε το υδροκυάνιο στη σύνθεση ενώσεων βιοχημικής σημασίας. | ||
Από το 1961 ο Ισπανός βιοχημικός ερευνητής της NASA
Joan
Oró (1924-2004) είχε υποθέσει ότι η νουκλεϊνική βάση αδενίνη
(C5H5N5) θα
μπορούσε να έχει συντεθεί με ολιγομερισμό του υδροκυανίου
(5 μόρια HCN ολιγομερίζονται προς 1 μόριο αδενίνης: 5HCN
![]() C5H5N5). Για
την απόδειξη της θεωρίας του, ο Oró διεξήγαγε πειράματα με υδατικά
διαλύματα κυανιούχου αμμωνίου στα οποία μετά τη θέρμανσή τους ανίχνευσε την παρουσία αδενίνης. Με αντίστοιχο τρόπο
διαπιστώθηκε η δυνατότητα σύνθεσης πυριμιδινών (κυτοσίνη, ουρακίλη), αδενίνης και
τριαζινών από ουρίες με στάδια ψύξης-απόψυξης και επίδρασης ηλεκτρικών
εκκενώσεων.
C5H5N5). Για
την απόδειξη της θεωρίας του, ο Oró διεξήγαγε πειράματα με υδατικά
διαλύματα κυανιούχου αμμωνίου στα οποία μετά τη θέρμανσή τους ανίχνευσε την παρουσία αδενίνης. Με αντίστοιχο τρόπο
διαπιστώθηκε η δυνατότητα σύνθεσης πυριμιδινών (κυτοσίνη, ουρακίλη), αδενίνης και
τριαζινών από ουρίες με στάδια ψύξης-απόψυξης και επίδρασης ηλεκτρικών
εκκενώσεων.
Τυπικό παράδειγμα αποτελεί ο ακόλουθος συνοπτικός μηχανισμός σύνθεσης πολλών πουρινών, μεταξύ των οποίων και οι νουκλεϊνικές βάσεις αδενίνη και η γουανίνη, με ολιγομερισμό του υδροκυανίου και με επιπλέον αντιδραστήρια προϊόντα οξείδωσης του υδροκυανίου (δικυάνιο, κυανικό οξύ) και το νερό:
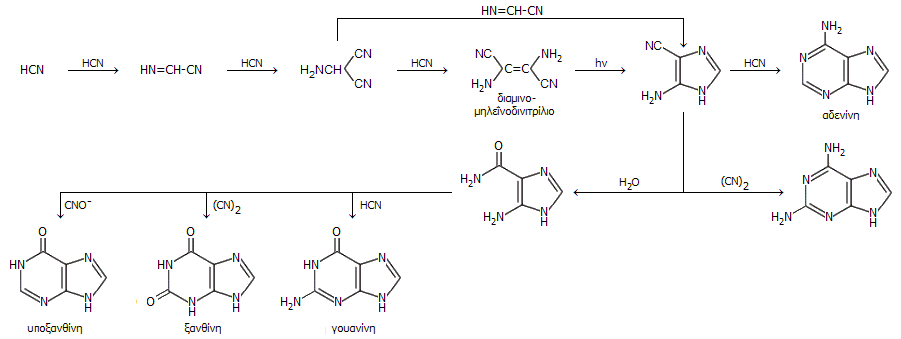
|
Ολιγομερισμός του υδροκυανίου οδηγεί σε μια ποικιλία πουρινών μεταξύ των οποίων οι νουκλεϊνικές βάσεις αδενίνη και γουανίνη (από το: Oró J." Mechanism of synthesis of adenine from hydrogen cyanide under possible primitive Earth conditions", Nature 191:1193-1194, 1961). |
Πειραματικά αποδείχθηκε πως το υδροκυάνιο δεν μπορεί να υποστεί ολιγομερισμό στις αραιές συγκεντρώσεις που θα βρισκόταν στους θερμούς αρχέγονους ωκεανούς. Ωστόσο, υπάρχει το ενδεχόμενο της συμπύκνωσής του μέσω ευτηκτικής κατάψυξης (eutectic freezing), οπότε, αν το υδροκυάνιο συμμετείχε στη δημιουργία ζωής, κάποιες περιοχές της Γης θα πρέπει να βρίσκονταν σε θερμοκρασίες κατάψυξης.
Το 2015, επιστήμονες του εργαστηρίου Μοριακής Βιολογίας του Παν/μίου του Cambridge (Patel et al.) ανακοίνωσαν σε επιστημονική δημοσίευσή τους, ότι έλυσαν το μυστήριο της έναρξης των αντιδράσεων για την προέλευση της ζωής στον πλανήτη Γη πριν από 4 δισεκατομμύρια χρόνια. Στην εργασία τους παρουσίασαν τις αντιδράσεις και τις πρώτες χημικές ενώσεις οι οποίες οδηγούν στη σύνθεση υδατανθράκων με 2 ή 3 άτομα άνθρακα, αμινοξέων και γλυκερόλης, ουσίες που είναι απαραίτητα βιοχημικά μόρια - βασικοί δομικοί λίθοι των πρωτεϊνών, ριβονουκλεοτιδίων, όπως και μόρια που σχηματίζουν λιποειδή και θα συνθέσουν αργότερα τις κυτταρικές μεμβράνες. Οι δομικοί λίθοι-μόρια κατά τους επιστήμονες ήταν το υδρόθειο και το υδροκυάνιο και η πρόσληψη ενέργειας από την υπεριώδη ακτινοβολία. Τονίζουν στην εργασία τους ότι τα μόρια αυτά βρίσκονται σε ήδη μετεωρίτες και η υπεριώδης ακτινοβολία είναι άφθονη στο ηλιακό σύστημα [Αναφ. 10θ-ια].
 |
 |
|
Η παγοκάλυψη του νότιου πόλου του Τρίτωνα [πηγή]. |
Ο στρόβιλος του νότιου πόλου του Τιτάνα [πηγή]. |
Το υδροκυάνιο στον διαστρικό χώρο [Αναφ. 11]
Το 1971 ανιχνεύθηκε για πρώτη φορά υδροκυάνιο σε νεφελώματα και στη μεσοαστρική ύλη, όπως και στην ατμόσφαιρα αστέρων άνθρακα. 'Εχουν πραγματοποιηθεί εκτεταμένες μελέτες ως προς τους τρόπους σύνθεσης υδροκυανίου στο διάστημα από αρχέγονες χημικές ενώσεις άνθρακα, υδρογόνου και αζώτου. Το υδροκυάνιο μπορεί να παρατηρηθεί και από επίγεια τηλεσκόπια στην υπέρυθρη περιοχή του φάσματος (infrared). Σχηματίζεται στα μεσοαστρικά νέφη με μία από δύο κύριες διεργασίες: της αντίδρασης ουδέτερων βραχύβιων σωματιδίων (1), ή της αντίδρασης αντιμετάθεσης φορτισμένων σωματιδίων με μεγάλες πιθανότητες σχηματισμού υδροϊσοκυανίου παράλληλα με τον σχηματισμό υδροκυανίου (2):
CH2
+ N
![]() HCN + H (1) HCNH+ + e-
HCN + H (1) HCNH+ + e-
![]() (HCN + HNC) + H (2)
(HCN + HNC) + H (2)
Το 2007, ανακοινώθηκε η ανίχνευση "πάγων" υδροκυανίου στον Τρίτωνα, τον μεγαλύτερο δορυφόρο του Ποσειδώνα, από τη διαστημοσυσκευή AKARI (διαστημικό τηλεσκόπιο για παρατηρήσεις στην υπέρυθρο περιοχή) με λεπτομερή εξέταση της φασματικής περιοχής 1,8-5,5 μm, περιοχή όπου βρίσκεται η απορρόφηση δόνησης τάσης του δεσμού C≡N στα 4,8 μm. Οι πάγοι υδροκυανίου μαζί με τους ήδη γνωστούς πάγους ύδατος, αζώτου, μεθανίου, διοξειδίου και μονοξειδίου του άνθρακα, φαίνεται να διαμορφώνουν την στερεά επιφάνεια του δορυφόρου. Πιθανώς το HCN είναι αποτέλεσμα προσκρούσεων ενεργητικών ηλεκτρονίων με μόρια CH4 και N2 στη στρατόσφαιρα του δορυφόρου, όπως είχε δειχθεί από παλαιότερα εργαστηριακά πειράματα.
Το 2012, παρατηρήσεις της διαστημοσυσκευής Cassini, έδειξαν ότι ο στρόβιλος του νοτίου πόλου του Τιτάνα (Titan South Pole Vortex), του μεγαλύτερου δορυφόρου του πλανήτη Κρόνου (ο μόνος δορυφόρος του ηλιακού συστήματος με πυκνή ατμόσφαιρα, κυρίως αζώτου), αποτελείται από σωματίδια παγωμένου υδροκυανίου και βρίσκεται σε ύψος 300 km από την επιφάνεια του Τιτάνα. 'Ετσι, το υδροκυάνιο συμμετέχει στους κύκλους εξάτμισης - κατακρήμνισης μαζί με τους διάφορους υδρογονάνθρακες, οι οποίοι κυκλοφορούν μεταξύ επιφάνειας και ατμοσφαίρας και πέφτουν σαν βροχή σχηματίζοντας λίμνες αποτελούμενες κυρίως από υγρό μεθάνιο και αιθάνιο (βλ. Χημική ένωση του μήνα: Μεθάνιο).
Η τοξικότητα του υδροκυανίου και τα χρησιμοποιούμενα αντίδοτα [Αναφ. 12]
 |
 |
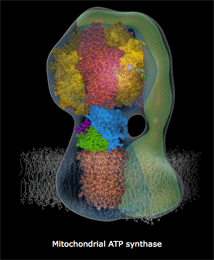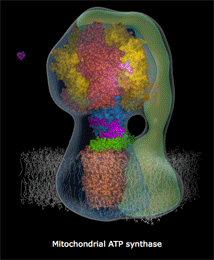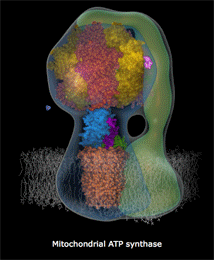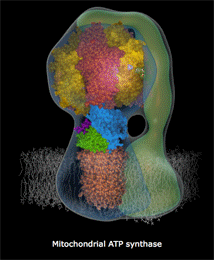
| Κινούμενο σχέδιο που δείχνει πως περίπου περιστρέφεται το τμήμα Fo της ATP-συνθάσης και παράγεται το ATP [πηγή]. Αυτή η εκπληκτική "μοριακή μηχανή" παύει να λειτουργεί σε περίπτωση δηλητηρίασης του οργανισμού από υδροκυάνιο και κυανιούχα άλατα. | |
Η μεγάλη τοξικότητα του υδροκυανίου και των κυανιούχων αλάτων οφείλεται στην εντονότατη συμπλεκτική δράση των ιόντων κυανίου, τα οποία συνδέονται σταθερά στον σίδηρο του ενζύμου κυτοχρωμική c οξειδάση (Cytochrome c oxidase), αναστέλλοντας τη λειτουργία του, καθιστώντας έτσι αδύνατη την "αναπνοή" των κυττάρων.
Σε αντίθεση με το υδροκυάνιο και τα κυανιούχα άλατα, τα οργανικά παράγωγα του υδροκυανίου, τα νιτρίλια (RCN), ως μη παρέχοντα ιόντα κυανίου είναι κατά πολύ λιγότερο τοξικά. Ωστόσο, τοξικά είναι τα οργανικά παράγωγα που υδρολύονται παρέχοντας υδροκυάνιο, όπως οι κυανοϋδρίνες.
Η κυτοχρωμική c οξειδάση (ή κυτόχρωμα c) είναι ένα διαμεμβρανικό (transmembrane) ένζυμο, το οποίο βρίσκεται στην εξωτερική μεμβράνη των μιτοχονδρίων και είναι το τελευταίο ένζυμο της αναπνευστικής αλυσίδας μεταφοράς ηλεκτρονίων. Κάθε μόριο ενζύμου παραλαμβάνει τέσσερα ηλεκτρόνια (ένα από κάθε μία υπομονάδα του) και τα αποδίδει σε ένα μόριο οξυγόνου (το οποίο μεταφέρεται από την αιμοσφαιρίνη), που μετατρέπεται έτσι σε δύο μόρια ύδατος:
Ο2 + 4Η+
+ 4e-
![]() 2H2O
2H2O
Η διαδικασία αυτή απαιτεί την πρόσληψη τεσσάρων πρωτονίων από την εσωτερική υδατική φάση των μιτοχονδρίων. Αυτό διαφοροποιεί τη συγκέντρωση των πρωτονίων μεταξύ των φάσεων, οι οποίες διαχωρίζονται από τη μιτοχονδριακή μεμβράνη και οδηγεί στην ανάπτυξη ενός ηλεκτροχημικού "δυναμικού μεμβράνης", που αποτελεί την "κινητήρια δύναμη" της λειτουργίας της ATP συνθάσης (ATP synthase) για τη σύνθεση μορίων ATP (5'-αδενοσινο-τριφωσφορικό οξύ).
Υπενθυμίζεται εδώ ότι τα μόρια ATP αποτελούν τα ενεργειακά "πακέτα", ένα είδος "ενεργειακών νομισμάτων", τα οποία τροφοδοτούν κάθε βιοχημική διαδικασία, που για την πραγματοποίησή καταναλίσκεται ενέργεια (βλ. Χημική ένωση του μήνα: 5'-Αδενοσινο-τριφωσφορικό οξύ (ATP)).
Η μεταφορά ηλεκτρονίων πραγματοποιείται μέσω του οξειδοαναγωγικού συστήματος Fe(II)/Fe(III) και συνοπτικά αποδίδεται με την αντίδραση:
![]()
Η σύνδεση του σιδήρου του ενζύμου με τα κυανιούχα καθιστά ανέφικτη την παραπάνω αντίδραση και επομένως τη λειτουργία της ATP συνθάσης, οπότε παύει η ενεργειακή τροφοδοσία κάθε βιοχημικής διεργασίας στα κύτταρα του οργανισμού και επιφέρει τον θάνατό τους.
|
Ποσότητα από 100 έως 150 mg κυανιούχου άλατος πρέπει να θεωρείται θανατηφόρα [πηγή]. |
Οξεία δηλητηρίαση. Εισπνοή αερίου υδροκυανίου ή η κατάποση κυανιούχων αλάτων ουσιαστικά καθιστά ανίκανο τον οργανισμό να προσλάβει οξυγόνο, προκαλεί κώμα με σπασμούς, άπνοια και επιφέρει τον θάνατο σε λίγα δευτερόλεπτα από καρδιακή ανακοπή. Αν ληφθούν μικρότερες ποσότητες προηγείται γενική αδυναμία, ίλιγγοι, κεφαλαλγία, σύγχυση και δύσπνοια. Ακολουθεί λιποθυμία, οι αναπνοές αυξάνουν σε συχνότητα αλλά γίνονται σύντομες, επέρχεται κώμα, ακολουθεί πνευμονικό οίδημα και τελικά καρδιακή ανακοπή.
Χαρακτηριστική είναι η κερασέρυθρη χρώση του δέρματος των θυμάτων δηλητηρίασης από κυανιούχα. Η χρώση αυτή είναι αποτέλεσμα αυξημένου κορεσμού οξυγονωμένης φλεβικής αιμοσφαιρίνης (λόγω μη κατανάλωσης του οξυγόνου της), ενώ δεν προκαλείται άμεση κυάνωση. Δηλαδή, ενώ το αρτηριακό αίμα καθίσταται πλούσιο σε οξυγόνο, αυτό δεν μπορεί να προσληφθεί από τα κύτταρα.
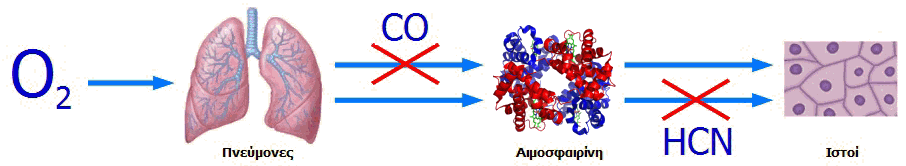
Η τοξική δράση του υδροκυανίου και των κυανιούχων ιόντων διαφέρει από εκείνη του μονοξειδίου του άνθρακα, αν και το τελικό αποτέλεσμα είναι το ίδιο: ο οργανισμός στερείται το οξυγόνο (ανοξία). Τα κυανιούχα δεν επιτρέπουν στους ιστούς την παραλαβή του οξυγόνου που μεταφέρει η αιμοσφαιρίνη, ενώ το μονοξείδιο του άνθρακα δεν επιτρέπει στην αιμοσφαιρίνη να παραλάβει οξυγόνο από τους πνεύμονες και να το μεταφέρει στους ιστούς (βλ. Χημική ένωση του μήνα: Μονοξείδιο του άνθρακα).
Η δόση LD50 του υδροκυανίου (δόση που προκαλεί το θάνατο στο 50% του εξεταζόμενου πληθυσμού) για τον άνθρωπο εκτιμάται στα 1,5 mg (ως CN) ανά kg σωματικού βάρους. Αντίστοιχα, η LD50 μετά δεκάλεπτη εισπνοή αέρα είναι 520 ppm (540 mg/m3).
Το υδρόθειο έχει κυρίως νευροτοξική δράση αλλά και δράση παρόμοια με εκείνη του υδροκυανίου και μάλιστα είναι τοξικότερο από το υδροκυάνιο, ωστόσο θεωρείται μικρότερης επικινδυνότητας από άποψη εργασιακής ασφάλειας, δεδομένου ότι γίνεται αντιληπτό σε υποχιλιoπλάσια συγκέντρωση στον αέρα, ενώ σε τοξικά επίπεδα η οσμή του είναι ανυπόφορη σε αντίθεση με εκείνη του υδροκυανίου.
|
Διαφορά τοξικής δράσης μονοξειδίου του άνθρακα και υδροκυανίου (ή κυανιούχων): Το μονοξείδιο του άνθρακα δεν επιτρέπει τη σύνδεση του οξυγόνου από τους πνεύμονες με την αιμοσφαιρίνη. Το υδροκυάνιο δεν επιτρέπει τη μεταφορά του οξυγόνου από την αιμοσφαιρίνη στα κύτταρα των ιστών. Και στις δύο περιπτώσεις το αποτέλεσμα είναι το ίδιο: κυτταρικός θάνατος λόγω ανοξίας. |
Χρόνια δηλητηρίαση. Τα κυανιούχα, σε αντίθεση με άλλες τοξικές ουσίες (π.χ. βαρέα μέταλλα, διοξίνες), δεν έχουν τάση συσσώρευσης στον οργανισμό. 'Εστω και εάν προσλαμβάνονται σε τακτική βάση σε μικρές ποσότητες, ο οργανισμός έχει την ικανότητα να τα "εξουδετερώνει" ταχύτατα με τη μετατροπή τους στα πολύ λιγότερο τοξικά θειοκυανικά ιόντα (20 φορές μικρότερης τοξικότητας), τα οποία αποβάλλονται με την ούρηση. 'Ετσι, ο άνθρωπος μπορεί να δέχεται καθημερινές ποσότητες 3 έως 5 mg κυανιούχων χωρίς κάποιο ιδιαίτερο πρόβλημα.
Χαρακτηριστική είναι η παρουσία αυξημένων συγκεντρώσεων θειοκυανικών ιόντων στον σίελο των καπνιστών, ως αποτέλεσμα της συνεχούς της αποτοξίνωσής του οργανισμού τους από το υδροκυάνιο, το οποίο προσλαμβάνεται κατά το κάπνισμα (10 έως 400 μg/τσιγάρο). Η συγκέντρωση των θειοκυανικών στον σίλεο είναι για τους μη καπνιστές ή περιπτωσιακούς καπνιστές 40 έως 50 μg SCN/mL, ενώ για τους τακτικούς καπνιστές είναι 80 έως 130 μg SCN/mL, δηλ. περίπου 2,5 φορές μεγαλύτερη. Μάλιστα, η μέτρηση των θειοκυανικών στον σίελο έχει προταθεί ως μέθοδος αντικειμενικής διαπίστωσης των καπνιστικών συνηθειών ενός ατόμου, όποτε τούτο χρειάζεται (π.χ. από ασφαλιστικές εταιρείες).
|
Για υψηλές συγκεντρώσεις HCN είναι απαραίτητη η χρήση προστατευτικής μάσκας που καλύπτει ολόκληρο το κεφάλι [πηγή]. |
Η μεταφορά θείου από πολυθειούχες ενώσεις (ενώσεις με δεσμό S-S, όπως π.χ. το αμινοξύ κυστίνη) προς τα κυανιούχα ιόντα με σχηματισμό θειοκυανικών ιόντων καταλύεται από το ένζυμο ροδανάση (rhodanese, "ροδανικά": παλαιά ονομασία των θειοκυανικών ιόντων). Η ροδανάση είναι ένα μιτοχονδριακό ένζυμο, μια μεταφοράση θείου (sulfur transferase), του οποίου ο ρόλος είναι ακριβώς η αποτοξίνωση του οργανισμού από τα ενδογενώς παραγόμενα κυανιούχα ιόντα, με βάση τη γενική αντίδραση:
![]()
Χρόνια έκθεση σε χαμηλά επίπεδα υδροκυανίου ή κυανιούχων (μέσω εισπνοής ή τροφής), μπορεί να οδηγήσει σε μια ποικιλία συμπτωμάτων μεταξύ των οποίων έχουν αναφερθεί: μόνιμη παράλυση, νευρικές βλάβες, υποθυρεοοειδισμό και αποβολές. Δεν έχουν διεξαχθεί συστηματικές μελέτες ως προς τη μεταλλαξιγόνο και καρκινογόνο δράση των κυανιούχων.
Όρια έκθεσης. Η παρουσία υδροκυανίου στον αέρα γίνεται αισθητή λόγω της χαρακτηριστικής οσμής του σε συγκεντρώσεις ακόμη και της τάξης του 1 ppm, συγκέντρωση η οποία δεν είναι τοξική (περίπου 1 mg/m3). Ωατόσο για γενετικούς λόγους, το 20 έως 40% του γενικού πληθυσμού έχει πολύ μειωμένη ευαισθησία στην οσμή του υδροκυανίου και δεν το αντιλαμβάνεται.
Μέγιστη επιτρεπτή έκθεση για 15-λεπτη έκθεση: 10 ppm. Συγκέντρωση, αμέσως επικίνδυνη για τη ζωή: 50 ppm. Η Διεύθυνση Επαγγελματικής Ασφάλειας και Υγείας των ΗΠΑ (Occupational Safety and Health Administration, OSHA) έχει θέσει τα 4,7 ppm (5 mg/m3) ως ανώτατη επιτρεπτή σταθμισμένη μέση τιμή (TWA). Ως παραμετρικό όριο κυανιούχων στο πόσιμο νερό έχει τεθεί η τιμή των 50 μg/L (οδηγία 98/83/EC).
 |
 |
|
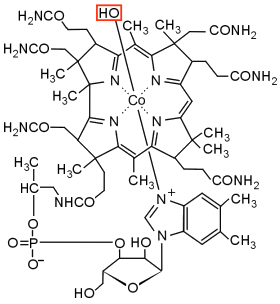
Αριστερά: Ο χημικός τύπος της υδροξυκοβαλαμίνης όπου φαίνεται το υδροξύλιο το οποίο αντικαθίσταται από το κυάνιο. Δεξιά: Το Cyanokit με τα περιεχόμενά του. Το αντίδοτο βρίσκεται σε δύο αμπούλες των 2,5 g η καθεμία [πηγή]. |
|
Αντίδοτα. 'Οποτε γίνεται χρήση υδροκυανίου και κυανιούχων αλάτων πρέπει τα ενδεικνυόμενα αντίδοτα να είναι αμέσως διαθέσιμα για την περίπτωση ατυχήματος. Η τοξική δράση των κυανιούχων είναι κεραυνοβόλος και δεν υπάρχουν χρονικά περιθώρια αναζήτησης αντιδότων ή ιατρικής βοήθειας την τελευταία στιγμή.
Πρέπει να σημειωθεί ότι ακόμη αν κάποιος σωθεί από τον θάνατο με τη χρήση αντιδότου, υπάρχει πάντοτε το ενδεχόμενο μόνιμης εγκεφαλικής βλάβης, εφόσον ο εγκέφαλος στερηθεί το οξυγόνο για σχετικώς μεγάλο χρονικό διάστημα, κάτι που ισχύει σε κάθε περίπτωση ασφυξίας.
Η χρήση προστατευτικής μάσκας που καλύπτει ολόκληρο το κεφάλι, εφοδιασμένη με ειδικά φίλτρα για το υδροκυάνιο είναι απαραίτητη για την είσοδο σε χώρους που υπάρχουν υψηλές συγκεντρώσεις υδροκυανίου.
Οι πλέον αποτελεσματικοί τρόποι αντιμετώπισης της δηλητηρίασης με κυανιούχα είναι:
(α) 'Ενας συνδυασμός ενδοφλέβιας χορήγησης νιτρώδους νατρίου (NaNO2) και μιας σχετικώς μεγαλύτερης ποσότητας θειοθειικών. Το πρώτο δεν είναι αβλαβές για τον οργανισμό και πρέπει η ποσότητά του να είναι ελεγχόμενη. Τα νιτρώδη οξειδώνουν τον Fe(II) της αιμοσφαιρίνης προς Fe(III) και έτσι μετατρέπουν την αιμοσφαιρίνη σε μεθαιμοσφαιρίνη, η οποία δεν μπορεί να μεταφέρει οξυγόνο στους ιστούς. Ωστόσο, επειδή ο Fe(III) σχηματίζει πολύ σταθερότερα σύμπλοκα με τα κυανιούχα σε σχέση με τον Fe(II), η μεθαιμοσφαιρίνη δρα ανταγωνιστικά και αποσπά τα κυανιούχα από το κυτόχρωμα c αποκαθιστώντας την κανονική λειτουργία του. Το θειοθειικό νάτριο (Na2S2O3) παρέχει το απαραίτητο υποστρωματικό θείο και διευκολύνει την ενζυματική μετατροπή των κυανιούχων σε θειοκυανικά, όπως αναφέρθηκε προηγουμένως, σύμφωνα με την αντίδραση:
![]()
Στο εμπόριο κυκλοφορεί κιτ "άμεσης χρήσης" αυτού του αντιδότου με την εμπορική ονομασία Nithiodote, εγκεκριμένο από την FDA των ΗΠΑ, το οποίο περιλαμβάνει δύο φιαλίδια με τα ακόλουθα διαλύματα: 10 mL με 300 mg NaNO2 και 50 mL με 12,5 g Na2S2O3 και με δύο σύριγγες για άμεση ενδοφλέβια χορήγηση.
(β) Με ενδοφλέβια έγχυση (βραδεία χορήγηση με ορό, infusion) διαλύματος υδροξυκοβαλαμίνης, μιας μορφής της βιταμίνης B12 στην οποία η μονάδα κυανίου που συνδέεται με το κοβάλτιο έχει αντικατασταθεί με υδροξύλιο. Με την εισαγωγή της στον οργανισμό η υδροξυκοβαλαμίνη αποσπά τα κυανιούχα από τα σημεία συνδεσής τους παρέχοντας την μη τοξική κυανοκοβαλαμίνη (βιταμίνη B12). Στο εμπόριο κυκλοφορεί κιτ "άμεσης χρήσης" αυτού του αντιδότου με την εμπορική ονομασία Cyanokit, στο οποίο περιλαμβάνεται φιαλίδιο με διάλυμα 5 g υδροξυκοβαλαμίνης και τα απαραίτητα μέσα ενδοφλέβιας χορήγησής του με έγχυση.
'Αλλα αντίδοτα είναι: η εισπνοή ατμών νιτρώδους αμυλεστέρα (C5H11ONO) και η 4-διμεθυλαμινοφαινόλη (4-DMAP) και τα δύο με δράση παρόμοια με εκείνη των νιτρωδών (προκαλούν μεθαιμοσφαιριναιμία), όπως και ένα σύμπλοκο κοβαλτίου(ΙΙ) με EDTA, το εδετικό δικοβάλτιο (dicobalt edate) με χημικό τύπο Co2(EDTA)(H2O)6, με δράση παρόμοια με εκείνη της υδροξυκοβαλαμίνης.
Το υδροκυάνιο και τα κυανιούχα άλατα ως μέσα μαζικών δολοφονιών [Αναφ. 13]
|
Υάλινες κάψουλες (Lethal Pill, LP) με πυκνό διάλυμα κυανιούχου άλατος [πηγή]. |
Μεταξύ όλων των χημικών ενώσεων, το υδροκυάνιο και τα κυανιούχα άλατα έχουν το θλιβερό προνόμιο να κατέχουν την πρώτη θέση ως μέσα μαζικών θανατώσεων και αυτοκτονιών.
Κυριαρχεί η φρικτή χρήση του υδροκυανίου για τη μαζική θανάτωση χιλιάδων κρατουμένων στα ναζιστικά στρατόπεδα συγκεντρώσεων κατά τον 2ο Παγκόσμιο Πόλεμο. Στους ονομαζόμενους "θαλάμους αερίων" (κατ' ευφημισμό: "θάλαμοι αποφθείρωσης") συνωστίζονταν εκατοντάδες κρατούμενοι και από τις οπές εξαερισμού της οροφής οι εκτελεστές έριχναν το εντομοκτόνο Zyklon B (υγρό υδροκυάνιο προσροφημένο σε γη διατόμων). Το υδροκυάνιο εξατμιζόταν στη σχετικά υψηλή θερμοκρασία των θαλάμων-εξολοθρευτηρίων προκαλώντας τον αργό και οδυνηρό θάνατο των εγκλεισμένων.
Ακολουθεί σε φρίκη, η θανάτωση (υποχρεωτική "αυτοκτονία") 900 οπαδών (το 1/3 μικρά παιδιά και βρέφη) της αίρεσης Peoples Temple (Ναός του Λαού) στην κοινότητά τους (καταυλισμός "Jonestown") στη ζούγκλα της Γουιάνας (Νότια Αμερική) το 1978, μετά από διαταγές του ημιπαράφρονα "πνευματικού" ηγέτη τους James Warren Jones.
Τα κυανιούχα άλατα αποτέλεσαν το μέσο επιλογής για την αυτοκτονία πλήθους ανώτατων ναζιστών αξιωματούχων του Γ' Ράιχ για να αποφύγουν τη σύλληψή τους μετά την ήττα των ναζιστικών δυνάμεων. Πολλοί από αυτούς αυτοκτόνησαν οικογενειακώς εξαναγκάζοντας σε αυτοκτονία (δηλ. δολοφονώντας) και τα ίδια τα μικρά παιδιά τους (περίπτωση Joseph Goebells).
Κατά την περίοδο του ονομαζόμενου Ψυχρού Πολέμου τα "χάπια αυτοκτονίας" (Lethal Pills, L-pills), υάλινες αμπούλες με πυκνό διάλυμα κυανιούχου καλίου, υπήρξαν το απαραίτητο εφόδιο στρατιωτικών (π.χ. πιλότων κατασκοπικών αεροπλάνων) και κατασκόπων, τα οποία θα έπρεπε να χρησιμοποιήσουν στην περίπτωση σύλληψής τους από τον εχθρό.
Πρέπει να σημειωθεί ότι το υδροκυάνιο ποτέ δεν κρίθηκε ως κατάλληλο για πολεμικό αέριο, επειδή είναι κατά τι ειδικώς ελαφρότερο από τον αέρα και θα διασκορπιζόταν ταχύτατα από τα πεδία μάχης. Αντίθετα, περιορισμένη χρήση ως πολεμικό αέριο είχε το παράγωγό του χλωροκυάνιο (cyanogen chloride, CK, με σ.ζ.=13ºC).
 |
 |
 |
|
Αριστερά: Θάλαμος αερίων του στρατοπέδου Auschwitz. Ο κυανός χρωματισμός των τοίχων οφείλεται στο κυανό της Πρωσίας που σχηματίστηκε με την αντίδραση μεταξύ του υδροκυανίου και των ιχνών σιδήρου του επιχρίσματος [πηγή]. Κέντρο: Η χαρακτηριστική ετικέτα του κάνιστρου με Zyklon B και δείγμα από το περιεχόμενό του (υδροκυάνιο προσροφημένο σε γη διατόμων) [πηγή]. Δεξιά: Σωρός χρησιμοποιημένων κάνιστρων Zyklon B που βρέθηκε στο στρατόπεδο του Auschwitz [πηγή]. |
||
|
'Οταν τα κυανιούχα "δεν δηλητηριάζουν": Η περίπτωση της δολοφονίας του Grigori Rasputin Ενδιαφέρουσα από χημική άποψη υπήρξε η περίπτωση χρήσης κυανιούχου καλίου (KCN) για τη δολοφονία του διαβόητου Ρώσου καλόγηρου και μυστικιστή θεραπευτή Grigori Yefimovich Rasputin (1869-1916).
Ο Rasputin είχε αποκτήσει την εύνοια της Τσαρίνας Αλεξάνδρας, πείθοντάς την ότι χάρις στις υπερφυσικές θεραπευτικές ικανότητες που διέθετε, ο ίδιος αποτελούσε τη μόνη ελπίδα θεραπείας για τον αιμορροφιλικό γιο της και διάδοχο του τσαρικού θρόνου (τσάρεβιτς) Αλέξιο. Η δυσμενής επίδραση του Rasputin τόσο στην Τσαρίνα, όσο και έμμεσα στον Τσάρο Νικολάο II (1868-1918), αλλά και στα πολιτικά πράγματα της χώρας, ανάγκασε τον Πρίγκιπα Felix Yusupof (1887-1967), ανηψιό του Τσάρου μαζί με άλλους ανθρώπους του αυτοκρατορικού περιβάλλοντος, να οργανώσουν τη δολοφονία του πανούργου καλόγηρου. Ο τρόπος δολοφονίας που επέλεξαν οι επίδοξοι δολοφόνοι του, ήταν η δηλητηρίασή του με KCN, το οποίο πράγματι του χορηγήθηκε μέσα σε ποτά και γλυκίσματα κατά τη διάρκεια ενός δείπνου, το οποίο οι συνωμότες οργάνωσαν "προς τιμήν του" στην Αγία Πετρούπολη. Η ποσότητα του KCN δεν είναι γνωστή, αλλά αναφέρεται ως "ικανή να σκοτώσει πολλούς ανθρώπους", δεδομένου ότι ήταν πασίγνωστη η θηριώδης σωματική αντοχή του Rasputin. Πανικόβλητοι οι συνωμότες διαπίστωσαν ότι παρά τη μεγάλη δόση KCN που ο Rasputin έλαβε με την τροφή και τα ποτά, δεν παρουσίαζε κάποιο σύμπτωμα δηλητηρίασης. Τελικά, αναγκάστηκαν να τον πυροβολήσουν επανειλημμένα, να τον χτυπήσουν και να τον ρίξουν στον παγωμένο ποταμό Νέβα. Είναι ασαφές το αν τελικά ο Rasputin σκοτώθηκε από τους πυροβολισμούς ή από πνιγμό. Ωστόσο, σίγουρα ο θάνατός του δεν οφειλόταν στο κυανιούχο άλας. Οι εκδοχές που δόθηκαν για την αντοχή του Rasputin προς το κυανιούχο άλας ήταν οι εξής:
(α) Το κυανιούχο
κάλιο που χρησιμοποιήθηκε μπορεί να ήταν "ξεθυμασμένο", δηλ.
φυλαγμένο σε όχι καλά σφραγισμένο φιαλίδιο, οπότε
μπορεί να είχε μετατραπεί εν μέρει ή ολικώς στο αβλαβές KHCO3
σύμφωνα με την αντίδραση: KCN + CO2
+ H2O
(β) Η κατανάλωση
μεγάλης ποσότητας γλυκών μπορεί να είχε ως αποτέλεσμα τη μερική δέσμευση
του HCN από τα σάκχαρα στη μορφή κυανυδρινών, σύμφωνα με την αντίδραση
προσθήκης: R-CHO + HCN
|