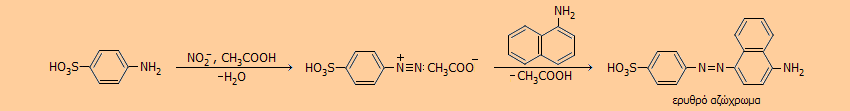Η ανιλίνη (aniline) (άλλες ονομασίες: φαινυλαμίνη, αμινοβενζόλιο, βενζεναμίνη) είναι η απλούστερη αρωματική αμίνη (ή αρυλαμίνη) και αποτελεί τη βασική πρώτη ύλη για τη σύνθεση πλήθους χημικών ουσιών στη χημική βιομηχανία, όπως χρώματα, φάρμακα, φυτοφάρμακα, εκρηκτικές ύλες, πολυμερή. Το 76% της παγκόσμιας παραγωγής της ανιλίνης το 2012 χρησιμοποιήθηκε για τη σύνθεση της ένωσης διισοκυανικού μεθυλενο-διφαινυλίου (methylene-diphenyl diisocyanate, MDI), που χρησιμοποιείται για τη σύνθεση πολυουρεθάνης και άλλων συνθετικών πολυμερών ευρύτατης χρησιμότητας. Η παγκόσμια ετήσια παραγωγή ανιλίνης φθάνει σχεδόν τα έξι εκατομμύρια τόνους.
 |
 |
 |
 |
|
Otto Unverdorben (1806-1873). Ο πρώτος που παρασκεύασε το 1826 ανιλίνη με θερμική διάσπαση του ινδικού και την ονόμασε "κρυσταλλίνη". |
Friedlieb Ferdinand Runge (1795-1867). Το 1834 παρέλαβε ανιλίνη από τη λιθανθρακόπισσα και την ονόμασε "κυανόλη". |
Nikolay Zinin (1812-1880). Παρασκεύασε το 1840 ανιλίνη με αναγωγή του νιτροβενζολίου με θειούχο αμμώνιο και την ονόμασε "βενζιδάμη". |
Carl Julius Fritzsche (1808-1871). Παρασκεύασε ανιλίνη το 1840 με απόσταξη ινδικού με KOH. Ονόμασε την νέα ουσία ανιλίνη. |
Το 1826, παρασκευάσθηκε για πρώτη φορά ανιλίνη σε μικρές ποσότητες ανιλίνης από τον χημικό Otto Unverdorben (1806-1873) με ξηρά (καταστροφική) απόσταξη του πολύτιμου φυσικού χρώματος ινδικό (indigo) [Otto Unverdorben "Ueber das Verhalten der organischen Körper in höheren Temperaturen" (Συμπεριφορά οργανικών ουσιών σε υψηλές θερμοκρασίες). Annalen der Physik und Chemie 8: 397-410, 1826].
Ο Unerdorben διαπίστωσε ότι το ελαιώδες υγρό που λαμβανόταν κατά την απόσταξη του ινδικού, κιτρίνιζε κατά την παραμονή στον αέρα, παρουσίαζε ιδιότητες ασθενούς βάσης και σχημάτιζε κρυσταλλικά άλατα με οξέα. Με βάση την τελευταία ιδιότητά της ονόμασε το υγρό αυτό κρυσταλλίνη (krystallin), χωρίς ωστόσο να μελετήσει περαιτέρω τις ιδιότητές της.
Το 1834, η ανιλίνη ανακαλύφθηκε εκ νέου από τον Γερμανό αναλυτικό χημικό Friedlieb Ferdinand Runge (1795-1867), ο οποίος είναι γνωστός κυρίως για την απομόνωση της καφεΐνης (βλ. Χημική ένωση του μήνα: Καφεΐνη), αλλά και ως ένας από τους πρωτεργάτες της χρωματογραφίας χάρτου.
Ο Runge πειραματιζόμενος με τα διάφορα κλάσματα της λιθανθρακόπισσας (coal tar) έλαβε με απόσταξη μια ελαιώδη ουσία (προφανώς ακάθαρτη ανιλίνη), η οποία μετά από αντίδραση χλωράσβεστο, παρείχε μια έντονα κυανή χρωστική ύλη. Ο Runge ονόμασε αυτήν την ελαιώδη ουσία κυανούν έλαιο ή κυανόλη (blue oil, Kyanol). Η νέα "πηγή" της ανιλίνης καθιστούσε εφικτή την παραγωγή της σε μεγαλύτερες ποσότητες σε αντίθεση με τις μικρές ποσότητες, που μπορούσαν να ληφθούν με θερμική διάσπαση του πολύτιμου ινδικού.
|
Δείγμα λιθανθρακόπισσας |
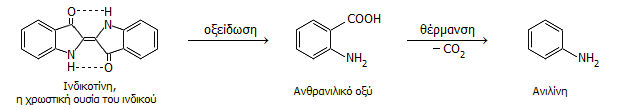
Το 1840, ο Γερμανός χημικός Carl Julius Fritzsche (1808-1871) απέσταξε ινδικό με καυστικό κάλιο και έλαβε την ίδια ελαιώδη ουσία, που είχε πρώτος ανακαλύψει ο Unverdoben λίγα χρόνια πριν. Ο Fritzsche ονόμασε την ουσία αυτή ανιλίνη από την πορτογαλική ονομασία του θαμνοειδούς φυτού του ινδικού añil. Με τη σειρά της, η πορτογαλική ονομασία προέρχεται από την αραβική ονομασία al-nil και την περσική nila του ίδιου φυτού, που και αυτές προέρχονται από τη σανσκριτική nilah: σκούρο μπλε χρώμα. Η αντίδραση διάσπασης της ινδικοτίνης (η φυσική χρωστική του ινδικού) κατά την οξειδωτική θέρμανση με ισχυρή βάση έχει περίπου ως εξής:
To 1840, o Fritzsche σε συνεργασία με τον Ρώσο χημικό Nikolay Zinin (1812-1880) στο εργαστήριό τους στο Πανεπιστήμιο του Kazan, έδειξαν ότι η ουσία που είχε παρασκευάσει ο Zinin με αναγωγή του νιτροβενζολίου με θειούχο αμμώνιο και είχε ονομάσει βενζιδάμη (benzidam), ήταν η ανιλίνη. Η αντίδραση αναγωγής των αρωματικών νιτροενώσεων με θειούχα άλατα είναι γενικής εφαρμογής και αναφέρεται στη βιβλιογραφία ως αντίδραση Zinin:
C6H5NΟ2
+ 3
H2S
![]() C6H5NH2 + 3
S + 2
H2O
C6H5NH2 + 3
S + 2
H2O
Το 1843, ο διάσημος Γερμανός χημικός August Wilhelm von Hofmann (1818-1892), βοηθός τότε του διάσημου Justus von Liebig (1803-1873), έδειξε ότι οι ουσίες που ανακάλυψαν οι Unverdorben, Runge και Fritzsche ήταν η ίδια ουσία και καθιέρωσε την ονομασία της ως "ανιλίνη". Επιπλέον, ο Hofmann παρουσίασε έναν εύκολο τρόπο σύνθεσης της ανιλίνης που βασιζόταν στην αναγωγή του νιτροβενζολίου με ψευδάργυρο και υδροχλωρικό οξύ και μελέτησε εκτενέστερα τη χημεία της:
C6H5NΟ2
+ 3 Zn + 6 HCl
![]() C6H5NH2 + 3
ZnCl2 + 2
H2O
C6H5NH2 + 3
ZnCl2 + 2
H2O
 |
 |
 |
|
Μετά την έναρξη της παραγωγής και διάθεσης συνθετικού ινδικού (αρχές 20ου αιώνα), αναπόφευκτα κατέρρευσαν οι οικονομίες πολλών περιοχών της Ινδίας και άλλων ασιατικών χωρών που βασίζονταν στην παραγωγή φυσικού ινδικού. Αριστερά: Το θαμνοειδές φυτό "ινδικό" ( Indigofera tinctoria) [πηγή]. Κέντρο: Παραλαβή της χρωστικής του ινδικού από το φυτό "ινδικό" από χωρική της Ταϋλάνδης [πηγή]. Δεξιά: Τεμάχια καθαρής χρωστικής του ινδικού [πηγή]. Η πρώτη μικρή ποσότητα ανιλίνης ελήφθη με ξηρά απόσταξη αυτής της χρωστικής. |
||

|
Απεικόνιση του εργαστηρίου του Justus von Liebig στην Giessen, γύρω στο 1840. Από το εργαστήριο αυτό πέρασαν πολλοί μετέπειτα διάσημοι χημικοί, όπως ο Augustus von Hofmann (άκρη δεξιά με το ψηλό καπέλο), μαθητής του οποίου υπήρξε ο William Henry Perkin, ο πατέρας της χημείας των οργανικών χρωμάτων. [Πηγή: Zvi Rapport: "The Chemistry of Anilines", Interscience Publications, 2007, p. 4]. |
 |
 |
| Πρώιμοι αντιδραστήρες νίτρωσης του βενζολίου (αριστερά) και αναγωγής του νιτροβενζολίου προς ανιλίνη (δεξιά). [Πηγή: Zvi Rapport: "The Chemistry of Anilines", Interscience Publications, 2007, p. 10] | O William Henry Perkin (1838-1907), ο πατέρας της χημείας των συνθετικών χρωμάτων, σε ηλικία 22 ετών (είχε ήδη ανακαλύψει τη μωβεΐνη). |
|
Antoine Béchamp (1816-1908). Ο Γάλλος χημικός και βιολόγος. Το 1854 ξεκίνησε τη βιομηχανική παραγωγή ανιλίνης σε ποσότητες τόνων. |
Παρασκευή της ανιλίνης
Εργαστηριακή σύνθεση [Αναφ. 2]. Η σύνθεση της ανιλίνης είναι απλή και συνηθίζεται ως μια εργαστηριακή άσκηση στα πανεπιστημιακά εργαστήρια Οργανικής Χημείας. Βασίζεται στην αναγωγή του νιτροβενζολίου (που παράγεται με νίτρωση του βενζολίου) συνήθως με μεταλλικό κασσίτερο παρουσία περίσσειας πυκνού υδροχλωρικού οξέος. Ο κασσίτερος οξειδώνεται μέχρι και της τετρασθενούς κατάστασής του. Η αντίδραση είναι εξώθερμη και απαιτείται προσεκτικός έλεγχος της θερμοκρασίας. Στο προϊόν της αντίδρασης (εξαχλωροκασσιτερικό άλας της ανιλίνης) προστίθεται περίσσεια ισχυρής βάσης για να απελευθερωθεί η ανιλίνη. Οι αντιδράσεις μπορούν να αποδοθούν από τις ακόλουθες χημικές εξισώσεις:
2 C6H5NO2
+ 3 Sn + 18 HCl
![]() [C6H5NH3+]2[SnCl62-]
+ 2 H2SnCl6 + 4 H2O
[C6H5NH3+]2[SnCl62-]
+ 2 H2SnCl6 + 4 H2O
[C6H5NH3+]2[SnCl62-]
+ 8 NaOH
![]() 2 C6H5NH2 + Na2SnO3
+ 6 NaCl + 5 H2O
2 C6H5NH2 + Na2SnO3
+ 6 NaCl + 5 H2O
|
Η ανιλίνη αποκτά ένα υποκίτρινο χρώμα κατά την έκθεσή της στο φως και στον αέρα. |
Το 95% της παραγωγής του νιτροβενζολίου, ενός υποκίτρινου και τοξικού υγρού (σ.ζ. 211ºC), χρησιμοποιείται για τη σύνθεση της ανιλίνης. |
Ο κασσίτερος μπορεί να αντικατασταθεί από τον φθηνότερο σίδηρο (σε ρινίσματα). Η αντίδραση (αναγωγή Béchamp) απαιτεί μικρή ποσότητα υδροχλωρικού οξέος για να ξεκινήσει, στη συνέχεια όμως η ταχύτητά της ελέγχεται με τη σταδιακή προσθήκη νιτροβενζολίου. Η κυρίως αντίδραση μπορεί να αποδοθεί από την ακόλουθη χημική εξίσωση:
C6H5NO2
+ 2 Fe + 4 H2O
![]() C6H5NH2 + 2 Fe(OH)3
C6H5NH2 + 2 Fe(OH)3
Η ανιλίνη παραλαμβάνεται από τα υπόλοιπα προϊόντα της αντίδρασης με απόσταξη με υδρατμούς ή με εκχύλιση με αιθέρα. Το αιθερικό διάλυμα της ανιλίνης ξηραίνεται με στερεό ΚΟΗ, ο αιθέρας εξατμίζεται και η ανιλίνη λαμβάνεται με απόσταξη (184ºC).
Η ανιλίνη αποκτά σταδιακά ένα κιτρινωπό χρώμα (οφειλόμενο σε ίχνη προϊόντων οξείδωσής της), ιδιαίτερα όταν εκτίθεται στο φως και στον αέρα. Πολυκαιρισμένη ανιλίνη μπορεί να απαλλαγεί από το χρώμα αυτό με απόσταξή της παρουσία μικρής ποσότητας σκόνης ψευδαργύρου.
Βιομηχανική σύνθεση. Η παλαιότερη βιομηχανική μέθοδος σύνθεσης της ανιλίνης βασιζόταν στην αναγωγή του νιτροβενζολίου με μίγμα σίδηρου - διχλωριούχου σιδήρου οφείλεται στον Γάλλο χημικό και βιολόγο Antoine Béchamp (1816-1908), περισσότερο διάσημο για την επιστημονική αντιπαλότητά του με τον Pasteur. To 1854, o Béchamp οργάνωσε μια μικρή βιομηχανική μονάδα παραγωγής ανιλίνης με βάση τη μέθοδό του. Σήμερα, η μέθοδος Béchamp έχει αντικατασταθεί ολοκληρωτικά από την καταλυτική υδρογόνωση του νιτροβενζολίου σε αέρια φάση (καταλύτης: Ni και άλλα μέταλλα).
Η σύνθεση του νιτροβενζολίου βασίζεται στην ελεγχόμενη νίτρωση του βενζολίου με το ονομαζόμενο "μικτό οξύ νίτρωσης" (μίγμα πυκνών H2SO4 - HNO3), όπου το ενδιάμεσο δραστικό σωματίδιο είναι το πανίσχυρο κατά Lewis οξύ NO2+ [Αναφ. 1β]:
![]()
Οι παραπάνω αντιδράσεις είναι ισχυρώς εξώθερμες (-536,6 ± 5,9 kJ/mole [Αναφ. 3γ]) και απαιτείται προσεκτικός έλεγχος της θερμοκρασίας των χημικών αντιδραστήρων, όπως και αξιοποίηση της εκλυόμενης θερμότητας για μείωση του κόστους της παραγωγής.
|
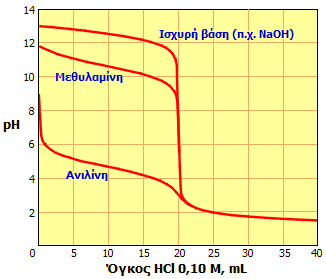
Σύγκριση καμπυλών ογκομέτρησης 20,0 mL υδατικού διαλύματος βάσης 0,10 M με υδατικό διάλυμα HCl 0,10 M. Είναι προφανές ότι η ανιλίνη δεν παρέχει σαφές ισοδύναμο σημείο. Οι καμπύλες ελήφθησαν υπολογιστικά με το applet που βρίσκεται σε αυτήν την ιστοσελίδα. |
Σε εργαστηριακή κλίμακα η υδρογόνωση του νιτροβενζολίου μπορεί να πραγματοποιηθεί σε σχετικά χαμηλές θερμοκρασίες και πιέσεις (50-60ºC, 2-6 bar), αν χρησιμοποιηθεί ως καταλύτης άνθρακας με 5% Pd. Αναφέρεται η πιθανότητας παραγωγής σχετικά ασταθών ενδιάμεσων προϊόντων, όπως η φαινυλοϋδροξυλαμίνη (C6H5NHOH), των οποίων η διάσπαση μπορεί να προκαλέσεις απότομες αυξήσεις της θερμοκρασίας και εκρήξεις [Αναφ. 3].
Μια βιομηχανική μέθοδος, η οποία εφαρμόζεται σε πολύ περιορισμένη κλίμακα, βασίζεται στην αντίδραση αμμωνίας με χλωροβενζόλιο ή φαινόλη:
C6H5Cl + 2NH3
![]() C6H5NH2
+ NH4Cl C6H5ΟΗ + NH3
C6H5NH2
+ NH4Cl C6H5ΟΗ + NH3
![]() C6H5NH2
+ Η2Ο
C6H5NH2
+ Η2Ο
Χημικές ιδιότητες της ανιλίνης [Αναφ. 4]
Η ανιλίνη είναι μια πρωτοταγής οργανική αμίνη και επομένως αναμένεται να δρα ως ασθενής βάση. Επίσης, αναμένεται να δίνει αρκετές από τις χαρακτηριστικές αντιδράσεις που παρέχουν και οι αλειφατικές πρωτοταγείς αμίνες, αλλά δεν ταυτοποιείται πλήρως με αυτές, λόγω της άμεσης σύνδεσης της αμινικής ομάδας με τον αρωματικό δακτύλιο.
Η ανιλίνη ως ασθενής βάση. Η ανιλίνη είναι μια ασθενέστατη οργανική βάση με pKb = 9,3, δηλ. είναι κατά 6 περίπου τάξεις μεγέθους ασθενέστερη βάση από την απλούστερη αλειφατική πρωτοταγή αμίνη, τη μεθυλαμίνη (CH3NH2) με pKb = 3,4. Σε υδατικά διαλύματα διίσταται σε μικρό βαθμό παρέχοντας ασθενέστατα βασικό διάλυμα (το pH υδατ. διαλύματος 0,2 Μ είναι μόλις 8,1) σύμφωνα με την εξίσωση:
C6H5NH2
+ H2O
![]() C6H5NH3+ + OH-
C6H5NH3+ + OH-
Οι ασθενέστατες βασικές ιδιότητες της ανιλίνης γίνονται πρόδηλες και με σύγκριση της καμπύλης ογκομέτρησης (pH ως προς όγκο προστιθέμενου τιτλοδότη) υδατικού διαλύματός της με ισχυρό οξύ, με τις αντίστοιχες καμπύλες υδατικών διαλυμάτων μεθυλαμίνης και μιας ισχυρής βάσης (αριστερά). Το ασθενέστατο (όχι απότομο) ισοδύναμο σημείο που παρέχει η ανιλίνη, ουσιαστικά αποκλείει τον ακριβή προσδιορισμό της σε υδατικά διαλύματα με οξεοβασική ογκομέτρηση.
Ως βάση, η ανιλίνη σχηματίζει απομονώσιμα κρυσταλλικά υδατοδιαλυτά άλατα με ισχυρά και μη οξέα. Το κατιόν της ανιλίνης αναφέρεται στη βιβλιογραφία ως ανιλίνιο (anilinium cation) και τα άλατά του αναφέρονται ως "άλατα του ανιλινίου" π.χ.
C6H5NH2 + HCl
![]() C6H5NH3+Cl-
(υδροχλωρικό ανιλίνιο) 2
C6H5NH2 + H2SO4
C6H5NH3+Cl-
(υδροχλωρικό ανιλίνιο) 2
C6H5NH2 + H2SO4
![]() (C6H5NH3+)2SO42-
(C6H5NH3+)2SO42-
Υδατικά διαλύματα των παραπάνω αλάτων είναι αρκετά όξινα λόγω της έντονης υδρόλυσής τους. Για παράδειγμα, υδατικό διάλυμα του υδροχλωρικού άλατος της ανιλίνης έχει οξύτητα σχεδόν ίση με εκείνη ισομοριακού υδατικού διαλύματος οξικού οξέος.
|
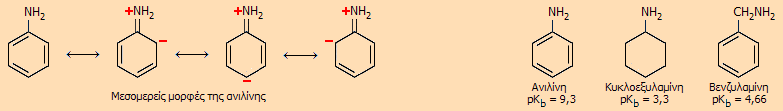
Γιατί οι αρωματικές αμίνες είναι ασθενέστερες βάσεις σε σχέση με τις αλειφατικές; [Αναφ. 4] Συχνά τίθεται το ερώτημα: Γιατί οι αρωματικές αμίνες είναι κατά πολλές τάξεις μεγέθους ασθενέστερες βάσεις σε σχέση με τις αλειφατικές αμίνες; Η απάντηση είναι απλή. Η ισχύς μιας γενικής βάσης κατά Lewis εξαρτάται από το κατά πόσο μπορεί να διαθέσει εύκολα το μονήρες ζεύγος ηλεκτρονίων της. Στην περίπτωση των αμινών το μονήρες ζεύγος ηλεκτρονίων διατίθεται από το άζωτο και όσο μεγαλύτερη η πυκνότητα του αρνητικού φορτίου στο άζωτο, τόσο ισχυρότερη βάση είναι η αμίνη.
Στην περίπτωση της ανιλίνης το μονήρες ζεύγος του αζώτου της αμινικής ομάδας "απορροφάται" από το σύστημα των π-ηλεκτρονίων του αρωματικού δακτυλίου και η διαθεσιμότητά του προς ένα κατά Lewis οξύ (όπως π.χ. το ιόν υδροξωνίου) είναι συγκριτικά εξαιρετικά περιορισμένη. Η αλληλεπίδραση του ζεύγους ηλεκτρονίων με τα π-τροχιακά, σταθεροποιεί με μεσομέρεια το μόριο της ανιλίνης, γεγονός που την καθιστά εξαιρετικά "απρόθυμη" να δράσει ως βάση. Επιπλέον, η διαθεσιμότητά του μονήρους ζεύγους περιορίζεται και για στερεοχημικούς λόγους. Είναι χαρακτηριστικό το ότι η κυκλοεξυλαμίνη, C6H11NH2, η οποία δεν διαθέτει αρωματικό δακτύλιο, έχει pKb ίσο προς 3,30, δηλαδή είναι κατά 1 εκατομμύριο φορές ισχυρότερη βάση σε σχέση με την ανιλίνη. Αντίστοιχα, η βενζυλαμίνη, C6H5CH2NH2, η οποία διαθέτει αρωματικό δακτύλιο, αλλά σε κάποια απόσταση από την αμινική ομάδα (μεσολαβεί η ομάδα -CH2-) έχει pKb ίσο προς 4,66, δηλαδή είναι 44.000 φορές ισχυρότερη βάση σε σχέση με την ανιλίνη. 'Ετσι, η ανιλίνη είναι ασθενέστατη βάση με pKb = 9,3, κατά πολύ ασθενέστερη από τις αντίστοιχες αλειφατικές αμίνες, όπως π.χ. την απλούστερη αλειφατική πρωτοταγή αμίνη, τη μεθυλαμίνη (CH3NH2) με pKb = 3,4). Υδατικά διαλύματα 0,10 Μ ανιλίνης και μεθυλαμίνης, έχουν αντίστοιχα pH 8,8 το πρώτο και 11,8 το δεύτερο.
Η επίδραση του αρωματικού δακτυλίου είναι εμφανέστερη στην περίπτωση της σύνδεση του αζώτου με ένα δεύτερο και πολύ περισσότερο και με ένα τρίτο αρωματικό δακτύλιο (φαινύλια). Ουσιαστικά, τα επιπλέον φαινύλια εξαλείφουν πλήρως τη δυνατότητα στο άζωτο της αμινομάδας να προσφέρει το μονήρες ζεύγος ηλεκτρονίων και να δράσει ως βάση. 'Ετσι, η pKb της διφαινυλαμίνης, C6H5NHC6H5, είναι 13,2, ενώ της τριφαινυλαμίνης (C6H5)3N είναι 19 (ουσιαστικά δεν είναι βάση). Επίδραση υποκαταστατών. Γενικά, υποκαταστάτες στον βενζολικό δακτύλιο της ανιλίνης που είναι δότες ηλεκτρονίων (π.χ. -CH3, -ΟΗ, -NH2, -OCH3), αυξάνουν τη διαθεσιμότητα του ζεύγους ηλεκτρονίων του αζώτου της αμινικής ομάδας και καθιστούν την ανιλίνη κάπως ισχυρότερη βάση. Αντίθετα, υποκαταστάτες που είναι δέκτες ηλεκτρονίων (π.χ. -Cl, -CN, -NO2) μειώνουν τη διαθεσιμότητα του ζεύγους ηλεκτρονίων και καθιστούν την ανιλίνη ακόμη ασθενέστερη βάση. Για παράδειγμα, οι νιτρο-ανιλίνες είναι κατά 2-4 τάξεις μεγέθους ασθενέστερες βάσεις σε σχέση με την ανιλίνη (τιμές pKb των ο-, m- και p- νιτροανιλινών: 13,7, 11,6 και 13,0, αντίστοιχα). |
Αντιδράσεις ανιλίνης
Αντιδράσεις παρόμοιες με εκείνες των αλειφατικών αμινών. Η ανιλίνη παρέχει αρκετές τυπικές αντιδράσεις των πρωτοταγών αμινικών ενώσεων. 'Ετσι, παρέχει, όπως και οι αλειφατικές πρωτοταγείς αμίνες, την αντίδραση ισονιτριλίου (ή καρβυλαμίνης) κατά τη θέρμανσή της με χλωροφόρμιο σε ισχυρώς αλκαλικό περιβάλλον (βλ. Χημική ένωση του μήνα: Χλωροφόρμιο). Λόγω της εξαιρετικά έντονης και δυσάρεστης οσμής του ισονιτριλίου, η αντίδραση αυτή είναι κατάλληλη για την εύκολη ανίχνευση (γενικά) των πρωτοταγών αμινών (αλειφατικών και αρωματικών):
![]()
Με διθειάνθρακα και περίσσεια αμμωνίας παρέχει φαινυλοδιθειοκαρβαμιδικό αμμώνιο, το οποίο κατά τη θέρμανσή του με άλατα μολύβδου (τα οποία αποσπούν H2S) παρέχει ισοθειοκυανικό φαινύλιο (υγρό, σ.ζ. 221ºC ή 121ºC/35 mm Hg):
![]()
'Οπως και οι αλειφατικές πρωτοταγείς αμίνες, η ανιλίνη ακυλιώνεται εύκολα με τα κοινά ακυλιωτικά μέσα (ανυδρίτες οξέων, ακυλοχλωρίδια). 'Ετσι, η ανιλίνη αντιδρά με οξικό ανυδρίτη παρουσία ισχυρού οξέος (HCl) παρέχοντας ακετανιλίδιο (στερεό, σ.τ. 114ºC), το οποίο παλαιότερα είχε χρησιμοποιηθεί ως αντιπυρετικό φάρμακο εγκαταλείφθηκε όμως λόγω της τοξικότητάς του. Η ακετυλίωση μπορεί να πραγματοποιηθεί σχετικώς εύκολα και με περίσσεια οξικού οξέος, αρκεί να υπάρχει η δυνατότητα απομάκρυνσης του παραγόμενου ύδατος κατά την αντίδραση:
![]()
Αντιδράσεις χαρακτηριστικές των αρωματικών αμινών. Η ανιλίνη αντιδρά απευθείας με χλώριο ή βρώμιο παρέχοντας 2,4,6-τριαλογονοπαράγωγο. Ειδικά η αντίδρασή της με βρώμιο προς 2,4,6-τριβρωμο-ανιλίνη είναι χαρακτηριστική, ταχύτατη και πραγματοποιείται και σε αραιά υδατικά διαλύματα των αντιδρώντων, οπότε καθιζάνει λευκό ίζημα του τριβρωμοπαραγώγου:
![]()
Με ακετυλίωση προστατεύεται η αμινομάδα της ανιλίνης και μπορεί να υποστεί μια σειρά αντιδράσεων αντικατάστασης, που είναι αδύνατον να πραγματοποιηθούν απ' ευθείας στην ελεύθερη ανιλινή. Τυπικά παραδείγματα αποτελούν οι παρασκευές p-βρωμο-ανιλίνης και p-νιτρο-ανιλίνης, όπου είναι απαραίτητο να προηγηθεί η προστασία της αμινομάδας με ακετυλίωση, πριν ακολουθήσει η βρωμίωση ή η νίτρωση. Στις περιπτώσεις αυτές, λόγω στερεοχημικής παρεμπόδισης της ακετυλαμινομάδας, η ποσότητα του σχηματιζόμενου ο-ισομερούς είναι περιορισμένη. Στη συνέχεια η προστατευτική ακετυλομάδα απομακρύνεται με όξινη ή αλκαλική υδρόλυση:
|
Peter Griess (1829-1888). Ανακάλυψε την αντίδραση διαζώτωσης και τη χρησιμότητά της για τη σύνθεση συνθετικών χρωμάτων. |
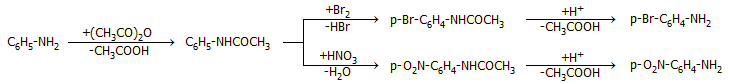
Η πλέον χαρακτηριστική και χρήσιμη αντίδραση της ανιλίνης, αλλά και των άλλων αρωματικών αμινών, είναι η αντίδραση διαζώτωσης (diazotization reaction) με σχηματισμό διαζωνιακών αλάτων. Η διαζώτωση πραγματοποιείται με αντίδραση της αρωματικής αμίνης με νιτρώδες οξύ (HNO2), το οποίο παράγεται επιτόπου με αντίδραση νιτρώδους άλατος με ισχυρό οξύ. Συνήθως, η αντίδραση (αρωματική αμίνη + οξύ + νιτρώδες άλας) πραγματοποιείται σε χαμηλές θερμοκρασίες (τυπικά: 0-5ºC) για να αποφευχθεί η υδρόλυση του διαζωνιακού άλατος, προς σχηματισμό φαινόλης. Ωστόσο, ορισμένες ασθενέστατα βασικές αρωματικές αμίνες (νιτροανιλίνες, ναφθυλαμίνες) μπορούν να διαζωτωθούν και σε συνήθεις θερμοκρασίες [Αναφ. 5]:
![]()
Τα διαζωνιακά άλατα είναι κατά κανόνα ασταθή σε υψηλότερες θερμοκρασίες και παρουσιάζουν μια τάση να αποβάλουν το άζωτό τους ως N2, υδρολυόμενα προς την αντίστοιχη υδροξυ-ένωση (φαινόλη). Στη στερεή κατάσταση είναι κατά κανόνα ασταθή και μπορεί να διασπασθούν εκρηκτικά. 'Εχουν αναφερθεί ατυχήματα και θάνατοι χειριστών σε βιομηχανίες χρωμάτων από εκρήξεις κρυσταλλωμένων διαζωνιακών αλάτων. Ευτυχώς, σχεδόν ποτέ δεν χρειάζεται η απομόνωση των διαζωνιακών αλάτων σε στερεή κατάσταση, αφού τις περισσότερες αντιδράσεις τους τις δίνουν με ασφάλεια στο διάλυμά τους αμέσως μετά την παρασκευή τους, ωστόσο απαιτείται προσοχή για να αποφευχθεί κάποια αιφνίδια κρυστάλλωση των αλάτων αυτών.
Η αντίδραση της διαζώτωσης ανακαλύφθηκε από τον Γερμανό χημικό Peter Griess (1829-1888) το 1858. Ο Griess μελέτησε διεξοδικά τις ιδιότητές των διαζωνιακών αλάτων και ανακάλυψε πολλές από τις αντιδράσεις τους και ιδιαίτερα τον σχηματισμό αζωχρωμάτων (azochromes), καθιερώνοντας την ανιλίνη και πολλές άλλες αρωματικές αμίνες ως πρώτες ύλες στη βιομηχανία συνθετικών χρωμάτων.
Τα διαζωνιακά άλατα είναι ιδιαίτερα δραστικές χημικές ενώσεις και μέσω αυτών η αρωματική αμινομάδα μπορεί να αντικατασταθεί με διάφορες άλλες μονάδες, ορισμένες από τις οποίες είναι αδύνατον να εισαχθούν άμεσα στον βενζολικό δακτύλιο. Στο επόμενο σχήμα δείχνεται συνοπτικά μια σειρά αντιδράσεων και των αντίστοιχων προϊόντων, τα οποία μπορούν να προκύψουν από την ανιλίνη μέσω του σχηματισμού του διαζωνιακού άλατός της. Ο σχηματισμός των αναφερόμενων προϊόντων συνοδεύεται από την έκλυση αερίου αζώτου. Τονίζεται ότι οι αντιδράσεις αυτές δεν αφορούν μόνο την ανιλίνη, αλλά στη θέση της μπορεί να είναι σχεδόν κάθε άλλη αρωματική αμίνη:
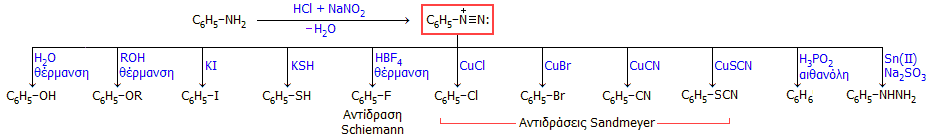
- Θέρμανση του διαζωνιακού άλατος με ύδωρ ή αλειφατική αλκοόλη παρέχει φαινόλη ή τον αντίστοιχο αιθέρα της φαινόλης.
|
Traugott Sandmeyer (1854 - 1922). Ελβετός χημικός γνωστός για την ομώνυμη αντίδραση των διαζωνιακών αλάτων, αλλά και για ένα νέο τρόπο σύνθεσης ινδικού. |
- Αντίδραση του διαζωνιακού άλατος με υδατικό διάλυμα ιωδιούχου άλατος παρέχει ιωδοβενζόλιο. Αυτός είναι ο πιο απλός εισαγωγής ιωδίου στον βενζολικό πυρήνα, αφού άμεση αντίδραση του βενζολίου με ιώδιο δεν είναι εφικτή, σε αντίθεση με την δυνατότητα άμεσης αντίδρασής του με χλώριο και βρώμιο. Ανάλογα παρασκευάζεται και η δυσώδους οσμής θειοφαινόλη.
- Θερμική διάσπαση του δυσδιάλυτου και εύκολα απομονώσιμου τετραφθοριοβορικού διαζωνιακού άλατος παρέχει φθοροβενζόλιο (αντίδραση Schiemann). Η αντίδραση αυτή αποτελεί έναν ήπιο και ελεγχόμενο τρόπο εισαγωγής φθορίου στον βενζολικό πυρήνα, αφού η άμεση αντίδραση του φθορίου με το βενζόλιο (όπως και με κάθε άλλη οργανική ένωση) είναι εκρηκτική και δεν μπορεί να ελεγχθεί ως προς τα προϊόντα της.
![]()
- Στις αντιδράσεις Sandmeyer (1884) χρησιμοποιούνται ως καταλύτες τα δυσδιάλυτα άλατα του Cu(I), CuX με αλογόνα (X: -Cl, -Br) ή ψευδαλογόνα (X: -CN, -SCN) για την αντικατάσταση της αμινομάδας του αρωματικού δακτυλίου με την ομάδα Χ:
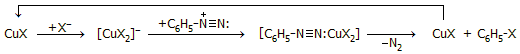
- Θέρμανση του διαζωνιακού άλατος με το ισχυρότατο αναγωγικό υποφωσφορώδες οξύ (ή φωσφινικό οξύ, H3PO2) ή με αιθανόλη οδηγεί στην πλήρη απομάκρυνση της διαζωτικής ομάδας και επανασχηματισμό του βενζολίου. Η αντίδραση μπορεί να αξιοποιηθεί για τη σύνθεση του 1,3,5-τριβρωμοβενζολίου μετά από διαζώτωση της 2,4,6-τριβρωμο-ανιλίνης.
- 'Ηπια αναγωγή των διαζωνιακών αλάτων με θειώδη άλατα ή άλατα του Sn(II) παρέχει τις αντίστοιχες υδραζίνες, χρήσιμα αντιδραστήρια για τη σύνθεση πλήθους άλλων χημικών ενώσεων.
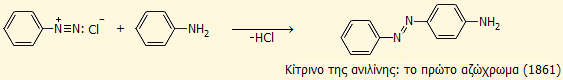
Ωστόσο, η πλέον χαρακτηριστική αντίδραση των διαζωνιακών αλάτων είναι η σύζευξη με αρωματικές ενώσεις που περιλαμβάνουν ομάδες-δότες ηλεκτρονίων, όπως άλλες αρωματικές αμίνες και φαινόλες. Οι συζεύξεις αυτές οδηγούν στο σχηματισμό ενώσεων με διαζωδεσμούς (-Ν=Ν-), οι οποίοι προσδίδουν έντονο χρώμα στα προϊόντα σύζευξης (χρωμοφόρος ομάδα). Τυπικό παράδειγμα αποτελεί η αντίδραση του διαζωνιακού άλατος με την ίδια την ανιλίνη με σχηματισμό του αζωχρώματος p-αμινο-αζω-βενζόλιο, γνωστό με το εμπορικό όνομα κίτρινο της ανιλίνης (aniline yellow), που ιστορικά υπήρξε το πρώτο αζώχρωμα που παρασκευάσθηκε το 1861:
Το επόμενο αζώχρωμα και το πρώτο με δύο διαζωδεσμούς ήταν το καστανόχρωμο του Bismark (Bismark brown). Αυτό το αζώχρωμα παρασκευάζεται με ανάμιξη του πλήρως διαζωτωμένου 1,3-διαμινο-βενζολίου (ή m-φαινυλενοδιαμίνης) με την ελεύθερη αρωματική αμίνη σε γραμμομοριακή αναλογία 1:2. Σήμερα το αζώχρωμα αυτό χρησιμοποιείται για τη χρώση κυττάρων στο γνωστό "τεστ Παπανικολάου":
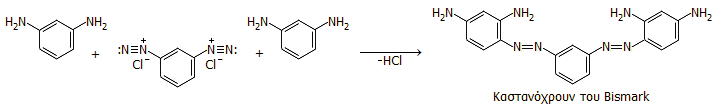
|
Ανίχνευση νιτρωδών ανιόντων με τη δοκιμασία Griess [Αναφ. 6] Μια εξαιρετικά ευαίσθητη δοκιμασία για την ανίχνευση ιχνών νιτρωδών αλάτων ανακαλύφθηκε από τον Peter Griess κατά τις μελέτες του στα διαζωνιακά άλατα κατά το 1858 και φέρει το όνομά του. Η δοκιμασία Griess, η οποία χρησιμοποιείται ευρύτατα ακόμη και σήμερα, βασίζεται στον σχηματισμό διαζωνιακού άλατος του σουλφανιλικού οξέος από τα ίχνη νιτρωδών και τη σύζευξή του με την α-ναφθυλαμίνη με σχηματισμό έντονα ερυθρού αζωχρώματος σύμφωνα με την αντίδραση:
Η δοκιμασία μπορεί να διεξαχθεί με σταγόνες αραιών διαλυμάτων των αντιδραστηρίων σε όξινο (με οξικό οξύ) διάλυμα και μπορεί να ανιχνεύσει ελάχιστες ποσότητες νιτρώδους οξέος (0,01 μg) και σε μεγάλες αραιώσεις (1:5.000.000). Με την ίδια αντίδραση μπορούν να ανιχνευθούν ιχνοποσότητες νιτρικών ιόντων αφού προηγουμένως υποστούν αναγωγή προς νιτρώδη, συνήθως με τη βοήθεια μεταλλικού ψευδαργύρου ή ενζύμου (νιτρική αναγωγάση). Η αντίδραση χρησιμοποιείται σε εγκληματολογικά εργαστήρια για την ανίχνευση ιχνών εκρηκτικών υλών, αλλά και σε βιοχημικά εργαστήρια για τον προσδιορισμό ιχνοποσοτήτων οξειδίων του αζώτου στο πλάσμα αίματος. Στη σύγχρονη "εκδοχή" αυτής της δοκιμασίας η α-ναφθυλαμίνη, η οποία είναι καρκινογόνος, αντικαθίσταται από το λιγότερο επικίνδυνο παράγωγό της την Ν-(1-ναφθυλο)-αιθυλενοδιαμίνη, όπου η ομάδα -ΝΗ2 της α-ναφθυλαμίνης αντικαθίσταται από την ομάδα -NHCH2CH2NH2. |
Η γένεση της βιομηχανίας των χρωμάτων ανιλίνης [Αναφ. 7] Το 1853, σε ηλικία 15 ετών, ο 'Αγγλος William Henry Perkin εισήχθη στο Βασιλικό Κολλέγιο Χημείας (Royal College of Chemistry) του Λονδίνου, όπου άρχισε τις σπουδές στη Χημεία υπό την επίβλεψη του διάσημου Γερμανού Καθηγητή Χημείας August Wilhelm von Hofmann (1818-1892). Ο Hofmann είχε διατυπώσει την υπόθεση ότι ενδεχομένως ήταν δυνατή η σύνθεση της πανάκριβης κινίνης στο εργαστήριο και ανέθεσε στον Perkin να δοκιμάσει αυτή τη σύνθεση. Θα πρέπει να σημειωθεί ότι την εποχή εκείνη οι δομές των μορίων ήταν ως επί το πλείστον αδιευκρίνιστες και περισσότερο εργάζονταν με βάση τους μοριακούς τύπους των διάφορων ενώσεων. Βέβαια, πολλές προσεγγίσεις στη σύνθεση ενώσεων εκείνης της εποχής μπορούν για τα σημερινά δεδομένα να θεωρηθούν μάλλον ως αφελείς.
Ο Perkin βασιζόμενος στον μοριακό τύπο της κινίνης C20H24Ν2Ο2 θεώρησε πως ίσως ένα παράγωγο της ανιλίνης, η N-αλλυλο-τολουιδίνη με μοριακό τύπο C10H13N (συντακτικός τύπος: CH3-C6H4-NH-CH2CH=CH2), θα μπορούσε να υποστεί οξειδωτικό διμερισμό σχηματίζοντας κινίνη με βάση την αντίδραση:
C10H13N
+ 3 [Ο]
Το 1856, σε ηλικία μόλις 18 ετών, άρχισε τα πειράματά του σε ένα μικρό πρωτόγονο εργαστήριο που είχε εγκαταστήσει στη σοφίτα του σπιτιού του στο Λονδίνο. Αρχικά, επεξεργάστηκε τη λιθανθρακόπισσα με υδατικό διάλυμα οξέος για να αποσπάσει από αυτήν τις οργανικές βάσεις. Το "βασικό" αυτό κλάσμα της λιθανθρακόπισσα περιείχε -μεταξύ άλλων- ανιλίνη και τολουιδίνες (ανιλίνες μεθυλιωμένες στον βενζολικό πυρήνα). Ο Perkin δοκίμασε την οξείδωση του ληφθέντος μίγματος ανιλίνης και τολουιδινών με διάλυμα διχρωμικού καλίου σε θειικό οξύ. Το προϊόν της αντίδρασης ήταν μια πισσώδης μαύρη ουσία. Για να καθαρίσει τη φιάλη ο Perkin χρησιμοποίησε αιθανόλη, οπότε είδε να σχηματίζεται ένα όμορφο έντονα πορφυρό διάλυμα, που μπορούσε να βάψει μόνιμα μεταξωτά και άλλα υφάσματα. Να σημειωθεί ότι μέχρι τότε, ως βαφές νημάτων και υφασμάτων χρησιμοποιούσαν αποκλειστικά ουσίες φυτικής (κυρίως) ή ζωικής προέλευσης, ενώ η έννοια των συνθετικών οργανικών χρωστικών ουσιών ήταν άγνωστη. Μια φυσική ουσία με αντίστοιχο χρώμα ήταν το πορφυρό της Τύρου (tyrian purple) ή απλά πορφύρα, μια ουσία γνωστή από την αρχαιότητα (πορφύρα) που λαμβανόταν από κάποια θαλάσσια οστρακοειδή της Μεσογείου. Η φυσική χρωστική ουσία κόστιζε περισσότερο απ' όσο χρυσός ίσου βάρους.
Ο Perkin αντιλήφθηκε την αξία της ανακάλυψής του, εγκατέλειψε τον αρχικό στόχο της σύνθεσης της κινίνης και άρχισε συστηματικά πειράματα με τη βοήθεια φίλων του και κρυφά από τον επιβλέποντα καθηγητή του. Τα πειράματά του πάνω σε οξειδώσεις μιγμάτων αρωματικών αμινών (ανιλίνης, ο- και p-τολουιδίνης) σύντομα οδήγησαν στη σύνθεση της μωβεΐνης (mauveine), γνωστής και ως πορφυρό της ανιλίνης (aniline purple), η οποία υπήρξε η πρώτη συνθετική οργανική χρωστική ουσία, ένα τυπικό "χρώμα ανιλίνης". Από τότε, μέχρι και σήμερα, η λέξη "ανιλίνη" έγινε σχεδόν συνώνυμη με τα "συνθετικά χρώματα". Πρέπει να σημειωθεί ότι την εποχή της ανακάλυψης της μωβεΐνης, η ανιλίνη ήταν ακόμη μια αρκετά ακριβή χημική ένωση, σύντομα όμως άρχισαν να εφαρμόζονται συνθετικές μέθοδοι παραγωγής της. Το 1854, ο Γάλλος χημικός και βιολόγος Antoine Béchamp ξεκίνησε να παράγει ανιλίνη σε ποσότητες τόνων με αναγωγή του νιτροβενζολίου. Η παραγωγή ανιλίνης με τη μέθοδο Béchamp επέτρεψε την εξέλιξη της μαζικής βιομηχανικής συνθετικής παραγωγής χρωμάτων με επίκεντρο την κύρια βιομηχανική δύναμη της εποχής, τη Γερμανία. Αυτή υπήρξε η αρχή της βιομηχανικής παρασκευής οργανικών χρωμάτων που έμελλε να οδηγήσει σε βιομηχανίες-κολοσσούς, όπως η BASF. 50 χρόνια μετά την ανακάλυψη της μωβεΐνης ήδη είχαν παρασκευασθεί περισσότερες από 2000 συνθετικές χρωστικές ύλες. Χημικός τύπος της μωβεΐνης. Μόλις το 1994 κατέστη δυνατός ο προσδιορισμός της ακριβούς σύνθεσης της μωβεΐνης, δηλ. του προϊόντος οξείδωσης μίγματος ανιλίνης, π-τολουιδίνης και ο-τολουιδίνης σε μοριακή αναλογία 1:1:2 με μίγμα θειικού οξέος-διχρωμικού καλίου. Αποδείχθηκε ότι είναι μίγμα τεσσάρων ισομερών μεθυλοπαραγώγων του ίδιου βασικού σκελετού μιας πολυπυρηνικής αρωματικής ένωσης. Ο Perkin υπήρξε τυχερός κατά το ότι χρησιμοποίησε ακάθαρτη ανιλίνη, διότι χωρίς τις προσμίξεις τολουιδινών δεν θα ελάμβανε τη μωβεΐνη.
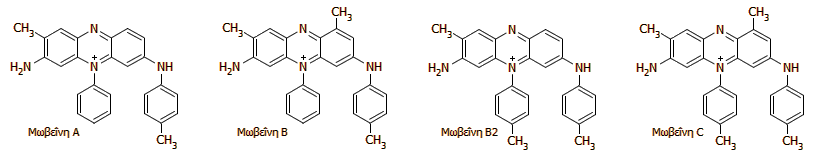
Μωβεΐνες: Τυπικά χρώματα ανιλίνης. Μίγμα των παραπάνω ενώσεων ήταν η πρώτη συνθετική οργανική χρωστική.
|
|||||||||||||||
Πολυανιλίνη: ένα οργανικό "μέταλλο" [Αναφ. 8]
To 1862, o Henry Letheby (1816–1876) μελέτησε την ηλεκτρολυτική συμπεριφορά διαλυμάτων της ανιλίνης σε αραιό θειικό οξύ και διαπίστωσε ότι στην στην άνοδο συλλεγόταν ένα σχεδόν μαύρο υλικό με πλαστική υφή, το οποίο προς έκπληξή του παρουσίαζε κάποια αγωγιμότητα. Αυτή ήταν η πρώτη ένδειξη ότι είναι δυνατή η σύνθεση υλικών οργανικής φύσης με σημαντική ηλεκτρική αγωγιμότητα.
Κατά την αντίδραση της ανιλίνης με οξειδωτικές ενώσεις (Fe(III), Ce(IV), Cr(VI), H2O2, συνηθέστερα όμως με υπερθειικά άλατα) δημιουργούνται πολυμερείς ενώσεις και υλικά με ιδιαίτερα ενδιαφέρουσες ιδιότητες, όπως η πολυανιλίνη (polyaniline, PANI) ή εμεραλδίνη (emeraldine, emerald: σμαράγδι), ένα αγώγιμο πολυμερές. Η συνολική αντίδραση της υδροχλωρικής ανιλίνης με υπερθειικό αμμώνιο μπορεί να αποδοθεί ως εξής [Αναφ. 8β]:
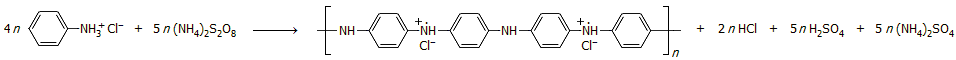
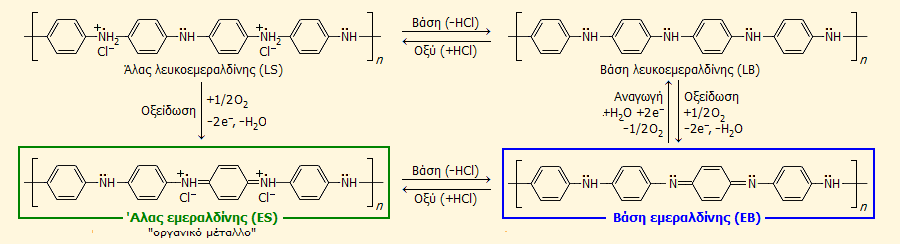
Το ως άνω πολυμερές παράγεται σε όξινο διάλυμα. Σε βασικό διάλυμα υπόκειται σε αντιστρεπτή οξείδωση παρέχοντας τη βασική μορφή της εμεραλδίνης (μπλε στερεό), η οποία σε όξινο διάλυμα παρέχει το άλας της εμεραλδίνης, ένα πράσινο αγώγιμο στερεό, το οποίο χρησιμοποιείται και ως οργανική χρωστική.
Η πρωτονίωση βοηθά στον απεντοπισμό των π-ηλεκτρονίων με αποτέλεσμα τη δυνατότητα ροής ηλεκτρονίων κατά μήκος της αλυσίδας του πολυμερούς. Η αγωγιμότητα εξαρτάται από δύο μεταβλητές: (α) τον βαθμό της οξείδωσης, δηλ. την αναλογία αμινικών δεσμών (-ΝΗ-) και ιμινικών δεσμών (-Ν=), που είναι 1:1 στην καθαρή εμεραλδίνη και (β) τον βαθμό πρωτονίωσης του υλικού.

|
Το άλας της λευκοεμεραλδίνης (LS) και η βάση της λευκοεμεραλδίνης είναι άχρωμα, μη αγώγιμα και ασταθή στερεά. Η βάση της εμεραλδίνης (ΕΒ) είναι μπλε, μη αγώγιμο και σταθερό στερεό, ενώ το άλας της εμεραλδίνης (ES) είναι πράσινο, αγώγιμο και σταθερό στερεό. Το άλας αυτό είναι το "οργανικό μέταλλο". |
Η αγωγιμότητα της εμεραλδίνης είναι τύπου p (φορείς ηλεκτρισμού οι "οπές" - κενά ηλεκτρονίων) και μπορεί να κυμαίνεται από 10-10 S/cm ουδέτερο ή βασικό περιβάλλον έως 1 S/cm σε pH = 0 (σε κατάσταση πλήρους πρωτονίωσης), χωρίς να αλλάζει η "συγκέντρωση" των ηλεκτρονίων στην μοριακή αλυσίδα. Η περνιγρανιλίνη αποτελεί την πλήρως οξειδωμένη μορφή της εμεραλδίνης, όπου οι αμινικοί δεσμοί έχουν αντικατασταθεί στο σύνολό τους από ιμινικούς δεσμούς και δεν είναι αγώγιμη.
 |
 |
|
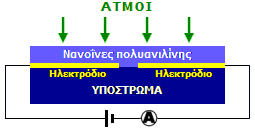
Αριστερά: Νανοΐνες πολυανιλίνης. Δεξιά: Αισθητήρας - "χημειοαντιστάτης" (chemiresistor) όξινων ατμών βασιζόμενος σε νανοΐνες πολυανιλίνης [Αναφ. 8η]. |
|
Αν και ο οξειδωτικός πολυμερισμός της ανιλίνης είναι γνωστός εδώ και 150 περίπου χρόνια, οι εξαιρετικά ενδιαφέρουσες ηλεκτρικές ιδιότητές της κατέστησαν την πολυανιλίνη αντικείμενο έντονης επιστημονικής έρευνας τα τελευταία 30 περίπου χρόνια. Ανάλογα πολυμερή προϊόντα παρέχουν και άλλα απλά οργανικά μόρια, όπως το πυρρόλιο και το θειοφαίνιο.
Οι εφαρμογές των αγώγιμων πολυμερών φαίνονται απεριόριστες: αντιστατικές επικαλύψεις αντιδιαβρωτικές επικαλύψεις, αγώγιμα νήματα, αντιστατικά υφάσματα, ηλεκτρομαγνητικές θωρακίσεις, εύκαμπτα ηλεκτρόδια, χημικοί αισθητήρες και ανιχνευτές αερίων, υπερπυκνωτές, τυπωμένα κυκλώματα, φωτοβολταϊκά στοιχεία. 'Ηδη προϊόντα της πολυανιλίνης, με την εμπορική ονομασία Ormecon, βρίσκουν μια ποικιλία τεχνολογικών εφαρμογών.
Παγκόσμια παραγωγή ανιλίνης [Αναφ. 9]
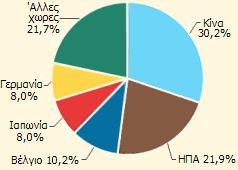
Σήμερα, η παγκόσμια παραγωγή ανιλίνης φθάνει τα πέντε εκατομμύρια τόνους και εκτιμάται ότι θα φθάσει τα 6,2 εκατομμύρια το 2015 με κύρια χώρα παραγωγής την Κίνα (περίπου το 30% της παγκόσμιας παραγωγής). Το κόστος της κυμαίνεται από 0,6 έως 1,4 ευρώ/kg ανάλογα με την καθαρότητα και την προέλευσή της.
Οι μεγαλύτερες ποσότητες της ανιλίνης δεν κατευθύνονται πλέον στη βιομηχανία χρωμάτων, όπως στο παρελθόν. Σήμερα, εκτιμάται πως περίπου το 75 έως 80% της παγκόσμιας παραγωγής ανιλίνης κατευθύνεται στην παραγωγή του διισοκυανικού μεθυλενο-διφαινυλίου (methylene-diphenyl diisocyanate, MDI). Το MDI είναι μια αρωματική δι-ισοκυανική ένωση που χρησιμοποιείται ως πρώτη ύλη για τη σύνθεση πολυμερών ουρεθάνης (πολυουρεθάνες) ευρύτατης χρησιμότητας μετά από τον συμπολυμερισμό της με διάφορες διόλες. Η σύνθεση του 4,4'-MDI (αλλά και των ισομερών του 2,2-, 2,4-MDI) πραγματοποιείται με συμπύκνωση δύο μορίων ανιλίνης με φορμαλδεΰδη και αντίδραση του προϊόντος με φωσγένιο (COCl2).
Η υπόλοιπη παραγωγή της ανιλίνης κατευθύνεται στις πλέον "παραδοσιακές" εφαρμογές της, όπως στις βιομηχανίες χρωμάτων και εκρηκτικών, στη φαρμακευτική βιομηχανία, στη σύνθεση αγροχημικών και γενικά στη σύνθεση μιας τεράστιας ποικιλίας χημικών ενώσεων.
 |
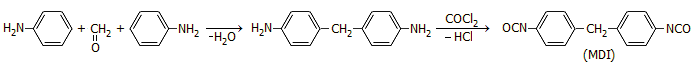 |
|
|
|
|
Κύριες παραγωγές χώρες ανιλίνης το 2012 |
Επάνω: Αλληλουχία αντιδράσεων βιομηχανικής σύνθεσης MDI. Κάτω: Τυπική πολυουρεθάνη (προϊόν συμπολυμερισμού MDI με 1,2-αιθανοδιόλη). |

|
Σήμερα το 75-80% της παγκόσμιας παραγωγής της ανιλίνης (που φθάνει περίπου τα 6 εκατομμύρια τόνους τον χρόνο) προορίζεται για τη σύνθεση της δι-ισοκυανικής αρωματικής ένωσης MDI, πρώτης ύλης για την παρασκευή προϊόντων πολυουρεθάνης, πολυμερών υλικών με πολλά "πρόσωπα". Οι μεγαλύτερες ποσότητες πολυουρεθάνης χρησιμοποιούνται ως θερμομονωτικά υλικά κτηρίων ("αφρώδης πολυουρεθάνη"). 'Αλλες εφαρμογές πολυουρεθανών: υλικά "παραγεμίσματος" στην επιπλοποιία (σε μαξιλάρια, καναπέδες, πολυθρόνες), ελαστικά υποδημάτων (σόλες, πατούσες), αερομονωτικές ταινίες (αεροστόπ), μονωτικές κόλλες, ιατρικά σκεύη, διάφορα άκαμπτα σκεύη και εξαρτήματα, επενδύσεις πατωμάτων και εσωτερικών αυτοκινήτων. |
BASF: Η κολοσσιαία χημική βιομηχανία με την ανιλίνη στο όνομά της [Αναφ. 10] Η μεγαλύτερη σήμερα χημική βιομηχανία του κόσμου είναι η BASF (Badische Anilin und Soda Fabrik: Βιομηχανία Ανιλίνης και Σόδας του Μπάντεν), η οποία ιδρύθηκε το 1865 στο Manheim του γερμανικού δουκάτου Μπάντεν, από τον Friedrich Engelhorn (1821-1902). O Engelhorn αρχικά (1847) εργάστηκε ως χρυσοχόος, αλλά η οικονομική κατάσταση της εποχής δεν του επέτρεψαν να συνεχίσει αυτό το επάγγελμα. Στη συνέχεια ίδρυσε μια ιδιωτική βιομηχανία παραγωγής φωταερίου και ανέλαβε τον φωτισμό των δρόμων του Menheim. Διέθετε επίσης εμφιαλωμένο φωταέριο για τον φωτισμό καταστημάτων.
Το φωταέριο παραγόταν με θερμική διάσπαση του άφθονου στην περιοχή λιθάνθρακα. Ωστόσο, οι μεγάλες ποσότητες πίσσας που απέμενε ως παραπροϊόν, από την οποία μπορούσε να ληφθεί ανιλίνη και τολουιδίνες και η επαναστατική -για την εποχή- ανακάλυψη των συνθετικών χρωμάτων από τον Perkin, έδωσαν την ιδέα στον Engelhorn να στραφεί στην παραγωγή συνθετικών οργανικών χρωμάτων και το 1865 ίδρυσε την BASF. Λόγω των αντιδράσεων των κατοίκων του Manheim, η βιομηχανία εγκαταστάθηκε τον επόμενο χρόνο (1866) στην απέναντι (ανατολική) όχθη του Ρήνου στη γειτονική πόλη Ludwigshafen (σήμερα ανήκει στο γερμανικό κρατίδιο της Ρηνανίας-Παλατινάτου), όπου σήμερα είναι και η έδρα της κολοσσιαίας αυτής χημικής βιομηχανίας. Η αλιζαρίνη ήταν ένα από τα πρώτα χρώματα που παρήγαγε η BASF, ενώ ακολούθησαν το κυανούν του μεθυλενίου, η εωσίνη, όπως και το (συνθετικό) ινδικό. Η βιομηχανία, εκτός από τα ίδια τα χρώματα, παρήγαγε και τις απαραίτητες για τις βαφές χημικές ύλες, όπως η σόδα (ανθρακικό νάτριο με τη μέθοδο Leblanc) και οξέα, όπως το θειικό οξύ. Μέχρι το 1901 το 80% της παραγωγής της BASF ήταν τα χρώματα. Ωστόσο, όταν το 1908 ανακαλύφθηκε η μέθοδος Haber για τη σύνθεση της αμμωνίας (βλ. Χημική ένωση του μήνα: Αμμωνία), η BASF αξιοποίησε τη μέθοδο Haber και από το 1913 άρχισε την παραγωγή αμμωνίας και από αυτήν νιτρικού οξέος, νιτρικών λιπασμάτων και εκρηκτικών υλών. Χάρις στη μέθοδο Haber η Γερμανία μπόρεσε να ανταπεξέλθει κατά τον 1ο Παγκόσμιο Πόλεμο στους αποκλεισμούς που της είχαν επιβάλλει οι αντίπαλοι και οι οποίοι καθιστούσαν αδύνατη την εισαγωγή νίτρου από τη Χιλή, τη μοναδική (μέχρι τότε) πηγή νιτρικών αλάτων. Σήμερα, στα προϊόντα της BASF περιλαμβάνονται σχεδόν κάθε είδους χημικά προϊόντα, πλαστικά, γεωργικά, χημικά κατασκευών, καθώς και αργό πετρέλαιο και φυσικό αέριο. Η BASF (ως BASF Group) έχει εξελιχθεί σε ένα βιομηχανικό χημικό κολοσσό. Διαθέτει θυγατρικές ή συνεργαζόμενες εταιρείες σε 80 χώρες του κόσμου. Μεταξύ άλλων, διαθέτει 6 τεράστια βιομηχανικά συγκροτήματα και 390 μικρότερες παραγωγικές μονάδες σε όλες τις ηπείρους. Απασχολεί (2013) 112.000 υπαλλήλους και πραγματοποιεί πωλήσεις ύψους 74 δισεκατομμυρίων ευρώ. Σχετικά πρόσφατα άρχισε η επέκταση της εταιρείας στη Κίνα (Nanjin και Shanghai) και στην Ινδία (Mangalore).
|
|||||||||
"Σημείο ανιλίνης": 'Ενας σημαντικός δείκτης ποιότητας πετρελαίου και προϊόντων του [Αναφ. 11] Το σημείο ανιλίνης (aniline point) αποτελεί ένα χαρακτηριστικό ποιότητας υδρογονανθρακικών ενώσεων, φυσικών μιγμάτων τους, όπως το πετρέλαιο αλλά και σχετικών προϊόντων (π.χ. λιπαντικά έλαια μηχανών). Ορίζεται ως η ελάχιστη θερμοκρασία στην οποία αναμιγνύονται πλήρως ίσοι όγκοι του εξεταζόμενου δείγματος και ανιλίνης. Σε θερμοκρασίες μικρότερες από το "σημείο ανιλίνης" το μίγμα υπόκειται σε μερικό ή πλήρη διαχωρισμό. Το σημείο ανιλίνης παρέχει στον χημικό μια ένδειξη της σχετικής περιεκτικότητας του εξεταζόμενου δείγματος σε αρωματικούς υδρογονάνθρακες. 'Οσο μεγαλύτερη είναι η περιεκτικότητα του δείγματος σε αρωματικούς υδρογονάνθρακες, τόσο πιο εύκολα διαλύει την ανιλίνη -με βάση τη γενική αρχή "τα όμοια διαλύονται στα όμοια"- και επομένως τόσο χαμηλότερο είναι το "σημείο ανιλίνης".
Ο τρόπος διεξαγωγής της δοκιμασίας είναι σχετικά απλός: 'Ογκος του εξεταζόμενου δείγματος αναμιγνύεται με ίσο όγκο ανιλίνης σε ένα περιέκτη, όπως π.χ. σε έναν δοκιμαστικό σωλήνα. Ο περιέκτης αρχίζει και θερμαίνεται με αργό ρυθμό, ενώ συγχρόνως τα δύο υγρά υπόκεινται σε ήπια ανάδευση. Όταν τα δύο υγρά διαλυθούν πλήρως το ένα μέσα στο άλλο, το μίγμα από θολό γίνεται διαυγές. Στη συνέχεια η θέρμανση διακόπτεται και το διαυγές μίγμα αφήνεται να κρυώσει σιγά-σιγά. Η θερμοκρασία στην οποία το μίγμα αρχίζει να θολώνει σημειώνεται ως "σημείο ανιλίνης". Με βάση τις τιμές του "σημείου ανιλίνης" πρότυπων μιγμάτων, ο χημικός μπορεί να εκτιμήσει την περιεκτικότητα των δειγμάτων σε αρωματικούς υδρογονάνθρακες. Η περιεκτικότητα αυτή έχει ιδιαίτερη σημασία κυρίως για προϊόντα πετρελαίου που χρησιμοποιούνται ως λιπαντικά και έρχονται σε επαφή με φυσικό καουτσούκ. Υψηλές περιεκτικότητες σε αρωματικά τα καθιστούν ακατάλληλα γιατί οι αρωματικοί υδρογονάνθρακες σταδιακά καταστρέφουν υλικά και εξαρτήματα από φυσικό καουτσούκ (σωλήνες, παρεμβύσματα), επομένως όσο υψηλότερο είναι το σημείο ανιλίνης, τόσο καλύτερης ποιότητας θεωρείται το λιπαντικό. Τυπικά θα πρέπει το σημείο ανιλίνης να είναι πάνω από τους 60ºC. Ο προσδιορισμός του "σημείου ανιλίνης" μπορεί να γίνει με μια πολύ απλή συσκευή για την οποία απαιτούνται: ένα θερμόμετρο και δύο δοκιμαστικοί σωλήνες, ο ένας (με το εξεταζόμενο μίγμα) μέσα στον άλλο (που χρησιμοποιείται ως ελαιόλουτρο), ένα θερμόμετρο, ένας χειροκίνητος αναδευτήρας και ένα θερμαντικό μέσο. Ωστόσο, στο εμπόριο κυκλοφορούν αρκετά συστήματα αυτόματου προσδιορισμού του σημείου ανιλίνης του πετρελαίου και των προϊόντων του. |
|||||
Περιβαλλοντική ρύπανση, υγιεινή και ασφάλεια για την ανιλίνη [Αναφ. 12]
Η ανιλίνη χρησιμοποιείται ωε πρώτη ύλη στη χημική βιομηχανία για την παρασκευή χημικών ενδιαμέσων, σύνθεση εκρηκτικών, επιταχυντές χημικών αντιδράσεων παραγωγής ελαστικών, ισοκυανικές ενώσεις, ζιζανιοκτόνα, μυκητοκτόνα, χρώματα και διαλύτες. Η παραγωγή της ανιλίνης και των βιομηχανικών προϊόντων έχει ως αποτέλεσμα την περιβαλλοντική ρύπανση και προβλήματα υγιεινής και ασφάλειας των εργαζομένων. Η ανιλίνη στον αέρα διασπάται και με φωτοχημικές αντιδράσεις παράγει ελεύθερες ρίζες.
Η ανιλίνη είναι τοξική και οι ατμοί της μπορούν να προκαλέσουν προβλήματα στους πνεύμονες, το στομάχι και το δέρμα. Η ανιλίνη είναι ύποπτη για καρκινογόνο δράση και η Διεθνής Υπηρεσία για την 'Ερευνα στον Καρκίνο (IARC) την τοποθετεί στην ομάδα 3 (not classifiable as to its carcinogenicity to humans) due to the limited and contradictory data available). Η κατηγορία αυτή περιλαμβάνει χημικές ενώσεις και παράγοντες για τις οποίες δεν υπάρχουν πειραματικά ή επιδημιολογικά δεδομένα για καρκινογόνο δράση στον άνθρωπο ή σε πειραματόζωα. Απλώς κάποιες έρευνες (in vitro) δείχνουν ύποπτη καρκινογόνο δράση. Σε παλαιότερες εποχές όπου οι κανόνες υγιεινής και ασφάλειας ήταν περιορισμένοι, οι εργάτες της βιομηχανίας ανιλίνης παρουσίασαν αυξημένο κίνδυνο για καρκίνο της ουροδόχου κύστης, αλλά νεότερες έρευνες έδειξαν ότι μάλλον ο κίνδυνος ήταν αποτέλεσμα της έκθεσης σε β-ναφθυλαμίνη ή ο-τολουϊδίνη (αποδεδειγμένες ισχυρές καρκινογόνες ενώσεις) που παράγονται σε μικρές ποσότητες κατά τη βιομηχανική παραγωγή της ανιλίνης.
Η μέγιστη επιτρεπτή συγκέντρωση ανιλίνης σε χώρους εργασίας (οριακή τιμή έκθεσης) έχει καθορισθεί στα 2,5 ppm (10 mg/m3), Προεδρικό Διάταγμα 90/1999 (ΦΕΚΛ 94, τ.Α, 13.5/.1999).
 Ιστορία
της ανιλίνης
Ιστορία
της ανιλίνης