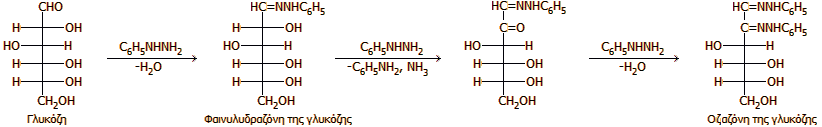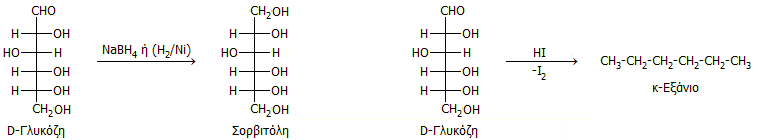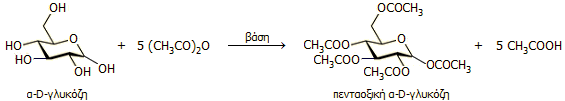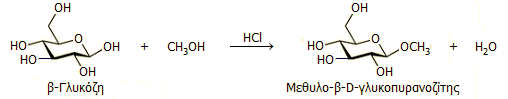Οι μέχρι σήμερα
Η χημική ένωση του
μήνα
[Ιανουάριος
2012]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες
[Αναφ. 1]:
Εμφάνιση: Λευκό κρυσταλλικό σώμα
Μοριακός τύπος:
C6H12O6
Σχετική μοριακή μάζα:
180,16
Σημείο τήξεως α-ανωμερούς:
146°C, 83°C (η
μονοϋδρική μορφή)
Σημείο τήξεως β-ανωμερούς:
150°C
Σημείο ζέσεως: αποσυντίθεται
Πυκνότητα:
1,54 g/cm3
Στροφική
ικανότητα: [α]D = +112,2°
 +52,7° (λόγω ανωμερείωσης της α- προς β-γλυκόζη) (c = 10 g/100 mL, στο
νερό)
+52,7° (λόγω ανωμερείωσης της α- προς β-γλυκόζη) (c = 10 g/100 mL, στο
νερό)
Διαλυτότητα στο νερό:
1 g διαλύεται σε 1,1 mL ύδατος στους 25°C
(0,8 mL
στους 30°C,
0,41 mL
στους 50°C,
0,28 mL
στους 70°C,
0,19 mL
στους 90°C).
Ελάχιστα διαλυτή σε απόλυτη αλκοόλη, στον αιθέρα, στην ακετόνη, διαλυτή
σε θερμά: οξικό οξύ, πυριδίνη και ανιλίνη. 1 g (μονοϋδρικής γλυκόζης) σε
60 mL αλκοόλης
pH υδατικού διαλύματος
0,5 Μ: 5,9
Θανάσιμη δόση (LD): 35 g/kg (ενδοφλεβίως σε
κουνέλια)
Γλυκύτητα
(μονοϋδρικής γλυκόζης):
0,74 (καλαμοσάκχαρο: 1)
|
 |
|
Γλυκόζη
Glucose
|
|
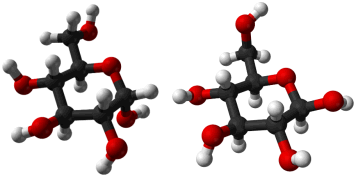
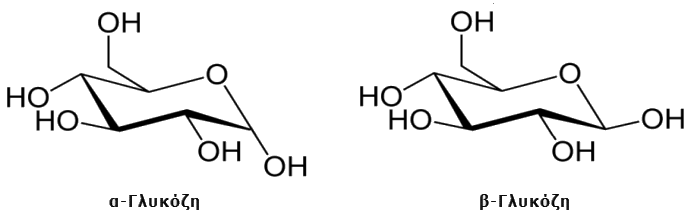
Τρισδιάστατες
απεικονίσεις των δύο ανωμερών μορφών της γλυκόζης. Αριστερά:
α-γλυκόζη, δεξιά: β-γλυκόζη. |
Υδατάνθρακες και μονοσακχαρίτες
Το άμυλο (starch) στους φυτικούς
οργανισμούς, η κυτταρίνη (κελλουλόζη,
cellulose) στα
διάφορα είδη ξύλου, το χαρτί, το βαμβάκι και διάφορα άλλα προϊόντα φυτικής
προέλευσης, είναι
καθαροί υδατάνθρακες, ενώ τροποποιημένα μόρια υδατανθράκων βρίσκονται στα μόρια
των νουκλεϊνικών οξέων (DNA,
RNA) και
σε άλλες βιοοργανικές ενώσεις. Μαζί με τις πρωτεΐνες και τα λίπη, οι
υδατάνθρακες αποτελούν βασικά συστατικά στους ζωντανούς οργανισμούς με
μεγάλη βιολογική και ενεργειακή σημασία
Οι υδατάνθρακες βιοσυντίθενται από τα φυτά
μέσω της φωτοσύνθεσης, όπου το ηλιακό φως προσφέρει την απαιτούμενη ενέργεια και μετατρέπει
το ατμοσφαιρικό διοξείδιο του
άνθρακα σε γλυκόζη. Η ολική αντίδραση μπορεί να γραφεί ως:
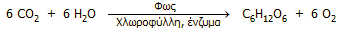
 Τα
μόρια της γλυκόζης που σχηματίζονται με αυτό τον τρόπο αποθηκεύονται στα φυτά
στην πολυμερισμένη μορφή της ως άμυλο ή
ως κυτταρίνη. Οι επιστήμονες έχουν υπολογίσει ότι το 50% του καθαρού βάρους
της βιομάζας στον πλανήτη Γη (σύνολο ζώων και φυτών) αποτελείται από πολυμερή
της γλυκόζης. Εκτιμάται πως ετησίως παράγονται 100 δισεκατομμύρια τόνοι
υδατανθράκων με τη διαδικασία της φωτοσύνθεσης [Αναφ.
2].
Τα
μόρια της γλυκόζης που σχηματίζονται με αυτό τον τρόπο αποθηκεύονται στα φυτά
στην πολυμερισμένη μορφή της ως άμυλο ή
ως κυτταρίνη. Οι επιστήμονες έχουν υπολογίσει ότι το 50% του καθαρού βάρους
της βιομάζας στον πλανήτη Γη (σύνολο ζώων και φυτών) αποτελείται από πολυμερή
της γλυκόζης. Εκτιμάται πως ετησίως παράγονται 100 δισεκατομμύρια τόνοι
υδατανθράκων με τη διαδικασία της φωτοσύνθεσης [Αναφ.
2].
Η κατανάλωση υδατανθράκων μέσω των τροφών και στη
συνέχεια ο μεταβολισμός τους αποτελούν την κύρια πηγή ενέργειας (μαζί με τα
λίπη) κάθε ζωντανού οργανισμού. Επιπλέον, ο οργανισμός μπορεί να αποθηκέψει τους
υδατάνθρακες στη μορφή γλυκογόνου (glycogen), ως ενεργειακό απόθεμα για μεταγενέστερη χρήση
ή άμεσης ανάγκης.
Τα μηρυκαστικά ζώα (αγελάδες,
πρόβατα, κ.λπ.) διαθέτουν στο στομάχι τους μικροοργανισμούς, που τους
επιτρέπουν τη διάσπαση της κυτταρίνης σε γλυκόζη. Ενώ ο άνθρωπος και τα
περισσότερα θηλαστικά δεν διαθέτουν τα απαραίτητα ένζυμα για την πέψη της
κυτταρίνης, έτσι χρησιμοποιούν το άμυλο ως διαιτητική πηγή υδατανθράκων.
Τα ζωικά τρόφιμα, όπως
το κρέας των ζώων που αφομοιώνουν την κυτταρίνη περιέχει και την αποθηκευμένη
ενέργειά της, που μεταφέρεται μέσω της βιολογικής τροφικής αλυσίδας.
Η γλυκόζη είναι το πλέον
διαδεδομένο στη φύση σάκχαρο σε ελεύθερη μορφή, αλλά κυρίως "πολυμερή"
μορφή. Ωστόσο, ως καθαρή γλυκόζη απομονώθηκε για πρώτη φορά από τη σταφίδα το
1747 και με υδρόλυση του αμύλου το 1811
[Αναφ.
2α].
Η ονομασία υδατάνθρακες
(carbohydrate)
προέρχεται ιστορικά από το γεγονός ότι η γλυκόζη (άλλες κοινές ονομασίες:
σταφυλοσάκχαρο, δεξτρόζη), ο πρώτος απλός
υδατάνθρακας που απομονώθηκε σε καθαρή μορφή, έχει μοριακό τύπο C6Η12Ο6 και αρχικά
θεωρήθηκε
ως ένα είδος
υδρίτη
του άνθρακα (εφυδατωμένος άνθρακας), δηλαδή
C6(H2O)6. Αν και η άποψη αυτή σύντομα εγκαταλείφθηκε, η ονομασία παρέμεινε. Ο όρος
υδατάνθρακες σήμερα περιλαμβάνει μια ευρύτατη ομάδα πολύ-υδροξυλιωμένων αλδεϋδών
και κετονών που κοινώς τα ονομάζουμε σάκχαρα.
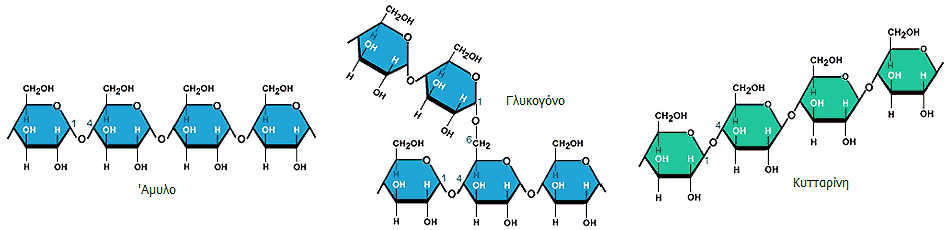
|
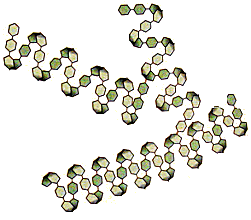
Τμήματα
των μορίων των τριών κυριότερων "πολυμερών" μορφών της γλυκόζης:
'Αμυλο: Πολυμερής μορφή αποτελούμενη από σειρά μορίων
α-γλυκόζης. Αποτελεί την κυριότερη μορφή υπό την οποία
προσλαμβάνεται η γλυκόζη από τον άνθρωπο. Γλυκογόνο:
Πολυμερής μορφή αποτελούμενη από σειρά μορίων α-γλυκόζης με
διασταυρώσεις. Η κυριότερη μορφή υπό την οποία αποθηκεύεται η
γλυκόζη στον ανθρώπινο οργανισμό (αποτελεί την κυριότερη πηγή
ενέργειας που απαιτείται από τον οργανισμό). Κυτταρίνη: :
Πολυμερής μορφή αποτελούμενη από σειρά μορίων β-γλυκόζης. Αποτελεί
την κυριότερη μορφή υπό την οποία βρίσκεται η γλυκόζη στη φύση. Δεν
αποτελεί τροφή για τον άνθρωπο, αλλά αφομοιώνεται από πολλούς άλλους
οργανισμούς, όπως τα μηρυκαστικά ζώα, που διαθέτουν τα κατάλληλα
ένζυμα για τη διάσπασής της. |
|
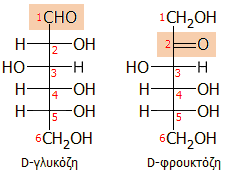
Η γλυκόζη και η
φρουκτόζη αποτελούν τα πλέον τυπικά παραδείγματα μιας αλδοεξόζης και
μιας κετοεξόζης αντιστοίχως. |
Τυπικές
κατατάξεις των υδατανθράκων
Οι υδατάνθρακες ταξινομούνται
σε δύο γενικές κατηγορίες.
1. Τα απλά
σάκχαρα ή μονοσακχαρίτες (τυπικά παραδείγματα: γλυκόζη, φρουκτόζη,
μαννόζη, γαλακτόζη) που δεν μπορούν να υδρολυθούν
σε άλλα μικρότερα μόρια και
2. Οι σύνθετοι
υδατάνθρακες που αποτελούνται από δυο ή περισσότερα, ίδια ή διαφορετικά
μεταξύ τους, απλά σάκχαρα που
συνδέονται μεταξύ τους. Διακρίνονται σε: α) δισακχαρίτες (αποτελούμενους
από δύο μονάδες απλών σακχάρων), β) ολιγοσακχαρίτες (αποτελούμενους από
τρία έως δέκα απλά σάκχαρα) και γ) πολυσακχαρίτες (αποτελούμενους από
περισσότερες από δέκα μονάδες απλών σακχάρων).
Τυπικά παραδείγματα δισακχαρίτη
είναι η σακχαρόζη (η κοινή ζάχαρη), που αποτελείται από μια γλυκόζη και μια φρουκτόζη και η λακτόζη (το γαλακτοσάκχαρο) που
αποτελείται από μια γλυκόζη και μια γαλακτόζη.
Το άμυλο και η κυτταρίνη
αποτελούν τυπικά παραδείγματα πολυσακχαριτών, αφού τα μόριά τους αποτελούνται από μερικές χιλιάδες
μόρια γλυκόζης συνδεδεμένα μεταξύ τους.
Οι μονοσακχαρίτες μπορούν να ταξινομηθούν επιπλέον
σε αλδόζες και κετόζες. Η κατάληξη -οζη
χρησιμοποιείται για να υποδηλώσει υδατάνθρακα, ενώ τα προθέματα αλδο-
και κετο-, προσδιορίζουν τη φύση της καρβονυλικής ομάδας στην άκυκλη
μορφή τους (αλδεΰδη ή κετόνη). Ο αριθμός των
ατόμων άνθρακα σε μονοσακχαρίτη δηλώνεται με τα προθήματα τρι-, τετρ-, πεντ-,
εξ-, κ.λπ. Η γλυκόζη είναι μία αλδοεξόζη και η φρουκτόζη είναι
κετοεξόζη.
Προβολές
υδατανθράκων
κατά Fischer
[Αναφ. 3]
Το πρόβλημα με τους
χημικούς τύπους των μονοσακχαριτών ήταν η δυσκολία της περιγραφής της
στερεοχημείας τους στο επίπεδο (στο χαρτί), λόγω της παρουσίας πολλών στερεογονικών
ατόμων άνθρακα. Στερεογονικό
άτομο άνθρακα είναι το άτομο άνθρακα δεσμικά συνδεδεμένου με τέσσερις
διαφορετικές ομάδες. Τέτοια είδη ατόμων άνθρακα καλούνται ασύμμετρα κέντρα ή
στερεογονικά
κέντρα. H χειρομορφία είναι ιδιότητα του αφορά ολόκληρο το
μόριο, ενώ το στερεογονικό κέντρο αποτελεί αίτιο της χειρομορφίας.
Ο συνηθέστερος
και ο παλαιότερος τρόπος απεικόνισης όλων των στερεογονικών κέντρων των
υδατανθράκων και των παραγώγων τους σε ένα επίπεδο
πραγματοποιείται με τις προβολές κατά
Fischer
(Fischer's projections).
Σε μια προβολή κατά Fischer η τετραεδρική διάταξη των δεσμών του άνθρακα αναπαρίσταται
με δύο διασταυρούμενες γραμμές (κάτω δεξιά). Οι οριζόντιες γραμμές αναπαριστούν δεσμούς που
κατευθύνονται μπροστά από το επίπεδο της σελίδας (προς τα δύο μάτια του
αναγνώστη), ενώ οι κάθετες γραμμές
αναπαριστούν δεσμούς που κατευθύνονται προς τα πίσω από το επίπεδο της σελίδας.
Οι προβολές κατά
Fischer μπορούν
να περιστραφούν στο επίπεδο της σελίδας μόνο κατά 180° χωρίς να αλλοιωθεί
η δομή που αναπαριστούν. Αντίθετα, περιστροφή κατά 90° ή 270°, θα οδηγούσε στο εναντιομερές
μόριο.
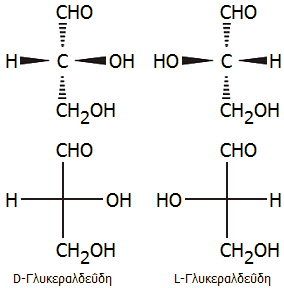
Ως ένωση αναφοράς ο
Fischer θεώρησε τη γλυκεραλδεΰδη, ένωση που λαμβάνεται
εύκολα με ήπια οξείδωση της γλυκερίνης με υπεροξείδιο του υδρογόνου παρουσία
αλάτων του Fe(II). Πρόκειται για ένα στερεό σώμα (σ.τ.
145°C)
με γλυκιά γεύση, το οποίο μπορεί να θεωρηθεί και ως η απλούστερη αλδόζη (αλδοτριόζη).
Ο Fischer
έπρεπε να αποδώσει στην κάθε μία από τις δύο εναντιομερείς μορφές της
γλυκεραλδεΰδης τους προσδιορισμούς D- και
L- (από τα λατινικά dextrus: δεξιός, laevus:
αριστερός), δηλ. να αποδώσει μια συγκεκριμένη χωροθέτηση των
τεσσάρων διαφορετικών ομάδων γύρω από το κεντρικό άτομο άνθρακα.
Φυσικά, τα μέσα εκείνης της εποχής δεν επέτρεπαν τον
προσδιορισμό της πραγματικής θέσης των τεσσάρων διαφορετικών ομάδων της γλυκεραλδεΰδης
στις κορυφές του τετραέδρου που αντιστοιχεί στο κεντρικό άτομο άνθρακα,
οπότε ο Fischer είχε 50% πιθανότητα να κάνει τη σωστή
και 50% πιθανότητα να κάνει λανθασμένη επιλογή. Βέβαια γνώριζε πως και λανθασμένη
(ορθότερα "ατυχή") επιλογή
να έκανε, αυτό δεν θα είχε καμιά ουσιαστική σημασία
στη συστηματική κατάταξη των εναντιομερών ενώσεων και στην πρόοδο της χημείας
των ενώσεων αυτών αλλά και γενικότερα. Εξήντα χρόνια αργότερα
αποδείχθηκε (Bijvoet
1951) ότι ο Fischer είχε κάνει τυχαία την ορθή
επιλογή και οι χωροθετήσεις των τεσσάρων ομάδων που είχε αποδώσει στο κεντρικό
άτομο της δεξιόστροφης (D) και αριστερόστροφης (L) γλυκεραλδεΰδης ήταν οι
πραγματικές (βλ.
Χημική ένωση του μήνα: Τρυγικό οξύ).
Συμβατικά, στους υδατάνθρακες ο καρβονυλικός
άνθρακας τοποθετείται στην κορυφή (C1 στις αλδόζες, C2 στις κετόζες). Στις
προβολές Fischer, καθοριστικός παράγοντας για
το αν ένας μονοσακχαρίτης θα χαρακτηριστεί ως D- ή ως
L- είναι η θέση του υδροξυλίου του
προτελευταίου άνθρακα. Στα D-σάκχαρα το υδροξύλιο βρίσκεται πάντοτε στα δεξιά και
στα L-σάκχαρα πάντοτε στα αριστερά, σε αναλογία με τις αντίστοιχες παραδοχές
για τα μόρια της D- και L-γλυκεραλδεΰδης.
Θα πρέπει να τονιστεί ότι οι
προσδιορισμοί D- και L-
προσδιορίζουν μόνο τη στερεοχημεία του σακχάρου και δεν
έχουν καμία σχέση με το αν το σάκχαρο (ή η ένωση γενικότερα) στρέφει το επίπεδο
του πολωμένου φωτός δεξιά ή αριστερά. Ούτε υπάρχει κάποιος απλός τρόπος για να προβλεφθεί
το αν μια
ένωση θα είναι αριστερόστροφη ή δεξιόστροφη, αν είναι γνωστός ο στερεοχημικός
τύπος της. Επομένως, το σωστό είναι οι προσδιορισμοί D-
και L- στον προφορικό λόγο να
αναφέρονται ως "ντι" και "ελ" και σε καμιά περίπτωση ως "ντέξτρο" ή "λέβο"
[Αναφ.
3δ].
Ο προσδιορισμός της στροφικής
ικανότητας πραγματοποιείται με τα μικρά γράμματα d- και
l- ή με τα πρόσημα + και -. 'Ετσι, για παράδειγμα σε
αντίθεση με την D-γλυκόζη, που είναι δεξιόστροφο σάκχαρο, η
D-φρουκτόζη είναι αριστερόστροφο σάκχαρο και για τον
λόγο αυτό
προσδιορίζεται ως D(-)-φρουκτόζη. 'Ετσι, όπως μια
λιγότερο χρησιμοποιούμενη ονομασία για τη D(+)-γλυκόζη είναι δεξτρόζη (dextrose),
μια επίσης λιγότερο χρησιμοποιούμενη ονομασία της D(-)-φρουκτόζης είναι
λεβουλόζη (levulose).
Η χρήση
των προβολών Fischer για μόρια που δεν σχετίζονται με
υδατάνθρακες δεν συνιστάται πλέον, λόγω της σύγχυσης που μπορεί να προκληθεί
κατά τη σύγκριση των προβολών αυτών με άλλους πιο διευκρινιστικούς
τρόπους προβολής (π.χ. με τις σφήνες:
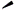
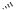 ).
).
|
 |
|
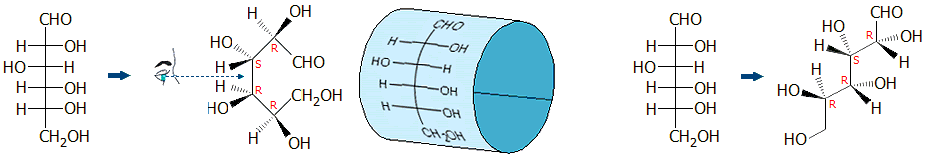
Σύγκριση της προβολής κατά Fischer της
άκυκλης D-γλυκόζης με την αντίστοιχη απεικόνιση με βάση τους
προσδιορισμούς R, S. Αριστερά: δείχνεται πως η άμεση προβολή
Fischer του άκυκλου μορίου της
D-γλυκόζης (ανοικτή δομή) οδηγεί σε μια "κυλινδρική"
διαμόρφωση στο χώρο του μορίου (με πολύ
μικρή πιθανότητα παρουσίας). Δεξιά: δείχνεται μια πολύ πιο πιθανή (zig-zag)
διαμόρφωση του μορίου της D-γλυκόζης.
Ωστόσο, παρά το τελείως διαφορετικό σχήμα των δύο
διαφορετικών διαμορφώσεων του μορίου και οι δύο
τους είναι ισοδύναμες από άποψη εναντιομέρειας, αφού η μία
προκύπτει από την άλλη μέσω ελεύθερων περιστροφών μέσω των δεσμών
C-C, χωρίς αλλαγή της θέσης των ομάδων που βρίσκονται σε κάθε
κορυφή του τετραέδρου κάθε άνθρακα. |
Κυκλικές δομές μονοσακχαριτών - Προβολές κατά Haworth
[Αναφ. 4]
 |
|
Sir (Walter) Norman Haworth (1883-1950). Βρετανός χημικός
διάσημος για τις μελέτες του στους υδατάνθρακες και στη βιταμίνη C.
Βραβείο Nobel 1937. |
Η γενική αντίδραση σχηματισμού ημιακετάλης (hemiacetal) μεταξύ μιας καρβονυλικής
ένωσης (αλδεΰδης ή κετόνης) και μιας αλκοόλης αποδίδεται από την αντίδραση ισορροπίας
(1):
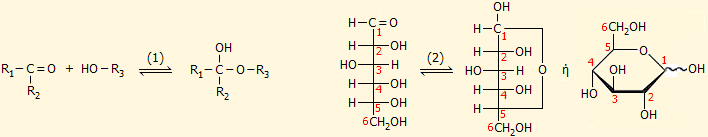
Να σημειωθεί εδώ ότι οι ημιακετάλες έχουν τη χαρακτηριστική ομάδα
R-CR'(OH)-O-R'' ένωσης με αλκοόλη), ενώ οι (πλήρεις)
ακετάλες έχουν τη χαρακτηριστική ομάδα R-CR'(O-R'')-O-R'''.
Εάν η υδροξυλομάδα
και το καρβονύλιο βρίσκονται στο ίδιο μόριο του μονοσακχαρίτη, μπορεί να
πραγματοποιηθεί ενδομοριακή πυρηνόφιλη προσθήκη, που
θα οδηγήσει στον σχηματισμό
κυκλικής ημιακετάλης (2).
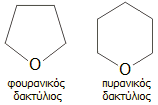 Οι πενταμελείς και οι εξαμελείς κυκλικές ημιακετάλες είναι
ιδιαίτερα σταθερές ενώσεις. Για τον λόγο αυτό οι υδατάνθρακες σε
διαλύματα βρίσκονται σε μορφές τόσο ανοικτής, όσο και κλειστής αλυσίδας σε μια
κατάσταση ισορροπίας, όπου κατά κανόνα κυριαρχεί η κλειστή (κυκλική) μορφή μέσω
του ημιακεταλικού δεσμού. Στην περίπτωση των εξοζών, το οξυγόνο του
υδροξυλίου του άνθρακα C5 καθίσταται το αιθερικό οξυγόνο εξαμελούς (πυρανικού)
δακτυλίου ή το το οξυγόνο του υδροξυλίου του άνθρακα C4 καθίσταται το αιθερικό
οξυγόνο πενταμελούς (φουρανικού) δακτυλίου.
Οι πενταμελείς και οι εξαμελείς κυκλικές ημιακετάλες είναι
ιδιαίτερα σταθερές ενώσεις. Για τον λόγο αυτό οι υδατάνθρακες σε
διαλύματα βρίσκονται σε μορφές τόσο ανοικτής, όσο και κλειστής αλυσίδας σε μια
κατάσταση ισορροπίας, όπου κατά κανόνα κυριαρχεί η κλειστή (κυκλική) μορφή μέσω
του ημιακεταλικού δεσμού. Στην περίπτωση των εξοζών, το οξυγόνο του
υδροξυλίου του άνθρακα C5 καθίσταται το αιθερικό οξυγόνο εξαμελούς (πυρανικού)
δακτυλίου ή το το οξυγόνο του υδροξυλίου του άνθρακα C4 καθίσταται το αιθερικό
οξυγόνο πενταμελούς (φουρανικού) δακτυλίου.
Η γλυκόζη σε υδατικό διάλυμα απαντά κυρίως με τη μορφή εξαμελούς
δακτυλίου της πυρανόζης, που οφείλεται σε ενδομοριακή πυρηνόφιλη προσθήκη του
-ΟΗ του άνθρακα 5 (C5) στον καρβονυλικό άνθρακα 1 (C1), όπως δείχνεται στην
ισορροπία (2).
Οι κυκλικές δομές
παριστάνονται κυρίως με τις προβολές κατά Haworth. Στις προβολές αυτές
ο ημιακεταλικός δακτύλιος σχεδιάζεται σαν να είχε επίπεδη μορφή, όπου το άτομο του ημιακεταλικού οξυγόνου τοποθετείται
συνήθως πίσω και δεξιά. Οι "παχιές" γραμμές του δακτυλίου παριστάνουν την πλευρά
του δακτυλίου προς τον αναγνώστη.
Στην πραγματικότητα ο δακτύλιος της πυρανόζης
δεν είναι επίπεδος και έχει
τη δομή κυκλοεξανικού ανακλίντρου (βλ. δομές στο επάνω μέρος της
ιστοσελίδας), αλλά οι προβολές
κατά Haworth χρησιμοποιούνται ευρύτατα, επειδή σχεδιάζονται
ευκολότερα και παρέχουν τη δυνατότητα άμεσης διάκρισης των cis- και trans-
συσχετισμών των υδροξυλίων του δακτυλίου. Στις προβολές κατά Haworth συνήθως δεν
εμφανίζονται (αλλά εννοούνται) στον δακτύλιο τα άτομα άνθρακα και οι δεσμοί C-H.
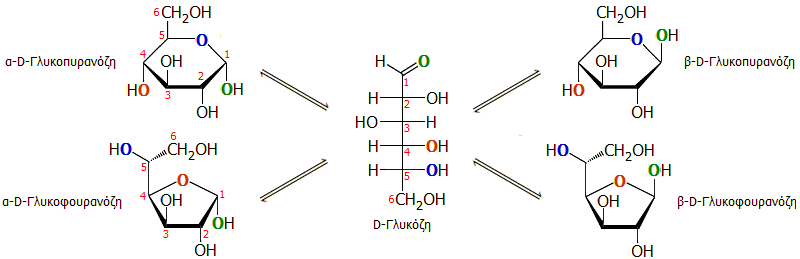
Στο επόμενο σχήμα δείχνονται οι 5 δυνατές μορφές
της D-γλυκόζης σε υδατικό διάλυμα. Από αυτές κυριαρχούν οι πυρανοζικές
μορφές (>99%) και σε αναλογία 36:64 μεταξύ της α- και της β-D-γλυκοπυρανόζης, η
ανοικτή (άκυκλη) μορφή περιορίζεται περίπου στο 0,25%, ενώ οι φουρανοζικές
μορφές βρίσκονται σε πρακτικώς αμελητέες αναλογίες.
|
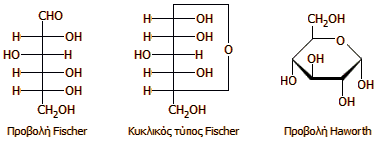
Σύγκριση των προβολών της D-γλυκόζης.
Στους κυκλικούς τύπους δείχνεται το α-ανωμερές. |
Μετατροπή της
προβολής κατά Fischer σε προβολή κατά Haworth
1. Προσδιορίζουμε την υδροξυλομάδα που θα κυκλοποιηθεί με την καρβονυλική ομάδα (μέσω σχηματισμού
ημιακετάλης). Το οξυγόνο αυτού του υδροξυλίου θα καταστεί το οξυγόνο του
δακτυλίου. Για την D-γλυκόζη είναι το υδροξύλιο του C5 για να ληφθεί η μορφή
πυρανόζης.
2. Φροντίζουμε η υδροξυλομάδα
αυτή να βρίσκεται στο κάτω μέρος της προβολής κατά Fischer.
3. Σχεδιάζουμε την προβολή κατά Haworth έτσι ώστε το οξυγόνο του δακτυλίου να είναι στο επάνω μέρος. Στις
πυρανόζες συνηθίζεται ο εξαμελής δακτύλιος να σχεδιάζεται με την πλευρά κάτω και
το οξυγόνο στην πάνω δεξιά γωνία.
4. Υποκαταστάτες στη δεξιά
πλευρά της προβολής κατά Fischer θα πρέπει να τοποθετηθούν στο κάτω μέρος της
προβολής κατά Haworth (κανόνας "κάτω-δεξιά"). Οι υποκαταστάτες στην αριστερά πλευρά της προβολής κατά
Fischer θα πρέπει να τοποθετηθούν στο επάνω μέρος της προβολής κατά Haworth.
5. Στην κυκλική μορφή, το
υδροξύλιο του άνθρακα C1 (το ανωμερικό κέντρο) μπορεί να βρίσκεται κάτω (α-ανωμερές)
ή πάνω (β-ανωμερές) ως προς το επίπεδο του δακτυλίου.
|
Πολυστροφισμός των
μονοσακχαριτών [Αναφ. 5]
'Οταν ένας μονοσακχαρίτης
υποστεί κυκλοποίηση αποκτώντας πυρανοζική ή φουρανοζική μορφή, τότε σχηματίζεται ένα
νέο στερεογονικό κέντρο στον πρώην καρβονυλικό άνθρακα. Τα δύο νέα διαστερεομερή ονομάζονται ανωμερή και ο ημιακεταλικός
άνθρακας ανωμερικό κέντρο ή ανωμερικός άνθρακας.
Τα δύο ανωμερή στις αλδοεξόζες
χαρακτηρίζονται γενικά ως: α-ανωμερές και β-ανωμερές. Στα α-ανωμερή
η ομάδα -ΟΗ του C1 βρίσκεται σε θέση trans ως προς την ομάδα -CH2OH
του C5 στις γλυκοπυρανόζες ή ως προς την ομάδα -CH(OH)CH2OH
του C4 στις γλυκοφουρανόζες, ενώ στα β-ανωμερή βρίσκεται σε θέση cis.
'Οταν η μια από τις δύο μορφές διαλυθεί στο νερό σταδιακά μετατρέπεται
μερικώς στην άλλη μορφή, μέχρις ότου επέλθει ισορροπία μεταξύ των δύο ανωμερών
μορφών. Κατά τη διάρκεια της
μετατροπής αυτής η στροφική ικανότητα του διαλύματος μεταβάλλεται και το
φαινόμενο αυτό ονομάζεται πολυστροφισμός (mutarotation). Το φαινόμενο
αυτό παρατηρήθηκε για πρώτη φορά το 1846 από τον Γάλλο χημικό
Augustin-Pierre Dubrunfaut (1797-1881).
Η ανωμερείωση καταλύεται από
βάσεις και επομένως η ταχύτητα αποκατάστασης της ισορροπίας μεταξύ των ανωμερών
μορφών αυξάνει με το pH του διαλύματος. Ο μηχανισμός της αναμερείωσης της
α-γλυκόζης προς β-γλυκόζη δείχνεται από την παρακάτω αλληλουχία αντιδράσεων:
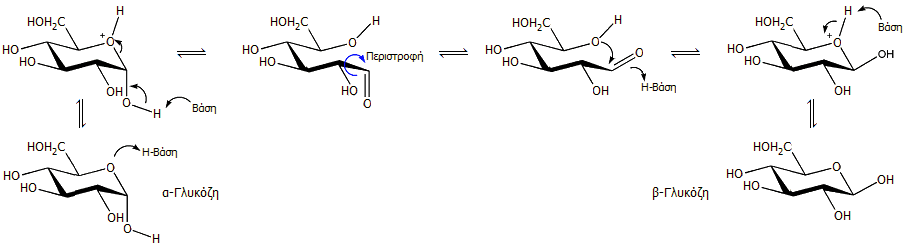
Μηχανισμός κατάλυσης της ανωμερείωσης
της α-γλυκόζης προς β-γλυκόζη. Η ισορροπία αποκαθίσταται μέσω της ανοικτής
μορφής του σακχάρου.
Τα δύο ανωμερή της
D-γλυκοπυρανόζης
μπορούν να κρυσταλλωθούν και να απομονωθούν. Με ανακρυστάλλωση D-γλυκόζης σε
αιθανόλη λαμβάνεται καθαρή α-D-γλυκοπυρανόζη (σ.τ. 146°C, [α]D +112,2°), ενώ με ανακρυστάλλωσή της σε μίγμα αιθανόλης-ύδατος λαμβάνεται καθαρή β-D-γλυκοπυρανόζη
(σ.τ. 148-155°C, [α]D +18,7°).
 Σε
στερεά κατάσταση τα ανωμερή μπορούν να διατηρηθούν σταθερά για απεριόριστο χρονικό
διάστημα. Μόλις διαλυθεί ένα από τα δύο ανωμερή στο νερό αρχίζει η διαδικασία
της ανωμερείωσης που, ανάλογα με τις συνθήκες, μπορεί να διαρκέσει λίγες ώρες
και καταλήγει σε μίγμα με [α]D
+52,5° (που αντιστοιχεί σε αναλογία α-ανωμερές:β-ανωμερές = 36:64) [Αναφ. 2].
Σε
στερεά κατάσταση τα ανωμερή μπορούν να διατηρηθούν σταθερά για απεριόριστο χρονικό
διάστημα. Μόλις διαλυθεί ένα από τα δύο ανωμερή στο νερό αρχίζει η διαδικασία
της ανωμερείωσης που, ανάλογα με τις συνθήκες, μπορεί να διαρκέσει λίγες ώρες
και καταλήγει σε μίγμα με [α]D
+52,5° (που αντιστοιχεί σε αναλογία α-ανωμερές:β-ανωμερές = 36:64) [Αναφ. 2].
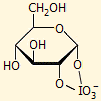
Η αντίδραση ανωμερείωσης μπορεί
να παρακολουθηθεί πολωσιμετρικώς, ωστόσο μπορεί να παρακολουθηθεί και με βάση την ταχύτητα
αντίδρασης του διαλύματος της γλυκόζης με υπεριωδικά ιόντα, που εκλεκτικά
διασπούν τους δεσμούς C-C που περιέχουν υδροξύλια (αντίδραση
Malaprade). Η δυνατότητα αυτή
οφείλεται στο εξής γεγονός: Το α-ανωμερές (δηλ. η α-D-γλυκοπυρανόζη)
διαθέτει cis-υδροξύλια στις θέσεις C1 και C2, γεγονός που διευκολύνει την
αντίδρασή της με υπεριωδικά ιόντα, αφού η αντίδραση χωρεί μέσω ενδιάμεσου
σχηματισμού κυκλικού ανιοντικού υπεριωδικού εστέρα (βλ. τύπο αριστερά). Αντίθετα, το β-ανωμερές (δηλ. η β-D-γλυκοπυρανόζη)
έχει στις ίδιες θέσεις trans-υδροξύλια, ο σχηματισμός του ενδιάμεσου υπεριωδικού
εστέρα δεν ευνοείται και έτσι αντιδρά πιο αργά (περίπου 4 φορές) με τα υπεριωδικά
ιόντα.
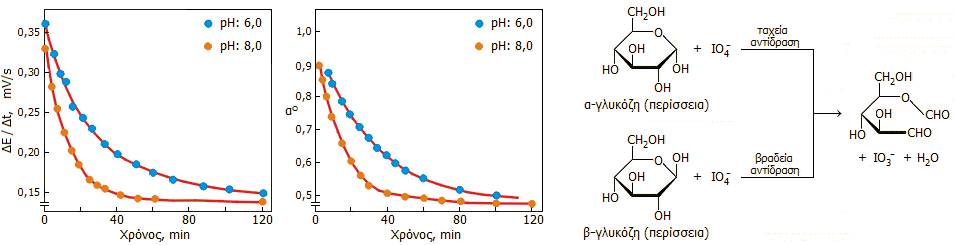
|
Δύο
τρόποι παρακολούθησης της ανωμερείωσης α-γλυκόζης προς β-γλυκόζη.
Αριστερά: με βάση την ταχύτητα αντίδρασης του διαλύματός της
με υπεριωδικά ιόντα (βλέπε κείμενο).
Δεξιά: με βάση τη στροφική ικανότητα του διαλύματός της. Και
στις δύο περιπτώσεις η θερμοκρασία ήταν 22°C, ενώ η μελέτη
πραγματοποιήθηκε σε pH 6,0 και pH 8,0. Και οι δύο (τελείως
διαφορετικές) μέθοδοι έδωσαν συγκρίσιμα αποτελέσματα. Επίσης, είναι
εμφανές ότι η ανωμερείωση επέρχεται ταχύτερα στο αλκαλικότερο
διάλυμα [Αναφ. 5β].
|
|
Αντίδραση περίσσειας α- και β-γλυκόζης με υπεριωδικά ιόντα.Η
α-γλυκόζη αντιδρά ταχύτερα λόγω της παρουσίας cis-υδροξυλίων στους
άνθρακες C1 και C2, σε αντίθεση με τη β-γλυκόζη, όπου τα υδροξύλια
αυτά βρίσκονται σε θέση trans, γεγονός που καθιστά τον αντίστοιχο
δεσμό C-C περισσότερο ευπρόσβλητο από τα υπεριωδικά ανιόντα. |
Με βάση τα προηγούμενα
αναμένεται ότι διάλυμα γλυκόζης, το οποίο αρχικά περιέχει σχεδόν καθαρή α-D-γλυκοπυρανόζη,
όταν είναι πρόσφατο θα αντιδρά ταχύτερα με τα υπεριωδικά ιόντα, ενώ όσο
παλαιώνει η ταχύτητα της ίδιας αντίδρασης θα μειώνεται. Το γεγονός αυτό
επαληθεύτηκε πειραματικά με ποτενσιομετρική παρακολούθηση της αντίδρασης με
εκλεκτικό ηλεκτρόδιο υπερχλωρικών ιόντων, το οποίο αποκρίνεται εξίσου καλά και
προς τα υπεριωδικά ιόντα και το δυναμικό του αποτελεί γραμμική συνάρτηση του
λογαρίθμου της ενεργότητας των υπεριωδικών ιόντων. Ο ρυθμός μείωσης της ταχύτητας αντίδρασης (εκφρασμένη
σε ταχύτητα μεταβολής του δυναμικού του εκλεκτικού ηλεκτροδίου) συμπίπτει με
εκείνο της μείωσης της στροφικής ικανότητας (όπως φαίνεται και από το σχήμα
πάνω αριστερά), αφού η ειδική στροφική ικανότητα του β-ανωμερούς είναι μικρότερη από
εκείνη του α-ανωμερούς.
Να σημειωθεί ότι κατά την αντίδραση
της γλυκόζης με περίσσεια υπεριωδικών αλάτων επέρχεται πλήρης διάσπαση του
σακχάρου σύμφωνα
με τη συνολική αντίδραση:

'Οπως είναι φυσικό να αναμένει κανείς, η παραπάνω αντίδραση πραγματοποιείται σε πολλά στάδια και απαιτεί (ανάλογα με τις συνθήκες, όπως το pH, η
θερμοκρασία, το φως κ.α.) ώρες ή και ημέρες για να περατωθεί με την παραπάνω στοιχειομετρία
[Αναφ. 5γ]. Αρχικά προχωρά
ταχύτατα και επιβραδύνεται στα στάδια παραγωγής του μυρμηκικού οξέος.
|
Πόσες
ισομερείς μορφές αλδοεξοζών υπάρχουν;
Συνολικά υπάρχουν οκτώ διαφορετικές αλδοεξόζες, οι
οποίες ορίζονται από τη στερεοχημεία των ανθράκων C2,
C3 και C4. 'Ολες διαθέτουν
τις δύο ανωμερείς α- και β-μορφές (στερεοχημεία του άνθρακα
C1). Οι D-γλυκοπυρανοζικές μορφές των οκτώ
αλδοεξοζών (περιλαμβανομένης και της γλυκόζης) και οι ονομασίες τους δίνονται
στο παρακάτω σχήμα.
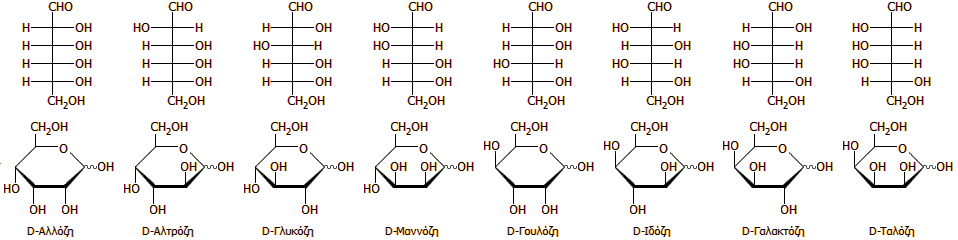
|
Οι οκτώ διαφορετικές D-αλδοεξόζες (διαστερεομερή): 'Ακυκλοι και κυκλικοί τύποι τους
(γλυκοπυρανοζικές
μορφές). Η
"κυματιστή" σύνδεση του υδροξυλίου στον
C1 καθορίζει τον
τύπο του ανωμερούς (α- ή β-) της αντίστοιχης αλδοεξόζης (υδροξύλιο
κάτω ή πάνω από το επίπεδο του γλυκοπυρανοζικού δακτυλίου στα α- και
β-ανωμερή, αντιστοίχως). |
Η παραπάνω σειρά
παρουσίασης των D-αλδοεξοζών δεν
είναι τυχαία αλλά ακολουθεί ένα είδος απαρίθμησης στο δυαδικό
σύστημα. 'Ετσι, αν π.χ. στους κυκλικούς τύπους, οι
άνθρακες C4, C5 και C6 ονομασθούν 0 και 1, ανάλογα
με το αν το
υδροξύλιο βρίσκεται κάτω ή πάνω από το επίπεδο του δακτυλίου, προκύπτουν οι αριθμοί 0 έως 7 στο
δυαδικό: 000, 001, 010, 011, 100,
101, 110 και 111. Στη σειρά αυτή, ένας
μνημονικός κανόνας, που αποδίδεται στον Emil Fischer, για
τις ονομασίες τους αποτελεί η φράση: ΑLL ALTRUISTS GLADLY MAKE GUM
IN GALLON TANKS
[Αναφ 2].
Από τις παραπάνω D-αλδοεξόζες,
αυτές που βρίσκονται σε μεγάλες ποσότητες στη φύση είναι η
D-γλυκόζη, η D-μαννόζη και η D-γαλακτόζη. Λαμβάνοντας υπ' όψη ότι
κάθε αλδοεξόζη μπορεί να εμφανισθεί σε: άκυκλη μορφή, α- και β-γλυκοπυρανοζική
μορφή και σε α- και β-γλυκοφουρανοζική μορφή, προκύπτουν
συνολικά 5 x 8 = 40 μορφές. Αν επιπλέον λάβουμε
υπόψη ότι κάθε μία από αυτές διαθέτει και τον κατοπτρικό αντίποδα (D-
και L-μορφές, συμπεραίνουμε ότι συνολικά
υπάρχουν 80 διαφορετικές μορφές αλδοεξοζών. |
Επιμήκυνση της ανθρακικής
αλυσίδας (δόμηση σακχάρου). Σύνθεση
Kiliani-Fischer
[Αναφ.
6]
|

Heinrich Kiliani
(1855-1945). Γερμανός χημικός, γνωστός για τις εργασίες του στη
χημεία των υδατανθράκων.
|
Το 1886, μετά από
τη διαπίστωση του
Heinrich Kiliani,
τότε βοηθού
του Emil Fischer,
ότι οι αλδόζες αντιδρούν με το
υδροκυάνιο
(ΗCN)
παρέχοντας κυανυδρίνες, οι οποίες μπορούν να αναχθούν (μέσω ενδιάμεσου
σχηματισμού λακτονών) προς αλδεΰδες. Ο
Fischer
αντιλήφθηκε τη σπουδαιότητα της αντίδρασης και μαζί με τον Kiliani δημοσίευσαν την περίφημη αντίδραση
επιμήκυνσης της ανθρακικής αλυσίδας των αλδοζών το 1890,
η οποία έχει το ακόλουθο γενικό σχήμα:
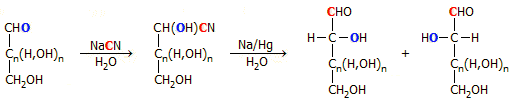
Τα διαστερεομερή μπορούν να διαχωρισθούν
κλασματικές κρυσταλλώσεις (των ίδιων ή παραγώγων τους), εκχύλιση ή με χρωματογραφικές
τεχνικές ως λακτόνες (πριν από το στάδιο αναγωγής) ή των σακχάρων. Η σύνθεση και ο επακόλουθος διαχωρισμός των διαστερεομέρων είναι
επίπονες διαδικασίες (τοξικά αντιδραστήρια, μικρές αποδόσεις) και φυσικά έχουν πρακτική
χρησιμότητα μόνο για τη σύνθεση σακχάρων τα οποία δεν μπορούν να ληφθούν από φυσικές πηγές
(μη φυσικά σάκχαρα).
Ωστόσο, η σύνθεση αυτή χρησίμευσε κυρίως για τον προσδιορισμό της στερεοχημείας των σακχάρων, όπως
π.χ. αναφέρεται στη συνέχεια για την κλασική περίπτωση της γλυκόζης.
Αν και ως συνθετική μέθοδος είναι επίπονη (εμπλέκει
τοξικά αντιδραστήρια, οι αποδόσεις είναι μικρές), η σύνθεση Kiliani-Fischer
είναι πολύτιμη γιατί δεν επιδρά στην υφιστάμενη
στερεοχημεία του υπό "επιμήκυνση" υδατάνθρακα. Για παράδειγμα, η εφαρμογή της
σύνθεσης Kiliani-Fischer στην D-αραβινόζη παρέχει ισομοριακό μίγμα D-γλυκόζης και D-μαννόζης:
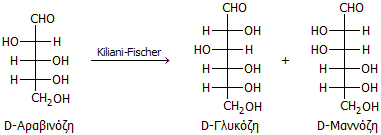
'Ετσι, με τη σύνθεση Kiliani-Fischer, ξεκινώντας
από την D- και την L-γλυκεριναλδεΰδη, μπορούν να παρασκευασθούν και οι οκτώ
αλδοεξόζες στην
D-
και στην L-μορφή τους, αντιστοίχως. Το 1890, μέσω αυτού του
συνθετικού σχήματος ο Fischer κατάφερε, ξεκινώντας από τη γλυκερίνη να
παρασκευάσει γλυκόζη, μαννόζη και φρουκτόζη, συνθέσεις που λαμβάνοντας υπόψη τα μέσα
και τις γνώσεις εκείνης της εποχής θεωρούνται μνημειώδης.
Βελτιώσεις της σύνθεσης. 'Ενα πρόβλημα της μεθόδου είναι η περαιτέρω αναγωγή
της αλδεϋδικής ομάδας (-CHO) προς υδροξυμεθυλο-ομάδα (-CH2OH)
με αποτέλεσμα την παραγωγή πολυυδροξυένωσης (αλδιτόλης) αντί της ζητούμενης αλδόζης.
Το γεγονός
αυτό οδηγούσε σε ακάθαρτα προϊόντα και μειωμένες αποδόσεις. Το πρόβλημα αυτό
περιορίζεται σημαντικά με αντικατάσταση της αναγωγής με αμάλγαμα Na, με
υδρογόνωση του διαλύματος παρουσία αιωρήματος καταλύτη παλλαδίου σε υπόστρωμα
θειικού βαρίου ("δηλητηριασμένος" καταλύτης), οπότε αποφεύγονται οι προσμίξεις
πολυυδροξυενώσεων (αλδιτολών) και βελτιώνονται οι σχετικές αποδόσεις.
|
Προσδιορισμός της δομής
της γλυκόζης
Ο
Fischer είχε προσδιορίσει ότι η γλυκόζη είναι μια αλδοεξόζη, αλλά ήθελε
να διαπιστώσει και τη στερεοχημική της διαμόρφωση, δηλαδή πoια από τις 16
δυνατές (8 D- και 8
L-) αλδοεξόζες είναι. Εκείνη την εποχή οι χημικοί δεν
διέθεταν τα μέσα για να καθορίσουν την απόλυτη (πραγματική) διαμόρφωση στο χώρο
και ποιο εναντιομερές (D- ή L-) με αναφορά πάντοτε στις αντίστοιχες διαμορφώσεις
της γλυκεραλδεΰδης. Οι κυκλικές δομές προτάθηκαν από τον Haworth αρκετά αργότερα
(1928).
Ο Fischer χρειαζόταν μια βάση
αναφοράς και αυθαίρετα επέλεξε την D-διαμόρφωση, γνωρίζοντας ότι είχε 50:50
πιθανότητες να είναι η πραγματική ή όχι.
'Oπως αποδείχθηκε 60 χρόνια αργότερα (Bijvoet
1951) η δομή αυτή αποδείχθηκε ότι ήταν και η σωστή (βλ.
Χημική ένωση του μήνα: Τρυγικό οξύ). Ωστόσο, και λάθος να ήταν, αυτό δεν θα
επηρέαζε σε τίποτα τα συμπεράσματα και το σύστημα κατάταξης των υδατανθράκων,
όπως και κάθε άλλης ομάδας εναντιομερών ενώσεων.
 Το 1891 ο Fischer
με πειράματα καθόρισε τη στερεοχημεία των ανθράκων C2, C3 και C4 της γλυκόζης σε
σχέση με εκείνη του C5 και απέδειξε ότι η γλυκόζη ήταν ή η ένωση που φαίνεται
δίπλα ή η εναντιομερής μορφή της. Για τον προσδιορισμό αυτό χρειάστηκε δουλειά
πολλών ετών και πολλά και διαφορετικού τύπου πειράματα. Το 1891 ο Fischer
με πειράματα καθόρισε τη στερεοχημεία των ανθράκων C2, C3 και C4 της γλυκόζης σε
σχέση με εκείνη του C5 και απέδειξε ότι η γλυκόζη ήταν ή η ένωση που φαίνεται
δίπλα ή η εναντιομερής μορφή της. Για τον προσδιορισμό αυτό χρειάστηκε δουλειά
πολλών ετών και πολλά και διαφορετικού τύπου πειράματα.
Στα πειράματα αυτά ο Fischer
χρησιμοποίησε ποικιλία αντιδράσεων και αντιδραστηρίων. Μια από τις "αγαπημένες"
του αντιδράσεις ήταν η αντίδραση των σακχάρων με τη
φαινυλυδραζίνη,
C6H5NHNH2,
ένα
αντιδραστήριο που ο ίδιος ανακάλυψε και εισήγαγε στη μελέτη των υδατανθράκων.
Η φαινυλυδραζίνη
παρασκευάζεται εύκολα με αναγωγή του διαζωνιακού άλατος της ανιλίνης και αντιδρά
με κάθε καρβονυλική ένωση. Με τα σάκχαρα αντιδρά σε δύο (πλήρως ελεγχόμενα
στάδια) παρέχοντας δύο παράγωγα: Σε χαμηλές θερμοκρασίες παρέχουν τις φαινυλυδραζόνες.
Οι φαινυλυδραζόνες των υδατανθράκων είναι σχετικώς διαλυτές στο νερό και δεν
είναι ιδιαίτερα χρήσιμες για τον χαρακτηρισμό των υδατανθράκων, αλλά μπορούν να
χρησιμοποιηθούν για το διαχωρισμό μίγματός τους με κλασματική κρυστάλλωση των
ίδιων.
Σε υψηλότερες θερμοκρασίας (σε
υδατόλουτρο) οι υδατάνθρακες με περίσσεια φαινυλυδραζίνης παρέχουν τις
οζαζόνες (osazones). Μέρος της φαινυλυδραζίνης δρα οξειδωτικά και οξειδώνει την υδροξυλομάδα του C2 των αλδοζών προς καρβονυλική ομάδα, η οποία
αντιδρά με τρίτο μόριο φαινυλυδραζίνης παρέχοντας οζαζόνη. Οι οζαζόνες είναι αδιάλυτες στο νερό και λαμβάνονται
εύκολα σε καθαρή κρυσταλλική μορφή. Η κρυσταλλική μορφή τους, ο χρόνος
σχηματισμού τους όσο
και (κυρίως) το σημείο τήξεώς τους αποτελεί χαρακτηριστικό ποιοτικής ταυτοποίησης
κάθε υδατάνθρακα.
Η περίσσεια φαινυλυδραζίνης δρα οξειδωτικά και
οξειδώνει την υδροξυλομάδα του C2 των αλδοζών προς καρβονυλική ομάδα η οποία
αντιδρά με τρίτο μόριο φαινυλυδραζίνης παρέχοντας την οζαζόνη. 'Ετσι, π.χ. η
αντίδραση της D-γλυκόζης με φαινυλυδραζίνη παρέχεται από την ακόλουθη σειρά
αντιδράσεων:
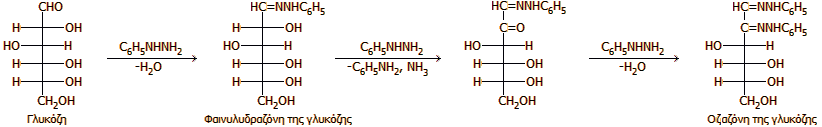
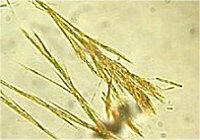
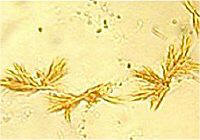
Κρύσταλλοι οζαζονών της γλυκόζης, της
μαλτόζης, της γαλακτόζης και της λακτόζης [Πηγή].
Στο επόμενο σχήμα φαίνονται τα
προϊόντα της αντίδρασης Kiliani-Fischer στα 4 δυνατά διαστερεομερή των
αλδοπεντοζών:
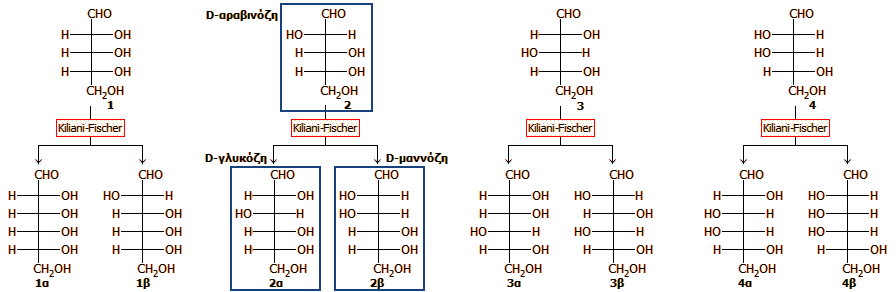
Ο Fischer για τον
προσδιορισμό της σχετικής θέσης των υδροξυλίων στο μόριο της
D-γλυκόζης (τύπος 2α) είχε στη διάθεσή του καθαρά
δείγματα D-αραβινόζης, D-γλυκόζης και D-μαννόζης, το μόνο που
γνώριζε για τα σάκχαρα αυτά ήταν ότι το πρώτο ήταν μια
αλδοπεντόζη και τα δύο άλλα αλδοεξόζες και βασίστηκε στα εξής πειραματικά
δεδομένα:
1) Η D-γλυκόζη και
η D-μαννόζη με φαινυλυδραζίνη παρέχουν την ίδια οζαζόνη. Αυτό
σημαίνει ότι οι δύο αλδοεξόζες είχαν την ίδια στερεοχημεία στους άνθρακες C3,
C4 και C5.
2) Η D-γλυκόζη και
η D-μαννόζη με νιτρικό όξύ οξειδώνονται και παρέχουν οπτικώς
ενεργά1,6-δικαρβοξυλικά οξέα. Επομένως αποκλείονται τα ζεύγη 1α - 1β
και 4α - 4β, επειδή οι αλδοεξόζες 1α και 4α θα παρείχαν οπτικώς
ανενεργά1,6-δικαρβοξυλικά οξέα, λόγω της ύπαρξης επιπέδου συμμετρίας στα μόριά τους χάρις στο
οποίο η στροφική δράση του ενός τμήματος εξουδετερώνεται επακριβώς από την ίση και
αντίθετη στροφική δράση του άλλου τμήματος (μεσο-ένωση).
3) Η αντίδραση επιμήκυνσης της
ανθρακικής αλυσίδας Kiliani-Fischer στην D-αραβινόζη, παρέχει μίγμα D-γλυκόζης και D-μαννόζης,
επομένως η D-αραβινόζη θα πρέπει να έχει τη δομή 2 ή 3. Οι
1 και 4 αποκλείονται λόγω της προηγούμενης παρατήρησης.
4) Η D-αραβινόζη με
νιτρικό οξύ παρέχει οπτικώς ενεργό 1,5-δικαρβοξυλικό οξύ, επομένως
αποκλείονται οι δομές 3α - 3β, επειδή προέρχονται από την αλδοπεντόζη
3, η οποία θα παρείχε οπτικώς ανενεργό 1,5-δικαρβοξυλικό οξύ (μεσο-ένωση). Στο στάδιο
αυτό ήταν πλέον γνωστό ότι η δομή της D-αραβινόζης
είναι η 2 και ότι οι δομές 2α και 2β ανήκουν στην
D-γλυκόζη και στην D- μαννόζη.
Δεν απέμενε
πλέον παρά να διευκρινιστεί
ποια από τις δύο δομές ανήκει στο κάθε ένα από τα δύο σάκχαρα.
5) Με μια σειρά αντιδράσεων ο Fischer
πέτυχε την ανταλλαγή των ομάδων στα άκρα της ανθρακικής αλυσίδας, δηλ. η ομάδα -CHO
αντικαθίσταται με την ομάδα -CH2OH
και αντιστρόφως. Με την ανταλλαγή των άκρων (termini
exchange), η μεν D-μαννόζη (2β) έδωσε τον εαυτό της, ενώ η
γλυκόζη (2α) έδωσε ένα νέο σάκχαρο, που ο Fischer ονόμασε L-γουλόζη.
Μ
Με βάση τις παραπάνω 5 πειραματικές παρατηρήσεις
συνεπάγεται ότι η D-γλυκόζη έχει τη δομή 2α και η D-μαννόζη τη δομή 2β. |
Σμίκρυνση της ανθρακικής
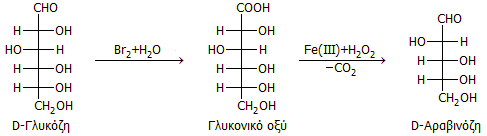
αλυσίδας (αποδόμηση σακχάρου). Αντίδραση Ruff
To 1898, o
Otto Ruff
δημοσίευσε μια μέθοδο μετατροπής της
D-γλυκόζης σε D-αραβινόζη.
Σύμφωνα με τη μέθοδο αυτή, η αλδεϋδική ομάδα οξειδώνεται επιλεκτικά προς καρβοξυλική
ομάδα
με βρωμιούχο ύδωρ παρέχοντας έτσι γλυκονικό οξύ (gluconic acid). Στη
συνέχεια, με επίδραση μίγματος τρισθενούς σιδήρου και πυκνού υπεροξειδίου του υδρογόνου, η καρβοξυλομάδα απομακρύνεται ως CO2 και η
υδροξυμεθυλοομάδα, που την ακολουθεί, μετατρέπεται σε αλδεϋδική ομάδα:
Γενικές
αντιδράσεις αλδοζών
Οι μονοσακχαρίτες
συμπεριφέρονται χημικά όπως οι απλές αλκοόλες. Οι υδροξυλομάδες μπορούν να
υποστούν τις τυπικές αντιδράσεις εστεροποίησης και αιθεροποίησης. Επειδή περιέχουν πολλές υδροξυλομάδες, οι μονοσακχαρίτες είναι συνήθως διαλυτοί στο νερό, αλλά πρακτικώς αδιάλυτοι
στους οργανικούς διαλύτες (π.χ. στον διαιθυλαιθέρα).
Αναγωγή. Με ήπια αναγωγικά μέσα η γλυκόζη ανάγεται προς την
αντίστοιχη πολυαλκοόλη, ενώ υπό έντονες συνθήκες (θέρμανση με HI σε κλειστό
σωλήνα) παρέχει (σε μικρές αποδόσεις) κ-εξάνιο. Με την τελευταία αντίδραση
διαπιστώθηκε η παρουσία της "σπονδυλικής στήλης" των έξι ανθράκων στις πρώτες
μελέτες της δομής της γλυκόζης.
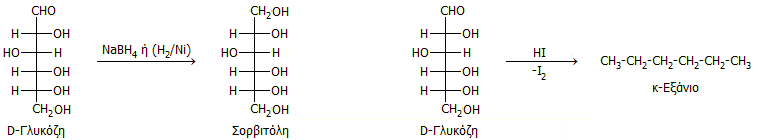
Οξείδωση.
Οι αλδόζες (γενικά) με ήπια οξείδωση (υδατικό διάλυμα
Br2, στην ουσία το οξειδωτικό
αντιδραστήριο είναι το υποβρωμιώδες οξύ HBrO) παρέχουν αλδονικά οξέα
(οξείδωση της ομάδας -CHO, προς -COOH), ενώ με εντονότερη οξείδωση (αραιό HNO3)
παρέχουν αλδαρικά οξέα (οξείδωση και των δύο τερματικών ομάδων προς -COOH).
Ειδικά, η τελευταία οξείδωση
προσέφερε (όπως προαναφέρθηκε) χρήσιμες
πληροφορίες για τον προσδιορισμό της στερεοχημείας των αντίστοιχων σακχάρων. 'Ετσι, η
γλυκόζη παρέχει τις αντιδράσεις:
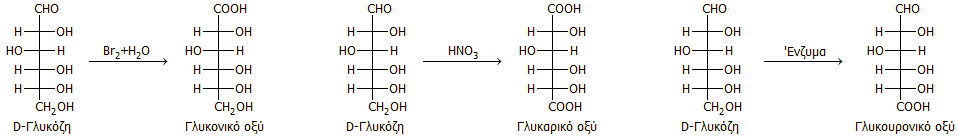
Να σημειωθεί ότι μέρος της
γλυκόζης οξειδώνεται στον οργανισμό προς γλυκουρονικό οξύ (glucuronic
acid). Ως παράγωγα του γλυκουρονικού οξέα αποβάλλει ο οργανισμός διάφορες
τοξικές ουσίες.
Η γλυκόζη ως αναγωγικό
μέσον.
Οι αλδόζες, όπως και άλλα
σάκχαρα, λόγω της παρουσίας της αλδεϋδικής ομάδας (στην άκυκλη μορφή) ή της ημιακεταλικής
ομάδας (στην κυκλική μορφή τους), δρουν ως ήπια αναγωγικά μέσα οξειδούμενες προς αλδονικά
οξέα. Τα
αντιδραστήρια
Tollen
(αμμωνιακό
διάλυμα ιόντων Ag(Ι)),
Fehling (αλκαλικό
διάλυμα Cu(II) - τρυγικού άλατος),
Benedict
(αλκαλικό
διάλυμα Cu(ΙΙ)
-
κιτρικού άλατος) χρησιμοποιούνται για απλές δοκιμασίες ανίχνευσης και προσδιορισμού των
αποκαλούμενων αναγωγικών σακχάρων (στα δύο τελευταία αντιδραστήρια, τα τρυγικά
και τα κιτρικά ιόντα είναι απαραίτητα για να συμπλέκουν τον Cu(ΙΙ) και να το
διατηρούν σε διάλυμα στις ισχυρώς αλκαλικές συνθήκες της αντίδρασης. Με το αντιδραστήριο Tollen παρέχουν
μεταλλικό άργυρο, που υπό κατάλληλες συνθήκες μπορεί να αποτεθεί σχηματίζοντας
κάτοπτρο στα τοιχώματα του δοχείου αντίδρασης. Με τα αντιδραστήριο Fehling και
Benedict σχηματίζουν κεραμέρυθρο ίζημα Cu2O.
Οι αντιδράσεις αυτές είναι οι ακόλουθες:

Το αντιδραστήριο Tollen έχει γενική χρησιμότητα για
την ανίχνευση αλδεϋδών, ενώ το αντιδραστήριο Fehling χρησιμοποιείται τόσο για
την ποιοτική ανίχνευση αναγόντων σακχάρων, όσο και για τον ογκομετρικό
προσδιορισμό τους. Η αντίδραση ή μη ενός σακχάρου με τα παραπάνω αντιδραστήρια
κατατάσσει τα σάκχαρα σε αναγωγικά και μη
αναγωγικά.
 |
 |
|
 |
 |
|
Σχηματισμός κατόπτρου αργύρου κατά τη θετική ανίχνευση αλδεϋδικής
ομάδας με το αντιδραστήριο Tollens. |
Bernhard Tollens
(1841-1918). Γερμανός
χημικός, γνωστός για το ομώνυμο αντιδραστήριο και τις μελέτες του
πάνω στη δομή των σακχάρων. |
|
Αριστερά:
Αντιδραστήριο Fehling. Δεξιά: το ίδιο μετά την
αντίδραση με ένα αναγωγικό σάκχαρο (π.χ. γλυκόζη). |
Hermann von Fehling
(1812 - 1885). Ο Γερμανός χημικός που
ανέπτυξε τη μέθοδο ανίχνευσης και
προσδιορισμού αναγωγικών σακχάρων με το
ομώνυμο αντιδραστήριο. |
Σχηματισμός εστέρων και αιθέρων.
Οι μονοσακχαρίτες
συμπεριφέρονται ως απλές αλκοόλες, άρα οι υδροξυλομάδες μπορούν να
εστεροποιηθούν ή να αιθεροποιηθούν με τα κατάλληλα αντιδραστήρια. Τα παράγωγα τους, εστέρων
και αιθέρων, είναι διαλυτά σε οργανικούς διαλύτες και μπορούν να
απομονωθούν εύκολα. Η εστεροποίηση πραγματοποιείται μέσω της κατεργασίας με ακυλοχλωρίδιο ή ανυδρίτη οξέος, παρουσία βάσης και μπορεί να είναι πλήρης (εστεροποίηση
και των πέντε υδροξυλίων) σε περίπτωση περίσσειας αντιδραστηρίου, π.χ.
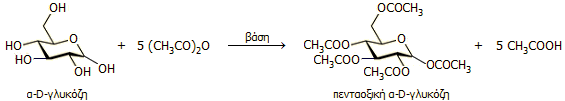
Οι
υδατάνθρακες μετατρέπονται σε αιθέρες κατά την επίδραση αλκυλιωτικών μέσων, όπως
αλκυλαλογονιδίων
παρουσία βάσης (σύνθεση αιθέρων κατά
Williamson)
ή θειικών αλκυλεστέρων. Η αιθεροποίηση μπορεί να πραγματοποιηθεί στο σύνολο των
υδροξυλίων ή σε
περιορισμένο αριθμό ανάλογα με τις συνθήκες.
Μέσω της εστεροποίησης ή (ακόμη καλύτερα) της
αιθεροποίησης, προστατεύονται οι υδροξυλικές ομάδες κατά την επίδραση
οξειδωτικών.
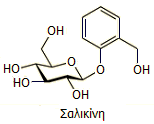 Γλυκοζίτες
γλυκόζης. Η ημιακετάλη ενός μονοσακχαρίτη
με μια αλκοόλη παρουσία όξινου καταλύτη, οδηγεί σε σχηματισμό μιας (πλήρους) ακετάλης στην
οποία το ανωμερικό ΟΗ (θέση C1) έχει αντικατασταθεί από την ομάδα -OR,
προερχόμενο από μια ένωση ΗΟR, που κατά κανόνα δεν έχει καμιά σχέση με
υδατάνθρακες και συχνά αναφέρεται ως άγλυκο τμήμα του σχηματιζόμενου
μορίου.
Γλυκοζίτες
γλυκόζης. Η ημιακετάλη ενός μονοσακχαρίτη
με μια αλκοόλη παρουσία όξινου καταλύτη, οδηγεί σε σχηματισμό μιας (πλήρους) ακετάλης στην
οποία το ανωμερικό ΟΗ (θέση C1) έχει αντικατασταθεί από την ομάδα -OR,
προερχόμενο από μια ένωση ΗΟR, που κατά κανόνα δεν έχει καμιά σχέση με
υδατάνθρακες και συχνά αναφέρεται ως άγλυκο τμήμα του σχηματιζόμενου
μορίου.
Οι ακετάλες των υδατανθράκων καλούνται
γλυκοζίτες (glycosides). Ανάλογα με το ανωμερές του μονοσακχαρίτη το
οποίο περιέχουν χαρακτηρίζονται ως α- ή β-γλυκοζίτες. 'Oπως και όλες
οι ακετάλες είναι οι γλυκοζίτες είναι σταθεροί σε υδατικά διαλύματα με ουδέτερο
pH.
Διασπώνται στα επιμέρους συστατικά τους κατά την υδρόλυσή τους με αραιό
διάλυμα οξέος ή
υπό την επίδραση εξειδικευμένων ενζύμων (α- και β-γλυκοσιδάσες).
Οι γλυκοζίτες είναι ευρύτατα
διαδεδομένοι στη φύση και πολλές ενώσεις βιοχημικού ενδιαφέροντος με σημαντικό ρόλο στους
ζωντανούς οργανισμούς. Πολλά φυτά περιέχουν
δραστικές χημικές ουσίες υπό τη μορφή κατά κανόνα αδρανών γλυκοζιτών. Οι
γλυκοζίτες αυτοί, υδρολύονται απελευθερώνοντας το δραστικό τμήμα τους με τη
βοήθεια εξειδικευμένων ενζύμων. Τυπικό παράδειγμα απλού γλυκοζίτη είναι η
σαλικίνη,
μια φυσική πηγή σαλικυλικού οξέος
(γλυκοζίτης β-γλυκόζης - σαλικυλικής αλκοόλης, βλ.
Χημική
ένωση του μήνα: Ακετυλοσαλικυλικό οξύ).
Ανεξάρτητα από το είδος της
ομάδας R οι γλυκοζίτες (ως πλήρεις ακετάλες) δεν υπόκεινται στο φαινόμενο του
πολυστροφισμού (δηλ. της ανωμερείωσης) στο οποίο υπόκεινται οι ημιακετάλες. 'Ετσι, συχνά για να προστατευθεί η θέση
(α- ή β-) του υδροξυλίου στις συνθέσεις παραγώγων υδατανθράκων και να αποφευχθεί
μια ανεπιθύμητη ανωμερείωση, σχηματίζονται απλοί γλυκοζίτες, π.χ. με μεθανόλη:
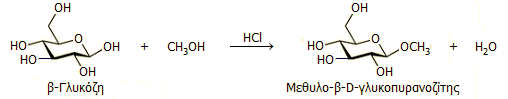
Η γλυκόζη ως συστατική μονάδα άλλων υδατανθράκων
Η γλυκόζη είναι ο πλέον διαδεδομένος
υδατάνθρακας-συστατικό άλλων υδατανθράκων, ορισμένα τυπικά παραδείγματα δίνονται
στη συνέχεια. Οι μονοσακχαρίτες "συγκρατούνται" μεταξύ του μέσω γλυκοζιτικών
δεσμών, δηλαδή μέσω του ημιακεταλικού υδροξυλίου του C1 και ενός άλλου
υδροξυλίου του επόμενου σακχάρου, οπότε οι δεσμοί αυτοί μπορεί να είναι α- ή β-γλυκοζιτικοί.
Δισακχαρίτες. Οι πιο γνωστοί δισακχαρίτες που
περιέχουν γλυκόζη ως συστατικό μονοσάκχαρο στο μόριό τους είναι η
σακχαρόζη
(η γνωστή ζάχαρη), η
μαλτόζη (κύριο προϊόν μερικής διάσπασης του αμύλου) και η
λακτόζη (το κύριο σάκχαρο του γάλακτος, γνωστό και ως γαλακτοσάκχαρο). Η
ισομαλτόζη
είναι μια παραλλαγή της μαλτόζης, όπου η σύνδεση των γλυκοζών πραγματοποιείται
με 1-6' δεσμούς, σε αντίθεση με τους 1-4' δεσμούς της μαλτόζη. Οι τύποι
τους είναι οι εξής:
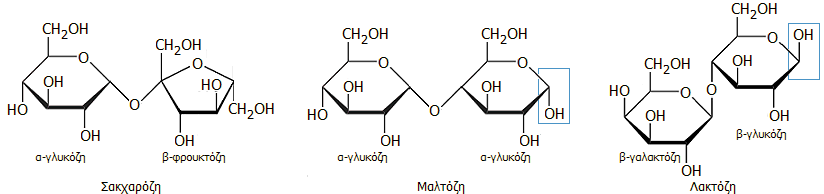
Από τους παραπάνω δισακχαρίτες
μόνο η μαλτόζη και η λακτόζη διαθέτουν αδέσμευτο ημιακεταλικό υδροξύλιο ή
ελεύθερο ανωμερικό άκρο (στο
μπλε τετράγωνο) και για τον λόγο αυτό είναι ανάγοντα σάκχαρα, σε αντίθεση με τη
σακχαρόζη, όπου το ημιακεταλικό υδροξύλιο συνδέεται με τη φρουκτόζη. Κατά την υδρόλυσή
τους (π.χ. με βρασμό με οξύ ή παρουσία εξειδικευμένου ενζύμου) οι δισακχαρίτες
διασπώνται παρέχοντας τους αντίστοιχους μονοσακχαρίτες. Βρασμός διαλύματος
σακχαρόζης με μικρή ποσότητα οξέος (π.χ. κιτρικού οξέος) οδηγεί σε μερική
υδρόλυσή του προς σιροπιώδες ισομοριακό μίγμα γλυκόζης και φρουκτόζης γνωστό ως
ιμβερτοσάκχαρο (invert sugar), που
χρησιμοποιείται ευρύτατα στη ζαχαροπλαστική. Την ίδια
διάσπαση μπορεί να προκαλέσει το ένζυμο
ιμβερτάση
που βρίσκεται στη ζύμη.
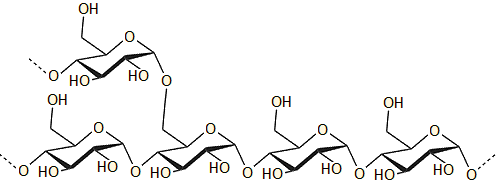
Πολυσακχαρίτες
[Αναφ. 7]
 |
 |
|
Αριστερα: Βασική δομή του μορίου του
αμύλου, όπου φαίνεται και ένας σταυροδεσμός. Δεξιά. Το χρώμα που
εμφανίζουν διαλύματα αμύλου 1%, 0,1% και 0,01% με μικρή ποσότητα
διαλύματος Ι2. |
Οι πολυσακχαρίτες
είναι υδατάνθρακες όπου χιλιάδες διαφορετικά μόρια απλών σακχάρων συνδέονται
μεταξύ τους με γλυκοζιτικούς δεσμούς. Οι πολυσακχαρίτες δεν είναι αναγωγικά
σάκχαρα, ούτε εμφανίζουν πολυστροφισμό. Οι πλέον διαδεδομένοι στη φύση είναι η
κυτταρίνη και το άμυλο.
Αμύλο.
To άμυλο (starch) είναι ο κύριος υδατάνθρακας των τροφών (πατάτες,
δημητριακά, ρύζι κ.α.) και αποτελείται από δύο διαφορετικά "πολυμερή" της
α-γλυκόζης, την αμυλόζη (20-25%) και την αμυλοπυκτίνη (75-80%). Η
πρώτη αποτελείται από ευθύγραμμες αλυσίδες α-γλυκόζης με δεσμούς 1-4' (το
υδροξύλιο του C1 του ενός μορίου γλυκόζης με το υδροξύλιο του C4 του επόμενου). Συνήθως
περιέχει 300 έως 600 μονάδες γλυκόζης ανά μόριο. Η δεύτερη περιέχει και
διακλαδώσεις 1-6' που εμφανίζονται ανά 12 έως 20 μονάδες γλυκόζης
[Αναφ.
7δ]. Η αναλογία αμυλόζης:αμυλοπυκτίνης εξαρτάται από την πηγή προέλευσης του αμύλου.
Λόγω των α-γλυκοζιτικών δεσμών,
η αμυλόζη σχηματίζει μόρια με σχήμα σπείρας, στο κέντρο της οποίας μπορεί να
εγκλωβίσει μόρια ιωδίου σχηματίζοντας μια ένωση εγκλεισμού (clathrate) με
εντονότατο σκούρο μπλε χρώμα, το οποίο χρησιμοποιείται τόσο για την ανίχνευση
του αμύλου, όσο και του ιωδίου. Διάλυμα αμύλου είναι εξαιρετικός δείκτης για την
ανίχνευση της πρώτης περίσσειας ιωδίου στις ιωδιομετρικές ογκομετρήσεις.
Το άμυλο αποτελεί την κύρια
πηγή γλυκόζης, τόσο για τον ανθρώπινο οργανισμό, όσο και για τη βιομηχανική
παραγωγή της. Με επίδραση ενζύμων (αμυλάσες) διασπάται σε μαλτόζη και στη
συνέχεια σε γλυκόζη, παρέχοντας διάφορα αμυλοσιρόπια (starch sirups),
κύρια μορφή υπό την οποία κινείται η γλυκόζη στη βιομηχανία τροφίμων.
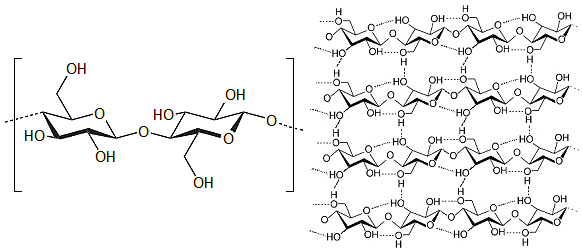
Κυτταρίνη.
Η
κυτταρίνη (cellulose) αποτελείται από
μονάδες
D-γλυκόζης, συνδεδεμένες μεταξύ τους με 1,4'-β-γλυκοζιτικούς δεσμούς. Χιλιάδες μόρια
ενώνονται μεταξύ τους σχηματίζοντας ένα γραμμικό μεγαλομόριο. Αυτά τα γραμμικά μόρια συνδέονται μεταξύ
τους με δεσμούς υδρογόνου, γεγονός που επαυξάνει τη σταθερότητα και τη μηχανική αντοχή των ινών
κυτταρίνης.
Η διαφορά της με το άμυλο
βρίσκεται μόνο στους β-γλυκοζιτικούς δεσμούς, που την καθιστούν άχρηστη ως
τροφή για τον άνθρωπο που δεν διαθέτει
κυττάσες
(cellulases), τα ένζυμα που διασπούν αυτούς του γλυκοζιτικούς δεσμούς, σε
αντίθεση με τα μηρυκαστικά ζώα (μέσω των βακτηρίων που διαθέτουν τα
απαραίτητα ένζυμα). Υδρόλυση με αυτά τα ένζυμα ή με οξέα της
κυτταρίνη οδηγεί στον σχηματισμό
κελλοβιόζης (cellobiose), ένα δισακχαρίτη ανάλογο με τη μαλτόζη,
αλλά με β-γλυκοζιτικό δεσμό μεταξύ των μονάδων γλυκόζης.
 |
|
 |
|
Δομή μορίου κυτταρίνης και σύνδεση
μεταξύ τους μέσω δεσμών υδρογόνου. |
|
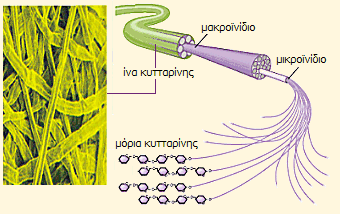
Τυπική δομή ίνας κυτταρίνης |
Αν και η κυτταρίνη δεν μεταβολίζεται από
τον άνθρωπο, η παρουσία της στις τροφές (ως φυτικές ίνες) είναι απαραίτητη
για την ομαλή λειτουργία του πεπτικού συστήματος.
Στη φύση, η κυτταρίνη χρησιμοποιείται
κυρίως στους φυτικούς ιστούς, προσδίδοντας σκληρότητα και μηχανική αντοχή. Τα
φύλλα, η χλόη και το ξύλο αποτελούνται σε μεγάλο ποσοστό από κυτταρίνη, ενώ οι
ίνες βάμβακα είναι πρακτικώς καθαρή κυτταρίνη. Πλήθος
προϊόντων βασίζονται στην κυτταρίνη, όπως ο χαρτοπολτός ή παράγωγά της
(οξική κυτταρίνη, νιτροκυτταρίνη).
Γλυκογόνο.
Το
γλυκογόνο
(glycogen) είναι ένας ζωικός πολυσακχαρίτης που έχει
τον ίδιο ρόλο με το άμυλο στα φυτά: την αποθήκευση
ενέργειας. Οι υδατάνθρακες της διατροφής που δεν χρησιμοποιούνται για ενεργειακές
ανάγκες, μετατρέπονται και αποθηκεύονται στο σώμα υπό μορφή γλυκογόνου.
Η δημιουργία του γλυκογόνου
πραγματοποιείται μέσω μιας πρωτεΐνης, της
γλυκογενίνης,
η οποία αναλαμβάνει τη "σύνδεση" των πρώτων μορίων γλυκόζης και στη συνέχεια
αναλαμβάνουν άλλα ένζυμα τη μεγέθυνση του μορίου. Η πρωτεΐνη αυτή βρίσκεται στο
κέντρο των σφαιριδίων γλυκογόνου.
Το
γλυκογόνο χαρακτηρίζεται από περίπλοκη δομή με γλυκοζιτικούς δέσμους 1,4' και
διακλαδώσεις 1,6' ανάλογες με εκείνες του αμύλου, αλλά εμφανιζόμενες με
μεγαλύτερη συχνότητα (ανά
8 έως 10 μονάδες γλυκόζης). Τα
μόρια του γλυκογόνου περιέχουν μέχρι και 100.000 μονάδες γλυκόζης
[Αναφ. 7δ].
|
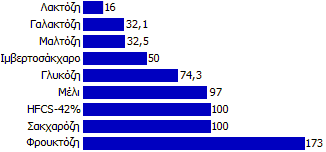
Σχετική γλυκύτητα
σακχάρων και άλλων γλυκαντικών υλών (HFCS:
High Fructose Corn Sirup). |
Σχετική γλυκύτητα σακχάρων
Η γλυκιά γεύση των διάφορων
τροφίμων ποικίλλει ανάλογα με τη σύσταση και την ποσότητα και
ποιότητα σακχάρων. Η γλυκύτητα μπορεί να διαφέρει σημαντικά από το ένα σάκχαρο στο άλλο. Για
παράδειγμα η
φρουκτόζη είναι σχεδόν 2 φορές γλυκύτερη από τη σακχαρόζη (ζάχαρη), ενώ στη
λακτόζη μόλις γίνεται αισθητή μια γλυκιά γεύση. Αυτό
σημαίνει ότι μπορεί να χρησιμοποιηθεί στη μισή ποσότητα από τη ζάχαρη και να
έχει το ίδιο γλυκαντικό αποτέλεσμα, αλλά να προσφέρει τις μισές περίπου
θερμίδες.
Στο παραπλεύρως διάγραμμα παρέχεται
η σχετική γλυκύτητα διάφορων σακχάρων και γλυκαντικών υλών σε σχέση με εκείνη
της σακχαρόζης, που γενικά θεωρείται ως το σάκχαρο αναφοράς. Θα πρέπει να σημειωθεί ότι η
γλυκύτητα των σακχάρων παρατηρείται σε όλες τις ενώσεις που διαθέτουν γειτονικά
υδροξύλια, όπως π.χ. η αιθυλενογλυκόλη, η γλυκερίνη και οι διάφορες πολυόλες (π.χ. σορβιτόλη),
χωρίς όμως αυτό να αποτελεί και απαραίτητη προϋπόθεση για να έχει μια ένωση
γλυκιά γεύση (βλ.
Χημική ένωση του μήνα: Ασπαρτάμη). H D-φρουκτόζη
είναι το πιο γλυκό απ' όλα τα φυσικά σάκχαρα
[Αναφ. 8].
Η L-γλυκόζη,
που δεν συναντάται στη φύση, έχει την ίδια γεύση και είναι είναι εξίσου γλυκιά
με τη D-γλυκόζη, αν και δεν μεταβολίζεται (δεν
"αναγνωρίζεται" από τα ένζυμα των ζωικών οργανισμών). Ωστόσο, η δυσκολία της
παρασκευής της αποκλείει τη χρήση ως φθηνής "τεχνητής" γλυκαντικής ύλης
[Αναφ. 8γ-δ].
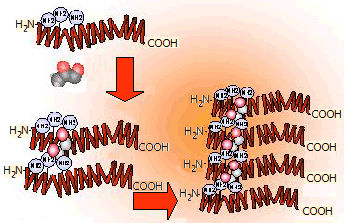
Γλυκίωση [Αναφ.
9]
Ως γλυκίωση (glycation) αναφέρεται η ομοιοπολική
σύνδεση σακχάρων (κυρίως γλυκόζης) με μόρια βιοχημικής σημασίας, όπως πρωτεΐνες, λιποειδή,
ακόμη και με το DNA. Για την πραγματοποίηση αυτής της σύνδεσης δεν απαιτούνται
ένζυμα (μη ενζυμική σύνδεση) και είναι καθαρά χημική. Τυπικότερες περιπτώσεις
σύνδεσης είναι μέσω της αντίδρασης ελεύθερων αμινοομάδων των πρωτεϊνών με την αλδεϋδική ομάδα του
σακχάρου με
σχηματισμό βάσης Schiff: R-CHO + H2N-R'
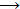 R-CH=N-R'
+ Η2Ο ή με σχηματισμό γλυκοζιτικού δεσμού με ελεύθερες υδροξυλοομάδες.
[Σημείωση: Στη βιβλιογραφία η γλυκίωση αναφέρεται συχνότερα ως γλυκοζυλίωση, ωστόσο η απόδοση αυτή
πρέπει να αναφέρεται αποκλειστικά στις αντιδράσεις σχηματισμού γλυκοζιτικών
δεσμών και η γλυκοζυλίωση αποτελεί μερική περίπτωση γλυκίωσης
[Αναφ. 9στ]].
R-CH=N-R'
+ Η2Ο ή με σχηματισμό γλυκοζιτικού δεσμού με ελεύθερες υδροξυλοομάδες.
[Σημείωση: Στη βιβλιογραφία η γλυκίωση αναφέρεται συχνότερα ως γλυκοζυλίωση, ωστόσο η απόδοση αυτή
πρέπει να αναφέρεται αποκλειστικά στις αντιδράσεις σχηματισμού γλυκοζιτικών
δεσμών και η γλυκοζυλίωση αποτελεί μερική περίπτωση γλυκίωσης
[Αναφ. 9στ]].
 Η
γλυκίωση μπορεί να θεωρηθεί ως μια ανεπιθύμητη διαδικασία "άτακτου" χαρακτήρα, που όχι μόνο δεν προβλέπεται
από κάποιο φυσιολογικό βιοχημικό κύκλο, αλλά ανάλογα με την έκτασή
της και το ποια μόρια προσβάλλει, μπορεί να προκαλέσει σημαντικότατες βλάβες σε έναν
οργανισμό και αποτελεί έναν από τους λόγους γήρανσής του.
Η
γλυκίωση μπορεί να θεωρηθεί ως μια ανεπιθύμητη διαδικασία "άτακτου" χαρακτήρα, που όχι μόνο δεν προβλέπεται
από κάποιο φυσιολογικό βιοχημικό κύκλο, αλλά ανάλογα με την έκτασή
της και το ποια μόρια προσβάλλει, μπορεί να προκαλέσει σημαντικότατες βλάβες σε έναν
οργανισμό και αποτελεί έναν από τους λόγους γήρανσής του.
Οι αντιδράσεις γλυκίωσης αναμένεται να πραγματοποιούνται με
ταχύτερους ρυθμούς στις περιπτώσεις υψηλής περιεκτικότητας του αίματος σε σάκχαρα (κυρίως
γλυκόζη) και επομένως αποτελεί μια από τις παράπλευρες, αλλά σοβαρότατες, ζημιές που προκαλεί ο
σακχαρώδης διαβήτης γεγονός, γεγονός που επιβάλλει την ονομαζόμενη "ρύθμιση" του σακχάρου
του αίματος με χορήγηση ινσουλίνης (βλ.
Χημική ένωση του μήνα: "Ινσουλίνη").
Η μέτρηση της γλυκιωμένης (γλυκοζυλιωμένης) αιμοσφαιρίνης (glycated
hemoglobin, HbA1c) αποτελεί πολύτιμο κλινικό δείκτη της μέσης περιεκτικότητας του
αίματος σε γλυκόζη για μεγάλο χρονικό διάστημα (τυπικά
θεωρείται ότι υποδεικνύει τη μέση περιεκτικότητα γλυκόζης τριών μηνών). 'Ετσι, οι τιμές της γλυκιωμένης αιμοσφαιρίνης αποτελούν πιο
αξιόπιστο δείκτη για τη διάγνωση του σακχαρώδους διαβήτη, αλλά και για το πόσο
καλά ελέγχεται ο διαβήτης, σε αντίθεση με τις
τιμές της συγκέντρωσης της ελεύθερης γλυκόζης στο αίμα, οι οποίες μπορεί να
υπόκεινται σε έντονες ημερήσιες διακυμάνσεις [Αναφ.
9ζ].
Τα
προϊόντα αυτής της χημικής σύνδεσης των βιομορίων με σάκχαρα ονομάζονται προϊόντα προχωρημένης γλυκίωσης
(advanced glycation endproducts, AGEs) συσσωματώνονται μεταξύ τους και δρουν σε βάρος της φυσιολογικής
λειτουργίας του οργανισμού. 'Ετσι, π.χ. πρωτεϊνικές ίνες,
συνδέονται μεταξύ τους με αποτέλεσμα την απώλεια της ελαστικότητας και τη σκλήρυνσή τους, γεγονός που
επιδρά αρνητικά στη λειτουργία του μυών της καρδιάς και προκαλεί βλάβες στις
αρτηρίες και σε άλλους ιστούς. Προβλήματα μπορούν να προκύψουν από τη γλυκίωση διάφορων χρήσιμων ενζύμων,
η οποία οδηγεί σε αχρήστευσή τους. Η συσσώρευση
των AGE εμπλέκεται σε οφθαλμολογικές νόσους όπως το γλαύκωμα και βλάβες
του αμφιβληστροειδούς (εκφύλιση ωχράς κηλίδος), στην αρθρίτιδα, στην
αρτηριοσκλήρυνση, στην Alzheimer και στην νόσο του Parkinson, σε νευροπάθειες και νεφροπάθειες, όπως και
σε πλήθος άλλων εκφυλιστικών καταστάσεων. 'Ενα
εξαιρετικά κατατοπιστικό άρθρο ανασκόπησης (στα ελληνικά) πάνω στο θέμα των φυσιολογικών
επιπτώσεων της γλυκίωσης αποτελεί η [Αναφ.
9γ].
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1. (α) Wikipedia "Glucose". (β)
"Glucose", Merck Index 12th edition,
p. 758.
2. (α) Carey FA: "Ch. 25
Carbohydrates", in "Organic Chemistry",4th ed. McGraw-Hill, 2000.
(β) Jetly S: "Lesson
on Carbohydrates", Dept. of Biomedical Sciences, Univ. of India. (γ)
Garrett & Grissam: "Chapter
7: Carbohydrates" in "Biochemistry",
3rd ed. (δ) Michigan State University, Dep. of
Chemistry: "Carbohydrates".
(ε) Bertozzi CR, Rabuka D: "Chapter
2: Structural Basis of Glycan Diversity", in
Essentials of Glycobiology. 2nd
edition, 2009.
3. (α) Wikipedia: "Fischer
projection". (β) Online Learning Center: "Organic
Chemistry 4e Carey: Chapter 7 (Stereochemistry): Fischer projections",
McGraw-Hill. (γ) Wikibooks: "Structural
Biochemistry/Carbohydrates/Monosaccharides/Stereochemistry of
Monosaccharides".
(δ) "Rules of Carbohydrate Nomenclature", The Journal of Organic
Chemistry 28(2): 281-291, 1963 (Abstract).
4. (α) Wikipedia: "Haworth
projection". (β) IUPAC, Gold Book: "Haworth
Representation".
5. (α) Wikipedia: "Mutarotation".
(β) Efstathiou CE, Hadjiioannou TP: "Kinetic
Identification and Determination of Certain Carbohydrates with a
Periodate-Sensitive Perchlorate-Selective Electrode", Anal Chim Acta,
89:55-63, 1977. (γ) Hughes G, Nevell TP: "The
Mecahnism of the Oxidation of Glucose by Periodate", Trans. Faraday
Soc., 44:941-948, 1948 (Abstract).
6. (α)
Wikipedia: "Kiliani
- Fischer". (β) Hudlicky T, Reed JW:
"The Way of Synthesis: Evolution of Design and Methods for Natural
Products", Wiley-VCH, 2007, p. 26. (γ) Krishnaswamy NR:
"Carbohydrate Chemistry from Fischer to Now", University of Delhi (αρχείο
PDF, 1,4 MB).
7.
(α) Wikipedia: "Starch".
(β) Wikipedia "
Glycogen". (γ) Wikipedia: "Cellulose".
(δ) Ophard CE: "Starch",
"Glycogen",
"Cellulose"
in
Virtual Chembook, 2003.
8. (α)
Wikipedia: "Fructose".
(β) Fontvieille Α-Μ, Faurion Α, Helal Ι, Rizkalla
SW, Falgon S,
Letanoux M, Tchobroutsky
G, Slama G: "Relative Sweetness of Fructose Compared With
Sucrose in Healthy and Diabetic Subjects",
Diabetes Care, 12:481-486, 1989 (Abstract).
(γ) Wikipedia: "L-glucose".
(δ) NASA: "A
Natural Way to Stay Sweet".
9. (α) Wikipedia: "Glycation".
(β) diseasefreeto100.com: "Glycation".
(γ) Χαβαράνη Β, Μπόζας Ε: "Τελικά προϊόντα υψηλής μη ενζυμικής
γλυκοζιλίωσης: Η Βιοχημεία και οι Επιπτώσεις του στον 'Ανθρωπο",
Αρχεία Ελληνικής Ιατρικής 18(4):338-348, 2001 (αρχείο
PDF, 177 KB). (δ) Wikipedia: "Advanced
glycation end-product". (ε)
Semba RD, Ferrucci L, Sun K, Beck J,
Dalal M, Varadhan R, Walston J, Guralnik JM, Fried LP: "Advanced
glycation end products and their circulating receptors predict
cardiovascular disease mortality in older community-dwelling women",
Aging Clin Exp Res 21(2):182-190, 2009. (στ) "Glycated
proteins", JCBN/NC-IUB
Newsletter 1984. (ζ) Wikipedia: "Glycated
hemoglobin".
|
Αποποίηση
ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η
ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο
έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν
τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες.
Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε
εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις
ιστοσελίδες αυτές υποδηλώνει ότι το Τμήμα Χημείας επικυρώνει ή καθ'
οιονδήποτε τρόπο αποδέχεται το περιεχόμενό
τους. |


 Τα
μόρια της γλυκόζης που σχηματίζονται με αυτό τον τρόπο αποθηκεύονται στα φυτά
στην πολυμερισμένη μορφή της ως άμυλο ή
ως κυτταρίνη. Οι επιστήμονες έχουν υπολογίσει ότι το 50% του καθαρού βάρους
της βιομάζας στον πλανήτη Γη (σύνολο ζώων και φυτών) αποτελείται από πολυμερή
της γλυκόζης. Εκτιμάται πως ετησίως παράγονται 100 δισεκατομμύρια τόνοι
υδατανθράκων με τη διαδικασία της φωτοσύνθεσης [
Τα
μόρια της γλυκόζης που σχηματίζονται με αυτό τον τρόπο αποθηκεύονται στα φυτά
στην πολυμερισμένη μορφή της ως άμυλο ή
ως κυτταρίνη. Οι επιστήμονες έχουν υπολογίσει ότι το 50% του καθαρού βάρους
της βιομάζας στον πλανήτη Γη (σύνολο ζώων και φυτών) αποτελείται από πολυμερή
της γλυκόζης. Εκτιμάται πως ετησίως παράγονται 100 δισεκατομμύρια τόνοι
υδατανθράκων με τη διαδικασία της φωτοσύνθεσης [





 Οι πενταμελείς και οι εξαμελείς κυκλικές ημιακετάλες είναι
ιδιαίτερα σταθερές ενώσεις. Για τον λόγο αυτό οι υδατάνθρακες σε
διαλύματα βρίσκονται σε μορφές τόσο ανοικτής, όσο και κλειστής αλυσίδας σε μια
κατάσταση ισορροπίας, όπου κατά κανόνα κυριαρχεί η κλειστή (κυκλική) μορφή μέσω
του ημιακεταλικού δεσμού. Στην περίπτωση των εξοζών, το οξυγόνο του
υδροξυλίου του άνθρακα C5 καθίσταται το αιθερικό οξυγόνο εξαμελούς (πυρανικού)
δακτυλίου ή το το οξυγόνο του υδροξυλίου του άνθρακα C4 καθίσταται το αιθερικό
οξυγόνο πενταμελούς (φουρανικού) δακτυλίου.
Οι πενταμελείς και οι εξαμελείς κυκλικές ημιακετάλες είναι
ιδιαίτερα σταθερές ενώσεις. Για τον λόγο αυτό οι υδατάνθρακες σε
διαλύματα βρίσκονται σε μορφές τόσο ανοικτής, όσο και κλειστής αλυσίδας σε μια
κατάσταση ισορροπίας, όπου κατά κανόνα κυριαρχεί η κλειστή (κυκλική) μορφή μέσω
του ημιακεταλικού δεσμού. Στην περίπτωση των εξοζών, το οξυγόνο του
υδροξυλίου του άνθρακα C5 καθίσταται το αιθερικό οξυγόνο εξαμελούς (πυρανικού)
δακτυλίου ή το το οξυγόνο του υδροξυλίου του άνθρακα C4 καθίσταται το αιθερικό
οξυγόνο πενταμελούς (φουρανικού) δακτυλίου. 


 Σε
στερεά κατάσταση τα ανωμερή μπορούν να διατηρηθούν σταθερά για απεριόριστο χρονικό
διάστημα. Μόλις διαλυθεί ένα από τα δύο ανωμερή στο νερό αρχίζει η διαδικασία
της ανωμερείωσης που, ανάλογα με τις συνθήκες, μπορεί να διαρκέσει λίγες ώρες
και καταλήγει σε μίγμα με [α]D
+52,5° (που αντιστοιχεί σε αναλογία α-ανωμερές:β-ανωμερές = 36:64) [
Σε
στερεά κατάσταση τα ανωμερή μπορούν να διατηρηθούν σταθερά για απεριόριστο χρονικό
διάστημα. Μόλις διαλυθεί ένα από τα δύο ανωμερή στο νερό αρχίζει η διαδικασία
της ανωμερείωσης που, ανάλογα με τις συνθήκες, μπορεί να διαρκέσει λίγες ώρες
και καταλήγει σε μίγμα με [α]D
+52,5° (που αντιστοιχεί σε αναλογία α-ανωμερές:β-ανωμερές = 36:64) [


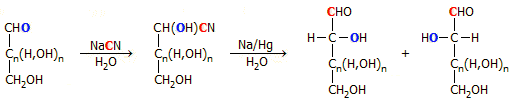

 Το 1891
Το 1891