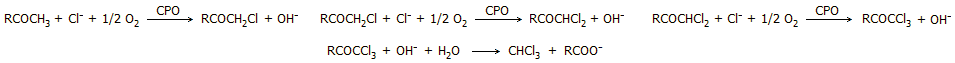Κάθε πειραματισμός
νάρκωσης με χλωροφόρμιο ή άλλες σχετικές ενώσεις μπορεί να αποβεί μοιραίος
Σύντομη ιστορία του χλωροφορμίου
 Το
χλωροφόρμιο
(chloroform) παρασκευάστηκε για πρώτη φορά το 1831 από τον Αμερικανό γιατρό και
χημικό, ο Samuel
Guthrie (1782-1848). Ο
Guthrie επιδίωκε να βρει ένα φθηνό τρόπο παρασκευής του 1,2-διχλωροαιθάνιου,
το οποίο χρησιμοποιούσαν τότε ως ζιζανιοκτόνο με το όνομα
ολλανδικό υγρό (dutch liquid) και παρασκεύαζαν με επίδραση χλωρίου σε
αιθυλένιο. Επειδή το αιθυλένιο λαμβανόταν με αφυδάτωση της αιθανόλης, ο Guthrie
δοκίμασε να επιδράσει απ' ευθείας με
χλωράσβεστο (clorinated lime)
σε ουίσκι. Η χλωράσβεστος (κοινώς: "βρωμούσα"), στην οποία αποδίδεται ο χημικός τύπος CaOCl2,
είναι ισομοριακό μίγμα Ca(OCl)2
και CaCl2 που
παρασκευάζεται με απ' ευθείας αντίδραση χλωρίου με υδατικό
αιώρημα Ca(OH)2
(γάλα της ασβέστου)
και τη χρησιμοποιούσαν τότε (όπως και σήμερα) ως
λευκαντική και απολυμαντική σκόνη.
Το
χλωροφόρμιο
(chloroform) παρασκευάστηκε για πρώτη φορά το 1831 από τον Αμερικανό γιατρό και
χημικό, ο Samuel
Guthrie (1782-1848). Ο
Guthrie επιδίωκε να βρει ένα φθηνό τρόπο παρασκευής του 1,2-διχλωροαιθάνιου,
το οποίο χρησιμοποιούσαν τότε ως ζιζανιοκτόνο με το όνομα
ολλανδικό υγρό (dutch liquid) και παρασκεύαζαν με επίδραση χλωρίου σε
αιθυλένιο. Επειδή το αιθυλένιο λαμβανόταν με αφυδάτωση της αιθανόλης, ο Guthrie
δοκίμασε να επιδράσει απ' ευθείας με
χλωράσβεστο (clorinated lime)
σε ουίσκι. Η χλωράσβεστος (κοινώς: "βρωμούσα"), στην οποία αποδίδεται ο χημικός τύπος CaOCl2,
είναι ισομοριακό μίγμα Ca(OCl)2
και CaCl2 που
παρασκευάζεται με απ' ευθείας αντίδραση χλωρίου με υδατικό
αιώρημα Ca(OH)2
(γάλα της ασβέστου)
και τη χρησιμοποιούσαν τότε (όπως και σήμερα) ως
λευκαντική και απολυμαντική σκόνη.
Ο Guthrie παρέλαβε με
απόσταξη ένα πτητικό υγρό
και διαπίστωσε ότι είχε παρόμοια οσμή με το "ολλανδικό υγρό", αλλά
είχε κάπως πιο ευχάριστη οσμή και πιο
γλυκιά γεύση (40 φορές πιο γλυκό από τη ζάχαρη). Αρχικά, ονόμασαν την ουσία
αυτή γλυκό ουίσκι του Guthrie (Guthrie's sweet
whiskey), ενώ ο ίδιος την ονόμασε χλωρικό αιθέρα (chloric ether). Αναφέρεται ότι ο Guthrie παρασκεύασε
αρκετά γαλόνια από την νέα αυτή ουσία
[Αναφ. 2].
Λίγους μήνες αργότερα, το 1832,
ο Γάλλος φαρμακοποιός
Eugène Soubeiran (1797-1859) παρασκεύασε
χλωροφόρμιο με αντίδραση χλωρασβέστου αρχικά με αιθανόλη και μετά με
ακετόνη, τα αποτελέσματα όμως της έρευνάς του δημοσιεύθηκαν λίγα χρόνια
αργότερα. Την ίδια χρονιά με παρόμοιο τρόπο παρασκεύασε χλωροφόρμιο και ο διάσημος Γερμανός χημικός
Justus von Liebig (1803-1873).
Ο χημικός χαρακτηρισμός του χλωροφορμίου
πραγματοποιήθηκε το 1834 από τον διάσημο Γάλλο χημικό
Jean-Baptiste Dumas, ο οποίος
ονόμασε την ένωση χλωροφόρμιο, λόγω της συγγένειάς
της με το μυρμηκικό οξύ (formic
acid), άλατα του οποίου παρέχει σε συνθήκες
έντονης αλκαλικής υδρόλυσης
[Αναφ. 3].
Οι συνολικές αντιδράσεις σύνθεσης μπορούν να
γραφούν ως εξής:
2
C2H5OH +
10 CaOCl2
 2 CΗCl3
+ 7 CaCl2
+ 2
CaCO3 +
Ca(OH)2 +
4 H2O
2 CΗCl3
+ 7 CaCl2
+ 2
CaCO3 +
Ca(OH)2 +
4 H2O
2
CΗ3COCH3 +
6 CaOCl2
 2 CHCl3
+ Ca(CH3COO)2
+ 2 Ca(OH)2
+ 3
CaCl2
2 CHCl3
+ Ca(CH3COO)2
+ 2 Ca(OH)2
+ 3
CaCl2
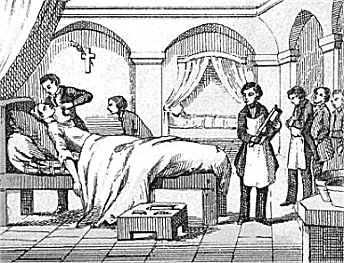
Το χλωροφόρμιο ως εισπνεόμενο αναισθητικό
Αν και
νωρίς είχε διαπιστωθεί η αναισθητική δράση της νέας ένωσης, το χλωροφόρμιο
χρησιμοποιήθηκε ως αναισθητικό από το 1847 και μετά, δηλαδή αρκετά χρόνια μετά την παρασκευή του, . Ο πρώτος που εξέτασε διεξοδικά το
χλωροφόρμιο ως γενικό αναισθητικό στην ιατρική ήταν ο Σκώτος γιατρός -
μαιευτήρας
Sir
James Young Simpson (1811-1870). Ο Simpson διεξήγαγε την πρώτη
εγχείρηση με χορήγηση χλωροφορμίου ως αναισθητικό τον Νοέμβριο του 1847.
Ως εισπνεόμενο αναισθητικό το χλωροφόρμιο αποδείχθηκε πολύ
δραστικότερο από το υποξείδιο του αζώτου (N2O),
το γνωστό ως "ιλαρυντικό αέριο", το
οποίο ήταν γνωστό από το 1800 και είχε αρχίσει να χρησιμοποιείται ως αναισθητικό
λίγα χρόνια πριν (1845) (βλ. Χημική ένωση του μήνα:
Υποξείδιο του αζώτου).
Το χλωροφόρμιο, ως άφλεκτο
υλικό, αποδείχθηκε ασφαλέστερο και ταχύτερο στη δράση του σε σχέση με τον
αιθέρα (διαιθυλαιθέρας, C2H5OC2H5),
ο οποίος ήταν σε χρήση ως αναισθητικό από το 1842 ή και
νωρίτερα. Δεν ήταν λίγες οι περιπτώσεις εκρήξεων και πυρκαγιών κατά τη διάρκεια ναρκώσεων
με αιθέρα, αφού συχνά οι εγχειρίσεις γίνονταν σε δωμάτια που φωτίζονταν με
κεριά και θερμαίνονταν με τζάκια
[Αναφ. 4α].
Πολλοί γιατροί αυτοπειραματίζονταν, όπως και ο ίδιος ο
Simpson, με το χλωροφόρμιο, συχνά
όμως με δυσάρεστα έως τραγικά αποτελέσματα.
Χαρακτηριστική είναι η περίπτωση του οδοντογιατρού Horace
Wells (1815-1848), ο οποίος καθιέρωσε τη χρήση του υποξειδίου του
αζώτου στην οδοντιατρική. Ο Wells μετά από μια εβδομάδα συνεχών πειραμάτων
που έκανε στον εαυτό του με το χλωροφόρμιο, περιήλθε σε κατάσταση αμόκ με αποτέλεσμα να διαπράξει
αναιτιολόγητες βίαιες ενέργειες. 'Οταν μετά τη σύλληψή του συνήλθε και κατάλαβε τι
είχε κάνει, αυτοκτόνησε
[Αναφ. 4γ].
Το 1853 συνέβη ένα γεγονός-σταθμός στην ιστορία του χλωροφορμίου,
όταν xορηγήθηκε ως αναλγητικό στη Βασίλισσα της
Μεγάλης Βρετανίας Βικτώρια, όταν η ίδια το ζήτησε επειδή
υπέφερε πολύ κατά τις προηγούμενες γέννες της. Έτσι υπό την επίβλεψη του
γιατρού
John Snow (1813-1858) [Αναφ. 4δ,ε], γέννησε το 8ο της παιδί τον Πρίγκιπα
Λεοπόλδο. Να σημειωθεί ότι μέχρι τότε η χρήση αναλγητικών κατά τους
τοκετούς ήταν απαγορευμένη από την Εκκλησία, αφού ο κλήρος και πολλοί
συντηρητικοί γιατροί θεωρούσαν τις ωδίνες του τοκετού ως "θεόσταλτες". Η χρησιμοποίηση αναισθητικού από τη Βασίλισσα Βικτώρια
συνέβαλε στην άρση αυτών των μάλλον περίεργων θρησκευτικών προκαταλήψεων.
Προβλήματα του
χλωροφορμίου. Τα αποτελέσματα της εισπνοής ατμών χλωροφορμίου
διακρίνονται στα ακόλουθα στάδια, ανάλογα με διάρκεια της εισπνοής των ατμών
του: (1) ο ασθενής περιέρχεται σε μια κατάσταση
αναισθησίας, αλλά εξακολουθεί να διατηρεί τη συνείδησή του. (2) Ο ασθενής περιέρχεται σε ληθαργική
κατάσταση, αλλά ακόμη αισθάνεται κάποιο πόνο. (3) Ο ασθενής παύει να αντιδρά και δεν
αισθάνεται πόνο. (4) Ο ασθενής αναπνέει δύσκολα και
οι μύες τους έχουν χαλαρώσει πλήρως. (5) Οι μύες του στήθους του ασθενούς παραλύουν
και ο ασθενής είναι ένα βήμα πριν από τον θάνατο από ασφυξία και καρδιακή
ανακοπή [Αναφ.
4στ].
Το επιθυμητό στάδιο είναι το 3ο, που δύσκολα
μπορεί να επιτευχθεί με ασφάλεια αφού δεν απέχει πολύ από το 5ο στάδιο ως
προς την εισπνεόμενη ποσότητα χλωροφορμίου. Το γεγονός αυτό καθιστά ιδιαίτερα επικίνδυνη
κάθε απόπειρα αναισθησίας με χλωροφόρμιο, χωρίς την παρουσία
ειδικευμένου αναισθησιολόγου, ο οποίος μπορεί να ναρκώσει αποτελεσματικά τον ασθενή μέσα σε
5 λεπτά.
Το χλωροφόρμιο
απέχει πολύ από το να θεωρηθεί ως το "ιδανικό" εισπνεόμενο γενικό αναισθητικό.
Απαιτούσε μεγάλη προσοχή στη χρήση για να αποφευχθούν επικίνδυνες καρδιακές
αρρυθμίες και
για τον λόγο αυτό, παρά την αποτελεσματικότητά του, ποτέ δεν υποκατέστησε πλήρως τον αιθέρα.
Ο αιθέρας ως αναισθητικό
εξακολούθησε να προτιμάται σε αρκετές χώρες λόγω του υψηλότερου
θεραπευτικού δείκτη,
αλλά
και της χαμηλότερης τιμής του. Ωστόσο, και του αιθέρα ο θεραπευτικός δείκτης κυμαίνεται από 1,5 έως 2,2
[Αναφ. 1β], που δεν μπορεί να θεωρηθεί
και ως ασφαλής. Να σημειωθεί ότι ο θεραπευτικός δείκτης, για να θεωρηθεί
ικανοποιητικός (γενικά) θα πρέπει να είναι μεγαλύτερος από 3.
Σε μια στατιστική μελέτη του 1934 διαπιστώθηκε ότι κατά την αναισθησία με τον αιθέρα οι
πιθανότητες θανάτου ήταν 1 στις 14.000 έως 28.000, ενώ με χλωροφόρμιο ήταν 1 στις 3.000 έως 6.000
[Αναφ. 4ζ]. Ως ένα είδος "συμβιβασμού"
αποτελεσματικότητας - επικινδυνότητας, συχνά διάφορες "σχολές" συνιστούσαν
ποικίλα μίγματα αιθέρα - χλωροφορμίου, όπως το
μίγμα ACE (Alcohol / Chloroform / Ether
1:2:3). Σήμερα, τόσο το χλωροφόρμιο, όσο και ο διαιθυλαιθέρας, ουσιαστικά
δεν χρησιμοποιούνται πλέον ως εισπνεόμενα γενικά αναισθητικά.
|
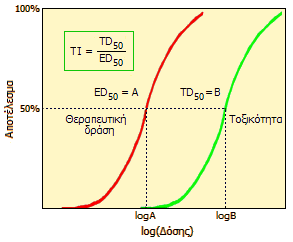
Καμπύλες αποτελέσματος ως προς τη
δόση και ορισμός του θεραπευτικού δείκτη (Therapeutic
Index, TI) |
Θεραπευτικός δείκτης
Ως θεραπευτικός δείκτης
(therapeutic index,
ΤΙ)
ορίζεται ο λόγος TD50
/ ED50
ή LD50
/ ED50,
δηλαδή ο λόγος της τοξικής δόσης (toxic dose,
TD50)
ή θανατηφόρας δόσης
(lethal dose, LD50)
για το 50% του
πληθυσμού, προς την ελάχιστη αποτελεσματική δόση (effective dose,
ED50) για
το 50% του πληθυσμού
[Αναφ. 5α].
Προφανώς, όσο μεγαλύτερος είναι ο θεραπευτικός δείκτης
μιας φαρμακευτικής ουσίας, τόσο ασφαλέστερη είναι η χρήση της για τον
ασθενή. Τόσο η θέση, όσο και κλίση των καμπυλών που αποδίδουν τη σωρευτική
κατανομή των επιθυμητών (θεραπευτική δράση) και των ανεπιθύμητων (τοξική
δράση, θάνατος) είναι σημαντικοί δείκτες που χαρακτηρίζουν την ασφάλεια ενός
φαρμάκου, όπως και τη δυνατότητα αποτελεσματικής χρήσης. Όσο μεγαλύτερο
είναι το κενό μεταξύ των καμπυλών, όπως και η απόσταση της μέγιστης
απαιτούμενης δραστική δόσης από την ελάχιστη που μπορεί να αποβεί τοξική,
τόσο ασφαλέστερη μπορεί να θεωρηθεί η χρήση μιας φαρμακευτικής ουσίας.
Σύγχρονα
εισπνεόμενα γενικά αναισθητικά
Σήμερα, τόσο το χλωροφόρμιο, όσο και ο διαιθυλαιθέρας,
ουσιαστικά δεν χρησιμοποιούνται πλέον ως εισπνεόμενα γενικά αναισθητικά. 'Εχουν αντικατασταθεί από άλλες ασφαλέστερες πτητικές
ουσίες, όπως είναι ορισμένοι αλογονωμένοι (κυρίως φθοριωμένοι) υδρογονάνθρακες και
αιθέρες (γενικώς γνωστά ως φλουράνια).
Ορισμένα από τα σύγχρονα
εισπνεόμενα αναισθητικά, που
έχουν αντικαταστήσει ουσιαστικά πλήρως το
χλωροφόρμιο και τον διαιθυλαιθέρα είναι τα ακόλουθα:
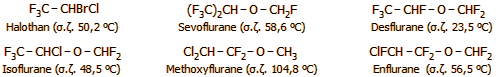
Μειονέκτημα αυτών των σύγχρονων αναισθητικών
είναι το ότι αποτελούν δραστικότητα αέρια θερμοκηπίου
(green house gases, βλ.
Χημική ένωση του μήνα: Εξαφθοριούχο θείο).
'Εχει εκτιμηθεί ότι κατά μέσον όρο μία χορήγηση αναισθησίας με τις ουσίες αυτές ισοδυναμεί
με έκλυση 22 kg CO2
στο περιβάλλον, ενώ η συνολική χρήση των ουσιών αυτών ως αναισθητικών αερίων,
συνεισφέρει στην υπερθέρμανση του πλανήτη μας, όσο περίπου ένα εκατομμύριο
αυτοκίνητα [Αναφ. 5β].
Τρόπος δράσης
των εισπνεόμενων γενικών αναισθητικών
Ο μηχανισμός δράσης των
εισπνεόμενων γενικών αναισθητικών μέχρι σήμερα δεν είχε διευκρινιστεί.
Φαίνεται παράδοξο το ότι ενώσεις τόσο διαφορετικές μεταξύ τους (υποξείδιο
του αζώτου, αιθέρες, αλογονωμένοι υδρογονάνθρακες, φθοριωμένοι αιθέρες)
ουσιαστικά έχουν το ίδιο ποιοτικό αποτέλεσμα και διαφέρουν μόνο ως προς
ποσοτικά χαρακτηριστικά. Μόλις πρόσφατα (2008) άρχισε να διαφαίνεται ο
μηχανισμός δράσης τους, που δείχνει να είναι παρόμοιος με τον μηχανισμό δράσης των
ενδοφλεβίως χορηγούμενων γενικών
αναισθητικών.
Η δράση τους εντοπίζεται στην
παρεμπόδιση της λειτουργίας ορισμένων ιοντικών διαύλων. Οι δίαυλοι αυτοί
(πρωτεΐνες) επιτρέπουν τη διέλευση ιόντων μέσω των κυτταρικών μεμβρανών για
να προκαλέσουν ορισμένες φυσιολογικές λειτουργίες, όπως η διάδοση του πόνου
και η ρύθμιση της συχνότητας των καρδιακών παλμών. Έτσι, διαπιστώθηκε ότι τα
αναισθητικά αυτά "μπλοκάρουν" τους διαύλους ιόντων ασβεστίου
TRPC5
(TRPC:
transient receptor potential channel), που βρίσκονται σε πολλούς ιστούς του
σώματος, αλλά κυρίως στον εγκέφαλο. Οι δίαυλοι αυτοί παίζουν σημαντικό ρόλο
στο κεντρικό νευρικό σύστημα και ρυθμίζουν τις καταστάσεις
συνειδητού/ασυνειδήτου [Αναφ. 5γ-ε].
|
Παρασκευή
χλωροφορμίου
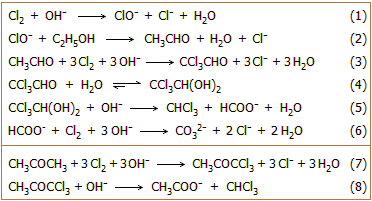 Εργαστηριακές
μέθοδοι. Η κλασική σύνθεση χλωροφορμίου βασίζεται στην αντίδραση
αιθανόλης με χλώριο προς σχηματισμό χλωράλης (αλληλουχία αντιδράσεων
1-3), η οποία
βρίσκεται σε ισορροπία με τον υδρίτη της (αντίδραση 4). Η χλωράλη (ή ο υδρίτης
της) σε ισχυρώς
αλκαλικό διασπάται προς χλωροφόρμιο και μυρμηκικά ανιόντα (αντίδραση 5). Αν
υπάρχει περίσσεια χλωρίου τα μυρμηκικά μπορούν να
οξειδωθούν προς ανθρακικά ιόντα (αντίδραση 6).
Εργαστηριακές
μέθοδοι. Η κλασική σύνθεση χλωροφορμίου βασίζεται στην αντίδραση
αιθανόλης με χλώριο προς σχηματισμό χλωράλης (αλληλουχία αντιδράσεων
1-3), η οποία
βρίσκεται σε ισορροπία με τον υδρίτη της (αντίδραση 4). Η χλωράλη (ή ο υδρίτης
της) σε ισχυρώς
αλκαλικό διασπάται προς χλωροφόρμιο και μυρμηκικά ανιόντα (αντίδραση 5). Αν
υπάρχει περίσσεια χλωρίου τα μυρμηκικά μπορούν να
οξειδωθούν προς ανθρακικά ιόντα (αντίδραση 6).
Χλωροφόρμιο μπορεί να
παραχθεί με την κλασική αντίδραση αλογονοφορμίου. Την αντίδραση αυτή την
παρέχει κάθε ένωση που περιέχει την ακετυλομάδα -COCH3
ή μπορεί να τη σχηματίσει την ίδια ομάδα με οξείδωση. 'Ετσι, σε ισχυρώς αλκαλικό διάλυμα ακετόνης
διαβιβάζεται χλώριο, σχηματίζεται 1,1,1-τριχλωρακετόνη (αντίδραση 7) η οποία
διασπάται αμέσως παρέχοντας χλωροφόρμιο και οξικά ανιόντα (αντίδραση
8).
Οι αντιδράσεις 5 και 8
χρησιμοποιούνται για την παρασκευή δευτεριωμένου χλωροφορμίου (CDCl3).
Το δευτεριωμένο χλωροφόρμιο είναι ο ευρύτερα χρησιμοποιούμενο διαλύτης στη φασματοσκοπία Η-NMR, αφού το ίδιο είναι
"αόρατο" και επιτρέπει τη λήψη καθαρών φασμάτων, χωρίς την εμφάνιση κορυφών
διαλύτη. Στις αντιδράσεις, η
χλωράλη και η 1,1,1-τριχλωρακετόνη αντιδρούν με διάλυμα δευτεριωμένης βάσης
(π.χ. NaOD) σε βαρύ ύδωρ (D2O) (βλ.
Χημική ένωση του μήνα: Βαρύ ύδωρ).
Βιομηχανικές μέθοδοι. Η κύρια βιομηχανική μέθοδος παρασκευής του
χλωροφορμίου βασίζεται στη θέρμανση μίγματος χλωρίου με μεθάνιο στους
400-600°C.
Κατά την αντίδραση, η οποία χωρεί με μηχανισμό ελεύθερων ριζών χλωρίου,
σχηματίζονται διαδοχικά όλα τα τα χλωριωμένα παράγωγα του μεθανίου:
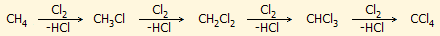
|
* υπό αποσύνθεση |
Με
έλεγχο της αναλογίας των αντιδρώντων αερίων βελτιστοποιείται η απόδοση ως
προς το χλωροφόρμιο, το οποίο υπόκειται σε περαιτέρω καθαρισμό με κλασματική
απόσταξη.
Για τα κύρια παραπροϊόντα (διχλωρομεθάνιο και τετραχλωράνθρακα),
σχετικά πρόσφατα, έχει περιγραφεί μέθοδος ανταλλαγής μεταξύ τους Η και Cl
(παρουσία LaCl3)
προς σχηματισμό χλωροφορμίου σύμφωνα με την αντίδραση
[Αναφ. 6]:
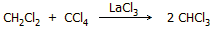
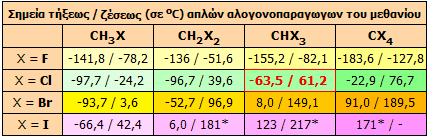
Τα σημεία ζέσεως και τήξεως όλων των απλών αλογονοπαραγώγων του μεθανίου δίνονται στον παραπλεύρως πίνακα.
Αντιδράσεις χλωροφορμίου [Αναφ. 7]
Οξείδωση. Υπόκειται σε βραδεία οξείδωση από το
ατμοσφαιρικό οξυγόνο παρέχοντας το τοξικότατο φωσγένιο (phosgene),
γνωστό πολεμικό αέριο, σύμφωνα με την αντίδραση:
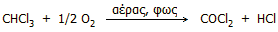
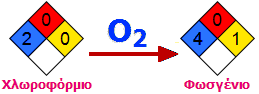 Η αντίδραση επιταχύνεται
εξαιρετικά από το φως και για τον λόγο αυτό το χλωροφόρμιο πρέπει να φυλάσσεται σε
σκοτεινόχρωμες φιάλες και κατά το δυνατόν γεμάτες, ώστε να μην έρχεται σε
επαφή με μεγάλη ποσότητα αέρα. Το χλωροφόρμιο, αν και το
ίδιο άφλεκτο, σε επαφή με γυμνή φλόγα μπορεί να σχηματίσει φωσγένιο και
απαιτείται ιδιαίτερη προσοχή.
Η αντίδραση επιταχύνεται
εξαιρετικά από το φως και για τον λόγο αυτό το χλωροφόρμιο πρέπει να φυλάσσεται σε
σκοτεινόχρωμες φιάλες και κατά το δυνατόν γεμάτες, ώστε να μην έρχεται σε
επαφή με μεγάλη ποσότητα αέρα. Το χλωροφόρμιο, αν και το
ίδιο άφλεκτο, σε επαφή με γυμνή φλόγα μπορεί να σχηματίσει φωσγένιο και
απαιτείται ιδιαίτερη προσοχή.
Ίχνη
φωσγενίου καθιστούν το χλωροφόρμιο ακατάλληλο για χορήγηση αναισθησίας, αλλά
ακόμη και ως διαλύτη,
αφού το φωσγένιο είναι εξαιρετικά δραστική ένωση και μπορεί να αντιδράσει με
τις διαλυμένες ή εκχυλιζόμενες ενώσεις. Χαρακτηριστικά, αναφέρεται πως πολλά
πειράματα απομόνωσης DNA θα πρέπει να έχουν
αποτύχει εξαιτίας χλωροφορμίου μολυσμένου με φωσγένιο.
Σε μια περίπτωση, σε μια προφανώς παλιά φιάλη χλωροφορμίου, στον
αέρα πάνω από τον διαλύτη αέρα διαπιστώθηκε η παρουσία φωσγένιου σε
συγκεντρώσεις 15.000 ppm (!), όταν το
LD50
του φωσγενίου είναι 570
ppm και χρόνο εισπνοής 1 min
[Αναφ. 7β]. Ευτυχώς, υπάρχουν απλές αντιδράσεις με τις οποίες
μπορούν εύκολα να ανιχνευθούν μικρές ποσότητες φωσγενίου σε χλωροφόρμιο.
Συνήθως στο χλωροφόρμιο προστίθεται ποσότητα αιθανόλης (περίπου
0,5-2%) ως σταθεροποιητής (stabilizer). Η αιθανόλη δεσμεύει το φωσγένιο προς τον μη τοξικό ανθρακικό
διαιθυλεστέρα (diethylcarbonate) σύμφωνα με την αντίδραση:
CΟCl2 + 2 C2H5OH
 (C2H5O)2CO + 2 HCl
(C2H5O)2CO + 2 HCl
Αναγωγή. Ανάγεται εύκολα με υδρογόνο "εν τω γεννάσθαι" ([H],
π.χ. Zn + HCl) προς χλωριωμένα παράγωγα του μεθανίου με
μικρότερο αριθμό ατόμων χλωρίου ή και προς μεθάνιο:
CΗCl3 + 2
[Η]
 CH2Cl2 + HCl CΗCl3 + 4
[Η]
CH2Cl2 + HCl CΗCl3 + 4
[Η]
 CH3Cl + 2 HCl CΗCl3 + 6
[Η]
CH3Cl + 2 HCl CΗCl3 + 6
[Η]
 CH4 + 3 HCl
CH4 + 3 HCl
Αντιδρά εκρηκτικά με δραστικά μέταλλα (Na, Li),
ενώ με σκόνη Ag παρέχει ακετυλένιο:
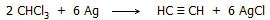
Νίτρωση. Αντιδρά με πυκνό - θερμό νιτρικό οξύ
παρέχοντας
χλωροπικρίνη (chloropicrin), μια τοξική ένωση (ελαιώδες
υγρό σ.ζ. 112ºC), που είχε χρησιμοποιηθεί ως
πολεμικό αέριο (εμετογόνο, δακρυγόνο) και βρίσκει ακόμη κάποια περιορισμένη χρήση ως
παρασιτοκτόνο:
CHCl3 + ΗΝΟ3
 Cl3C-NO2 + H2O
Cl3C-NO2 + H2O
Αλκαλική υδρόλυση. Αντιδρά με αλκοολικό διάλυμα
ισχυρών βάσεων (π.χ. ΚΟΗ) παρέχοντας μυρμηκικά ιόντα:
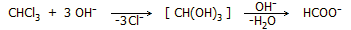
Σχετικά πρόσφατα διεξήχθη λεπτομερής μελέτη της
κινητικής της αλκαλικής υδρόλυσης του χλωροφορμίου και του τετραχλωράνθρακα,
στο πλαίσιο μιας έρευνας πάνω στους αβιοτικούς παράγοντες απομάκρυνσης των
ενώσεων αυτών από το περιβάλλον [Αναφ. 7γ].
Αντιδράσεις
συμπύκνωσης. Σε αλκαλικό διάλυμα αντιδρά με ακετόνη (απλή
πυρηνόφιλη προσθήκη) παρέχοντας 1,1,1-τριχλωρο-2-μεθυλο-2-προπανόλη, γνωστή ως
χλωρετόνη (chloretone), ένα στερεό (σ.τ. 95-99ºC, σ.ζ. 167ºC), που δρα ως συντηρητικό και ήπιο
αναισθητικό-καταπραϋντικό:
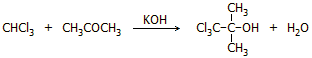
 Αντίδραση "ισονιτριλίου".
Με πρωτοταγείς αμίνες το χλωροφόρμιο
αντιδρά σε αλκαλικό διάλυμα σχηματίζοντας ισονιτρίλια (ή
ισοκυανίδια ή καρβυλαμίνες, RNC), σύμφωνα με την ακόλουθη
αντίδραση:
Αντίδραση "ισονιτριλίου".
Με πρωτοταγείς αμίνες το χλωροφόρμιο
αντιδρά σε αλκαλικό διάλυμα σχηματίζοντας ισονιτρίλια (ή
ισοκυανίδια ή καρβυλαμίνες, RNC), σύμφωνα με την ακόλουθη
αντίδραση:
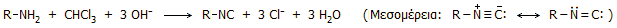
Η
αντίδραση "ισονιτριλίου" είναι χαρακτηριστική για τις πρωτοταγείς αμίνες και
χρησιμοποιείται για την ποιοτική ανίχνευσή τους. Τα
υγρά ισονιτρίλια είναι εξαιρετικά δύσοσμες, τοξικές ουσίες
και
είναι ισομερή προς τα νιτρίλια (RCN), τα οποία έχουν ανεκτή έως και
μάλλον ευχάριστη οσμή και πολύ μικρότερη τοξικότητα
[Αναφ. 7δ].
Η εισπνοή ατμών ισονιτριλίων αφήνει μια εξαιρετικά
οδυνηρή και αξέχαστη οσφρητική εμπειρία. Χαρακτηριστικά αναφέρεται πως πολλοί από τους επιστήμονες
που δοκίμασαν να εμβαθύνουν στη μελέτη των ενώσεων αυτών, εγκατέλειψαν την
προσπάθειά τους εξαιτίας της άκρως δυσάρεστης οσμής τους.
Αντίδραση Friedel -
Crafts. Το χλωροφόρμιο αντιδρά με το βενζόλιο παρουσία AlCl3
για να δώσει σε ικανοποιητική απόδοση τριφαινυλομεθάνιο (σ.τ. 92-94ºC):
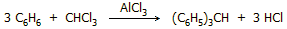
Αντιδράσεις
διχλωροκαρβενίου. Το χλωροφόρμιο είναι εύχρηστη πηγή του
εξαιρετικά δραστικού διχλωροκαρβένιου, [:CCl2
], (dichlorocarbene).
Το δραστικό αυτό ενδιάμεσο (είναι εξαιρετικά βραχύβιο)
παράγεται κατά την αντίδραση χλωροφορμίου με μια ισχυρή βάση ή κατά τη
θερμική διάσπαση του χλωροφορμίου ("θερμικό διχλωροκαρβένιο") σύμφωνα με τις
αντιδράσεις:
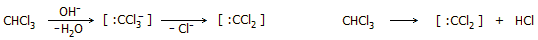
Τυπική αντίδραση που χωρεί μέσω ενδιάμεσου σχηματισμού διχλωροκαρβενίου,
είναι η σύνθεση σαλικυλικής αλδεΰδης (αντίδραση
Reimer-Tiemann),
που παρασκευάζεται με άμεση αντίδραση μίγματος φαινόλης - χλωροφορμίου σε
αλκαλικό διάλυμα. Η αντίδραση συνοψίζεται ως εξής:
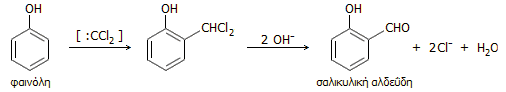
Στην ουσία, όλες οι αντιδράσεις του
χλωροφορμίου που πραγματοποιούνται σε αλκαλικό διάλυμα (π.χ. αντίδραση
υδρόλυσης, αντίδραση ισονιτριλίου) χωρούν μέσω σχηματισμού διχλωροκαρβενίου.
Θερμική διάσπαση
χλωροφορμίου. Μελετήθηκε η θερμική διάσπαση του χλωροφορμίου στην
περιοχή θερμοκρασιών 450-525ºC. Διαπιστώθηκε ότι παρέχει κυρίως τετραχλωροαιθυλένιο,
δευτερευόντως εξαχλωροαιθάνιο, όπως και μερικώς υδρογονωμένα
παράγωγά τους και ιχνοποσότητες άλλων ουσιών (ακόμη και εξαχλωροβενζόλιο). Οι αντιδράσεις χωρούν μέσω παραγωγής "θερμικού διχλωροκαρβενίου" [Αναφ. 7ε,στ],
π.χ. η αντίδραση σχηματισμού τετραχλωροαιθυλενίου
συνοψίζεται ως εξής:
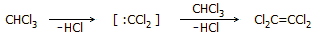
|
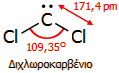 Καρβένια:
Ενώσεις "δισθενούς" άνθρακα Καρβένια:
Ενώσεις "δισθενούς" άνθρακα
Καρβένια
(carbenes) είναι μια οικογένεια ηλεκτρικώς
ουδέτερων οργανικών μορίων
που αποτελούνται από ένα άτομο δισθενούς άνθρακα (με μια εξάδα ηλεκτρονίων
σθένους)
ενωμένου με δύο υποκαταστάτες. Το απλούστερο καρβένιο είναι το μεθυλένιο
(:CH2)
το οποίο δεν μπορεί
να απομονωθεί. Τα καρβένια είναι εξαιρετικώς ασταθή για να απομονωθούν και
να αποθηκευθούν, πολλά όμως έχουν σταθεροποιηθεί όσο χρειάζεται για
φασματοσκοπικές μελέτες σε ειδικές πειραματικές διατάξεις και σε εξαιρετικά χαμηλές θερμοκρασίες. Η αναζήτηση
σταθερών καρβενίων αποτελεί αντικείμενο έντονης ερευνητικής προσπάθειας στην
Οργανική Χημεία
[Αναφ. 8].
Σταθερότερα αναμένονται να είναι τα καρβένια στα οποία ο άνθρακας συνδέεται
με αμινομάδες, λόγω προσφοράς αρνητικού ηλεκτρονιακού φορτίου προς τον
"δισθενή" άνθρακα και σταθεροποίησης μέσω μεσομέρειας της μορφής:
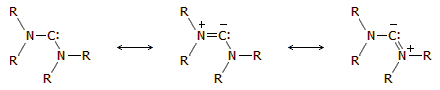
Από τα πλέον μελετηθέντα καρβένια
είναι το διχλωροκαρβένιο και το διβρωμοκαρβένιο. Το διχλωροκαρβένιο
δεν μπορεί να απομονωθεί, αλλά η παρουσία του ως ενδιαμέσου σε οργανικές
συνθέσεις έχει τεκμηριωθεί και παράγεται εύκολα με αντίδραση χλωροφορμίου με
ισχυρές βάσεις ή με θερμική πυρόλυσή του. Από τις πιο χαρακτηριστικές
αντιδράσεις του διχλωροκαρβενίου είναι εκείνες με αλκένια ή κυκλοαλκένια,
όπου σχηματίζονται παράγωγα του κυκλοπροπανίου (κυκλοπροπανοποιήσεις) όπως η ακόλουθη:
|
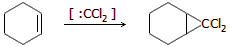 |
: 1,2-διχλωρομεθυλενο-κυκλοεξάνιο ή 7,7-διχλωρο-δικυκλο[4.1.10]επτάνιο |
Στην περίπτωση σχηματισμού
καρβενίων με επίδραση υδατικών διαλυμάτων ισχυρών βάσεων, η απόδοση των αντιδράσεων
αυτών αυξάνεται παρουσία καταλυτών που υποβοηθούν την ανάμιξη των
αντιδραστηρίων (του υδατικού διαλύματος
ισχυρής βάσης και της οργανικής φάσης χλωροφορμίου/αλκενίου). Οι
καταλύτες αυτοί γνωστοί ως καταλύτες μεταφοράς φάσης (phase
transfer catalysts) συνήθως είναι άλατα τεταρτοταγών βάσεων του
αμμωνίου, όπως π.χ. το χλωριούχο δωδεκυλο-τριμεθυλαμμώνιο,
C12H25(CH3)3N+Cl-
(κατιοντικό απορρυπαντικό).
|
|

Οι μεγαλύτερες
ποσότητες του παραγόμενου σήμερα χλωροφορμίου χρησιμοποιούνίται
στην παραγωγή υπερφθοριωμένων πολυμερών, όπως του Teflon. |
Παραγωγή και χρήσεις του χλωροφορμίου
Χλωροφόρμιο παράγεται κυρίως στις ΗΠΑ, στην
Ευρωπαϊκή Ένωση και στην Ιαπωνία και εκτιμάται ότι κατά τα τέλη της
δεκαετίας του 1990 η ετήσια παραγωγή έφτανε τους 520.000 τόνους
[Αναφ. 9].
Το 90-95% της παραγωγής του χλωροφορμίου χρησιμοποιείται για
την παρασκευή του χλωροφθοράνθρακα
CHClF2
(CFC-22, σ.ζ. -40,7°C).
Το CFC-22 έχει δύο κύριες χρήσεις: (α) Χρησιμοποιείται ως ψυκτικό και
προωθητικό αέριο στη θέση των
CFCl3
(CFC-11, σ.ζ. 23,7ºC) και CF2Cl2
(CFC-12, σ.ζ. -29,8°C)
και (β) στην παραγωγή υπερφθοριωμένων πολυμερών.
Το CFC-22 χρησιμοποιείται ως ψυκτικό
(ψυγεία, κλιματιστικά) και ως προωθητικό αέριο,
επειδή έχει πολύ μικρότερη δυναμικότητα ως αέριο
καταστρεπτικό του όζοντος σε σχέση με τα CFC-11 και CFC-12. Η
παραγωγή των CFC-11 και CFC-12 έχει πλέον απαγορευθεί λόγω της καταστρεπτικής δράσης του επί της
στιβάδας του όζοντος (Δυναμικό καταστροφής όζοντος,
ODP: CFC-22 = 0,055, ενώ
CFC-11 και CFC-12 = 1, βλ.
Χημική ένωση του μήνα: 'Οζον).
Ωστόσο, το CFC-22
αποτελεί "αέριο θερμοκηπίου" και η απελευθέρωσή του στο περιβάλλον συμβάλλει
στη παγκόσμια υπερθέρμανση (Δυναμικό θέρμανσης του
πλανήτη, GWP: CFC-22 = 1280, ενώ
CO2
= 1, βλ.
Χημική ένωση του μήνα: 'Εξαφθοριούχο θείο). Σύμφωνα με το
πρωτόκολλο του Montreal, κάθε
άλλη χρήση του CFC-22
πλην της σύνθεσης πολυφθοριωμένων πολυμερών, θα
πρέπει σταδιακά από το 2010 μέχρι το 2020 να μηδενισθεί, κάτι που αναμένεται να επηρεάσει σοβαρά την αγορά του χλωροφορμίου.
Σήμερα, περίπου το 40%
του παραγόμενου CFC-22 χρησιμοποιείται για τη σύνθεση
υπερφθοριωμένων πολυμερών και ειδικά του πολυ(τετραφθοροαιθυλενίου),
που είναι ευρύτερα γνωστό με την εμπορική ονομασία Teflon. Η αλληλουχία των αντιδράσεων έχει ως
εξής:

Μικρότερες ποσότητες χλωροφορμίου χρησιμοποιούνται ως πρώτη ύλη στη
φαρμακευτική βιομηχανία, στις συνθέσεις διάφορων εντομοκτόνων και ως διαλύτης
σε διάφορες βιομηχανίες και στα χημικά εργαστήρια. Το χλωροφόρμιο είναι καλός διαλύτης των
πολυμεθακρυλικών εστέρων (plexiglas). Λίγες σταγόνες χλωροφορμίου ανάμεσα σε
δύο πλάκες plexiglas και πίεσή τους για λίγα
λεπτά αρκούν για να συγκολλήσουν μόνιμα τις πλάκες του πολυμερούς
[Αναφ. 9γ].
|
Κωδικοποίηση των διάφορων
χλωροφθορανθράκων [Αναφ. 9δ]
 Οι
διάφοροι (κορεσμένοι) χλωροφθοράνθρακες (με γενικό μοριακό τύπο CxHyFzClw), που
χρησιμοποιούνται ως ψυκτικά υγρά (refrigerants), προωθητικά
αέρια (propellants) ή διαλύτες και είναι γνωστά και με διάφορα
εμπορικά ονόματα (π.χ. Freon της Du Pont), περιγράφονται με έναν κωδικό διψήφιο ή
τριψήφιο αριθμό από τον οποίο προκύπτει ο μοριακός τους τύπος με βάση
τον μνημονικό κανόνα του 90 (Rule of 90). Οι
διάφοροι (κορεσμένοι) χλωροφθοράνθρακες (με γενικό μοριακό τύπο CxHyFzClw), που
χρησιμοποιούνται ως ψυκτικά υγρά (refrigerants), προωθητικά
αέρια (propellants) ή διαλύτες και είναι γνωστά και με διάφορα
εμπορικά ονόματα (π.χ. Freon της Du Pont), περιγράφονται με έναν κωδικό διψήφιο ή
τριψήφιο αριθμό από τον οποίο προκύπτει ο μοριακός τους τύπος με βάση
τον μνημονικό κανόνα του 90 (Rule of 90).
Εύρεση μοριακού τύπου από τον
κωδικό αριθμό: Στον κωδικό αριθμό προσθέτουμε το 90, οπότε προκύπτει o
τριψήφιος αριθμός xyz. Οι
αριθμοί των εκατοντάδων (x), των δεκάδων (y) και των μονάδων (z),
αντιστοιχούν στον αριθμό των ατόμων C, H, και F στο
μόριο του χλωροφθοράνθρακα.
Ο αριθμός w (άτομα Cl)
προκύπτει εκ διαφοράς. Δεδομένου ότι ισχύει πάντοτε ότι y + z + w =2x + 2 (ως
παράγωγα κεκορεσμένου υδρογονάνθρακα), επομένως είναι w = 2x + 2 - y - z.
Παραδείγματα:
CFC-12 ή
R-12: 12 + 90=102, οπότε είναι C = 1, H = 0, F = 2, Cl = 2x1 + 2 - 0 -
2 = 2, επομένως η ένωση είναι το CF2Cl2.
CFC-22 ή
R-22: 22 + 90=112, οπότε είναι C = 1, Η = 1, F = 2, Cl = 2x1 + 2 - 1 -
2 = 1, επομένως η ένωση είναι το CHF2Cl.
CFC-124 ή R-124:
124 + 90 = 214, οπότε είναι C = 2, Η = 1, F = 4, Cl = 2x2 + 2 - 1 - 4 = 1,
επομένως η ένωση είναι το C2HF4Cl.
Εύρεση του κωδικού αριθμού από
τον μοριακό τύπο: Ακολουθείται η αντίστροφη διαδικασία. Γράφουμε τον
τριψήφιο αριθμό xyz που καθορίζεται από τoν αριθμό των ατόμων C,
H και F, αντιστοίχως. Από τον αριθμό αυτόν αφαιρείται το 90
και ο αριθμός που προκύπτει αποτελεί τον κωδικό του χλωροφθοράνθρακα.
Παραδείγματα:
CFCl3:
Είναι C = 1, H = 0, F = 1, επομένως ο τριψήφιος αριθμός είναι 101 και ο
κωδικός είναι 101 - 90 = 11, επομένως το
CFCl3
είναι το CFC-11 ή R-11.
C2F3Cl3:
Είναι C = 2, H = 0, F = 3, επομένως ο τριψήφιος αριθμός είναι 203 και ο
κωδικός είναι 203 - 90 = 113, επομένως το
C2F3Cl3
είναι το CFC-113 ή R-113.
CHCl3:
Είναι C = 1, H = 1, F = 0, επομένως ο τριψήφιος αριθμός είναι 110 και ο
κωδικός είναι 110 - 90 = 20. Επομένως το χλωροφόρμιο
είναι το CFC-20
ή R-20.
 Στις περιπτώσεις
χλωροφθορανθράκων με 2 ή περισσότερα άτομα άνθρακα, ο κωδικός
αριθμός δεν παρέχει πληροφορίες και ως προς την κατανομή των ατόμων Η, F, Cl
στα επιμέρους άτομα άνθρακα, δηλ. δεν μας παρέχει τον συντακτικό τύπο της ένωσης. Για να διακρίνονται τα διάφορα ισομερή, ο αριθμός ακολουθείται από γράμματα,
έτσι CFC-113 ή R-113 είναι το
CCl2F-CClF2,
ενώ CFC-113a ή R-113a είναι το
Cl3C-CF3. Στις περιπτώσεις
χλωροφθορανθράκων με 2 ή περισσότερα άτομα άνθρακα, ο κωδικός
αριθμός δεν παρέχει πληροφορίες και ως προς την κατανομή των ατόμων Η, F, Cl
στα επιμέρους άτομα άνθρακα, δηλ. δεν μας παρέχει τον συντακτικό τύπο της ένωσης. Για να διακρίνονται τα διάφορα ισομερή, ο αριθμός ακολουθείται από γράμματα,
έτσι CFC-113 ή R-113 είναι το
CCl2F-CClF2,
ενώ CFC-113a ή R-113a είναι το
Cl3C-CF3.
Κωδικοποίηση των
Halon: Τα Ηalon
είναι αλογονωμένοι υδρογονάνθρακες που στο μόριο τους μπορεί να
περιλαμβάνουν και βρώμιο. Η κωδικοποίηση των Halon
είναι απλή και άμεση. Ο κωδικός αριθμός τους είναι τετραψήφιος και αποδίδει
τον αριθμό (κατά σειρά) των ατόμων C, F,
Cl και Br.
Εάν ο κωδικός είναι πενταψήφιος, τότε στο μόριο υπάρχει και Ι, ο
αριθμός των ατόμων του οποίου αποδίδεται από το 5ο αριθμό.
Δεσμοί που δεν καταλαμβάνονται
από αλογόνο είναι δεσμοί υδρογόνου.
Παραδείγματα:
Halon-1301: C
= 1, F = 3, Cl = 0, Br = 1, επομένως η ένωση είναι:
CF3Br.
Halon-1030:
C = 1, F = 0,
Cl = 3, Br =
0,
επομένως η ένωση είναι:
CHCl3.
Halon-10101:
C = 1, F = 0,
Cl = 1, Br =
0, I = 1,
επομένως η ένωση είναι:
CH2ClI. |
Το χλωροφόρμιο στο περιβάλλον
Παλαιότερα οι επιστήμονες πίστευαν ότι ελάχιστες οργανοαλογονικές
υπήρχαν στη φύση. Ωστόσο μέχρι σήμερα έχουν εντοπισθεί
περισσότερες από 2000 φυσικές οργανοαλογονικές ενώσεις. Αρκεί να αναφερθεί ότι σε
ένα μόνο είδους φυκιού (Hawaiian red seaweed) έχουν βρεθεί πάνω από 50
οργανοαλογονικές ενώσεις "εξωτικού χαρακτήρα", όπως οι: CHBr3,
CHBrClI, BrCH2CH2I,
CH2I2,
Br2CHCHO,
I2CHCOOH
και η CCl3COCCl3.
Είναι λογικό να αναμένει κανείς πως θαλάσσιοι οργανισμοί που ζουν σε
περιβάλλον πλούσιο αλογονοϊόντα, έχουν προσαρμοσθεί σε σημείο που να
περιλαμβάνουν τα αλογόνα στις μεταβολικές διεργασίες τους.
Πολλά φύκη παράγουν τα μεθυλαλογονίδια CH3X
(X: Cl, Br, I). Ακόμη και τα γνωστά "μπούζια" (ice plants), που αφθονούν
στις βραχώδεις παραθαλάσσιες περιοχές, βιοσυνθέτουν CH3Cl
και CH3Br.
Να σημειωθεί ότι το CH3Cl
είναι η πλέον άφθονη στη φύση οργανοαλογονική ένωση. Στον αέρα βρίσκεται
σε συγκεντρώσεις 500-550 ppt (μέρη στο τρισεκατομμύριο) και μάλιστα δεν
φαίνεται να αποτελεί δημιούργημα της βιομηχανικής εποχής, αφού σε αέρα 300
ετών (εγκλωβισμένο σε πάγο) βρέθηκε στα ίδια επίπεδα με τα σημερινά.
Εκτιμάται ότι στη φύση κάθε χρόνο απελευθερώνονται περίπου 5 εκατομμύρια
τόνοι μεθυλαλογονιδίων από ζώντες οργανισμούς
[Αναφ. 10].
|
(1) |
(2) |

(3) |

(4) |

(5) |
|
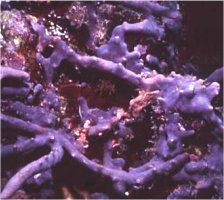
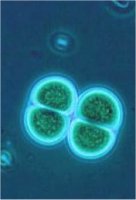
Φυσικές πηγές
οργανοαλογονικών ενώσεων: (1) Dysedia granulosa: κυανοβακτήριο, (2)
Chroococcus turgidus: κυανοβακτήριο, από τους πλέον δραστήριους
παραγωγούς οργανοαλογονικών ενώσεων, (3)
Carpobrotus edulis, τα γνωστά "μπούζια" (ice
plants), που αφθονούν στις θαλάσσιες ακτές, αποτελούν μια από τις κυριότερες
φυσικές πηγές CH3Cl
και CH3Br, (4) βαλτότοποι και (5) ηφαίστεια.
|
Η βιοσύνθεση των τριαλομεθανίων (CHCl3,
CHBr3,
CHI3)
πραγματοποιείται με μια σειρά αντιδράσεων που θυμίζουν την αλογονοφορμική
αντίδραση. Στη βιοσύνθεσή του εμπλέκεται ενεργά το ένζυμο χλωροϋπεροξειδάση
(chloroperoxidase, CPO), ένα ένζυμο του οποίου δραστηριότητα έχει
διαπιστωθεί σε πολλά εδάφη. Για παράδειγμα, η βιοσύνθεση χλωροφορμίου,
μπορεί να αποδοθεί από την ακόλουθη σειρά αντιδράσεων:
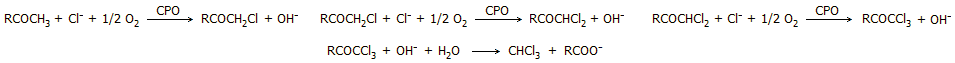
Σε
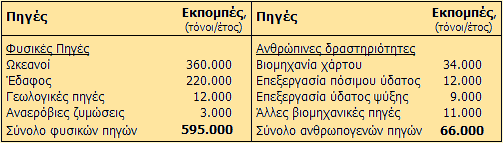
μια μελέτη του 1993 έχει εκτιμηθεί ότι οι συνολικές (φυσικές +
ανθρωπογενείς) ετήσιες εκπομπές χλωροφορμίου στο περιβάλλον φθάνουν περίπου
τις 660 χιλιάδες τόνων και παρέχονται στον παραπλεύρως πίνακα.
Οι κυριότερες
φυσικές πηγές εκπομπών χλωροφορμίου είναι: οι ωκεανοί (44%) και το έδαφος (21%).
Σημαντικές πηγές είναι και οι
τερμίτες (13%) και οι ορυζώνες (3%), που συμβαίνει να είναι και πηγές
μεθανίου (βλ.
Χημική ένωση του μήνα: Μεθάνιο). Σε ανθρώπινες δραστηριότητες
αποδίδεται περίπου το 10% των εκπομπών χλωροφορμίου
Οι κυριότερες ανθρωπογενείς εκπομπές προέρχονται από τη
βιομηχανία χάρτου, όπου μεγάλες ποσότητες χλωρίου χρησιμοποιούνται για τη
λεύκανση της χαρτομάζας. Σημαντική πηγή αποτελούν οι μονάδες επεξεργασίας
του πόσιμου ύδατος με χλώριο
[Αναφ. 10γ,δ].
Στον αέρα το χλωροφόρμιο οξειδώνεται αργά.
Ο χρόνος υποδιπλασιασμού του
στην ατμόσφαιρα κυμαίνεται από 55 έως 660 ημέρες με κύριο προϊόν το
COCl2,
το οποίο υδρολύεται ταχύτατα προς CO2
και HCl
[Αναφ. 1γ].
Το χλωροφόρμιο εκτιμάται ότι συνεισφέρει μόλις κατά περίπου 0,3% στην
καταστροφή του όζοντος. Δεδομένου ότι οι ανθρωπογενείς εκπομπές συνεισφέρουν
κατά 10% στο ατμοσφαιρικό χλωροφόρμιο, η παραγωγή και οι διάφορες χρήσεις
του δεν θεωρούνται επιβλαβείς
για τη στιβάδα όζοντος και έτσι το χλωροφόρμιο δεν περιλαμβάνεται στον κατάλογο των καταστρεπτικών
ουσιών για το όζον, που αναφέρονται στο
πρωτόκολλο του Montreal. Το χλωροφόρμιο δεν
περιλαμβάνεται επίσης και στα "αέρια θερμοκηπίου",
που ελέγχονται από το
πρωτόκολλο του Kyoto
[Αναφ.
10γ].
Ασφάλεια και υγιεινή για το χλωροφόρμιο
 |
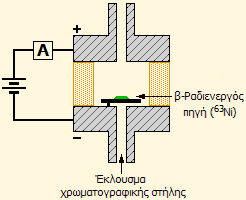 |
|
Αλογονωμένες
οργανικές ενώσεις, όπως το χλωροφόρμιο, μπορούν να
προσδιορισθούν με αεριοχρωμα-τογραφους (αριστερά), στους οποίους
ως ανιχνευτής χρησιμοποείται
ανιχνευτής σύλληψης ηλεκτρονίων (electron capture detector,
ECD). Δεξιά δείχνεται σχηματικά ένας ανιχνευτής ECD. Μια πηγή
ηλεκτρονίων (ένα β-ραδιενεργό ισότοπο, όπως το Ni-63) δημιουργεί
ένα σταθερό ρεύμα βάσης το οποίο καταγράφεται. Όταν στο έκλουσμα
της στήλης παρουσιαστούν αλογονούχες ενώσεις, οι οποίες έχουν
μια τάση να "συλλάβουν" ηλεκτρόνια, το ρεύμα μειώνεται. Η μείωση
του ρεύματος συσχετίζεται με την ποσότητα της αλογονούχου
ένωσης. Η ευαισθησία επαρκεί για τη μέτρηση χλωριωμένων ενώσεων
σε συγκεντρώσεις μερικών ppt (μέρη στο τρισεκατομμύριο) ή
(χονδρικά) 1 σταγόνα χλωροφορμίου σε μία πισίνα κολύμβησης
Ολυμπιακών προδιαγραφών. |
Το χλωροφόρμιο είναι γνωστό για την τοξική του
δράση στον άνθρωπο και για τον λόγο αυτό, όταν χρησιμοποιείται ως διαλύτης
πρέπει να λαμβάνονται οι απαραίτητες προφυλάξεις (χειρισμοί μέσα στον
απαγωγό) και αποφυγή κάθε επαφής με το δέρμα. Εισπνοή ή κατάποση των ατμών
του χλωροφορμίου πρέπει να αποφεύγεται. Η θανατηφόρος δόση του χλωροφορμίου
έχει προσδιορισθεί στα περίπου 10 mL ή 15 g. Ο θάνατος επέρχεται εξαιτίας
δυσλειτουργίας των πνευμόνων, που οδηγεί σε καρδιακή ανακοπή.
Ως αναισθητικό το χλωροφόρμιο μπορεί να αρχίσει
να γίνεται τοξικό σε συγκεντρώσεις 500 ppm (μέρη ανά εκατομμύριο), σύμφωνα
με το Ινστιτούτο Επαγγελματικής Ασφάλειας και Υγείας των ΗΠΑ NIOSH (U.S.
National Institute for Occupational Safety and Health). Εισπνοή μέχρι 900
ppm για μικρές περιόδους μπορεί να προκαλέσει πονοκέφαλο, κούραση και
ζαλάδα.
Χρόνια έκθεση σε χλωροφόρμιο μπορεί να προκαλέσει βλάβες στο ήπαρ,
λόγω του μεταβολισμού του σε φωσγένιο στο όργανο αυτό. Επίσης, μπορεί να
προκαλέσει βλάβες στα νεφρά και ορισμένοι άνθρωποι μετά από χρόνια έκθεση
αναπτύσσουν πληγές στις περιοχές του δέρματος που έρχονται σε επαφή με
χλωροφόρμιο, πιθανώς λόγω της απολίπανσης του δέρματος.
Εισπνοή χλωροφορμίου σε συγκεντρώσεις
30-300 ppm από πειραματόζωα (μύες και επίμυες) σε κατάσταση εγκυμοσύνης
προκάλεσε μεγάλη συχνότητα αποβολών εμβρύων. Ποντίκια που γεννήθηκαν από πειραματόζωα που εκτέθηκαν για λίγες μέρες σε συγκεντρώσεις 400 ppm
παρουσίασαν μεγάλη συχνότητα γενετικών βλαβών και ανώμαλη κατανομή σπέρματος
[Αναφ. 1γ, Αναφ. 11].
Το χλωροφόρμιο λόγω της κατευναστικής τάσης στο
κεντρικό νευρικό σύστημα, χρησιμοποιήθηκε σε παλαιότερες εποχές σε
οδοντόπαστες, αντιβηχικά σιρόπια και άλλες φαρμακευτικές ουσίες. Η χρήση αυτή
και η παρουσία χλωροφορμίου σε κάθε καταναλωτικό προϊόν έχει
πλέον απαγορευθεί οριστικά (από το 1976 στις ΗΠΑ).
Η Διεθνής Υπηρεσία για την 'Ερευνα στον Καρκίνο
(International Agency for Research on Cancer), της Παγκόσμιας Οργάνωσης
Υγείας (World Health Organization) των Ηνωμένων εθνών κατατάσσει το χλωροφόρμιο στην Κατηγορία 2Β (πιθανό
καρκινογόνο στους ανθρώπους, με επιβεβαιωμένη καρκινογόνο δράση σε
πειραματόζωα). Τα τελευταία χρόνια, το χλωροφόρμιο έχει αντικατασταθεί ως
διαλύτης σε χημικά εργαστήρια από το λιγότερο τοξικό διχλωρομεθάνιο (CH2Cl2).
Το χλωροφόρμιο έχει βρεθεί ότι κατά το μεταβολισμό παρέχει ελεύθερες ρίζες
(με απώλεια ενός χλωρίου), που έχουν οξειδωτική δράση και αυξημένη
γονοτοξικότητα μέσω βλαβών στο DNA των κυττάρων.
Χλωροφόρμιο από τη
χλωρίωση ύδατος. Η χλωρίωση του πόσιμου νερού είναι η πλέον
διαδεδομένη και σίγουρη μέθοδος απολύμανσης από παθογόνους μικροοργανισμούς.
Ανάλογα με το οργανικό φορτίο του νερού (χουμικά οξέα και άλλες οργανικά
υλικά) σχηματίζονται χλωριωμένες οργανικές ενώσεις και κυρίως χλωροφόρμιο.
Oι αντιδράσεις παραγωγής χλωροφορμίου
στην πολύ γενική μορφή τους μπορούν να αποδοθούν ως εξής:
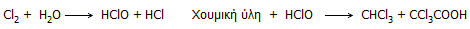
Οι
συγκεντρώσεις των χλωριωμένων ενώσεων από την χλωρίωση αυτή είναι εξαιρετικά
χαμηλές, αλλά λόγω των καρκινογόνων ιδιοτήτων τους αυξάνουν τον κίνδυνο για
καρκίνο της ουροδόχου κύστης. Επιδημιολογικές έρευνες δείχνουν ότι υπάρχει
ένα σχετικά χαμηλό ποσοστό αύξησης καρκίνου της ουροδόχου κύστης για
καταναλωτές πόσιμου νερού με χλωρίωση [Αναφ. 12α].
Η Υπηρεσία Προστασίας Περιβάλλοντος των ΗΠΑ (EPA)
έχει καθιερώσει ως ανώτερο αποδεκτό όριο (συνολικών) τριαλογονομεθανίων στο
πόσιμο ύδωρ τα 80 ppb (μέρη στο δισεκατομμύριο),
ενώ στην Ευρωπαϊκή 'Ενωση το αντίστοιχο όριο είναι 100 ppb.
Ως τριαλογονομεθάνια (trihalomethanes, THMs), στην προκειμένη περίπτωση εννοούνται οι ενώσεις:
CHCl3
(το πλέον κοινό), CHBr3,
CHBr2Cl
(το πλέον επικίνδυνο) και
CHBrCl2.
Σχετικά αυξημένες περιεκτικότητες σε βρωμιούχα τριαλογονομεθάνια αναμένονται
σε παραθαλάσσιες περιοχές, όπου στο πόσιμο νερό διεισδύουν ποσότητες
θαλασσινού νερού.
Τα τριαλογονομεθάνια στο πόσιμο νερό μπορούν να
μειωθούν με την κατά το δυνατόν πληρέστερη απομάκρυνση των πρόδρομων
οργανικών ενώσεων (χουμικά) με διήθηση και κροκίδωση, πριν από το στάδιο της
χλωρίωσης. Μέτρο της
περιεκτικότητας του νερού σε χουμικά οξέα αποτελούν οι δείκτες
TOC (total organic carbon) και
TOD (dissolved organic carbon). Πάντως, σύμφωνα με την EPA, οι κίνδυνοι ανάπτυξης καρκίνου
από τα ίχνη των τριαλογονομεθανίων στο πόσιμο ύδωρ υπερ-αντισταθμίζονται από
τα οφέλη της απολύμανσής του [Αναφ. 12β,γ].
Σε μια μελέτη που διεξήχθη στις ΗΠΑ (έκθεση
1990), η συγκέντρωση του χλωροφορμίου στην ατμόσφαιρα των ΗΠΑ εκτιμάται στα
περίπου 30 ppt, ενώ στο πόσιμο νερό (σε περιοχές της Καλιφόρνιας) βρέθηκε
από 14 έως 50 ppb (μέρη στο δισεκατομμύριο) [Αναφ.
10ε]. Σε αντίστοιχη μελέτη
σε πόσιμα ύδατα της Ελλάδας, διαπιστώθηκε ότι γενικώς τα τριαλογονομεθάνια
στα εξετασθέντα δείγματα (δείγματα μέσων δεκαετίας 1990) βρίσκονται κάτω από το όριο των 100
ppb εκτός από μια περίπτωση που παρουσιάσθηκε μια
μικρή υπέρβασή τους σε δείγματα που ελήφθησαν κατά τους καλοκαιρινούς
μήνες [Αναφ. 12γ].
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1.
(α) Merck Index, 12th ed, σελ. 2195. (β)
Wikipedia: "Chloroform".
(γ) International Programme on Chemicals Safety (INCHEM): "Concise
International Chemical Assessment Document 58:
Chloroform".
(δ) Louisiana State University: "Chloroform
Solvent Properties".
2. (α) FamousAmericans.net: "Samuel
Guthrie". (β) Monroe Soucie
JI,(AssociatedContent.com): "Samuel
Guthrie: Discoverer of Chloroform".
3. (α)
Societe d' Histoire de la Pharmacy: "Eugène
Soubeiran (1797-1858)".
(β) Wikipedia: "Eugène
Soubeiran".
(γ)
www.general-anaesthesia.com: "Justus
von Liebig".
(δ) Wikipedia: "Justus
von Liebig". (ε)
1902encyclopedia.com: "Justus
Liebig: German Chemist (1803-73)".
4. (α) www.discoveriesinmedicin.com:
"Chloroform".
(β)
www.general-anaesthesia.com:
"Chloroform".
(γ)
www.general-anaesthesia.com:
"Dr
Horace Wells".
(δ) Wikipedia: "John
Snow (Physician)".
(ε) Φραγκάκης Γ: "1847:
H πρώτη χορήγηση αναλγησίας στον τοκετό στη Δύση και στην Eλλάδα", Ελληνική
Μαιευτική και Γυναικολογία, 2002. (στ) Belding S (Oxford
University): "The
Chloroform: The Molecular Life Saver". (ζ) Wawersik J: "History of chloroform anesthesia", Allerg Immunol (Paris)
30(5):135-137, 1998 (Abstract).
5. Pharmpedia: "General
Principles of Pharmacology / Therapeutic Index". (β) Sulbaek Andersen
MP, Sander SP, Nielsen
OJ, Wagner DS, Sanford Jr TJ,
Wallington ΤJ: "Ιnhalation anaesthetics and climate change",
British Journal of Anaesthesia 105(6):760-766, 2010 (Abstract).
(γ)
www.general-anaesthesia.com:
"Chloroform
Provides Clue To 150 Year Old Medical Puzzle".
(δ) University of Leeds: "Chloroform
Provides Clue To 150 Year Old Medical Puzzle",
ScienceDaily, April 2008.
(ε) Bahnasi YM,Wright HM, Milligan
CJ, Dedman AM, Zeng F, Hopkins PM, Bateson AN, Beech DJ: "Modulation
of TRPC5 cation channels by halothane, chloroform and propofol", Br J
Pharmacol. 153(7):1505–1512, 2008.
6. (α) Science Daily: "New
Method To Recycle Unwanted Byproduct οf Chlorinated Hydrocarbon Production",
2008. (β) van der Heijden AWAM, Podkolzin SG, Jones ME, Bitter JH, Weckhuysen BM:
"Catalytic Hydrogen-Chlorine Exchange between Chlorinated Hydrocarbons under
Oxygen-Free Conditions", Angewandte Chemie International Edition, 2008
(Abstract).
7. (α) TutorVista.com: "Chloroform".
(β) Turk E: "Phosgene
from Chloroform", Chemical
& Engineering News, 76(9):6,
1998.
(γ) Amonette JE, Jeffers
PM, Qafoku O, Russell CK, Wietsma TW, Truex MJ: "Carbon Tetrachloride and
Chloroform Attenuation Parameter Studies: Heterogeneous Hydrolytic Reactions" (Status
Report), Pacific Northwest National Laboratory, 2009 (αρχείο
PDF, 662 KB). (δ) Wikipedia: "Isocyanide".
(ε) Semeluk GP, Bernstein RB: "The Thermal Decomposition of Chloroform. I.
Products",
J. Am. Chem. Soc.
76(14):3793-3796, 1954 (Abstract).
(στ) Semeluk GP, Bernstein RB: "The Thermal Decomposition of Chloroform. II.
Kinetcs",
J. Am. Chem. Soc.
79(1):46-49, 1957 (Abstract).
8. (α)
Wren C: "Carbenes: Synthesis, Isolation, and
Characterization" (αρχείο
PowerPoint, 217 ΚΒ). (β)
Wikipedia: "Carbene".
(γ) Wikipedia: "Dichlorocarbene".
9.
(α) International
Programme on Chemical Safety (IPCS) - World Health Organization: "Concise
International Chemical Assesment Document 58: Chloroform", Geneva, 2004
(Google
Ebook). (β)
Vithoontien V: "Managing
HCFC Production and Consumption",
The World Bank Group, The 12th Annual Financial
Agent Workshop, April 2008.
(αρχείο
PDF, 67 KB). (γ)
www.science-projects.com: "Working
with Plexiglas". (δ)
U.S. Environmental Protection Agency:
"Numbering
Scheme for Ozone-Depleting Substances and their Substitutes".
10. (α)
Gribble GW: "Naturally
Occurring Organohalogen Compounds - A Comprehensive Update", SpringerWienNewYork,
2010
(Google
Ebook). (β) Gribble GW: "Natural Organohalogens",
Eurochlor, October
2004
(αρχείο
PDF, 571 KB)
(εξαιρετικά
πληροφοριακό άρθρο ανασκόπησης 90 σελίδων). (γ) EUROCHLOR: "Chloroform
in the environment: Occurrence, sources,
sinks and effects", May
2002 (αρχείο
PDF 261 KB). (δ) Laturnus F, Haselmann KF, Borch T, Groen Ch:
"Terrestrial natural sources of trichloromethane (chloroform, CHCl3)
- An overview", Biogeochemistry 60:121-139, 2002 (αρχείο
PDF, 149 KB). (ε)
California Air Resources Board:
"Proposed
Identification of CHLOROFORM
As a Toxic Air Contaminant",
STAFF REPORT/EXECUTIVE SUMMARY, 1990.
(στ) National Institute of Health (USA): "Substance
Profile: Chloroform CAS No.67-66-3", Report on Carcinogens, 11th Ed. (αρχείο
PDF, 229 KB). (ζ) United States Department of Labour: "Occupational
Safety and Health Guideline for Chloroform"
11.
(α)
National Toxicology Program (NTP): "Report on Carcinogenesis Bioassays of
Chloroform", NIOH
publications, Bethesda, 1976
(αρχείο
PDF, 1,94 MB). (β)
Wolf DC, Butterworth BE: "Risk assessment of inhaled chloroform based on its
mode of action. Review", Toxicol
Pathol
25: 49-52, 1997 (PubMed).
(γ)
International Agency for Research on Cancer (IARC):
"Summaries
& Evaluations: Chloroform (Group 2B)",
Εκδόσεις IARC, Vol. 73, 1999,
Lyon,
France.
(δ)
Fawell J: "Risk assessment case study-Chloroform and related substances", Food Chem Toxicol 38 (Suppl 1): S91-S95,
2000 (PubMed).
Beddowes EJ, Faux SP, Chipman JK: "Chloroform, carbon
tetrachloride and glutathione depletion induce secondary genotoxicity in
liver cells via oxidative stress", Toxicology 187(2-3):101-115, 2003
(PubMed).
(ε)
Vittozzi L, Simonetta Gemma S, Sbraccia M, Testai
E: "Comparative characterization of
CHCl3 metabolism and toxicokinetics in rodent strains diffently subseptible
to chloroform-induced carcinogenicity", Environ Toxicol Pharmacol 8:103-110,
2003 (Abstract).
(στ)
Komulainen H: "Experimental cancer studies of chlorinated
by-products. Review", Toxicology 198(1-3):239-248,
2004 (PubMed).
(ζ)
Nagano K, Kano H, Arito H, Yamamoto S,
Matsushima T:
"Enhancement of renal
carcinogenicity by combined inhalation and oral exposures to chloroform in
male rats", J Toxicol Environ Health A, 69:1827-1842, 2006 (PubMed).
(η) Βαλαβανίδης
Αθ: "Βασικές Αρχές Υγιεινής και Ασφάλειας σε Χημικά και Βιοχημικά
Εργαστήρια. Πληροφορίες για Επικίνδυνες Χημικές Ουσίες" , Εκδόσεις
Σύγχρονα Θέματα, Αθήνα, 2008.
(θ) Βαλαβανίδης
Αθ, Βελονάκης Εμ: "Επαγγελματικός Καρκίνος. 'Εκθεση σε
Καρκινογόνους Παράγοντες στο Εργασιακό Περιβάλλον και Εκτίμηση
Κινδύνου", Ινστιτούτο Υγείας Ασφάλειας και Συνθηκών Εργασίας - Ελληνική
Αντικαρκινική Εταιρεία, Αθήνα, 1997.
12.
(α) Morris RD, Audet AM, Angelillo IF, Chalmers TC,
Mosteller F: "Chlorination, chlorination by-products, and cancer: a meta-analysis",
Am J Public Health. 82(7):955-963, 1992 (PubMed).
(β) Oram B: "Disinfection
By-Products: Trihalomethanes",
Water Research Center. (γ)
Golfinopoulos SK: "The occurrence of
trihalomethanes in the drinking water in Greece", Chemosphere, 41(11) 1761-1767,
2000 (Abstract)
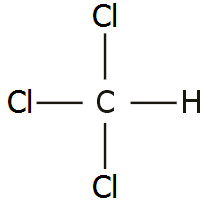
 Το
χλωροφόρμιο
(chloroform) παρασκευάστηκε για πρώτη φορά το 1831 από τον Αμερικανό γιατρό και
χημικό,
Το
χλωροφόρμιο
(chloroform) παρασκευάστηκε για πρώτη φορά το 1831 από τον Αμερικανό γιατρό και
χημικό, 














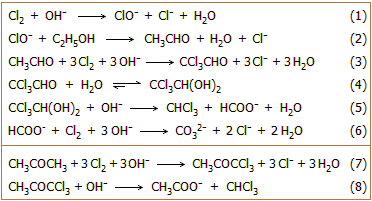

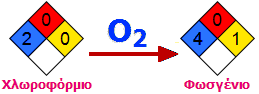 Η αντίδραση επιταχύνεται
εξαιρετικά από το φως και για τον λόγο αυτό το χλωροφόρμιο πρέπει να φυλάσσεται σε
σκοτεινόχρωμες φιάλες και κατά το δυνατόν γεμάτες, ώστε να μην έρχεται σε
επαφή με μεγάλη ποσότητα αέρα. Το χλωροφόρμιο, αν και το
ίδιο άφλεκτο, σε επαφή με γυμνή φλόγα μπορεί να σχηματίσει φωσγένιο και
απαιτείται ιδιαίτερη προσοχή.
Η αντίδραση επιταχύνεται
εξαιρετικά από το φως και για τον λόγο αυτό το χλωροφόρμιο πρέπει να φυλάσσεται σε
σκοτεινόχρωμες φιάλες και κατά το δυνατόν γεμάτες, ώστε να μην έρχεται σε
επαφή με μεγάλη ποσότητα αέρα. Το χλωροφόρμιο, αν και το
ίδιο άφλεκτο, σε επαφή με γυμνή φλόγα μπορεί να σχηματίσει φωσγένιο και
απαιτείται ιδιαίτερη προσοχή. 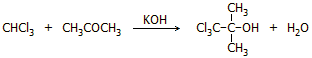
 Αντίδραση "ισονιτριλίου".
Με πρωτοταγείς αμίνες το χλωροφόρμιο
αντιδρά σε αλκαλικό διάλυμα σχηματίζοντας ισονιτρίλια (ή
ισοκυανίδια ή καρβυλαμίνες, RNC), σύμφωνα με την ακόλουθη
αντίδραση:
Αντίδραση "ισονιτριλίου".
Με πρωτοταγείς αμίνες το χλωροφόρμιο
αντιδρά σε αλκαλικό διάλυμα σχηματίζοντας ισονιτρίλια (ή
ισοκυανίδια ή καρβυλαμίνες, RNC), σύμφωνα με την ακόλουθη
αντίδραση: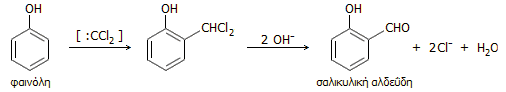
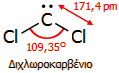 Καρβένια:
Ενώσεις "δισθενούς" άνθρακα
Καρβένια:
Ενώσεις "δισθενούς" άνθρακα
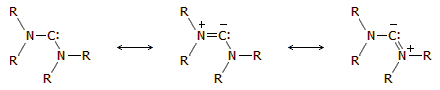

 Οι
διάφοροι (κορεσμένοι) χλωροφθοράνθρακες (με γενικό μοριακό τύπο CxHyFzClw), που
χρησιμοποιούνται ως ψυκτικά υγρά (refrigerants), προωθητικά
αέρια (propellants) ή διαλύτες και είναι γνωστά και με διάφορα
εμπορικά ονόματα (π.χ. Freon της Du Pont), περιγράφονται με έναν κωδικό διψήφιο ή
τριψήφιο αριθμό από τον οποίο προκύπτει ο μοριακός τους τύπος με βάση
τον μνημονικό κανόνα του 90 (Rule of 90).
Οι
διάφοροι (κορεσμένοι) χλωροφθοράνθρακες (με γενικό μοριακό τύπο CxHyFzClw), που
χρησιμοποιούνται ως ψυκτικά υγρά (refrigerants), προωθητικά
αέρια (propellants) ή διαλύτες και είναι γνωστά και με διάφορα
εμπορικά ονόματα (π.χ. Freon της Du Pont), περιγράφονται με έναν κωδικό διψήφιο ή
τριψήφιο αριθμό από τον οποίο προκύπτει ο μοριακός τους τύπος με βάση
τον μνημονικό κανόνα του 90 (Rule of 90).  Στις περιπτώσεις
χλωροφθορανθράκων με 2 ή περισσότερα άτομα άνθρακα, ο κωδικός
αριθμός δεν παρέχει πληροφορίες και ως προς την κατανομή των ατόμων Η, F, Cl
στα επιμέρους άτομα άνθρακα, δηλ. δεν μας παρέχει τον συντακτικό τύπο της ένωσης. Για να διακρίνονται τα διάφορα ισομερή, ο αριθμός ακολουθείται από γράμματα,
έτσι CFC-113 ή R-113 είναι το
Στις περιπτώσεις
χλωροφθορανθράκων με 2 ή περισσότερα άτομα άνθρακα, ο κωδικός
αριθμός δεν παρέχει πληροφορίες και ως προς την κατανομή των ατόμων Η, F, Cl
στα επιμέρους άτομα άνθρακα, δηλ. δεν μας παρέχει τον συντακτικό τύπο της ένωσης. Για να διακρίνονται τα διάφορα ισομερή, ο αριθμός ακολουθείται από γράμματα,
έτσι CFC-113 ή R-113 είναι το