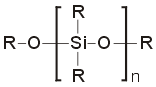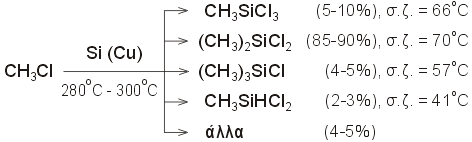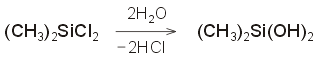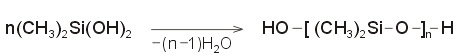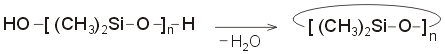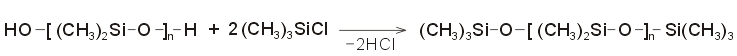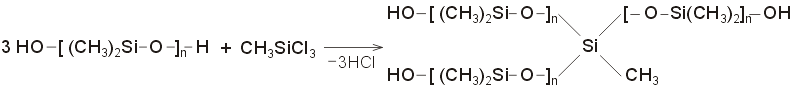Οι μέχρι σήμερα
Η χημική ένωση του
μήνα
[Αύγουστος
2006]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες:
Εμφάνιση: 'Αχρωμo,
άοσμo, μη ελαιώδες υγρό
Σχετική μοριακή μάζα:
370,78
Σημείο πήξης: -38,5oC
Σημείο βρασμού:
210οC (101οC / 20 mm Hg)
Σημείο ανάφλεξης:
76οC
Τάση
ατμών: 1,1 mm Hg (25οC)
Πυκνότητα: 0,96 g/mL
Διαλυτότητα
στο νερό: < 0,05 mg/L
Κινηματικό
ιξώδες: 3,9
cSt *
Συντελεστής κατανομής
(οκτανόλη/νερό): logPOW = 5,2
Πηγές: αναφ.
1 - 3 |
|
|
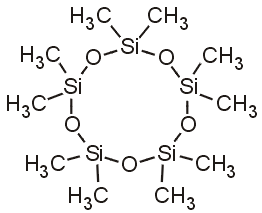
Δεκαμεθυλοκυκλοπεντασιλοξάνιο
Decamethylcyclopentasiloxane (D5) |
* Για
σύγκριση, τα κινηματικά ιξώδη, σε cSt (centiStokes)
στους 25οC
γνωστών υγρών είναι: ακετόνη: 0,40, ύδωρ:
0,89, αιθανόλη: 1,5, κ-βουτανόλη: 3,7,
βενζυλική αλκοόλη: 7,7, αιθυλενογλυκόλη: 14 (βλέπε
και διάγραμμα στη συνέχεια).
Λίγα
πράγματα για τα πολυσιλοξάνια (σιλικόνες) (αναφ.
4-7)
Τα
σιλάνια είναι οι αντίστοιχες προς τα αλκάνια
ενώσεις του πυριτίου με γενικό τύπο SinH2n+2.
Σε αντίθεση με τα αλκάνια, τα σιλάνια είναι
ασταθή, υδρολύονται εύκολα και παρουσία ατμοσφαιρικού οξυγόνου
αυτοαναφλέγονται.
Ωστόσο, εάν τα υδρογόνα
των σιλανίων αντικατασταθούν με αλκύλια (R)
ή άλλες ανάλογες ομάδες (ακόρεστα αλκύλια,
αρύλια κ.λπ.) και οι δεσμοί Si-Si
αντικατασταθούν με τους εξαιρετικά
σταθερούς δεσμούς Si-O-Si,
λαμβάνεται μια σειρά σταθερών ενώσεων, τα
πολυσιλοξάνια (ως σιλοξάνια ορίζονται
οι ενώσεις με 2 έως 4 οξυγόνα ενωμένα με
πυρίτιο) με γενικό τύπο:
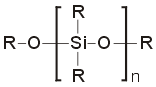
O
βασικός σκελετός στήριξης (-O-Si-O-Si-...) των
πολυσιλοξάνιων είναι ανόργανος και η
παρουσία των οργανικών ομάδων τα καθιστά
υδρόφοβα. Έτσι, τα πολυσιλοξάνια θεωρούνται
οργανικές ενώσεις με ανόργανο σκελετό.
Ανάλογα
με τον βαθμό πολυμερισμού, το είδος των
οργανικών ομάδων, την ύπαρξη ή όχι
διακλαδώσεων, οι φυσικές ιδιότητες των
πολυσιλοξανίων ποικίλουν ευρύτατα. Μπορεί
να είναι ευκίνητα και πτητικά υγρά έως και
ελαιώδη, παχύρρευστα και σχεδόν μη πτητικά
υγρά, ακόμη μπορεί να είναι ημιστερεά (με
εμφάνιση "ζελέ") ή κολλώδη υλικά και ελαστικά ή και
δύσκαμπτα στερεά.
Όπως
και στην περίπτωση του άνθρακα, έτσι και οι
δεσμοί του πυριτίου σχηματίζουν κανονικά
τετράεδρα και οι δεσμοί σχηματίζουν τη
γνωστή γωνία των 109ο 28'. Ωστόσο, στην
περίπτωση του πυριτίου η γωνία αυτή μπορεί
να αποκλίνει θετικά ή αρνητικά από την
τιμή αυτή πιο εύκολα (με πολύ μικρότερες
ενεργειακές απαιτήσεις), γεγονός που προσδίδει
στα πολυσιλοξάνια ιδιαίτερα
χαρακτηριστικά ελαστικότητας.
Η
δυνατότητα ρύθμισης των φυσικών
χαρακτηριστικών τους σε συνδυασμό με την
εξαιρετική χημική αδράνειά τους, καθιστούν
τα πολυσιλοξάνια πολύτιμα σύγχρονα υλικά
με πλήθος εφαρμογών σε διάφορα πεδία (διαλύτες,
στεγανοποιητικά υλικά και σπρέυ
αδιαβροχοποίησης, θερμοανθεκτικές ηλεκτρικές μονώσεις,
κόλλες, υγρά φρένων, γυαλιστικά σπρέυ
αυτοκινήτου, υγρά αντλιών υψηλού κενού, καλλυντικά, ενθέματα πλαστικής χειρουργικής, διαστημική τεχνολογία και στολές).
Οι διάφορες μορφές
πολυσιλοξανίων αναφέρονται γενικά ως σιλικόνες,
αν και ο όρος δεν είναι σωστός διότι δεν
διαθέτουν ομάδες του τύπου >Si=O, δηλ.
ανάλογες του καρβονυλίου >C=O των κετονών,
όπως είχε αρχικά υποτεθεί
|

Μπότα
αστροναύτη από σιλικόνη |

Σωλήνας
σιλικόνης |

'Eνθεμα σιλικόνης
πλαστικής χειρουργικής |

'Ελαιο
σιλικόνης |
Η
σύνθεση των πολυσιλοξανίων ξεκινάει από τα
χλωροσιλάνια, τα οποία στο εργαστήριο παρασκευάζονται με
αντίδραση SiCl4
με οργανομεταλλικά αντιδραστήρια (π.χ.
αντιδραστήρια Grignard
ή οργανολιθικές ενώσεις):
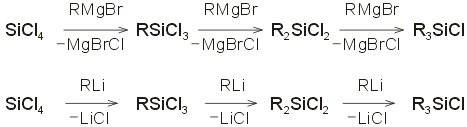
Ο
πιο συνηθισμένος και φθηνός τύπος
πολυσιλοξανίων είναι τα πολυδιμεθυλοσιλοξάνια
(PDMS)
ή διμεθικόνες
(dimethicones),
στα οποία είναι R = CH3-. Η βιομηχανική σύνθεση των
πολυδιμεθυλοσιλοξανίων ξεκινάει από τα
μεθυλοχλωροσιλάνια.
Τα
μεθυλοχλωροσιλάνια παρασκευάζονται σε
βιομηχανική κλίμακα με τη μέθοδο των Mueller-Rochow
(1941) (αναφ. 5): Αέριο CH3Cl
διαβιβάζεται σε θερμό μίγμα λεπτής σκόνης Si
και Cu
(καταλύτης), οπότε προκύπτει μίγμα διάφορων μεθυλοχλωροσιλανίων:
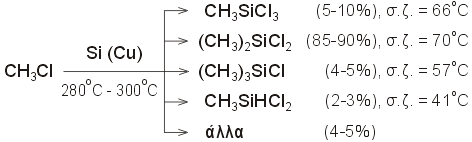
Το
επιθυμητό προϊόν είναι κυρίως το διμεθυλοδιχλωροσιλάνιο
(dimethyldichlorosilane, DMS), (CH3)2SiCl2
και οι συνθήκες της αντίδρασης
βελτιστοποιούνται έτσι, ώστε το DMS να
αποτελεί και το κύριο προϊόν. Αυτό
πετυχαίνεται με έλεγχο της ομοιογένειας
και της θερμοκρασίας του μίγματος Cu-Si.
Η καθαρότητα του Cu έχει ιδιαίτερη σημασία, π.χ.
ίχνη Pb μειώνουν την απόδοση σε DMS, ενώ ίχνη Sb
τη βελτιώνουν.
Το
DMS δεν πρέπει να
περιέχει
ακαθαρσίες
άλλων μεθυλοχλωροσιλανίων σε
αναλογίες μεγαλύτερες από λίγα ppm
για λόγους
που θα γίνουν αντιληπτοί στη συνέχεια.
Ο καθαρισμός του πετυχαίνεται με
προσεκτική κλασματική απόσταξη λόγω του
παραπλήσιου σημείου βρασμού των διάφορων
μεθυλοχλωροσιλανίων.
Αναφέρεται
ότι μια
τυπική βιομηχανική μονάδα παραγωγής, για να
είναι οικονομικά βιώσιμη,
θα πρέπει να παράγει τουλάχιστον 50.000
τόννους διμεθυλοδιχλωροσιλανίου ετησίως.
Οι
δεσμοί Si-O και Si-C είναι εξαιρετικά σταθεροί
και στο γεγονός αυτό οφείλεται η
σταθερότητα των σιλοξανίων. Αντίθετα, οι
δεσμοί Si-αλογόνο και Si-H είναι ασταθείς.
Έτσι, τα μεθυλοχλωροσιλάνια αντιδρούν έντονα με το νερό εκλύοντας
αέριο υδροχλώριο. Για τον λόγο
αυτό η ψύξη των βιομηχανικών χημικών
αντιδραστήρων παραγωγής
μεθυλοχλωροσιλανίων πραγματοποιείται
πάντοτε με
πεπιεσμένο αέρα και ποτέ με νερό.
Το
DMS με ελεγχόμενη υδρόλυση παρέχει αρχικά διμεθυλοσιλανόλη:
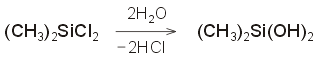
η
οποία υφίσταται ταχύτατο συμπυκνωτικό πολυμερισμό με
αποβολή μορίων ύδατος, οπότε δημιουργείται
η βασικός σκελετός πολυδιμεθυλοσιλοξάνιου, σύμφωνα με την
αντίδραση:
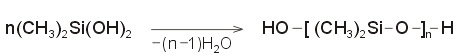
Ως
έχει το προϊόν της
αντίδρασης, με επίδραση ισχυρής βάσης
μπορεί να υποστεί κυκλοποίηση και να
ληφθούν κυκλικά πολυδιμεθυλοσιλοξάνια
(ή κυκλοδιμεθικόνες), όπως
το εξεταζόμενο μόριο D5
(συνήθως n
=
3-6).
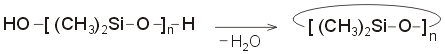
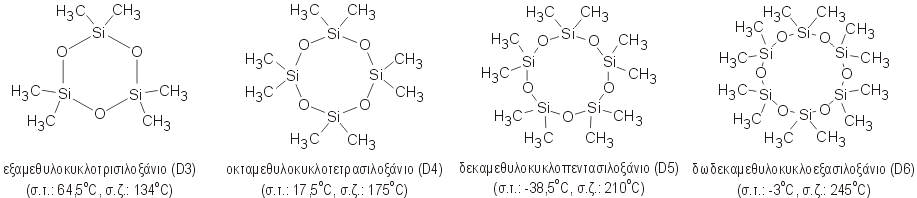
Για
να ληφθούν γραμμικά πολυδιμεθυλοσιλοξάνια,
η υδρόλυση και ο πολυμερισμός
πραγματοποιούνται παρουσία
τριμεθυλοχλωροσιλανίου (TMS) σε μικρή
αναλογία. Το TMS θα "μπλοκάρει" τις
ομάδες -ΟΗ
στα δύο άκρα της αλυσίδας γεγονός που θα θα τερματίσει τον πολυμερισμό. Όσο
μικρότερη είναι η αναλογία του TMS προς το DMS, τόσο ο
πολυμερισμός διαρκεί περισσότερο και
λαμβάνονται μεγαλύτερα μόρια
πολυδιμεθυλοσιλοξανίου. Αυτός είναι και ο
λόγος που επιβάλλει το DMS να έχει εξαιρετική
καθαρότητα, ώστε να υπάρχει ακριβής ρύθμιση
και έλεγχος της αναλογίας TMS/DMS και
ιδιαίτερα εάν το επιθυμητό προϊόν πρέπει
να έχει μεγάλο βαθμό πολυμερισμού (π.χ. n ³
1000 για σιλικόνες που θα χρησιμοποιηθούν ως
θερμοανθεκτικά μονωτικά).
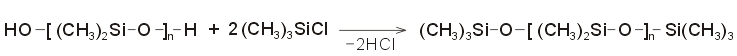
Επιπλέον,
εάν ο πολυμερισμός του DMS πραγματοποιηθεί
παρουσία μικρής αναλογίας
μεθυλοτριχλωροσιλανίου ή τετραχλωριούχου
πυριτίου, επιτυγχάνονται διασταυρώσεις,
όπως π.χ.
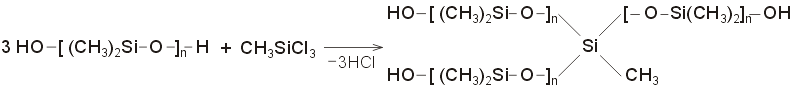
Αποτέλεσμα
της ύπαρξης διασταυρούμενων δεσμών
(cross-links) είναι η παραγωγή λιγότερο ελαστικών
πολυδιμεθυλοσιλοξανίων.
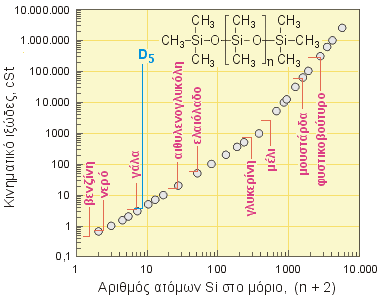
Στο
επόμενο διάγραμμα δείχνεται η εξάρτηση του
κινηματικού ιξώδους των γραμμικών
πολυδιμεθυλοξάνιων ως συνάρτηση του
συνολικού αριθμού ατόμων Si (n+2) στο μόριό
τους. Επειδή τόσο το ιξώδες, όσο και ο
αριθμός n+2 καλύπτουν ευρύτατη περιοχή τιμών,
το διάγραμμα παρουσιάζεται στη λογαριθμική
του μορφή. Για σύγκριση παρατίθενται οι
θέσεις που αντιστοιχούν στο κινηματικό
ιξώδες ορισμένων κοινών υλικών (τα δεδομένα
ιξώδους των πολυδιμεθυλοσιλοξάνιων, όπως και
άλλων φυσικοχημικών χαρακτηριστικών τους βρέθηκαν
στην αναφ. 8).
Σύντομη
αναδρομή στην τεχνική του ξηρού καθαρισμού
Σε
αντίθεση με τον καθαρισμό με νερό ή υγρό
καθαρισμό (wet cleaning)
των ρούχων, κατά τον ξηρό καθαρισμό (dry
cleaning) δεν χρησιμοποιείται νερό, αλλά
χημικός διαλύτης, που συνδυάζεται με κατάλληλα ανιοντικά ή
κατιοντικά ή και μη ιοντικά απορρυπαντικά για να
απομακρύνει κηλίδες και ρύπους από είδη
ιματισμού [Σημείωση: είναι προφανές ότι ο
όρος "ξηρός καθαρισμός" δεν είναι και
τόσο σωστός]. Η ιστορία του ξηρού καθαρισμού
ξεκίνησε στις αρχές της δεκαετίας του 1920. (αναφ.
9).
Η
διαδικασία του ξηρού καθαρισμού
πραγματοποιείται σε ειδικά κλειστά
πλυντήρια (μηχανές ξηρού καθαρισμού, dry cleaning
machines), όπου ο
διαλύτης καθαρίζεται συνεχώς διερχόμενος
μέσω φίλτρων διατομικής γης και άλλων
προσροφητικών υλικών και
επαναχρησιμοποιείται σε διάταξη κλειστής
κυκλοφορίας. Θα μπορούσαμε να θεωρήσουμε
τις μηχανές αυτές σαν ένα είδος "συσκευής
εκχύλισης στερεών", όπως π.χ. είναι η συσκευή Sohxlet.
Οι
πρώτοι διαλύτες που χρησιμοποιήθηκαν ήσαν
κλάσματα υδρογονάνθρακων, σχετικά υψηλού σ.ζ.,
ώστε να περιορισθεί ο κίνδυνος αναφλέξεων.
Στη συνέχεια χρησιμοποιήθηκαν διάφοροι
άφλεκτοι ή σχετικά άφλεκτοι διαλύτες, όπως ο
τετραχλωράνθρακας, CCl4 και κυρίως το
υπερχλωροαιθυλένιο, CCl2=CCl2 (perchloroethylene,
"perc").
Το perc καθιερώθηκε ως ο πιο αποτελεσματικός διαλύτης ξηρού
καθαρισμού και αποτελεί τον διαλύτη-"πρότυπο",
ως προς τον οποίο συγκρίνεται η
αποτελεσματικότητα κάθε νέου
προτεινόμενου διαλύτη.
Ωστόσο,
το perc είναι τοξικό και καρκινογόνο (σύμφωνα
με πειράματα του National
Toxicology
Program)
για τους εργαζόμενους καθαριστηρίων και
πολλές επιδημιολογικές έρευνες βρήκαν
αυξημένο κίνδυνο για επαγγελματικές
ασθένειες μετά από μακροχρόνια χρήση του
διαλύτη. 'Ετσι, από τις αρχές του 2000
αναζητήθηκαν τρόποι αντικατάστασής του με λιγότερο τοξικούς
διαλύτες, που να διασπώνται ευκολότερα μετά
την απόρριψή τους σε ειδικούς χώρους
διάθεσης αποβλήτων. Χαρακτηριστικά, η
πολιτεία της Καλιφόρνιας αποφάσισε τον
σταδιακό περιορισμό της χρήσης του
και τον οριστικό τερματισμό της μέχρι το 2020.
Το γεγονός αυτό προκάλεσε την εμφάνιση στην
αγορά διάφορων εναλλακτικών διαλυτών
μικρής τοξικότητας και φιλικότερων για το
περιβάλλον ("non-perc solvents").
Τα
τελευταία χρόνια οι εναλλακτικές λύσεις
που άρχισαν να εφαρμόζονται στις ΗΠΑ
εστιάζονται: στις κυκλικές σιλικόνες, σε
μίγματα αιθέρων της προπυλενογλυκόλης, σε
μίγματα βελτιωμένων υδρογονανθράκων και
στο υπερκρίσιμο CO2.
Στον
επόμενο πίνακα παρουσιάζονται οι διαλύτες,
οι οποίοι έχουν χρησιμοποιηθεί ως σήμερα για ξηρό
καθάρισμα και τα διάφορα χαρακτηριστικά
τους.
Διαλύτες
που χρησιμοποιήθηκαν ή χρησιμοποιούνται
για τον ξηρό καθαρισμό (δεδομένα
κυρίως από την αναφ. 3
και την αναφ.
10)
| Διαλύτης
(διάφορες εμπορικές ονομασίες) |
Χημικός
τύπος
|
σ.ζ., οC /
d,
g/mL
|
Χαρακτηριστικές
ιδιότητες*
|
| Διαλύτης
Stoddard (γνωστός και ως "white spirit") |
Μίγμα
υδρογονανθράκων (κατά 65% >C10) |
150-200
/0,75-0,82 |
Εύφλεκτος
(σημείο ανάφλεξης >40οC).
Από τους πρώτους διαλύτες που
χρησιμοποιήθηκαν στον ξηρό καθαρισμό,
σε αντικατάσταση της βενζίνης που ήταν
εξαιρετικά εύφλεκτη.
|
| Τετραχλωράνθρακας
(tetra) |
CCl4 |
76
/ 1,59 |
'Αφλεκτος.
Χρησιμοποιούνταν σε μίγμα με
άλλους διαλύτες. Λόγω υψηλής τοξικότητας, δεν
χρησιμοποιείται ήδη από τη δεκαετία του 1950
.
|
| Τριχλωροαιθυλένιο
(tri) |
CHCl=CCl2 |
87
/ 1,46 |
'Αφλεκτος.
Τοξικός. 'Aρχισε να χρησιμοποιείται σε
περιορισμένη κλίμακα μετά τη δεκαετία
του 1950. Επιδρά σε ορισμένα υφάσματα
(acetates).
|
| Υπερχλωροαιθυλένιο
(perc, PCE) |
CCl2=CCl2 |
121
/ 1,62 |
'Αφλεκτος. Ο ευρύτερα χρησιμοποιούμενος
διαλύτης για ξηρό καθάρισμα (από το 1930).
Σταδιακά, η χρήση του έχει αρχίσει να
απαγορεύεται λόγω τοξικότητας,
καρκινογόνου δράσης και προβλημάτων
διάθεσης.
|
| 1,1,1-τριχλωροαιθάνιο,
μεθυλοχλωροφόρμιο (TCA) |
CCl3CH3 |
75
/ 1,34 |
Σχεδόν
άφλεκτος. Λιγότερο τοξικός σε σχέση με
τους άλλους χλωριούχους διαλύτες. Ιδιαίτερα κατάλληλος για
δερμάτινα είδη. Περιορισμένης χρήσης
λόγω χημικής αστάθειας και επειδή
προκαλεί διάβρωση σε τμήματα των
μηχανών ξηρού καθαρισμού.
|
|
1,1,2-τριχλωρο-τριφθοροαιθάνιο
(freon-113
/ valclene
113)
|
CCl2FCClF2 |
47
/ 1,57 |
Τελείως
άφλεκτος. Χρησιμοποιήθηκε ως διαλύτης
επιλογής για καθαρισμό ευαίσθητων
υφασμάτων. Δεν παράγεται πλέον, ως ουσία
υπαγόμενη στο πρωτόκολλο του Montreal (καταστρεπτική
της στιβάδας όζοντος).
|
| Κυκλικά
πολυδιμεθυλοσιλοξάνια και κυρίως το D5
(Dow Corning fluid 245TM,
GreenEarthTM) |
[-(CH3)2Si-O-]5 |
210
/ 0,96 |
Περιορισμένης
ευφλεκτότητας (σημείο ανάφλεξης 76οC).
'Αοσμος.
Περιορισμένης τοξικότητας. Διασπάται
στο περιβάλλον σε ακίνδυνες ενώσεις (CO2,
SiO2).
|
| PureDryTM
(αναφ. 11) |
Μίγμα
ισοπαραφινών C9-C12,
φθοροαιθέρων και υπερφθοροανθράκων |
148
/ 0,8 |
Σχετικά
νέος διαλύτης μικρής ευφλεκτότητας
(σημείο ανάφλεξης 177οC). 'Αρχισε
να χρησιμοποιείται από το 2000. Θεωρείται
ως περιορισμένης τοξικότητας και
ευφλεκτότητας. Δεν υπάρχουν ακόμη
ολοκληρωμένες μελέτες.
|
| Rynex
TM
(αναφ. 12) |
Αζεοτροπικό
μίγμα tert-βουτυλαιθέρων
διπροπυλενογλυκολών, και "άλλων
χημικών" |
65
(100 mb) / 0,91 |
Περιορισμένης
ευφλεκτότητας (σημείο ανάφλεξης 93οC).
Σχεδόν άοσμος. 'Αρχισε να
χρησιμοποιείται κατά τα τελευταία
χρόνια. Θεωρείται
ως περιορισμένης τοξικότητας και
υπόκειται σε βιοαποσύνθεση. Δεν
υπάρχουν ακόμη ολοκληρωμένες μελέτες.
|
| Υπερκρίσιμο
ρευστό διοξείδιο του άνθρακα |
CO2 |
- |
Θεωρείται
ως ο ιδανικός διαλύτης από κάθε
άποψη (άφλεκτος, ατοξικός, ο πλέον "οικολογικός")
. Προς το παρόν χρησιμοποιείται κυρίως
σε βιομηχανικές εγκαταστάσεις
καθαρισμού. (αναφ.
13, 14). |
*
Ως σημείο ανάφλεξης (flash point,
fp) ενός καύσιμου υγρού
ορίζεται
η χαμηλότερη θερμοκρασία στην
οποία η φλόγα μπορεί να διαδοθεί μέσω των
ατμών στην υγρή επιφάνειά του (αναφ.
15). Καθορίζεται
από την τάση ατμών του υγρού. Η πηγή
θερμότητας δεν είναι ανάγκη να είναι γυμνή
φλόγα, αλλά μπορεί εξίσου αποτελεσματικά
να είναι μια θερμή επιφάνεια
(π.χ. θερμαντική πλάκα). Ως εξαιρετικά
εύφλεκτα (extremely flammable) χαρακτηρίζονται τα
υγρά με fp <21οC, ενώ ως εύφλεκτα
(flammable) εκείνα με 21οC <
fp< 55οC. Τα υγρά με fp>55οC
χαρακτηρίζονται ως αναφλέξιμα (combustible).
Για σύγκριση
δίνονται τα σημεία ανάφλεξης (σε οC)
μερικών γνωστών οργανικών υγρών:
διθειάνθρακας: -30, κ-εξάνιο: -22, ακετόνη: -10,
αιθανόλη: 12, κ-βουτανόλη: 29, κυκλοεξανόλη: 68,
αιθυλενογλυκόλη: 111.
|

Δεκαμεθυλοκυκλοπεντασιλοξάνιο
(D5)
|
Το
δεκαμεθυλοκυκλοπεντασιλοξάνιο (D5) ως
διαλύτης ξηρού καθαρισμού και πρόσθετο
καλλυντικών (αναφ.
16-19)
D5
είναι άοσμο και άχρωμο υγρό, χωρίς ελαιώδη
υφή, το οποίο σε συνδυασμό με διάφορα
απορρυπαντικά μπορεί να απομακρύνει
κηλίδες και ρύπους από είδη ιματισμού.
Φαίνεται ότι δεν επηρεάζει τους διάφορους
τύπους υφασμάτων, αλλά αντίθετα τα "μαλακώνει" και τα προστατεύει.
'Ολες
οι έρευνες έδειξαν ότι το D5
είναι ασφαλές για τους εργαζόμενους σε
καθαριστήρια, αλλά και για τους καταναλωτές
που θέλουν τα ρούχα τους να είναι
περιποιημένα μετά το καθάρισμα και έτοιμα
για χρήση, χωρίς να χρειάζονται κάποια
περίοδο εξαερισμού. Το γεγονός αυτό καθιστά
το D5
κατάλληλο για καθαριστήρια "άμεσης
εξυπηρέτησης", που συνήθως βρίσκονται σε
μεγάλα "πολυκαταστήματα". Tα απόβλητα D5
συλλέγονται από ειδικές εταιρίες και
εξουδετερώνονται με υγειονομική ταφή, όπου
διασπάται σε λίγες ημέρες σε SiO2,
CO2
και H2O.
Αν
και το κόστος του D5 είναι 2 έως και 3
φορές μεγαλύτερο από εκείνο του perc, η χρήση
του εξακολουθεί να είναι οικονομικώς
συμφέρουσα εάν ληφθούν υπόψη παράγοντες
όπως: οι φόροι που επιβάλλονται στη χρήση
του perc, η μικρότερη απώλεια λόγω εξατμίσεων,
η ταχύτερη διαδικασία καθαρισμού (αφού
μπορεί να αυξηθεί η θερμοκρασία έκπλυσης),
το μικρότερο κόστος διάθεσης λόγω
περιορισμένης επικινδυνότητας προς το
περιβάλλον.
Tο
D5
καθιερώθηκε
στις ΗΠΑ ως υγρό ξηρού καθαρισμού από την
αλυσίδα καθαριστηρίων GreenEarth.
Η χρήση του D5
ως διαλύτη ξηρού καθαρισμού προωθείται από
δύο μεγάλες εταιρίες, την General
Electric
και την Procter
& Gamble.
Γενικά,
το D5
είναι υλικό με ενδιαφέρουσες ιδιότητες που
το καθιστά χρήσιμο συστατικό καλλυντικών,
όπως είναι τα αποσμητικά (roll-on
deodorant),
αντι-ιδρωτικά (antiperspirants),
σπρέϋ μαλλιών (hair
conditioners),
προϊόντα μπάνιου, σαπούνια, υγραντές (moisturizers)
και υγρά πλύσης σώματος (body
lotions).
Το D5
βοηθά τα προϊόντα αυτά
να απλωθούν εύκολα στην επιφάνεια του
σώματος, δρώντας το ίδιο ως μαλακτικό (emolient)
παρέχοντας στο δέρμα μια ελκυστική υφή
μεταξιού. Μετά την εφαρμογή του καλλυντικού,
το D5
εξατμίζεται κατά 50-90% και μόνο μία μικρή
ποσότητα παραμένει για να ξεπλυθεί.
Δεκαμεθυλοκυκλοπεντασιλοξάνιο:
Περιβάλλον και Υγεία (αναφ.
16-19)
Επειδή
το D5
εξατμίζεται ταχύτατα (λόγω μικρής
λανθάνουσας θερμότητας βρασμού) δεν
παραμένει στα απόνερα και οι μικρές
ποσότητες υπολειμμάτων του
συγκεντρώνονται σε αιωρούμενα σωματίδια,
περιορίζοντας έτσι την επίδραση στους
υδρόβιους οργανισμούς.
Το
D5
δεν αποτελεί ουσία η οποία επηρεάζει το
στρατοσφαιρικό όζον, όπως οι χλωριούχοι
διαλύτες και παρά την πτητικότητά του, λόγω
της ταχύτατης διάσπασής του στην
ατμόσφαιρα, δεν θεωρείται ότι αποτελεί
επικίνδυνη πτητική οργανική ένωση (Volatile
Organic
Compound, VOC),
όπως το βενζόλιο, το τολουόλιο και τα
ξυλόλια.
Οι
30 τοξικολογικές έρευνες για την ασφάλεια
του D5
έδειξαν ότι σε πολύ υψηλότερες
συγκεντρώσεις, από αυτές που
χρησιμοποιείται στα διάφορα προϊόντα, δεν
προκαλεί βλάβες σε πειραματόζωα (ποντίκια).
Μόνο σε δύο έρευνες με επαναλαμβανόμενες
δόσεις και σε υψηλές συγκεντρώσεις
διαπιστώθηκε αύξηση του βάρους του ήπατος των
ποντικών και αυξημένος κίνδυνος καρκίνου
της μήτρας θηλυκών ποντικών. Στην πρώτη
περίπτωση η αύξηση του βάρους του ήπατος
συσχετίσθηκε με αύξηση των ενζύμων που
μεταβολίζουν την ουσία και είναι
αντιπροσωπευτική του μεταβολισμού των
πειραματόζωων. Στη δεύτερη περίπτωση (χρόνια
εισπνοή D5,
διάρκειας δύο ετών με υψηλές συγκεντρώσεις
ατμού D5)
η εμφάνιση των αδενοκαρκινωμάτων στα
πειραματόζωα συσχετίσθηκε με βιολογικό
μηχανισμό εξειδικευμένο για
ποντίκια και άσχετο με μεταβολικές
διεργασίες στο ανθρώπινο σώμα.
Βιβλιογραφία
και πηγές από το διαδίκτυο για τις σιλικόνες, τον
ξηρό καθαρισμό και το D5
1.
Dow Corning Corporation: "Decamethylcyclopentasiloxane Material Safety Data
Sheet" (http://www.greenearthcleaning.com/_secureArea/MSDSDC.pdf).
2.
Clearco Products Inc.: "Decamethylcyclopentasiloxane Material Safety Data
Sheet" (http://www.clearcoproducts.com/pdf/msds/cosmetic/MSDS-Cyclo-2245.pdf).
3.
State Coalition for Remediation of Dry Cleaners (http://www.drycleancoalition.org/download/solvent_table.pdf).
4. Dow Corning:
"Silicon Technology" (http://www.dowcorning.com/content/sitech/default.asp).
5. M. Hermes (Kennesaw State University):
"Silicones: A Case Study Component of Heat and Chemical Resistant Silicone Rubber"
(http://chemcases.com/silicon/index.htm)
6. Silicon Science On-Line (http://www.silicones-science.com/chemistry.html)
7. United Chemical Technologies:
"Silanes and Silicones for creative Chemists, " (http://www.unitedchem.com/pdf/SILICONES_INTRODUCTION.PDF,
αρχείο
PDF 307 KB)
8.
Clearco Products Inc.: "Properties of polydimethylsiloxanes from 0.65 cSt
to 2.5 million cSt" (http://www.clearcoproducts.com/pdf/library/Polydimethylsiloxanes1.pdf).
9. Wikipedia free encyclopedia:
"Dry-cleaning", (http://en.wikipedia.org/wiki/Dry_cleaning).
10. State
Coalition for Remediation of Dry Cleaners: "Chemicals Used In
Drycleaning Operations" (http://www.drycleancoalition.org/chemicals/ChemicalsUsedInDrycleaningOperations.htm)
11.
PureDry [δεν υπάρχει
σύνδεσμος πλέον].
12.
Rynex Holdings, Ltd: "A scientific breakthrough in cleaning earth-friendly
chemistry" (http://rynex.com/main/info/Rynex%20Info.pdf,
αρχείο PDF 1,94 ΜΒ).
13. Μ.
McCoy: "Green Chemistry. CO2-based dry-cleaning chain lunched
in Germany", Chemical Engineering News, 84(22), 7, 2006 (βλ. και
http://www.nsfstc.unc.edu).
14. Μ.
McCoy: "Dry cleaning dreams", Chemical Engineering News, 14.11.2005 (http://pubs.acs.org/cen/coverstory/83/8346specialtychem2.html)
15.
National Physical Laboratory (The UK's National Measurement Laboratory):
"Kaye & Laby Tables of physical & chemical tables: 3.11.5
Flammability of gases and vapours" (http://www.kayelaby.npl.co.uk/chemistry/3_11/3_11_5.html).
16. Consumer Reports:
"Dry-cleaning alternatives" (http://www.consumerreports.org/cro/home-garden/cooking-cleaning/drycleaning-alternatives-203/index.htm)
17. Drycleaners
News: "Solvent Sweepstakes? You Pick A Winner" (http://www.dcn-online.com/dcn/ar-emerging.phtml)
18. Silicones Environmental, Health and Safety Council of North
America (SEHSC): "D5 in Dry Cleaning. Fact Sheet. Environmental Fate and Effects of
D5" (www.sehsc.com/d5.asp)
19. Research Fellowship (GreenEarth Fellowship), International Fabricare Institute (συγκριτική
μελέτη GreenEarth-Perc, αρχείο PDF 472 KB) (http://www.greenearthcleaning.com/secureArea/IFIFellowshipReport.pdf)
|
Αποποίηση
ευθυνών: Έχει καταβληθεί κάθε
προσπάθεια για να εξασφαλισθεί η
ορθότητα των πληροφοριών που
περιλαμβάνονται σε αυτή τη σελίδα,
ωστόσο οι έχοντες την επιμέλεια της σελίδας
αυτής και το Τμήμα Χημείας δεν
αναλαμβάνουν τη νομική ευθύνη για τυχόν
σφάλματα, παραλείψεις ή ανακριβείς
πληροφορίες. Επιπλέον, το Τμήμα Χημείας
δεν εγγυάται την ορθότητα των
αναφερόμενων σε εξωτερικές ιστοσελίδες,
ούτε η αναφορά μέσω συνδέσμων (links) στις
ιστοσελίδες αυτές, υποδηλώνει ότι το
Τμήμα Χημείας επικυρώνει ή καθ'
οιονδήποτε τρόπο αποδέχεται το
περιεχόμενό τους. |