Ιστορικά στοιχεία για το βόριο, το βορικό οξύ και τα άλατά του [Αναφ. 1]
|
Τριδιάστατη αναπαράσταση του μορίου του βορικού οξέος (επίπεδο). |
Η ονομασία του στοιχείου βόριο (boron) προήλθε από την ονομασία του ορυκτού βόρακα (borax) (Na2B4O7·10H2O), η οποία με τη σειρά της προήλθε από την περσική ονομασία του ορυκτού burah. Οι αρχαίοι 'Ελληνες αναφέρουν τον βόρακα ως νίτρον βόρακα. Οι Εβραίοι αναφέρουν τον βόρακα ως borith και οι 'Αραβες ως buraq (που σημαίνει "λευκός").
Η κατάληξη (-on) στη σύγχρονη αγγλική ονομασία του βορίου boron προτάθηκε από τον Humphry Davy (1778-1829), ο οποίος πρώτος, το 1808 παρασκεύασε το στοιχείο σε ακάθαρτη μορφή με αναγωγή του οξειδίου του (B2O3) με μεταλλικό κάλιο (1808). Η κατάληξη -on προτιμήθηκε για να είναι ίδια με τις αντίστοιχες των carbon (άνθρακα) και silicon (πυρίτιο), στοιχείων γειτονικών με το βόριο στον Περιοδικό Πίνακα. Αρχικά, είχε προταθεί η ονομασία boracium σε συμφωνία με τη λατινική ονομασία acidum boracicum του βορικού οξέος.
 Wilhelm Homberg (1652-1715) |
 Georgius Agricola (1494-1555) |
Ο βόρακας στην αρχαιότητα. Το από πότε ο άνθρωπος γνωρίζει και χρησιμοποιεί τον βόρακα δεν είναι δυνατόν να διευκρινιστεί. Εικάζεται πως οι Βαβυλώνιοι έφεραν τον βόρακα από την 'Απω Ανατολή εδώ και τουλάχιστον 4.000 χρόνια. Εκεί υπήρχε άφθονος βόρακας στις δυσπρόσιτες ξηρές λίμνες των υψιπέδων του Θιβέτ, σε υψόμετρα 4000-4500 μέτρων, απ' όπου ποσότητές του μεταφέρονταν με καραβάνια στην Ινδία, με την ονομασία tincal, η οποία είναι σε χρήση μέχρι και σήμερα και δηλώνει ακάθαρτο, ανεπεξέργαστο βόρακα.
Σε κείμενα αναφέρεται ότι τον χρησιμοποιούσαν οι χρυσοχόοι, χάρις στην ιδιότητα του τηγμένου βόρακα, να διευκολύνει τη συγκόλληση τεμαχίων χρυσού ή χρυσού με χαλκό, εξ ου και μια από τις μετέπειτα ονομασίες του: chrysocolla. Οι αρχαίοι Αιγύπτιοι χρησιμοποιούσαν τον βόρακα τόσο στη μεταλλουργία, όσο και στην ιατρική όπως επίσης και στην ταρίχευση των νεκρών τους, χωρίς ωστόσο το τελευταίο να έχει τεκμηριωθεί.
Βορικά άλατα και βορικό οξύ χρησιμοποιούσαν οι αρχαίοι 'Ελληνες κυρίως για καθαρισμούς και ως συντηρητικό τροφίμων λόγω της χαμηλής τοξικότητάς του και της αντισηπτικής δράσης του.
Σε κινεζικά κεραμικά αντικείμενα του 300 μ.Χ. διαπιστώθηκε η χρήση βόρακα στα υαλώματα (σμάλτα, glazes), ενώ η χρησιμότητα αυτή του βόρακα περιγράφεται από 'Aραβες αλχημιστές από το 700 μ.Χ. Η χρήση αυτή βασίζεται στην ιδιότητα του τηγμένου βόρακα να διαλυτοποιεί μεταλλικά οξείδια αποκτώντας διαφορετικά χρώματα (βλ. παρακάτω: "μαργαρίτες βόρακα").
|
Θερμοπηγές της περιοχής Sasso Pisano της Ιταλίας, μόνη πηγή βορικού οξέος στην Ευρώπη μέχρι τα μέσα του 19ου αιώνα [πηγή]. |
Ο βόρακας στην Ευρώπη. Ο Ιταλός περιηγητής και έμπορος Marco Polo (1254-1324) έφερε από την Κίνα στην Ιταλία κάποια δείγματα από τα υαλώματα βόρακα κατά τον 13ο αιώνα.
Ο γνωστός ως "πατέρας της ορυκτολογίας", διάσημος Γερμανός επιστήμονας Αγκρίκολα (Georgius Agricola, 1494-1555), στο έργο του "De Natura Fossilium" και ο Ιταλός μεταλλουργός Vanoccio Buringuccio (1480-1538) στο βιβλίο του "De la Pyrotechnica", αναφέρουν τον βόρακα ως "Chrysocolla (Borax)", από τη χρησιμότητά του στη χρυσοχοΐα και περιγράφουν τη χρήση του ως συλλίπασμα (ρευστοποιητής, flux) στη μεταλλουργία. 'Ενα στρώμα τηγμένου βόρακα πάνω από τον λευκοπυρακτωμένο ή τηγμένο σίδηρο τον προστατεύει από την οξείδωση, ενώ συγχρόνως δρα ως "συλλέκτης" οξειδίων και άλλων ανεπιθύμητων ακαθαρσιών, τα οποία διαλύει και παραλαμβάνει στο τήγμα του.
Το 1702, ο Ολλανδός φυσιοδίφης Wilhelm Homberg (1652-1715) παρασκεύασε για πρώτη φορά βορικό οξύ (H3BO3) με απόσταξη μίγματος βόρακα και θειικού σιδήρου(ΙΙ) (πράσινο βιτριόλιον). Το άλας του σιδήρου διασπάται θερμικά και δρα ως πηγή θειικού οξέος (βλ. χημική ένωση του μήνα: Θειικό οξύ), το οποίο απελευθερώνει το βορικό οξύ από το άλας του. Τη λευκή ουσία που έλαβε την ονόμασε "πτητικό ναρκωτικό άλας του βιτριολίου" (sel volatile narcotique du vitriol), η οποία έγινε γνωστή ως Sal Sedativum Hombergi (ηρεμιστικό άλας του Homberg). Μέχρι τότε περίπου, ο βόρακας ήταν ένα μάλλον δυσεύρετο υλικό Ασιατικής προέλευσης.
Το 1772, σε θερμοπηγές (fumaroles, suffioni) κοντά στη Φλωρεντία της Ιταλίας διαπιστώθηκε η παρουσία ενός σπάνιου ορυκτού, το οποίο αργότερα αποδείχθηκε ότι ήταν σχεδόν καθαρό βορικό οξύ. Το ορυκτό αυτό ονομάστηκε σασσολίτης (sassolite) από την ονομασία Sasso Pisano αυτής της περιοχής. Βορικό οξύ βρέθηκε επίσης σε θερμοπηγές των νήσων Lipari, στο Τυρρηνικό Πέλαγος κοντά στη Σικελία.
Από το 1818 έως το 1872, οι θερμοπηγές της Ιταλίας υπήρξαν οι σχεδόν αποκλειστικές πηγές βορικού οξέος και βόρακα. Η αρχική ετήσια παραγωγή έφτανε μόλις τους 75 τόνους, όμως ταχύτατα αυξήθηκε και το 1860 έφθασε τους 3 χιλιάδες τόνους. Ωστόσο, λόγω των συνεχώς διευρυνόμενων εφαρμογών του βόρακα και του βορικού οξέος σε διάφορους τομείς, όπως η υαλουργία, η κεραμική, η μεταλλουργία και η παρασκευή απορρυπαντικών, οι θερμοπηγές της Ιταλίας δεν επαρκούσαν πλέον να καλύψουν τη ζήτηση στην Ευρώπη και στην Αμερική.
 |
 |
 |
 |
|
Τα κυριότερα ορυκτά του βορίου. Κατά σειρά: (1) Σασσολίτης (sassolite), Η3ΒΟ3 [πηγή]. (2) Βόρακας (borax), Na2B4O7·10H2O [πηγή]. Οι κρύσταλλοι του βόρακα είναι διαφανείς, ωστόσο επειδή χάνουν κρυσταλλικό ύδωρ (λόγω εξάνθισης), η επιφάνειά τους καλύπτεται από λευκή σκόνη από μερικώς αφυδατωμένο βόρακα. (3) Ουλεξίτης (ulexite), NaCaB5O6(OH)6·5H2O, ένα περίεργο ινώδες ορυκτό, του οποίου οι ίνες συμπεριφέρονται όπως οι σύγχρονες οπτικές ίνες [πηγή]. (4) Βορακίτης (boracite), Mg3B7O13Cl [πηγή]. |
|||
'Ενα μάλλον παράδοξο εμπορικό σήμα. Το 1872, σε ερημικές και άνυδρες περιοχές (έρημοι Mojave και Death Valley) της Ν.Α. Καλιφόρνιας και της Νεβάδας, χρυσοθήρες διαπίστωσαν την παρουσία τεράστιων επιφανειακών κοιτασμάτων βοριούχων ορυκτών, όπως βόρακα και διάφορων μικτών βορικών αλάτων νατρίου-ασβεστίου, όπως του ουλεξίτη και μιγμάτων του με βόρακα. Αποτέλεσμα της ανακάλυψης των απεριόριστων ποσοτήτων βορικών αλάτων ήταν η ίδρυση πολλών αμερικανικών εταιριών αξιοποίησης τους. Περιβόητη υπήρξε η Pacific Coast Borax Company, η οποία ως "σήμα κατατεθέν" (trade mark) των προϊόντων της είχε την ονομασία 20 Mule Team Borax (βόρακας των 20 ζευγμένων ημιόνων).
Αυτή η παράδοξη ονομασία οφειλόταν στις άμαξες που χρησιμοποιούσε η εταιρία για τη μεταφορά βόρακα, από τα σημεία εξόρυξης και προεπεξεργασίας μέχρι τον πλησιέστερο σιδηροδρομικό σταθμό. Η διαδρομή έφτανε τα 270 km και διαρκούσε δέκα ημέρες κάτω από τις φρικτές συνθήκες των ερήμων της Νότιας Καλιφόρνιας και της Νεβάδας. Αν και οι άμαξες αυτές χρησιμοποιήθηκαν μόνο κατά το διάστημα 1883-1889, η ονομασία αυτή παρέμεινε για πολλές δεκαετίες αργότερα, ακόμη και για προϊόντα (κυρίως απορρυπαντικά) που δεν περιείχαν πλέον βόρακα. Και σήμερα ακόμη αυτό το "σήμα κατατεθέν" είναι πασίγνωστο στις ΗΠΑ. Η ίδια εταιρία κυκλοφορούσε ένα είδος σαπουνιού σε σκόνη, το Boraxo, ιδιαίτερα κατάλληλο για καθαρισμούς χεριών μετά την επαγγελματική συχνή επαφή με λιπαρά υλικά (π.χ. μηχανουργεία, συνεργεία αυτοκινήτων).
Σήμερα, η ετήσια παραγωγή βορικού οξέος, αλάτων του, όπως και άλλων ενώσεων του βορίου, εκφρασμένη σε βόριο μετρείται πλέον σε εκατομμύρια τόνους. Περισσότερη από τη μισή ποσότητα βορικών προέρχεται από τις ΗΠΑ και την Τουρκία, η οποία διαθέτει τα μεγαλύτερα εξακριβωμένα αποθέματα βορικών ορυκτών σε διεθνή κλίμακα.
 |
 |
 |
 |
|
Ο βόρακας στην Καλιφόρνια: κατά σειρά, (1) Η είσοδος της μικρής πόλης Boron της Νότιας Καλιφόρνιας, όπου διαπιστώθηκε για πρώτη φορά η παρουσία πλουσιότατων κοιτασμάτων βορίου, που έδωσαν και το όνομα στην πόλη, η οποία αποτέλεσε το κέντρο των επιχειρήσεων αξιοποίησης των βοριούχων ορυκτών [πηγή]. (2) Παλαιά φωτογραφία της άμαξας με φορτία βόρακα και άλλων βοριούχων ορυκτών, την οποία έσερναν είκοσι ημίονοι. Οι αποστάσεις έφθαναν τα 270 km και η διάρκεια του ταξιδιού τις 10 ημέρες (από τα σημεία εξόρυξης μέχρι τον πλησιέστερο σιδηροδρομικό σταθμό) [πηγή]. (3) Τυπική συσκευασία απορρυπαντικού οικιακής χρήσης με βόρακα, που φέρει ως σήμα κατατεθέν τον τίτλο "20 mule team borax" και τη σχετική απεικόνιση της διάσημης άμαξας [πηγή]. (4) Francis Marion Smith (1846 -1931), γνωστός ως ο "βασιλιάς του βόρακα" (borax king), ιδρυτής της Pacific Coast Borax Company. |
|||

Το εμπορικό "σήμα κατατεθέν" των "είκοσι ημιόνων" που έχει ιστορικά συνδεθεί με το βορικό οξύ και τα βορικά άλατα.
Παρασκευή βορικού οξέος
Αν και στη φύση υπάρχει ελεύθερο βορικό οξύ (ορυκτό σασσολίτης), η εκμετάλλευση του ορυκτού δεν είναι οικονομικώς συμφέρουσα, αφού οι ποσότητές του δεν επαρκούν για να καλύψουν τις απαιτούμενες ποσότητες βορικού οξέος. 'Ετσι, το βορικό οξύ παρασκευάζεται με επίδραση ισχυρού oξέος (HCl ή H2SO4) σε ορυκτό βόρακα ή σε ορυκτό (κυρίως) ουλεξίτη, ο οποίος αποτελεί το κύριο ορυκτό του βορίου και βρίσκεται σε άφθονες ποσότητες. Τυπικές αντιδράσεις αντικατάστασης είναι οι ακόλουθες:
Na2B4O7
+ 5H2O + H2SO4
![]() Na2SO4 + 4H3BO3
NaCaB5O6(OH)6
+ 3HCl + 3H2O
Na2SO4 + 4H3BO3
NaCaB5O6(OH)6
+ 3HCl + 3H2O
![]() NaCl + CaCl2 + 5H3BO3
NaCl + CaCl2 + 5H3BO3
Το βορικό οξύ ως σχετικά δυσδιάλυτο
λαμβάνεται ως ίζημα, το οποίο παραλαμβάνεται και καθαρίζεται εύκολα με
ανακρυστάλλωση, δεδομένου ότι η διαλυτότητά του αυξάνει ταχύτατα με τη
θερμοκρασία (βλ. παρακάτω). Στο εργαστήριο δεν έχει νόημα η παρασκευή
βορικού οξέος, αφού
πρόκειται για μια πάμφθηνη χημική ουσία και κάθε άλλη ένωση του βορίου
που θα μπορούσε να χρησιμοποιηθεί ως πρώτη ύλη είναι κατά πολύ πιο
δυσεύρετη και ακριβότερη. Ενδεικτικά πάντως, βορικό οξύ λαμβάνεται
με υδρόλυση βορικών εστέρων (βλ. παρακάτω) ή από το τριχλωριούχο βόριο
(αέρια ομοιοπολική ένωση, σ.ζ.=12,6°C):
BCl3
+ 3H2O
![]() H3BO3
+
3HCl.
H3BO3
+
3HCl.
Χημικές ιδιότητες του βορικού οξέος και των αλάτων του [Αναφ. 2]
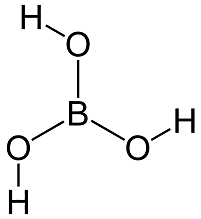
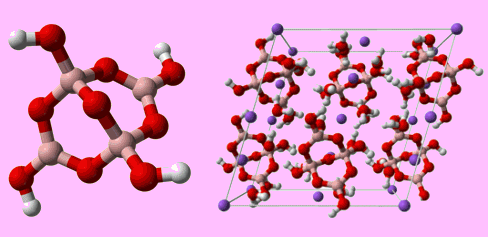
Σε στερεά κατάσταση τα επιμέρους τρίγωνα επίπεδα μόρια του βορικού οξέος (Η3ΒΟ3) συνδέονται σταθερά μεταξύ τους μέσω διαδοχικών δεσμών υδρογόνου σχηματίζοντας δισδιάστατα πολυμοριακά συμπλέγματα. Τα συμπλέγματα τοποθετούνται ως στιβάδες η μία πάνω στην άλλη. Οι αποστάσεις Β-Ο, Ο-Η και Η...Β είναι 136 pm, 97 pm και 272 pm, αντιστοίχως. Η απόσταση μεταξύ των στιβάδων είναι 318 pm. Στις στιβάδες αυτές οφείλεται η λεπιδοειδής (φυλλωτή) μορφή των κρυστάλλων του βορικού οξέος (ανάλογη με εκείνη του γραφίτη) και η σαπωνώδης (γλυστερή) υφή του.
|
|
|
|
Αριστερά: Σύνδεση των επιμέρους μορίων βορικού οξέος (H3BO3) με δεσμούς υδρογόνου στη στερεά μορφή της ουσίας [πηγή]. Δεξιά: Διάγραμμα κατανομής των σωματιδιακών μορφών του βορικού οξέος. |
|
Το βορικό οξύ ως ασθενές οξύ. Το βορικό οξύ είναι ένα τυπικό εξαιρετικά ασθενές ανόργανο οξύ. Είναι τόσο ασθενές, που διαλύματά του (περίπου 1,5% κ.β.) χρησιμοποιούνται για εκπλύσεις εγκαυμάτων και για οφθαλμικές εκπλύσεις (ως ήπιο αντισηπτικό) χωρίς να προκαλέσουν κάποιο πρόβλημα.
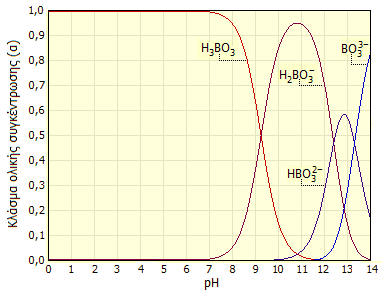
Τυπικά, το βορικό οξύ μπορεί να θεωρηθεί ως τριπρωτικό οξύ και διίσταται σύμφωνα με τις ακόλουθες ισορροπίες και στη βιβλιογραφία παρέχονται οι ακόλουθες σταθερές διάστασης κάθε σταδίου:
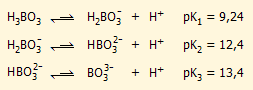
Λόγω των εξαιρετικά μικρών σταθερών διάστασης Κ2 και Κ3, στις συνήθεις περιοχές pH λαμβάνεται υπόψη μόνο η πρώτη διάσταση και το βορικό οξύ θεωρείται ως ουσιαστικά μονοπρωτικό οξύ.
Με βάση τις αναφερόμενες τιμές σταθερών διάστασης προκύπτει το παραπλεύρως διάγραμμα κατανομής των σωματιδιακών μορφών του βορικού οξέος. Από το διάγραμμα φαίνεται ότι τα δι- και τρι-φορτισμένα βορικά ιόντα εμφανίζονται σε σημαντικές αναλογίες σε ισχυρώς αλκαλικά διαλύματα (>11-11,5).
Ωστόσο, στην πραγματικότητα αυτό το διάγραμμα κατανομής αποτελεί μια υπεραπλούστευση, αφού δεν λαμβάνεται υπόψη η τάση των βορικών ανιόντων να συνδέονται μεταξύ τους και να σχηματίζουν πολυπυρηνικά ανιοντικά σύμπλοκα.
 Μελέτες με φασματοσκοπία Raman έδειξαν ότι σε αλκαλικά
υδατικά διαλύματα δεν υφίσταται ανιόν H2BO3-,
αλλά το εικονιζόμενο παραπλεύρως τετραεδρικής σύνταξης
τετραϋδροξυβορικό (tetrahydroxyborate) ανιόν, το οποίο δρα ως
ασθενής βάση. Επομένως η παραπάνω αναφερόμενη ως "διάσταση του βορικού
οξέος", στην πραγματικότητα είναι απόσπαση υδροξυλίου από το ύδωρ
σύμφωνα με την αντίδραση:
Μελέτες με φασματοσκοπία Raman έδειξαν ότι σε αλκαλικά
υδατικά διαλύματα δεν υφίσταται ανιόν H2BO3-,
αλλά το εικονιζόμενο παραπλεύρως τετραεδρικής σύνταξης
τετραϋδροξυβορικό (tetrahydroxyborate) ανιόν, το οποίο δρα ως
ασθενής βάση. Επομένως η παραπάνω αναφερόμενη ως "διάσταση του βορικού
οξέος", στην πραγματικότητα είναι απόσπαση υδροξυλίου από το ύδωρ
σύμφωνα με την αντίδραση:
![]()
Με άλλα λόγια, το βορικό οξύ δρα περισσότερο ως δέκτης ζεύγους ηλεκτρονίων (του υδροξυλίου), δηλ. δρα ως γενικό οξύ κατά Lewis, παρά ως δότης πρωτονίων, δηλ. ως οξύ κατά Brønsted. Για τον λόγο αυτό το βορικό οξύ συχνά γράφεται ως B(OH)3. 'Ενα πιο σύνθετο, ενδεικτικό διάγραμμα κατανομής των βορικών σωματιδίων, όπου λαμβάνεται υπόψη η παρουσία πολυπυρηνικών βορικών ανιόντων δίνεται στη συνέχεια.
|
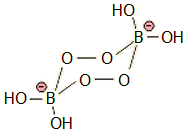
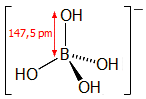
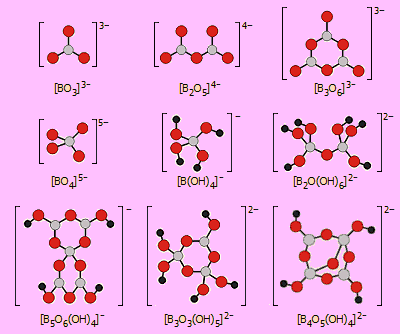
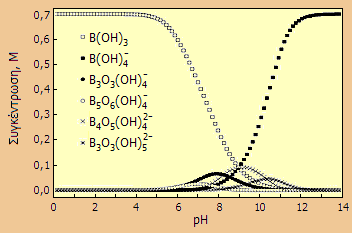
Οι ποικίλες μορφές των βορικών ανιόντων [Αναφ. 2γ] Η υδατική χημεία των βορικών αλάτων είναι ιδιαίτερα περίπλοκη. Ενδιαφέρον παρουσίαζει η μεγάλη ποικιλία των μορφών των βορικών ανιόντων, τόσο στα στερεά κρυσταλλικά άλατα και ορυκτά του βορίου, όσο και στα υδατικά διαλύματα βορικών αλάτων. Στο παρακάτω σχήμα απεικονίζονται οι βασικότερες δομές των βορικών ανιόντων (αριστερά), όπως και των ανιόντων που συνιστούν το κυριότερο βορικό άλας, το τετραβορικό νάτριο γνωστότερο ως βόραξ (δεξιά).
Αντίστοιχες εξισώσεις ισορροπίας μπορούν να γραφούν για το κάθε πολυπυρηνικό σωματίδιο του βορίου. Στην ποικιλία των μορφών των βορικών ιόντων τόσο σε κρυσταλλικά άλατα, όσο και σε διαλύματά τους συμβάλλει το γεγονός ότι το βόριο παρουσιάζει ενδιαφέρουσα στερεοχημεία, επειδή διαθέτει δύο είδη σταθερών συντακτικών δομών: (α) επίπεδα τρίγωνα του τύπου BO3 (με φορτίο 0 στο Β) και (β) τετράεδρα του τύπου BO4 (με φορτίο -1 στο B). Οι δομές αυτές μπορεί να συνδέονται μεταξύ τους σχηματίζοντας πολυπυρηνικά ανιόντα (δι-, τρι-, τετρα- και πεντα-βορικά) ή ακόμη και πολυμερικά βορικά ανιόντα. Οι αποστάσεις B-O εξαρτώνται από τη συνολική δομή των ανιόντων. Για τις συντάξεις ΒΟ3 και ΒΟ4 οι μέσες αποστάσεις B-O είναι 136,6 pm και 147,5 pm, αντιστοίχως. Εξαιτίας της ιδιαιτερότητας αυτής του βορίου, το διάγραμμα κατανομής των σωματιδίων του σε διαλύματα με διάφορα pH εξαρτάται από την αναλυτική (συνολική) συγκέντρωση βορικών. Ενδεικτικό παράδειγμα κατανομής των ποικίλων μορφών των βορικών σωματιδίων δείχνεται παραπλεύρως. Το διάγραμμα έχει υπολογιστεί για αναλυτική συγκέντρωση βορικών 0,70 Μ και σχεδιάστηκε με βάση δημοσιευμένες τιμές σταθερών σχηματισμού πολυπυρηνικών βορικών ανιόντων ανάλογων της προηγούμενης ισορροπίας [Αναφ. 2στ]. |
Θερμική διάσπαση του βορικού οξέος. Θερμαινόμενο το ορθο-βορικό οξύ (το κοινό βορικό οξύ, Η3ΒΟ3) χάνει μόρια ύδατος και μεταπίπτει αρχικά σε μετα-βορικό οξύ (HBO2), στη συνέχεια σε πυρο-βορικό ή (συνηθέστερα) τετρα-βορικό (Η2Β4Ο7) και τελικά σε οξείδιο (B2O3, "βορικός ανυδρίτης"). Το οξείδιο είναι σχετικά εύτηκτο και κατά κανόνα λαμβάνεται σε υαλώδη κατάσταση. Η σειρά των αντιδράσεων δείχνεται παρακάτω. Οι αναφερόμενες θερμοκρασίες είναι μόνο ενδεικτικές, αφού δεν υπάρχει σαφής θερμοκρασία απόσπασης κάθε μορίου ύδατος. Να σημειωθεί ότι η διάσπαση του βορικού οξέος ξεκινάει ήδη από τους 100°C, αλλά πραγματοποιείται με πολύ μικρή ταχύτητα:
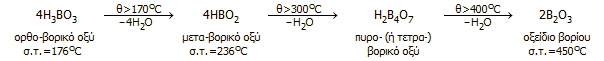
 'Αλατα βορικού οξέος
[Αναφ. 3].
Γενικά, τα βορικά άλατα των μετάλλων είναι δυσδιάλυτα στο
νερό με εξαίρεση τα άλατα των αλκαλίων. Τα υδατικά διαλύματα των βορικών αλάτων των
αλκαλίων είναι μετρίως αλκαλικά λόγω υδρόλυσης των βορικών ανιόντων.
Ενδεικτικά, υδατικό διάλυμα του
Na2B4O7
περίπου 0,1 Μ έχει pH 10,0.
'Αλατα βορικού οξέος
[Αναφ. 3].
Γενικά, τα βορικά άλατα των μετάλλων είναι δυσδιάλυτα στο
νερό με εξαίρεση τα άλατα των αλκαλίων. Τα υδατικά διαλύματα των βορικών αλάτων των
αλκαλίων είναι μετρίως αλκαλικά λόγω υδρόλυσης των βορικών ανιόντων.
Ενδεικτικά, υδατικό διάλυμα του
Na2B4O7
περίπου 0,1 Μ έχει pH 10,0.
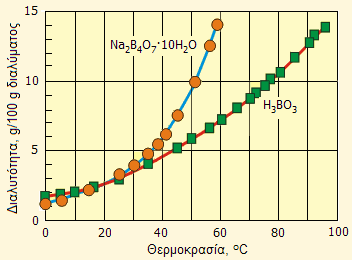
Το κυριότερο άλας του βορικού οξέος είναι το δεκαϋδρικό τετραβορικό νάτριο, Na2B4O7·10H2O (βόρακας). Το Na2B4O7·10H2O έχει παραπλήσια διαλυτότητα στο νερό με εκείνη του βορικού οξέος στις συνήθεις θερμοκρασίες, ενώ η διαλυτότητά του αυξάνει ταχύτατα σε υψηλότερες θερμοκρασίες (βλ. παραπλεύρως διάγραμμα, [Αναφ. 3γ]). Kατά την ταχεία θέρμανση, το στερεό άλας αρχικά τήκεται (στην ουσία διαλύεται στο κρυσταλλικό του ύδωρ) και στη συνέχεια χάνει διαδοχικά μόρια ύδατος ως εξής:
![]()
Στο εμπόριο το τετραβορικό δινάτριο διακινείται ως δεκαϋδρικό άλας (11,3% σε Β) και πενταϋδρικό άλας (14,8% σε Β), όπως επίσης και ως άνυδρο (προϊόν τήξης, fused) (21,5% σε Β). Τα άλατα αυτά στο εμπόριο συνήθως αναφέρονται συλλογικά ως βόρακας (borax), αν και η ονομασία αυτή τυπικά ανήκει αποκλειστικά στο δεκαϋδρικό άλας.
Το
Na2B4O7·10H2O μπορεί να ληφθεί σε εξαιρετικώς καθαρή
μορφή (99,999%) με ανακρυστάλλωση, είναι σταθερό κατά τη φύλαξη υπό συνήθεις
συνθήκες, έχει περιορισμένη υγροσκοπικότητα, όπως επίσης και μικρή τάση απώλειας κρυσταλλικού ύδατος. Ως εκ τούτου, έχει εξετασθεί και προταθεί ως
πρωτογενές πρότυπο (primary standard) για την
τιτλοδότηση διαλυμάτων ισχυρών οξέων (δείκτης: φαινολοφθαλεΐνη). 1 mol
τετραβορικού δινατρίου αντιστοιχεί σε 2 mol υδρογονοκατιόντων: Β4Ο72-
+ 2Η+ + 5Η2Ο
![]() 4Η3ΒΟ3.
4Η3ΒΟ3.
Πλεονεκτήματα του Na2B4O7·10H2O έναντι του συνήθως χρησιμοποιούμενου ως πρωτογενούς προτύπου Na2CO3 είναι το σαφέστερο ισοδύναμο σημείο και το σχεδόν 5-πλάσιο χημικό ισοδύναμο (190,7 έναντι 41,5 g/mol H+), το οποίο σημαίνει ότι απαιτείται μεγαλύτερη ποσότητα στερεού άλατος για κάθε ογκομέτρηση γεγονός που περιορίζει το σφάλμα ζύγισης.
Στο εμπόριο διατίθενται μεγάλη ποικιλία αλάτων του βορικού οξέος, αλλά σε πολύ μικρότερες ποσότητες σε σχέση με το Na2B4O7·10H2O (βόρακας). Τυπικά βορικά άλατα του εμπορίου είναι: (α) Αλλά βορικά άλατα νατρίου διαφόρων συστάσεων, π.χ. το πενταϋδρικό πενταβορικό νάτριο (Na2B4O7·5H2O), οκταβορικό νάτριο (Na2B8O13.4H2O). (β) Το τετραβορικό κάλιο (K2B4O7·4H2O) που παρασκευάζεται από βορικό οξύ και υδροξείδιο του καλίου. Είναι πιο ευδιάλυτο άλας από τον βόρακα και χρησιμοποιείται σε περιπτώσεις που δεν είναι επιθυμητή η παρουσία νατρίου. (γ) Το πενταβορικό αμμώνιο, (ΝΗ4)2Β5Ο8·5H2O και τετραβορικό αμμώνιο (ΝΗ4)2Β4Ο7 σε διάφορες ένυδρες μορφές. (δ) 'Ανυδρα βορικά άλατα λιθίου LiBO2 και Li2B4O7, η χρήση των οποίων ως συλλιπασμάτων στη χημική ανάλυση περιγράφεται παρακάτω. (ε) Βορικά άλατα ψευδαργύρου, τα οποία χρησιμοποιούνται ως επιβραδυντές καύσης.
|
Πυκνά διαλύματα τετραφθοροβορικού νικελίου, Ni(BF4)2, χρησιμοποιούνται σε ηλεκτρολυτικά λουτρά επινικέλωσης [πηγή]. |
Αντίδραση βορικού οξέος με υδροφθόριο - Τετραφθοροβορικό οξύ [Αναφ. 4]. Το βόριο σχηματίζει σταθερό σύμπλοκο με φθοριούχα, το τετραφθοροβορικό ιόν (BF4-). Η αντίδραση πραγματοποιείται με ανάμιξη βορικού οξέος με υδροφθορικό οξύ ή με διάλυμα όξινου φθοριούχου άλατος, π.χ.:
Η3ΒΟ3 + 2H2F2
![]() HBF4 + 3H2O
H3BO3 + 4NH4ΗF2
HBF4 + 3H2O
H3BO3 + 4NH4ΗF2
![]() ΗBF4 + 4NH4F + 3H2O
ΗBF4 + 4NH4F + 3H2O
Το τετραφθοροβορικό οξύ (HBF4) είναι ένα ισχυρό (πλήρως διιστάμενο) ανόργανο οξύ, το οποίο σχηματίζει εξαιρετικώς ευδιάλυτα άλατα με όλα τα μεταλλικά ιόντα. Πολύτιμο χαρακτηριστικό των τετραφθοροβορικών ανιόντων είναι το ότι praktik;a δεν διαθέτουν συμπλεκτική ικανότητα και δεν μπορούν να δράσουν ως υποκαταστάτες. 'Ετσι, υδατικά διαλύματα τετραφθοροβορικών μεταλλοϊόντων, περιέχουν αποκλειστικώς ενυδατωμένα μεταλλικά κατιόντα.
Ανάλογη ιδιότητα, διαθέτουν τα υπερχλωρικά ανιόντα και σε μικρότερο βαθμό τα νιτρικά ανιόντα. Τα ιόντα αυτά παρουσιάζουν σχεδόν μηδενική τάση εφυδάτωσης και συχνά αναφέρονται ως γυμνά ιόντα (naked ions). Ωστόσο, το βασικό πλεονέκτημα των τετραφθοροβορικών ανιόντων έναντι των υπερχλωρικών είναι ότι δεν είναι οξειδωτικά, οπότε τα τετραφθοροβορικά άλατα οργανικών βάσεων μπορούν να ξηρανθούν σε σχετικώς υψηλές θερμοκρασίες σε αντίθεση με τα αντίστοιχα υπερχλωρικά, τα οποία θερμαινόμενα εκρήγνυνται (βλ. χημική ένωση του μήνα: Υπερχλωρικό οξύ και άλατά του).
To τετραφθοροβορικό οξύ διατίθεται συνήθως ως υδατικό διάλυμα 48% και χρησιμοποιείται κυρίως στην οργανική σύνθεση (χρησιμοποιείται ως όξινος καταλύτης), όπως επίσης και για την παρασκευή αλάτων του. Πολύ πυκνά διαλύματα τετραφθοροβορικού νικελίου, Ni(BF4)2, (μέχρι και 120 g Ni/L) χρησιμοποιούνται σε ηλεκτρολυτικά λουτρά επινικέλωσης.
Τα τετραφθοροβορικά διαζωνιακά άλατα είναι δυσδιάλυτα, απομονώνονται εύκολα και θερμαινόμενα διασπώνται παρέχοντας φθοριωμένα αρωματικά παράγωγα, μέσω της αντίδρασης Balz-Schiemann, ενός εύκολου τρόπου εισαγωγής φθορίου σε αρωματικό δακτύλιο, π.χ.
C6H5NH2
+ HNO2 + HBF4
![]() C6H5N2+BF4- +
2H2O C6H5N2+BF4-
C6H5N2+BF4- +
2H2O C6H5N2+BF4-
![]() C6H5F + BF3 + N2
C6H5F + BF3 + N2
 Αντίδραση βορικού
οξέος με πολυυδροξυενώσεις [Αναφ. 5].
Ως ασθενέστατο
οξύ, το βορικό οξύ είναι ουσιαστικά αδύνατον να προσδιορισθεί ογκομετρικά σε υδατικά
διαλύματά του με πρότυπα διαλύματα ισχυρών βάσεων. Ωστόσο, το 1893 διαπιστώθηκε (Thompson)
ότι ήταν δυνατή η ογκομέτρηση υδατικών διαλυμάτων βορικού οξέος, εάν στο διάλυμά
του προστεθεί προηγουμένως περίσσεια γλυκερόλης.
Παράλληλα, άλλοι
ερευνητές (Boesecken, Van Rossen) διαπίστωσαν ότι η προσθήκη ορισμένων
ουδέτερων οργανικών πολυυδροξυενώσεων αύξανε την ασθενή ηλεκτρική αγωγιμότητα των
υδατικών διαλυμάτων του βορικού οξέος.
Αντίδραση βορικού
οξέος με πολυυδροξυενώσεις [Αναφ. 5].
Ως ασθενέστατο
οξύ, το βορικό οξύ είναι ουσιαστικά αδύνατον να προσδιορισθεί ογκομετρικά σε υδατικά
διαλύματά του με πρότυπα διαλύματα ισχυρών βάσεων. Ωστόσο, το 1893 διαπιστώθηκε (Thompson)
ότι ήταν δυνατή η ογκομέτρηση υδατικών διαλυμάτων βορικού οξέος, εάν στο διάλυμά
του προστεθεί προηγουμένως περίσσεια γλυκερόλης.
Παράλληλα, άλλοι
ερευνητές (Boesecken, Van Rossen) διαπίστωσαν ότι η προσθήκη ορισμένων
ουδέτερων οργανικών πολυυδροξυενώσεων αύξανε την ασθενή ηλεκτρική αγωγιμότητα των
υδατικών διαλυμάτων του βορικού οξέος.
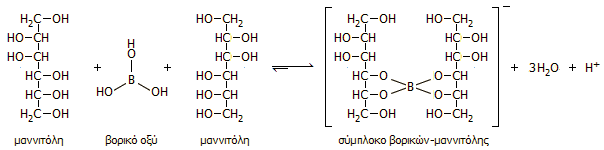
Τα παραπάνω οφείλονται σε μια τελείως χαρακτηριστική ιδιότητα του βορικού οξέος: Διαθέτει μια ιδιαίτερη "συγγένεια" με πολυυδροξυενώσεις, όπως είναι οι πολυόλες και οι υδατάνθρακες. Ακόμη και σε αραιά υδατικά διαλύματά του, το βορικό οξύ σχηματίζει σχεδόν ακαριαία με πολυυδροξυενώσεις ένα είδος βορικών εστέρων με το βόριο σε τετραεδρική σύνταξη ΒΟ4. Ο σχηματισμός των εστέρων συνοδεύεται από απελευθέρωση υδρογονοκατιόντος με αποτέλεσμα το βορικό οξύ να καθίσταται κατά έμμεσο τρόπο ισχυρότερο οξύ κατά 3 έως και 4 τάξεις μεγέθους.
Εάν σε ένα υδατικό διάλυμα βορικού οξέος, που είναι ελαφρά όξινο (pH 5,5-6), προστεθεί περίσσεια μιας πολυόλης, που είναι μια ουδέτερη ένωση, το pH του διαλύματος μειώνεται κατά 3 έως 4 μονάδες. 'Ετσι, ενώ σε καθαρά υδατικά διαλύματα το βορικό οξύ έχει pK1 = 9,24, παρουσία περίσσειας μαννιτόλης (mannitol), HOCH2(CHOH)4CH2OH, αποκτά ένα φαινομενικό pK1=5,15, δηλ. δηλαδή καθίσταται οξύ με ισχύ της τάξης εκείνης του οξικού οξέος, οπότε μπορεί να ογκομετρηθεί με διάλυμα ισχυρής βάσης χωρίς πρόβλημα.
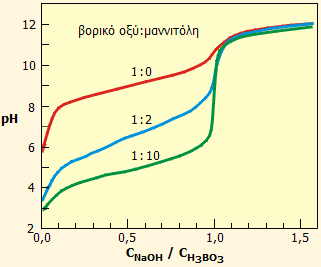
Σχεδόν όλες οι πολυόλες μπορούν να χρησιμοποιηθούν για την "επαύξηση" της ισχύος του βορικού οξέος, αν και κατά κανόνα χρησιμοποιείται η μαννιτόλη ως καταλληλότερη. Γενικά, η σύνδεση βορικού οξέος ευνοείται με υδροξύλια σε cis- παρά σε trans-διαμόρφωση. Η ιδιότητα αυτή έχει αξιοποιηθεί αναλυτικά για τη δέσμευση και διαχωρισμό ιχνών βορικών από διάφορα δείγματα, αλλά και (αντίστροφα) για τον διαχωρισμό με χρωματογραφικές τεχνικές πολυυδροξυενώσεων μετά τη σύμπλεξή τους με βορικό οξύ. Παρακάτω δείχνονται οι σχετικές ισορροπίες μεταξύ βορικού οξέος και μαννιτόλης και οι καμπύλες ογκομέτρησης βορικού οξέος απουσία και παρουσία μαννιτόλης.
 |
 |
|
Αριστερά: Αντίδραση βορικού οξέος με μια πολυόλη (π.χ. μαννιτόλη) που ερμηνεύει την "έμμεση" αύξηση της ισχύος του βορικού οξέος. Δεξιά: Καμπύλες ογκομέτρησης διαλύματος βορικού οξέος με διάλυμα NaOH παρουσία διαφόρων ποσοτήτων μαννιτόλης. Είναι προφανές ότι απουσία μαννιτόλης (κόκκινη καμπύλη) το ισοδύναμο σημείο είναι ασαφές, ενώ όσο αυξάνεται η περίσσεια μαννιτόλης, το ισοδύναμο σημείο είναι καθίσταται όλο και περισσότερο σαφές. Έτσι με δεκαπλάσια περίσσεια μαννιτόλης (πράσινη καμπύλη) το ισοδύναμο σημείο μπορεί να εντοπιστεί εύκολα με κατάλληλο οξεοβασικό δείκτη (π.χ. φαινολοφθαλεΐνη) [πηγή]. |
Σταυροδεσμοί βορικών ιόντων: Η σύνθεση ενός παράδοξου υλικού [Αναφ. 6] Η μεγάλη συγγένεια του βορικού οξέος και των ανιόντων του με τις πολυδροξυενώσεις τους παρέχει τη δυνατότητα να δράσουν ως μέσα δημιουργίας σταυροδεσμών (cross-linkers) με ορισμένα υδατοδιαλυτά πολυμερή. Χαρακτηριστική είναι η αντίδραση των βορικών με υδατικά διαλύματα πολυβινυλικής αλκοόλης (polyvinyl alcohol, PVA). Πρόκειται για ένα εντυπωσιακό πείραμα επίδειξης, που εισάγει μαθητές και φοιτητές στην έννοια των σταυροδεσμών μεταξύ αλυσίδων πολυμερών. Η πολυβινυλική αλκοόλη (PVA), [-CH2CH(OH)-]x είναι φθηνό πολυμερές, προϊόν υδρόλυσης του πολυ(οξικού βινυλεστέρα) [-CH2CH(OCOCH3)-]x. Διαλύεται εύκολα στο νερό και παρέχει σχετικώς ιξώδη διαλύματα. Έχει πλήθος εφαρμογών, π.χ. δρα ως σταθεροποιητικό αιωρημάτων, ως συγκολλητική ουσία και χρησιμοποιείται ως πληρωτικό υλικό στη χαρτοποιία, ενώ σε στερεά μορφή (ως φιλμ) δρα ως υδατοδιαλυτή μεμβράνη. 'Οταν σε υδατικό διάλυμα PVA προστεθούν βορικά ανιόντα, τότε μέσω αυτών πραγματοποιείται σύνδεση μεταξύ των αλυσίδων των μορίων του πολυμερούς, η οποία μπορεί να αποδοθεί από την ακόλουθη αντίδραση:
Το λαμβανόμενο προϊόν είναι ένα βλεννώδες υλικό, το οποίο δεν μπορεί να χαρακτηρισθεί ούτε ως υγρό, ούτε ως στερεό. Με προηγούμενη προσθήκη μιας χρωστικής στα διαλύματα, στο υλικό αυτό μπορεί να δοθεί και ένα χρώμα. Κύριο χαρακτηριστικό του υλικού αυτού είναι το ότι το ιξώδες αυξάνει με αύξηση της πίεσης (γίνεται σχεδόν στερεό) και επανέρχεται στην ημίρρευστη κατάσταση, όταν μειωθεί η ασκούμενη πίεση. Δεν υπακούει στους νόμους των ρευστών του Νεύτωνα και χαρακτηρίζεται ως μη-Νευτώνιο ρευστό (non-Newtonian fluid). Η σκληρότητα του λαμβανόμενου υλικού μπορεί εύκολα να τροποποιηθεί αν αλλάξει η πυκνότητα των σταυροδεσμών, κάτι το οποίο μπορεί να πραγματοποιηθεί με αλλαγή της αναλογίας βορικών/PVA ή μεταβάλλοντας το pH του διαλύματος, που επίσης επηρεάζει τη συγκέντρωση των βορικών ανιόντων. 'Eνα υλικό με παρόμοιες ιδιότητες (κατασκευασμένο από σιλικόνες) κυκλοφορεί στο εμπόριο σαν παιχνίδι και είναι γνωστό ως Silly Puty. |
|
Οι εστέρες του βορικού οξέος καίονται με πράσινη φλόγα [πηγή]. |
Εστέρες του βορικού οξέος [Αναφ. 7]. Το βορικό οξύ θερμαινόμενο με αλκοόλες παρουσία ενός αφυδραντικού μέσου (π.χ. θειικό οξύ) παρέχει (ορθο)βορικούς εστέρες, π.χ.:
![]()
Οι βορικοί εστέρες των "χαμηλών" αλκοολών είναι σχετικώς πτητικά υγρά, π.χ. το σ.ζ. των (CH3O)3B και (C2H5O)3B είναι 68οC και 118οC, είναι τοξικοί και καίγονται παρέχοντας οξείδιο του βορίου (B2O3), το οποίο χρωματίζει τη φλόγα πράσινη. Στην ιδιότητα αυτή βασίζεται η κλασική ποιοτική ανίχνευση βορικού οξέος και βορικών αλάτων, κατά την οποία μικρή ποσότητα του αναλυόμενου δείγματος θερμαίνεται με μεθανόλη και σταγόνες θειικού οξέος και αναφλέγονται οι εκλυόμενοι ατμοί.
Η παραπάνω δοκιμασία, γνωστή ως "δοκιμασία της πράσινης φλόγας", ήταν σε χρήση ήδη από τις αρχές του 18ου αιώνα. Φλόγα πράσινου χρώματος μαρτυρεί την παρουσία βορικού οξέος ή βορικών αλάτων στο δείγμα. Πράσινη φλόγα παρέχουν τα ιόντα χαλκού και βαρίου, ωστόσο -στην περίπτωσή τους- πρέπει να τοποθετηθεί το δείγμα απ' ευθείας στη φλόγα. Ο χρωματισμός της φλόγας κατά την καύση των βορικών εστέρων οφείλεται σε ενεργειακές μεταπτώσεις του σωματιδίου BO* (πυροφωταύγεια).
Επίσης, χάρις στον σχηματισμό πτητικού βορικού εστέρα είναι δυνατή η ποσοτική παραλαβή του βορίου με απόσταξη από δείγματα πολύπλοκης σύνθεσης για να ακολουθήσει ο απαρεμπόδιστος ποσοτικός προσδιορισμός του στο απόσταγμα μετά την αλκαλική υδρόλυση του εστέρα.
Οι εστέρες του βορικού οξέος χρησιμεύουν για τη σύνθεση οργανοβορικών ενώσεων (με άμεσο δεσμό C-B). Για παράδειγμα, με αντίδρασή του με αντιδραστήρια Grignard, παρέχουν βορονικά οξέα (boronic acids), π.χ.:
C6H5MgBr +
(CH3O)3B ![]() CH3OMgBr + C6H5-B(OCH3)2 C6H5-B(OCH3)2 + 2H2O
CH3OMgBr + C6H5-B(OCH3)2 C6H5-B(OCH3)2 + 2H2O
![]() C6H5-B(OH)2 + 2CH3OH
C6H5-B(OH)2 + 2CH3OH
Τα βορονικά οξέα και τα παράγωγά τους αποτελούν χρήσιμα ενδιάμεσα για την οργανική σύνθεση ενώσεων μέσω της αντίδρασης Suzuki (Akira Suzuki, Βραβείο Nobel Χημείας, 2010) με την οποία επιτυγχάνεται εύκολα η σύζευξη δύο οργανικών ομάδων R, R' (: αρύλια ή βινύλια) με δεσμό C-C, σύμφωνα με το γενικό σχήμα:
R-BΥ2
+ R'-X
![]() R-R' + X-BΥ2, όπου (Υ: -ΟΗ, -OCH3,
X: -Cl, -Br)
R-R' + X-BΥ2, όπου (Υ: -ΟΗ, -OCH3,
X: -Cl, -Br)
 |
 |
|
Αριστερά: Αυτοματοποιημένη μονάδα σύντηξης [πηγή]. Δεξιά: Φιάλες με συλλιπάσματα σύντηξης (fusion flux) LiBO2/Li2B2O7 και τα χρησιμοποιούμενα χωνευτήρια λευκοχρύσου [πηγή]. |
|
Συντήξεις με βορικά άλατα [Αναφ. 8]
Βορικά άλατα ιδιαίτερου αναλυτικού ενδιαφέροντος είναι το μεταβορικό λίθιο (lithium metaborate,¨"LiM", LiBO2) και το άνυδρο τετραβορικό λίθιο (lithium tetraborate, "LiT", Li2B4O7). Τα άλατα αυτά χρησιμοποιούνται ως συλλιπάσματα (ή ρευστοποιητές, fluxes) κατά τη χημική ανάλυση ορυκτών (κυρίως πυριτικών και αργιλικών), σκωριών, κεραμικών υλικών, υάλων και τσιμέντων, ουσίες που είναι αδύνατον να διαλυθούν πλήρως με επίδραση οξέων. Στην ουσία αξιοποιείται η από αρχαιοτάτων χρόνων γνωστή ιδιότητα των βορικών αλάτων να διαλύουν ως τήγματα (σχεδόν) τα πάντα.
Συχνά αυτές οι αναλύσεις των ορυκτών αφορούν προσδιορισμούς μεταλλικών στοιχείων, τα οποία βρίσκονται σε μικρές αναλογίες και όχι των κύριων συστατικών. Επομένως τα βορικά άλατα του λιθίου, των οποίων τα τήγματα δρουν σαν διαλύτες, πρέπει να είναι ιδιαίτερης καθαρότητας, δηλ. να είναι απαλλαγμένα από ιχνοποσότητες άλλων μετάλλων, ώστε να μην αλλοιώσουν το αναλυτικό αποτέλεσμα με τις δικές τους προσμίξεις. Η χρήση βορικών αλάτων λιθίου και όχι νατρίου επιτρέπει τον συχνά ζητούμενο προσδιορισμό νατρίου στα δείγματα.
Τα κονιοποιημένα δείγματα των ορυκτών αναμιγνύονται με 5-πλάσια έως 10-πλάσια ποσότητα μίγματος των βορικών αλάτων του λιθίου (σ.τ. του LiM: 845°C και του LiT: 920°C) και πυρακτώνονται στους 1000-1100°C σε χωνευτήρια λευκοχρύσου. Η αναλογία των δύο αλάτων (LiM/LiT) καθορίζεται από το είδος του ορυκτού, ώστε να επιτευχθεί το καλύτερο αποτέλεσμα (πλήρης διαλυτοποίηση του δείγματος).
|
Βίντεο τυπικής διαδικασίας σύντηξης δειγμάτων ορυκτών με βορικά άλατα λιθίου. |
Τα βορικά άλατα του λιθίου τήκονται και τα ορυκτά διαλύονται στο τήγμα των βορικών αλάτων μετατρεπόμενα σε μια ρευστή, ομοιογενή και σχετικά ευκίνητη υαλώδη μάζα. Η διαδικασία αυτή είναι γνωστή ως σύντηξη (fusion). Με τη σύντηξη αποφεύγεται η χρήση επικίνδυνων μιγμάτων οξέων, όπως π.χ. H2SO4+HF για τη διαλυτοποίηση πυριτικών ορυκτών σε σφραγισμένα δοχεία ("βόμβες") σε υψηλές θερμοκρασίες και υπό πίεση.
Η ομοιογενής υαλώδης μάζα βορικών αλάτων μετά την ψύξη και στερεοποίησή της χρησιμοποιείται ως έχει (για ορισμένες αναλυτικές τεχνικές) ή παραλαμβάνεται ποσοτικά με υδατικά διαλύματα οξέων και λαμβάνεται καθαρό διάλυμα του ορυκτού χωρίς αιωρούμενα αδιάλυτα σωματίδια. Ακολουθούν μετρήσεις των επιμέρους στοιχείων με ευαίσθητες ενόργανες αναλυτικές τεχνικές, όπως είναι η φασματομετρία ατομικής απορρόφησης (AAS), η συζευγμένη τεχνική φασματομετρίας εκπομπής επαγόμενου πλάσματος/φασματοσκοπίας μαζών (ICP-MS) και η φθορισμομετρία ακτίνων X (XRF). Ειδικά με την τελευταία τεχνική, που είναι και η πλέον χρησιμοποιούμενη, οι μετρήσεις πραγματοποιούνται απ' ευθείας στο στερεό υάλωμα.
Στο εμπόριο διατίθενται ειδικές συσκευές για τη διευκόλυνση και αυτοματοποίηση της επίπονης επεξεργασίας των δειγμάτων με σύντηξη. 'Ενα πρόσθετο πλεονέκτημα της χρήσης τήγματος βορικών αλάτων είναι ότι το τήγμα τους δεν "διαβρέχει" τα τοιχώματα του χωνευτηρίου λευκοχρύσου και με απλή απόχυση μεταφέρεται ποσοτικά από τα χωνευτήρια στα δισκία ψύξης (βλ. βίντεο).
Πέραν των βορικών αλάτων του λιθίου, ως συλλιπάσματα για τη σύντηξη δειγμάτων ορυκτών, χρησιμοποιούνται και άλλες χημικές ουσίες και μίγματά τους, όπως τα: KNaCO3, Na2CO3+KNO3, NaNH4ΗPO4, K2S2O7, Na2O2, ΚΟΗ, από τα οποία επιλέγεται το καταλληλότερο για κάθε τύπο δείγματος και τα ζητούμενα προς προσδιορισμό συστατικά τους. Αντίστοιχα, επιλέγεται και ο καταλληλότερος τύπος χωνευτηρίου (π.χ. από Pt, Pt-Au, Pt-Ir, Ni, γραφίτη), το οποίο θα πρέπει να "αντέχει" το δεδομένο τύπο συλλιπάσματος σε υψηλές θερμοκρασίες και να υφίσταται τη μικρότερη δυνατή φθορά.
|
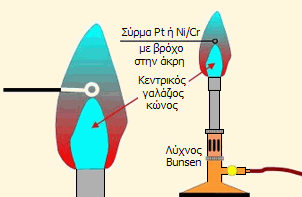
Η ιδιότητα των τηγμένων βορικών αλάτων να διαλυτοποιούν μεταλλικά οξείδια αξιοποιήθηκε για την ανάπτυξη μια πυροχημικής μεθόδου ποιοτικής ανάλυσης με την ονομασία (όπως αναφέρεται σε παλαιά ελληνικά συγγράμματα): "Δοκιμασία μαργαρίτου βόρακος" (borax bead test). Κατά τη δοκιμασία "μαργαρίτου" (μαργαριταριού) βόρακα χρησιμοποιείται ένα λεπτό σύρμα λευκοχρύσου ή Nichrom (κράμα Ni-Cr, το οποίο χρησιμοποιείται στις θερμαντικές αντιστάσεις), στου οποίου στην άκρη του έχει σχηματιστεί ένας μικρός βρόχος, διαμέτρου περίπου 4 mm. Ο βρόχος θερμαίνεται στον λύχνο Bunsen μέχρι ερυθροπυράκτωσης και αμέσως βυθίζεται σε λεπτή σκόνη βόρακα. Το άλας χάνει το κρυσταλλικό του ύδωρ, "μαζεύει" και με επιπλέον θέρμανση στη φλόγα σχηματίζει ένα διαφανές σφαιρίδιο σαν μικρή γυάλινη χάντρα (μίγμα NaBO2+B2O3). Το σφαιρίδιο μετά τη ψύξη υγραίνεται ελαφρά και βυθίζεται στιγμιαία στο προς ανάλυση διάλυμα. Στη συνέχεια φέρεται πάλι στη φλόγα του λύχνου στην υψηλή (οξειδωτική) περιοχή της, επαναλαμβάνεται η τήξη. Μετά την ψύξη παρατηρείται το χρώμα του σφαιριδίου. Μπορεί να επαναληφθεί η τήξη του ίδιου σφαιριδίου με θέρμανση στη χαμηλή (αναγωγική) περιοχή της φλόγας, δεδομένου ότι ορισμένα μέταλλα παρέχουν διαφορετικό χρώμα σφαιριδίου ανάλογα με την περιοχή της φλόγας στην οποία θερμαίνονται. Τυπικοί χρωματισμοί του σφαιριδίου που λαμβάνεται σε οξειδωτική φλόγα είναι: Πράσινο για το Cr, μπλε για το Co, πρασινογάλαζο για τον Cu, ιώδες για το Mn, καφεκόκκινο για το Ni. Ο Fe δίνει κίτρινο σφαιρίδιο σε οξειδωτική φλόγα και πρασινωπό σε αναγωγική, ο χαλκός πρασινογάλαζο σε οξειδωτική, κοκκινωπό σε αναγωγική και το U καφεκίτρινο σε οξειδωτική και πράσινο σε αναγωγική. Οι διαφορές στους χρωματισμούς οφείλονται στα διαφορετικά προϊόντα κατά περίπτωση, π.χ. για τον χαλκό:
- Σε οξειδωτική
φλόγα: CuSO4
+ B2O3
- Σε αναγωγική φλόγα:
CuSO4
+ B2O3
Η πυροχημική δοκιμασία "μαργαρίτου βόρακος" συμπληρώνει κατά κάποιο τρόπο τη δοκιμασία χρωματισμού της φλόγας, με την οποία λίγα μόνο ιόντα μετάλλων μπορούν να ανιχνευθούν. Η ίδια δοκιμασία μπορεί να πραγματοποιηθεί και με άλλα άλατα που χρησιμοποιούνται ως συλλίπασμα, όπως το NaNH4HPO4 ("μικροκοσμικό" άλας) και το Na2CO3. |
Παραγωγή βορικού και βορικών αλάτων και χρήσεις τους [Αναφ. 10]
Τα κυριότερα ορυκτά βορίου εμπορικής σημασίας είναι το tincal (ακατέργαστή μορφή βόρακα, Na2B4O7·10H2O, αναφέρεται και ως τινκαλίτης), ο κερνίτης (μερικώς αφυδατωμένος βόρακας, Na2B4O7·4H2O), ο κολεμανίτης (βορικό ασβέστιο, CaB3O4(OH)3·H2O) και ο ουλεξίτης (μικτό βορικό άλας νατρίου ασβεστίου, NaCaB5O6(OH)6·5H2O). Συνήθως, από το tincal παράγεται καθαρός βόρακας, από τον κερνίτη καθαρό βορικό οξύ, ενώ ο κολεμανίτης και ο ουλεξίτης κατευθύνονται κυρίως στην υαλουργία και κεραμοποιία.
Η μετατροπή των βορικών αλάτων ασβεστίου σε βόρακα πραγματοποιείται με επεξεργασία τους με θερμό διάλυμα ανθρακικού νατρίου (σόδας), π.χ. για τον κολεμανίτη οι αντιδράσεις είναι:
2CaB3O4(OH)3·H2O
+ 2Na2CO3 ![]() 2CaCO3 + Na2B4O7 + 2NaBO2
+ 5H2O
4NaBO2 + CO2
2CaCO3 + Na2B4O7 + 2NaBO2
+ 5H2O
4NaBO2 + CO2 ![]() Na2B4O7 + Na2CO3
Na2B4O7 + Na2CO3
Οι κύριες παραγωγές χώρες βορικού οξέος και αλάτων του είναι ακόλουθες (σε παρένθεση η παραγωγή του 2010 εκφρασμένη σε χιλιάδες τόνους βορίου): Τουρκία (1850), ΗΠΑ (1150), Αργεντινή (650), Χιλή (460), Ρωσία (400), Κίνα (140), Βολιβία (60), Καζακστάν (30), Περού (10) και Ιράν (2). Το 2006 εντοπίστηκαν για πρώτη φορά σε ευρωπαϊκό έδαφος σημαντικά κοιτάσματα γιανταρίτη στην Σερβία, ενός βοριοπυριτικού άλατος νατρίου και λιθίου (LiNaSiB3O7(OH)), τα οποία μπορούν να αξιοποιηθούν για την παραγωγή βορίου αλλά και λιθίου, στοιχείου μεγάλης πλέον σημασίας για την παραγωγή μπαταριών ιόντων λιθίου.
 |
 |
 |
|
Το μεγαλύτερο ορυχείο βορικών αλάτων στον κόσμο βρίσκεται στην αφιλόξενη Κοιλάδα του Θανάτου στη Νότια Καλιφόρνια. Εκεί βρίσκεται και η μικρή πόλη Boron, η οποία αποτελεί το κέντρο των επιχειρήσεων εξόρυξης βορικών. Από αριστερά προς τα δεξιά: (1) Ορυχείο ανοικτής εξόρυξης (open pit) βορικών [πηγή]. (2) Τμήμα των εγκαταστάσεων της Rio Tinto US Borax κοντά στην πόλη Boron [πηγή]. (3) τα ορυχεία της περιοχής αποτελούν τουριστικό αξιοθέατο και στην πόλη Boron υπάρχει Μουσείο με σχετικά ιστορικά εκθέματα [πηγή]. |
||
 |
 |
|
Τα πλουσιότερα στον κόσμο επιβεβαιωμενα αποθέματα βορικών αλάτων βρίσκονται στην Τουρκία, η οποία είναι η μεγαλύτερη παραγωγός χώρα βορικών αλάτων. Αριστερά: Ορυχείο tincal (Na2B4O7·10H2O) στην κοντά πόλη Kirka της επαρχίας Εσκισεχίρ. Δεξιά: Ορυχείο κολεμανίτη (CaB3O4(OH)3·H2O) κοντά στην πόλη Emet της επαρχίας Κιουτάχιας, [πηγή]. |
|
 |
 |
|
Οι μεγαλύτερες ποσότητες βορικών αλάτων κατευθύνονται στην κατασκευή βοριοπυριτικής υάλου και υαλονήματος fiberglass. |
|
Οι κύριες χρήσεις του βορικού οξέος και των βορικών αλάτων [Αναφ. 11]
Οι κύριες χρήσεις του βορικού οξέος και των βορικών αλάτων συνοψίζονται στις ακόλουθες:
- Υαλουργία. Η κυριότερη χρήση σήμερα των ενώσεων του βορίου βρίσκεται στην κατασκευή ειδικής υάλου, η οποία γνωστή ως βοριοπυριτική ύαλoς (borosilicate glass, BSG). Στην ύαλο αυτή το βόριο αντικαθιστά το μεγαλύτερο μέρος του νατρίου της κοινής υάλου. Η βοριοπυριτική ύαλος χαρακτηρίζεται από μεγάλη ανοχή στις απότομες θερμοκρασιακές διακυμάνσεις (thermal shock) λόγω μικρού συντελεστή θερμικής διαστολής (περίπου το 1/3 του συντελεστή της κοινής υάλου), από μηχανική αντοχή, όπως επίσης και από αντοχή έναντι χημικών αντιδραστηρίων (π.χ. πυκνά διαλύματα βάσεων).
Μια τυπική σύνθεση βοριοπυριτικής υάλου είναι 80% SiO2, 13% B2O3, 4% Νa2O και 2-3% Al2O3. Τα περισσότερα υάλινα σκεύη που χρησιμοποιούνται στα χημικά εργαστήρια κατασκευάζονται από βοριοπυριτική ύαλο. Στην παραγωγή βοριοπυρυτικής ύαλου κατευθύνεται το 29% της παραγωγής βορικών αλάτων. Ο υαλοβάμβακας (glass wool) και πλαστικά ενισχυμένα με υαλόνημα (fiberglass) είναι δομικά μονωτικά υλικά, στα οποία κατευθύνεται το 30% της παραγωγής βορικών αλάτων. Οθόνες τηλεοράσεων, οθόνες LCD χρησιμοποιούν ειδικές βοριοπυριτικές υάλους. Συνολικά, σχεδόν τα 2/3 της παραγωγής βορικών αλάτων κατευθύνονται στην παραγωγή διάφορων μορφών υάλου.
|
Μεγάλες ποσότητες βορικών αλάτων χρησιμοποιούνται για τα σμάλτα κεραμικών αντικειμένων [πηγή]. |
- Κεραμοποιία. Τα άλατα του βορίου φαινομενικά μειώνουν το σημείο τήξης οξειδίων (στην ουσία τα μετατρέπουν σε εύτηκτα μεταβορικά άλατα) και έτσι αναμιγνυόμενα με διάφορα οξείδια μετάλλων λαμβάνονται πολύχρωμα σμάλτα με ελεγχόμενους συντελεστές θερμικής διαστολής, ώστε να αποφεύγεται το ονομαζόμενο "κρακελάρισμα" του σμάλτου κατά την ψύξη του επισμαλτωμένου κεραμικού αντικειμένου. Επικαλύψεις με βορικά σμάλτα είναι ανθεκτικές στην τριβή και δύσκολα χαράσσονται.
- Γεωργία. Το βόριο αποτελεί βασικό μικροθρεπτικό συστατικό (micronutrient) για την ανάπτυξη των φυτών και συνήθως αναμιγνύεται με τα κύρια λιπάσματα (N-P-K) για καλλιέργειες σε χώματα πτωχά σε βόριο. Το βόριο βοηθά την πρόσληψη άλλων πρωτευόντων και δευτερευόντων θρεπτικών στοιχείων (Ca, Mg, P, Mn, Zn). Τα φύλλα των φυτών τυπικά περιέχουν 25 έως 100 ppm βορίου, το οποίο για να συντηρηθεί απαιτεί περίπου 120 g βορίου/στρέμμα. Ωστόσο, το βόριο αν και απαραίτητο μικροθρεπτικό συστατικό για τα φυτά, είναι τοξικό σε μεγαλύτερες ποσότητες και απαιτείται προσεκτικός έλεγχος στις χρησιμοποιούμενες ποσότητες βορικών αλάτων.
|
Παλαιά διαφήμιση απορρυπαντικού με βόρακα [πηγή]. |
- Επιβραδυντές φλόγας. 'Ηδη από τον 19ο αιώνα ήταν γνωστό ότι ξύλινα αντικείμενα που είχαν διαποτιστεί με διάλυμα μίγματος βορικού οξέος και βόρακα, δεν μπορούσαν να καούν εύκολα. Σήμερα, ενώσεις του βορικού οξέος χρησιμοποιούνται ως επιβραδυντικά φλόγας (βλ. χημική ένωση του μήνα: Τετραβρωμοδισφαινόλη Α) για υλικά από κυτταρίνη, ενώ αδιάλυτα στο νερό βορικά άλατα ψευδαργύρου (με γενικό τύπο: xZnO·yB2O3·zH2O) χρησιμοποιούνται σε πολυμερή υλικά και σε ελαστικά. Η δράση των βορικών οφείλεται στο σχηματισμό εύτηκτων υαλωμάτων, τα οποία σταθεροποιούν τη μονωτική απανθρακωμένη στιβάδα (carbonized layer).
- Αναστολείς διάβρωσης. Διάφορες συνθέσεις βορικών αλάτων χρησιμοποιούνται ως αναστολείς διάβρωσης συστήματα ψύξης (π.χ. στα ψυγεία αυτοκινήτων σε μίγματα με αιθυλενογλυκόλη), όπως και σε ψυκτικές εγκαταστάσεις βιοαντιδραστήρων, σε υδραυλικά υγρά και στην επεξεργασία μεταλλικών προϊόντων.
- Συντηρητικά ξύλων και εντομοκτόνα. Το βορικό οξύ και τα άλατά είναι πολύ αποτελεσματικά για τον έλεγχο και καταστροφή εντόμων και μυκήτων, ενώ δεν είναι επικίνδυνα για τα θηλαστικά. Είναι τοξικά για κατσαρίδες, μυρμήγκια, τερμίτες, σκαθάρια, ψύλλους και κάμπιες.
- Μεταλλουργία. Παραδοσιακή εφαρμογή του βόρακα είναι η κάλυψη τηγμάτων μετάλλων με ένα στρώμα τηγμένου βόρακα που "μαζεύει" τα οξείδια και αποτρέπει τον σχηματισμό επιπλέον ποσοτήτων. Ο βόρακας είναι το κύριο συστατικό συλλιπασμάτων συγκολλήσεων (soldering fluxes), που χρησιμοποιούνται κατά τις συγκολλήσεις μη σιδηρούχων μετάλλων. Τα συλλιπάσματα απαλλάσσουν τις συγκολλούμενες επιφάνειες από επιφανειακά οξείδια και το τηγμένο κράμα συγκόλλησης (αργυρούχο, κασσιτερούχο) έρχεται σε επαφή με καθαρό μέταλλο, προσφύεται αποτελεσματικότερα σ' αυτό και ρέει ευκολότερα. Επίσης, τα συλλιπάσματα εξασφαλίζουν μια καθαρή και απαλλαγμένη από οξείδια επιφάνεια μετά τη συγκόλληση.
|
|
 |
|
Τα υπερβορικά άλατα είναι ενώσεις του παραπάνω υπερβορικού ανιόντος με υπεροξειδικές γέφυρες. |
- Φαρμακευτικά και καλλυντικά. Διαλύματα βορικού οξέος έχουν αντισηπτική δράση και χρησιμοποιούνται σε οφθαλμικές και ωτικές σταγόνες, όπως επίσης σε αλοιφές για ελαφρά εγκαύματα. Βορικά προστίθενται και ως συντηρητικά σε διάφορα παρασκευάσματα για να προληφθεί η ανάπτυξη μικροοργανισμών.
Βορικό οξύ, ως αποτελεσματικό αντιμυκητιακό μέσο, χρησιμοποιείται σε σκόνες για την καταπολέμηση της κακοσμίας των ποδιών και της ανάπτυξης μυκήτων στα δάκτυλα των ποδιών (athlete's foot fungus). Συνηθισμένο συστατικό σε στοματικά διαλύματα, κρέμες, αφροσάπουνα. Η χρήση του βορικού οξέος (Ε284) και του τετραβορικού νατρίου (Ε285) ως συντηρητικών τροφών υπόκειται σε περιορισμούς ή έχει πλέον απαγορευθεί.
|
Το υπό κατασκευή νέο "κέλυφος" που καλύπτει τον μοιραίο αντιδραστήρα 4 στο Chernobyl. Κύριο κατασκευαστικό υλικό είναι το καρβίδιο του βορίου (B4C) που θα συμβάλλει στη μείωση της ακτινοβολίας προς το περιβάλλον [πηγή]. |
- Απορρυπαντικά. Μία από τις πρώτες χρήσεις του βόρακα ήταν η χρήση του σε απορρυπαντικά, λόγω της ήπιας αλκαλικής του δράσης. Σήμερα η χρήση αυτή έχει περιορισθεί, ωστόσο μια σύνθετη ένωση βορικού νατρίου-υπεροξειδίου υδρογόνου, γνωστή ως υπερβορικό νάτριο (sodium perborate) με τυπική σύνθεση NaBO2·H2O2·3H2O χρησιμοποιείται ως ήπιο λευκαντικό μέσο, το οποίο δεν καταστρέφει τις υφάνσιμες ίνες στον ίδιο βαθμό με εκείνο των υποχλωριωδών αλάτων.
- Στο χημικό εργαστήριο. Ο βόρακας ανακρυσταλλώνεται εύκολα και μπορεί να ληφθεί με καθαρότητα που φθάνει το 99,99% και επομένως μπορεί να χρησιμοποιηθεί ως πρωτογενές πρότυπο για την τιτλοδότηση διαλυμάτων οξέων (βλ. παραπάνω). Το σύστημα βορικού οξέος/βόρακα είναι συνηθισμένο ρυθμιστικό σύστημα στην περιοχή pH 8-10 και υπάρχουν πίνακες που παρέχουν τις ακριβείς ποσότητες βόρακα και βορικού οξέος που απαιτούνται για την παρασκευή ρυθμιστικών διαλυμάτων επακριβώς γνωστού pH για τη βαθμονόμηση πεχαμέτρων. Μικρές ποσότητες βορικού οξέος προστίθεται σε ορισμένα αντιδραστήρια ως συντηρητικό (π.χ. σε διαλύματα αμύλου, δείκτη για την ιωδιμετρία) για να αποφευχθεί η αλλοίωσή τους λόγω ανάπτυξης μικροοργανισμών.
- Πυρηνική τεχνολογία. Το φυσικό βόριο αποτελείται από δύο ισότοπα το B-10 (20%) και το B-11 (80%). Το ισότοπο B-10 παρουσιάζει μεγάλη ενεργό διατομή (cross-section) για την απορρόφηση νετρονίων χαμηλής ενέργειας (θερμικά νετρόνια), μέσω της αντίδρασης κατά την οποία δεν παράγονται ραδιενεργά νουκλίδια:
10Β5 + 1n0(θερμ.)
![]() 4He2 + 7Li3
4He2 + 7Li3
Οι ράβδοι ελέγχου των πυρηνικών αντιδραστήρων συνήθως περιέχουν καρβίδιο του βορίου (B4C), ένα ιδιαίτερα σκληρό και δύστηκτο υλικό (σ.τ.=2760oC), ως υλικό απορρόφησης των θερμικών νετρονίων και καταστολής της πυρηνικής αντίδρασης. Εναλλακτικά, με αύξηση της συγκέντρωσης βορικών στα ψυκτικά υγρά των ορισμένων τύπων πυρηνικών αντιδραστήρων η πιθανότητα πυρηνικών σχάσεων μειώνεται και επομένως, μέσω ελέγχου της συγκέντρωσης των βορικών, μπορεί να ελεγχθεί ο ρυθμός των πραγματοποιούμενων πυρηνικών αντιδράσεων. Ακόμη, η κατάκλυση με υδατικό διάλυμα βορικού οξέος και βόρακα αποτελεί μέτρο ασφάλειας για την κατεπείγουσα διακοπή της λειτουργίας του αντιδραστήρα, αφού προλαμβάνεται ο πολλαπλασιασμός των νετρονίων.
Να σημειωθεί ότι ο αντιδραστήρας 4 στο Chernobyl, αμέσως μετά το τραγικό ατύχημα του 1986 κατακλύσθηκε με άφθονες ποσότητες βορικού οξέος για να αποφευχθεί η τήξη του πυρήνα του (meltdown). Χρειάστηκαν 1800 υπερπτήσεις ελικοπτέρων για να "θάψουν" τον αντιδραστήρα κάτω από 6 χιλιάδες τόνους μίγματος άμμου και βορικού οξέος και 2400 τόνους μολύβδου.

Βορικό οξύ, τοξικότητα, υγιεινή και ασφάλεια [Αναφ. 12]
Η τοξικότητα του βορικού οξέος βρίσκεται σε σχετικώς χαμηλά επίπεδα, εάν λάβουμε υπόψη ότι η θανατηφόρος δόση 50% (LD50) είναι 2,6 g/kg βάρους των πειραματοζώων (επίμυες). Το βορικό οξύ είναι τοξικό μόνο όταν ληφθεί από το στόμα, ή όταν κάποιος το εισπνεύσει, σε σχετικά μεγάλες ποσότητες. Η 13η έκδοση του Merck Index αυξάνει τη δόση LD50 του βορικού οξέος σε 5,14 g/kg για δόσεις από το στόμα σε ποντίκια και σε 5 έως 20 g/kg (τεράστια ποσότητα) για να προκαλέσει θάνατο στον άνθρωπο.
Περισσότερο ενδιαφέρουν οι επιπτώσεις της έκθεσης για μακρό χρονικό διάστημα σε βορικό οξύ. Στις επιπτώσεις αυτές περιλαμβάνονται νεφρικές βλάβες. Αν και φαίνεται πως το βορικό οξύ δεν είναι καρκινογόνο, μελέτες σε σκύλους οι οποίοι εκτέθηκαν σε ημερήσιες δόσεις 32 mg/kg σωματικού βάρους για 90 ημέρες (κατά πολύ μικρότερες της τιμής LD50), ανέφεραν πως προκλήθηκε ατροφία των όρχεων.
Σύμφωνα με τη βάση δεδομένων της IUCLID (International Uniform Chemical Information Database), μεγάλες δόσεις βορικού οξέος σε κουνέλια, αρουραίους και έμβρυα ποντικιών προκάλεσαν σημαντικά αναπτυξιακά προβλήματα και τερατογενέσεις, όπως επίσης σκελετικές και νεφρικές βλάβες.
Γενικά πάντως, τα δελτία ασφαλείας (MSDS) χαρακτηρίζουν το βορικό οξύ ως μη τοξικό, όχι καρκινογόνο και μεταλλαξιγόνο, ελαφρά επικίνδυνο σε επαφή με το δέρμα (ως απορροφούμενη ουσία), ερεθιστικό για τα μάτια, όπως επίσης ερεθιστικό κατά την εισπνοή και κατάποση. Ενδεχομένως, το βορικό οξύ είναι βλαπτικό για το αναπαραγωγικό σύστημα και άλλα όργανα, σε περιπτώσεις συνεχούς χρήσης του. Επίσης, δεν φαίνεται να υπάρχουν επαγγελματικές νόσοι που συνδέονται με καθημερινή επαφή με βορικά άλατα (π.χ. σε ορυχεία βορικών).

 Σε
σχετικώς πυκνά υδατικά διαλύματα βορικών αλάτων
Σε
σχετικώς πυκνά υδατικά διαλύματα βορικών αλάτων


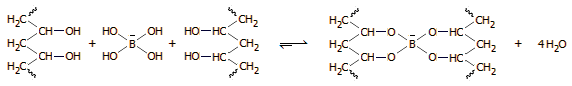


 Μια παλαιά πυροχημική δοκιμασία: Η δοκιμασία "μαργαρίτου βόρακος"
[
Μια παλαιά πυροχημική δοκιμασία: Η δοκιμασία "μαργαρίτου βόρακος"
[