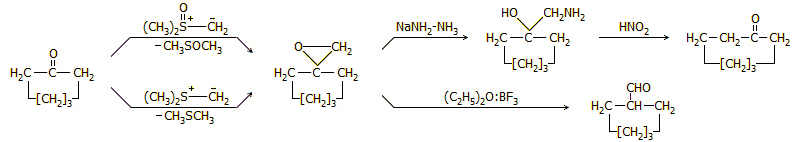
Λεπτομέρειες πάνω στη σύνθεση του οξιρανικού παραγώγου της κυκλοεξανόνης, μπορούν να αναζητηθούν εδώ [Αναφ. 4στ].
| |||||||||||||||
Η χημική ένωση του μήνα
[Φεβρουάριος 2011]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής - Κωνσταντίνος Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες [Αναφ. 1]: Εμφάνιση: 'Αχρωμο, εξαιρετικά υγροσκοπικό, ελαφρά ιξώδες και ελάχιστα πτητικό υγρό. Καθαρό είναι πρακτικά άοσμο, αλλά συνήθως έχει μια ελαφριά οσμή σκόρδου λόγω ιχνών ακαθαρσιών, πικρή γεύση και γλυκιά μετα-γεύση Μοριακός τύπος: C2H6OS Σχετική μοριακή μάζα: 78,13 Σημείο βρασμού: 189 ºC (760 mm Hg), 83 ºC (17 mm Hg), 56,6 ºC (5,11 mm Hg) Σημείο τήξης: 18,45 ºC (περιέρχεται εύκολα σε κατάσταση υπέρψυξης, δηλ. διατηρείται υγρό και σε χαμηλότερες θερμοκρασίες από το σημείο τήξης) Πυκνότητα (σχετική): 1,1004 (20 ºC) Δείκτης διάθλασης (nD20): 1,479 Διπολική ροπή: 3,96 D (25 ºC) Ιξώδες: 1,996 cP (20 ºC) [συγκριτικά (σε cP): βενζόλιο: 0,60, ύδωρ: 0,89, νιτροβενζόλιο: 1,86, αιθυλενογλυκόλη: 16] Θερμοκρασία ανάφλεξης: 95 ºC Διαλυτότητα: Αναμίξιμο με το νερό και με τους περισσότερους οργανικούς διαλύτες σε κάθε αναλογία. Τοξικότητα: Ελάχιστη (LD50, από το στόμα σε αρουραίους): 17,9 mL/kg. Παρά τη χαμηλή τοξικότητά του, επειδή απορροφάται εύκολα από το δέρμα, μπορεί να εισάγει εύκολα στον οργανισμό άλλες τοξικές ουσίες διαλυμένες σε αυτό και επομένως απαιτείται ιδιαίτερη προσοχή κατά τη χρήση του ως διαλύτη. |
|
|
Διμεθυλοσουλφοξείδιο (DMSO) Dimethylsulfoxide (DMSO) |
Γενικά για το διμεθυλοσουλφοξείδιο
 Το
διμεθυλοσουλφοξείδιο
(dimethylsulfoxide, DMSO)
είναι η απλούστερη οργανοσουλφινυλική ένωση με χημικό
τύπο
(CH3)2SO.
Η συστηματική ονομασία του είναι μεθανοσουλφινυλομεθάνιο (methanesulfinylmethane),
αλλά γενικά είναι γνωστό απλά ως DMSO. Μια ακόμη εμπορική ονομασία
του DMSO (κυρίως για φαρμακευτική χρήση) είναι διμεξίδιο (dimexide).
Το
διμεθυλοσουλφοξείδιο
(dimethylsulfoxide, DMSO)
είναι η απλούστερη οργανοσουλφινυλική ένωση με χημικό
τύπο
(CH3)2SO.
Η συστηματική ονομασία του είναι μεθανοσουλφινυλομεθάνιο (methanesulfinylmethane),
αλλά γενικά είναι γνωστό απλά ως DMSO. Μια ακόμη εμπορική ονομασία
του DMSO (κυρίως για φαρμακευτική χρήση) είναι διμεξίδιο (dimexide).
Το DMSO είναι ένα άχρωμο, ελαιώδες, ελαφρά ιξώδες και εξαιρετικά υγροσκοπικό υγρό. Το καθαρό DMSO είναι πρακτικά άοσμο, ωστόσο πάντοτε το DMSO του εμπορίου περιέχει ιχνοποσότητες άλλων ουσιών (κυρίως του διμεθυλοσουλφιδίου, CH3SCH3), που του προσδίδουν μια ελαφριά σκορδώδη οσμή.
Το DMSO είναι ένας εξαιρετικός πολικός, (CH3)2S[+δ]O[-δ], και ουσιαστικά απρωτικός διαλύτης (polar aprotic solvent), δηλ. διίσταται, παρέχοντας πρωτόνια, σε απειροελάχιστο βαθμό, pKΗΑ = 35). Η χρήση του ως διαλυτικού μέσου άρχισε να γενικεύεται κυρίως μετά το 1950. Διαλύει εύκολα και μη πολικές ενώσεις, όπως και πολλά ανόργανα άλατα. Αναμιγνύεται με το νερό σε οποιαδήποτε αναλογία, όπως επίσης και με τους περισσότερους οργανικούς διαλύτες.
Η τοξικότητα του DMSO είναι πρακτικά μηδενική, ωστόσο η χρήση του στο χημικό εργαστήριο απαιτεί ιδιαίτερη προσοχή, γιατί απορροφάται με εξαιρετική ευκολία από το δέρμα και εισέρχεται ταχύτατα στην κυκλοφορία του αίματος To DMSO δεν είναι ο μόνος διαλύτης που έχει αυτήν την ιδιότητα, αλλά ίσως είναι ο ταχύτερα απορροφούμενος και ο λιγότερο τοξικός.
Χαρακτηριστικό γεγονός είναι το ότι αν απλωθούν στο δέρμα λίγες σταγόνες DMSO, σε λίγα δευτερόλεπτα ή λεπτά (ανάλογα με την περιοχή του σώματος) θα γίνει αντιληπτή η χαρακτηριστική γεύση του, όπως και μια οσμή στη στοματική κοιλότητα και ειδικότερα στη βάση της γλώσσας, αν και το ίδιο είναι ένα σχεδόν άοσμο υγρό. Η οσμή αυτή οφείλεται στον σχηματισμό μικροποσοτήτων διμεθυλοσουλφιδίου (CH3SCH3), το οποίο είναι ένα από τα προϊόντα μεταβολισμού του DMSO. Αν η ποσότητα του DMSO είναι κάπως μεγάλη, το άτομο που θα είχε την ατυχή έμπνευση να κάνει αυτή τη δοκιμή, θα έχει για ώρες μια μάλλον δυσάρεστη σκορδώδη εκπνοή.
Αυτή η ιδιότητα του DMSO καθιστά εξαιρετικώς επικίνδυνα τα διαλύματα τοξικών ενώσεων σε αυτό, αφού αν αυτά έρθουν σε επαφή με το δέρμα, το DMSO θα τις μεταφέρει ταχύτατα στον οργανισμό, όπου θα εκδηλώσουν την τοξική τους δράση, η οποία μπορεί να είναι και μοιραία.
|
Απλές θειούχες οργανικές ομάδες Στον επόμενο πίνακα δίνονται οι απλούστερες θειούχες οργανικές ομάδες με το θείο σε διαφορετικά σθένη (II, ΙV και VI). Ακόμη δίνονται τυπικές απλές ενώσεις που περιέχουν τις ομάδες αυτές, η ονομασία τους, όπως και συγγενείς ή παράγωγες οργανικές και ανόργανες ενώσεις.
|
|
Alexander Mikhaylovich Zaytsev (1841-1910). Διάσημος Οργανικός Χημικός, Καθηγητής στο Πανεπιστήμιο του Kazan. Είναι γνωστός κυρίως για τον "κανόνα Zaytsev", που διέπει τις αντιδράσεις απόσπασης (elimination reactions) [Αναφ. 2α]. |
Ιστορία και σύνθεση του DMSO
Το DMSO παρασκευάστηκε για πρώτη φορά το 1866 από τον διάσημο Ρώσο οργανικό χημικό Alexander Mikhaylovich Zaytsev (ή: Zaitsev, Saytzeff, Saytzev) στην πόλη Kazan της Κεντρική Ρωσίας. Η παρασκευή του πραγματοποιήθηκε απλά με αργή προσθήκη υγρού διμεθυλοθειαιθέρα ή διμεθυλοσουλφιδίου, (dimethylsulfide, DMS, σ.ζ. 36ºC) σε πυκνό νιτρικό οξύ, με βάση την ακόλουθη γενική αντίδραση οξείδωσης:
CH3SCH3 + [O] ![]() CH3SOCH3 + 33,26 kcal
CH3SOCH3 + 33,26 kcal
Η παραπάνω οξείδωση μπορεί να επιτευχθεί και με άλλα οξειδωτικά μέσα (οξείδια αζώτου, υπεροξείδιο υδρογόνου, χλώριο) [Αναφ. 2β].
O Zaytsev διαπίστωσε ότι η νέα αυτή υδατοδιαλυτή και κάπως ελαιώδης ουσία με την ελαφριά σκορδώδη οσμή, ήταν ένας εξαιρετικός διαλύτης, χρήσιμος ως μέσον απολίπανσης, ως αραιωτικό χρωμάτων, αλλά και ως αντιψυκτικό μέσο.
Για περίπου 80 χρόνια, η ένωση αυτή με τις τόσο πολύτιμες ιδιότητες, έμεινε άγνωστη στους χημικούς, αφού ο Zaytsev (νέος τότε ερευνητής) είχε δημοσιεύσει τα ευρήματά του σε ένα μάλλον άσημο γερμανικό επιστημονικό περιοδικό. Ο τίτλος της εργασίας αυτής ήταν "Μελέτη της επίδρασης του νιτρικού οξέος στο μεθυλοσουλφιδίο και το αιθυλοσουλφιδίο".
Το ενδιαφέρον για το DMSO άρχισε να εκδηλώνεται μετά τον 2ο Παγκόσμιο Πόλεμο. Αφορμή γι αυτό έδωσε: (α) η διαπίστωση ότι το DMSO είναι εξαιρετικός διαλύτης για τη βιομηχανία των πλαστικών και (β) το ότι μπορούσε να παραχθεί εύκολα σε μεγάλες ποσότητες με πρώτη ύλη παραπροϊόντα της βιομηχανίας χαρτοπολτού, που ήταν διαθέσιμα σε άφθονες ποσότητες και ουσιαστικώς άχρηστα.
Το 1959, το ενδιαφέρον για το DMSO αυξήθηκε, όταν μια ερευνητική ομάδα στη Μεγάλη Βρετανία διαπίστωσε ότι ερυθρά αιμοσφαίρια και άλλοι ιστοί μπορούν καταψυχθούν μέσα σε DMSO χωρίς να υποστούν βλάβη.
Το 1961, διαπιστώθηκε ότι το DMSO μπορούσε να απορροφηθεί ταχύτατα από το δέρμα χωρίς να προκαλέσει κάποια βλάβη σε αυτό. Η ιδιότητα αυτή σε συνδυασμό με την ουσιαστικά μηδενική τοξικότητά του, άνοιγε δρόμους πλήθους εφαρμογών του DMSO στη φαρμακευτική.
Σύγχρονες μέθοδοι παρασκευής του DMSO. Σήμερα το DMSO εξακολουθεί να παρασκευάζεται ουσιαστικά με την ίδια μέθοδο, δηλ. με οξείδωση του διμεθυλοσουφιδίου. Η ένωση αυτή, λαμβάνεται σε μεγάλες ποσότητες ως παραπροϊόν της αναγωγικής υδρόλυσης της σουλφονικών παραγώγων της λιγνίνης (lignosulfonates). Τα παράγωγα αυτά προκύπτουν κατά την επεξεργασία ξύλου με θειώδη άλατα για την παρασκευή χαρτοπολτού στη χαρτοβιομηχανία.
Η λιγνίνη (lignin) είναι ένα πολυμερές υλικό με χημικές μονάδες φαινολικού χαρακτήρα, με πολύπλοκο και εν μέρει άγνωστο χημικό τύπο. Το ξύλο περιέχει λιγνίνη σε αναλογία περίπου 25-30% και ο ρόλος της είναι να δρα σαν "κόλλα" των ινών κυτταρίνης του ξύλου. Στη χαρτοβιομηχανία, η παρασκευή του χαρτοπολτού γίνεται από ξέσματα ξύλου διαφόρων προελεύσεων. Από το ξύλο θα πρέπει να αφαιρεθεί η λιγνίνη και να μείνουν κατά το δυνατόν ίνες καθαρής κυτταρίνης.
Μία από τις συνηθέστερες μεθόδους απολιγνιτοποίησης (delignification) βασίζεται στην όξινη σχάση των αιθερικών δεσμών, που συγκρατούν πολλά από τα συστατικά τμήματα των πολυμερών μορίων της λιγνίνης. Τα ξέσματα ξύλου θερμαίνονται σε διάλυμα όξινου θειώδους άλατος (νατρίου, αμμωνίου, μαγνησίου ή ασβεστίου). Τα ηλεκτρονιόφιλα καρβοκατιόντα, που σχηματίζονται κατά τη σχάση των αιθερικών δεσμών, δεσμεύονται από τα όξινα θειώδη ιόντα παρέχοντας σουλφονικά οξέα σύμφωνα με την αλληλουχία των αντιδράσεων:
![]()
Το υγρό που απομένει από τη διαδικασία, γνωστό ως κόκκινο ή καφέ υγρό (red or brown liquid), τυπικά περιέχει περίπου 6% λιγνίνη ως διαλυτό σουλφονικό παράγωγο. Αυτά τα σουλφονικά παράγωγα της λιγνίνης αποτελούν πολύτιμα παραπροϊόντα της χαρτοβιομηχανίας και βρίσκουν ποικιλία εφαρμογών, όπως: στην παρασκευή στόκου, ως μέσο διασποράς στη λάσπη που χρησιμοποιείται στις γεωτρήσεις πετρελαίου, στα φυτοφάρμακα και στα χρώματα, όπως και ως δεψική ύλη στη βυρσοδεψία (αντί για τις τανίνες). Ακόμη, με οξείδωση ορισμένων από αυτά τα σουλφονικά παράγωγα μπορεί να ληφθεί βανιλλίνη.
 |
 |
|
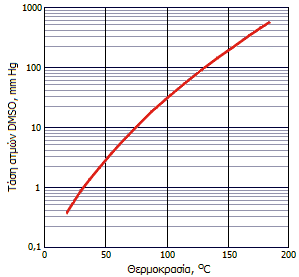
Αριστερά: Διάγραμμα τάσης ατμών του DMSO ως προς την πίεση [Αναφ. 1γ]. Δεξιά: Πρόχειρη διάταξη απόσταξης DMSO υπό ελαττωμένη πίεση. |
|
Κατά τη θέρμανση των σουλφονικών παραγώγων της λιγνίνης με θειούχα άλατα ή στοιχειακό θείο, παράγεται διμεθυλοσουφίδιο, το οποίο στη συνέχεια μπορεί να οξειδωθεί με διοξείδιο του αζώτου προς DMSO [Αναφ. 3].
Κατά τα τέλη της δεκαετίας του 1940, ξεκίνησε η βιομηχανική παραγωγή DMSO σε μια μικρή βιομηχανία έξω από το Σικάγο, τη Stepan Chemical Company. Το 1959, η βιομηχανία αυτή καταστράφηκε από μια έκρηξη που συνέβη σε έναν από τους χημικούς αντιδραστήρες.
Η παραγωγή του DMSO συνεχίστηκε από μια μονάδα της μεγάλης βιομηχανίας Crown Zellerbach Company, στην Bogalusa της Λουιζιάνας. Το 1964, η ετήσια παραγωγή της μονάδας σε DMSO ξεπερνούσε τους 2.500 τόνους. Η διάθεση της ουσίας γινόταν σε βαρέλια με κόστος περίπου 0,7 $/kg. Σήμερα, η βιομηχανία αυτή ονομάζεται Gaylord Chemical Company, L.L.C., και πέραν από την παραγωγή του DMSO, ειδικεύεται και στη σύνθεση και παραγωγή μεγάλου αριθμού ανάλογων οργανικών ενώσεων του θείου [Αναφ. 2γ, 3γ].
Το 2008, η ετήσια κατανάλωση του DMSO σε παγκόσμια κλίμακα ήταν περίπου 60.000 τόνοι με κύριους καταναλωτές τη βιομηχανία ηλεκτρονικών εξαρτημάτων, τη φαρμακευτική βιομηχανία και τη βιομηχανία φυτοφαρμάκων [Αναφ. 3δ].
Καθαρισμός του DMSO. Συνήθεις προσμίξεις του DMSO (βιομηχανικής ποιότητας) είναι η ίδια η μητρική ένωση από την οποία παρασκευάζεται, δηλ. το διμεθυλοσουλφίδιο. Αυτή η δύσοσμη και εξαιρετικά πτητική ουσία ευθύνεται για τη δυσάρεστη σκορδώδη οσμή του ακάθαρτου DMSO και το καθιστά σε κάποιο βαθμό ερεθιστικό ως προς το δέρμα. 'Αλλες προσμίξεις είναι προϊόντα περαιτέρω οξείδωσης του DMSO, όπως η διμεθυλοσουλφόνη (CH3SO2CH3, στερεό με σ.τ. 108-110ºC) και ο θειικός διμεθυλεστέρας (CH3OSO2OCH3, υγρό με σ.ζ. 188ºC). Η πρώτη είναι ουσία πρακτικά μηδενικής τοξικότητας, η δεύτερη όμως είναι ισχυρότατο μεθυλιωτικό μέσο και επομένως επικίνδυνη μεταλλαξιγόνος-καρκινογόνος ουσία. Στο σημείο αυτό θα πρέπει να σημειωθεί ότι και η διμεθυλοσουλφόνη "προωθείται" και αυτή στην αγορά ως φάρμακο-"θαύμα", ανάλογο με το DMSO, και ως διατροφικό πρόσθετο.
Ο καθαρισμός του DMSO πραγματοποιείται με απόσταξη υπό ελαττωμένη πίεση, επειδή σε θερμοκρασίες πάνω από 150 ºC υπόκειται στην ακόλουθη βραδεία αντίδραση αυτοοξειδοαναγωγής:
2 CΗ3SOCH3
![]() CΗ3SCH3
+ CH3SO2CH3
CΗ3SCH3
+ CH3SO2CH3
Εναλλακτικά, για να ληφθεί DMSO φαρμακευτικής ποιότητας, έχει προταθεί θέρμανσή του στους 100 ºC με στερεό KOH, που ακολουθείται από απόσταξή του υπό ελαττωμένη πίεση [Αναφ. 2γ].
Αντιδράσεις του DMSO
Το DMSO μπορεί να δράσει ως ήπια οξειδωτικό, αναγόμενο προς διμεθυλοσουλφίδιο (ημιαντίδραση 1), αλλά και ως ήπιο αναγωγικό οξειδούμενο προς διμεθυλοσουλφόνη (ημιαντίδραση 2):
CH3SOCH3 + 2H+ + 2e- ![]() CH3SCH3 + H2O (1),
CH3SOCH3 + 2H2O
CH3SCH3 + H2O (1),
CH3SOCH3 + 2H2O ![]() CH3SO2CH3 + 2H+
+ 2e- (2)
CH3SO2CH3 + 2H+
+ 2e- (2)
Ορισμένες αντιδράσεις, όπου το DMSO δρα ως οξειδωτικό και οι οποίες έχουν χρησιμοποιηθεί για τον ογκομετρικό προσδιορισμό ποσοτήτων του, είναι οι εξής:
CH3SOCH3 + Sn2+
+ 2H+ ![]() CH3SCH3 + Sn4+ + H2O ,
CH3SOCH3 + 2 Ti3+ +
2H+
CH3SCH3 + Sn4+ + H2O ,
CH3SOCH3 + 2 Ti3+ +
2H+ ![]() CH3SCH3 + 2Ti4+ + 2H2O
CH3SCH3 + 2Ti4+ + 2H2O
Το DMSO οξειδώνει οργανικές θειόλες προς τα αντίστοιχα δισουλφίδια [Αναφ. 2δ]:
CH3SOCH3 +
RSH ![]() CH3SCH3 + RS-SR
+ H2O
CH3SCH3 + RS-SR
+ H2O
Η παραπάνω αντίδραση ενδεχομένως μετέχει στον μεταβολισμό του DMSO εντός του οργανισμού προς διμεθυλοσουλφίδιο (έχει διαπιστωθεί η in vitro αντίδρασή του με κυστεΐνη και γλουταθειόνη [Αναφ. 2ε]).
Ορισμένες αντιδράσεις, όπου το DMSO δρα ως αναγωγικό και έχουν χρησιμοποιηθεί για τον ογκομετρικό προσδιορισμό ποσοτήτων του, είναι οι εξής:
CH3SOCH3 +
RCOOOH (μονο-υπερφθαλικό
οξύ) ![]() CH3SΟ2CH3 + RCOOH ,
3CH3SOCH3 + Cr2O72-
+ 8H+
CH3SΟ2CH3 + RCOOH ,
3CH3SOCH3 + Cr2O72-
+ 8H+ ![]() 3CH3SO2CH3 + 2Cr3+
+ 4H2O
3CH3SO2CH3 + 2Cr3+
+ 4H2O
Οι παραπάνω αντιδράσεις για τον ογκομετρικό προσδιορισμό DMSO συνήθως απαιτούν σχετικά υψηλές θερμοκρασίες (π.χ. σε θερμοκρασία βρασμού των υδατικών διαλυμάτων τους) και ο προσδιορισμός περατώνεται με ογκομέτρηση της περίσσειας του προστεθέντος οξειδωτικού ή αναγωγικού αντιδραστηρίου (οπισθογκομέτρηση). Είναι αυτονόητο ότι με ογκομετρικούς προσδιορισμούς μπορούν να προσδιορισθούν μόνο σχετικά μεγάλες ποσότητες DMSO (ενδεικτικά: > 10 mg) και ότι οι προσδιορισμοί αυτοί παρεμποδίζονται από πλήθος άλλων ενώσεων. 'Εχουν αναπτυχθεί πιο ευαίσθητες και εκλεκτικές φωτομετρικές τεχνκές, αλλά σε κάθε περίπτωση ο προσδιορισμός του DMSO, π.χ. σε φαρμακευτικά σκευάσματα, πραγματοποιείται εύκολα με χρωματογραφικές μεθόδους, που επιτρέπουν και τον σύγχρονο προσδιορισμό ακαθαρσιών [Αναφ. 2γ].
|
Τα δραστικά παράγωγα του DMSO που είναι χρήσιμα στην οργανική σύνθεση:
|
|
Elias James Corey (1928). Καθηγητής Οργανικής Χημείας, στο Πανεπιστήμιο Harvard. Τιμήθηκε με το Nobel Χημείας του 1990 για τις εργασίες του πάνω στη ρετροσύνθεση. Από τους πρωτεργάτες των εφαρμογών του DMSO στην οργανική σύνθεση. |
'Αλλες χημικές ιδιότητες του DMSO. Το θείο του DMSO είναι πυρηνόφιλο ως προς "μαλακά" ηλεκτρονιόφιλα και το οξυγόνο του είναι πυρηνόφιλο ως προς "σκληρά" ηλεκτρονιόφιλα. Τα μεθύλια του DMSO είναι όξινα σε απειροελάχιστο βαθμό (pKΗΑ = 35) λόγω της ελαφριάς σταθεροποίησης του προκύπτοντος καρβανιόντος από την ομάδα S(+δ)=Ο(-δ). Η απόσπαση πρωτονίου μπορεί να επιτευχθεί μόνο με εξαιρετικά ίσχυρες βάσεις ή "σουπερβάσεις" (για τα "σουπεροξέα" και τις "σουπερβάσεις", βλ. Χημική ένωση του μήνα: "Μαγικό οξύ"), όπως είναι το διισοπροπυλαμιδο-λίθιο, [(CH3)2CH]2N-Li, και το υδρίδιο του νατρίου, NaH, π.χ.
CH3SOCH3 +
[(CH3)2CH]2N-Li
![]() CH3SOCH2-Li+
+
[(CH3)2CH]2NH,
CH3SOCH3 +
NaH
CH3SOCH2-Li+
+
[(CH3)2CH]2NH,
CH3SOCH3 +
NaH ![]() CH3SOCH2-Na+
+ H2
CH3SOCH2-Na+
+ H2
Το παραγόμενο ανιόν CH3SOCH2- (μεθυλοσουλφινυλικό καρβανιόν), αποτελεί τη συζυγή βάση του DMSO και του έχει αποδοθεί η εμπειρική ονομασία διμσύλιο (dimsyl). Το διμσύλιο είναι μια πανίσχυρη βάση και αποτελεί χρήσιμο αντιδραστήριο για την οργανική σύνθεση (βλ. παρακάτω) [Αναφ. 4α].
Εφαρμογές του DMSO στην οργανική σύνθεση [Αναφ. 4]. Πέρα από τη χρήση του ως διαλύτη, το DMSO χρησιμοποιείται ως ήπιο οξειδωτικό στην οργανική σύνθεση. Τυπική είναι η οξείδωση Swern, κατά την οποία δευτεροταγής υδροξυλοομάδα οξειδώνεται προς καρβονύλιο χωρίς να υποστούν βλάβη άλλες ευαίσθητες ομάδες του τροποποιούμενου μορίου:
![]()
Μια παραλλαγή της παραπάνω οξείδωσης, με το πρόσθετο πλεονέκτημα ότι μπορεί να πραγματοποιηθεί σε πολύ χαμηλές θερμοκρασίες (-25 ºC), είναι η οξείδωση Corey-Kim, όπου αντί DMSO χρησιμοποείται μίγμα CH3SCH3 - Ν-χλωρο-ηλεκτριμιδίου (οξειδωτικό αντιδραστήριο, με το Cl σε κατάσταση οξείδωσης +1). Το μίγμα αυτό παράγει in situ DMSO, αποκαλούμενο "ενεργοποιημένο DMSO" [Αναφ. 2δ].
Σημαντικότερη εφαρμογή του DMSO στην οργανική σύνθεση, είναι η παρασκευή από αυτό θειούχων υλιδίων (sulfur ylides). Τα υλίδια αυτά είναι δραστικότατα ενδιάμεσα αντιδραστήρια πολύτιμα για πλήθος οργανικών συνθέσεων και είναι γνωστά ως αντιδραστήρια των Corey-Chaykovsky. Η σύνθεσή τους συνοψίζεται στην ακόλουθη αλληλουχία αντιδράσεων:
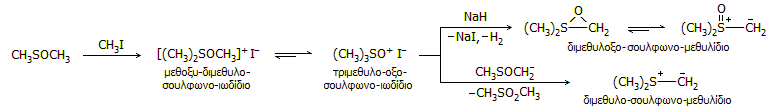
Το DMSO αντιδρά με μεθυλοϊωδίδιο και παρέχει το σταθερό (και εμπορικά διαθέσιμο) τριμεθυλοξοσουλφωνο-ιωδίδιο (trimethyloxosulfonium iodide). Το τριμεθυλοξοσουλφωνο-ιωδίδιο αντιδρά με υδρίδιο του νατρίου και παρέχει το διμεθυλοξοσουλφωνο-μεθυλίδιο (dimethyloxosulfonium methylide), ενώ με διάλυμα διμσυλίου (το ανιόν του DMSO, προϊόν αντίδρασής του, όπως το NaH) παρέχει το ακόμη δραστικότερο (και ασταθέστερο) υλίδιο διμεθυλοσουλφωνο-μεθυλίδιο (dimethylsulfonium methylide).
Και τα δύο υλίδια είναι δραστικότατα και πολύτιμα ενδιάμεσα για την οργανική σύνθεση και παράγονται πάντοτε in situ. Τυπικό παράδειγμα εφαρμογής τους αποτελεί η εισαγωγή μεθυλενικής μονάδας, μέσω αντικατάστασης της καρβονυλικής ομάδας με την οξιρανική ομάδα (ή εποξειδική ομάδα). Οι λαμβανόμενες οξιρανικές ενώσεις είναι χρήσιμα ενδιάμεσα συνθετικά παράγωγα, που μπορούν να δώσουν διάφορα προϊόντα, όπως δείχνεται παρακάτω στην περίπτωση της κυκλοεπτανόνης [Αναφ. 4ε]:
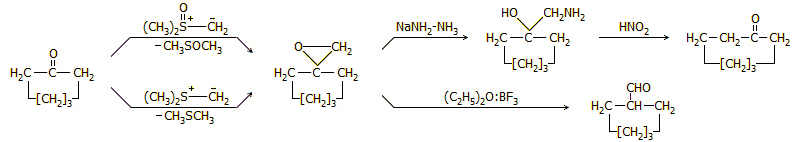
Λεπτομέρειες πάνω στη σύνθεση του οξιρανικού παραγώγου της κυκλοεξανόνης, μπορούν να αναζητηθούν εδώ [Αναφ. 4στ].
 Το DMSO ως διαλύτης
Το DMSO ως διαλύτης
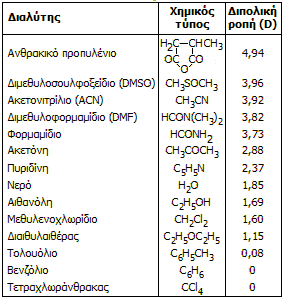
Η μεγάλη διπολική ροπή του μορίου του DMSO το καθιστά ικανό να σχηματίσει συζεύγματα και ενώσεις προσθήκης με πλήθος οργανικών και ανόργανων μορίων. Το DMSO επιδιαλυτώνει ευκολότατα τα κατιόντα οργανικών και ανόργανων αλάτων, δρώντας συγχρόνως και ως ένας εξαιρετικός απρωτικός διαλύτης και υποκαταστάτης. Στον παραπλεύρως πίνακα δίνονται ενδεικτικά ορισμένες τιμές διπολικής ροπής (σε μονάδες Debye) διαφόρων κοινών διαλυτών [Αναφ. 5α, β].
Κάποιες διαλυτότητες ορισμένων αλάτων (σε g/100 g, στους 25 ºC) που είναι ενδεικτικές της μεγάλης διαλυτικής ισχύος του DMSO για ανόργανα άλατα:
(CH3COO)2Hg : 100, SnCl2.H2O : 40, ZnCl2 : 30, FeCl3.6H2O : 30, NaI : 30, NaNO2 : 20 [Αναφ. 2γ]
Στο DMSO μπορούν να διαλυθούν και πολλά ανόργανα άλατα που δεν διαλύονται στο νερό. Σε μια περίπτωση, το DMSO χρησιμοποιείται ως διαλύτης ανάπτυξης μεγάλων κρυστάλλων HgI2 (για χρήση ως ανιχνευτή στερεάς κατάστασης ακτίνων Χ). Ο HgI2 είναι ένα ερυθρό κρυσταλλικό άλας αδιάλυτο στο νερό, που όμως διαλύεται άφθονα στο DMSO (272 g στα 100 mL). Η διαλυτότητά του μειώνεται δραματικά όσο αυξάνεται η περιεκτικότητα του DMSO σε νερό [Αναφ. 5γ].
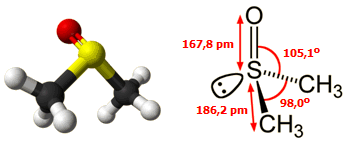
Σε αντίθεση με το μόριο της ακετόνης (CH3COCH3), το μόριο του DMSO (CH3SOCH3) δεν είναι επίπεδο, αλλά έχει σχήμα τριγωνικής πυραμίδας. Διαθέτει ένα ασύζευκτο ζεύγος ηλεκτρονίων υψηλής κατευθυντικότητας στην κορυφή της πυραμίδας, το οποίο του επιτρέπει να δράσει ως υποκαταστάτης για τον σχηματισμό συμπλόκων, όπως και στην επιδιαλύτωση των ενώσεων που διαλύονται σε αυτό [Αναφ. 5στ].
|
|
Δεξιά δείχνεται η δομή ενός οκταεδρικού συμπλόκου του ρουθηνίου(ΙΙ), όπου το DMSO δρα ως υποκαταστάτης. Το σύμπλοκο αυτό παρασκευάζεται εύκολα με αντίδραση θερμού DMSO με άνυδρο RuCl3. Αξίζει να σημειωθεί ότι στο σταθερότερο cis-ισομερές ένα από τα μόρια του DMSO συνδέεται με το Ru μέσω του ατόμου οξυγόνου, σε αντίθεση με όλα τα άλλα στα οποία η σύνδεση πραγματοποιείται μέσω του ατόμου θείου. Αναφέρεται ότι τα σύμπλοκα αυτά διαθέτουν αντικαρκινικές ιδιότητες [Αναφ. 5δ].
Στο DMSO αναμιγνύεται με τους συνηθέστερους διαλύτες, όπως είναι οι μικρού μοριακού βάρους αλκοόλες, εστέρες, κετόνες, αιθέρες, όπως και οι οργανοχλωριούχοι και αρωματικοί διαλύτες. Αξιοσημείωτη εξαίρεση αποτελούν οι κορεσμένοι αλειφατικοί υδρογονάνθρακες, οι οποίοι είναι ουσιαστικά αδιάλυτοι στο DMSO. Στη βιβλιογραφία υπάρχουν λεπτομερή αριθμητικά δεδομένα διαλυτότητας (αλλά και συμβατότητας) διάφορων ουσιών, όπως διαλυτών, ανόργανων και οργανικών ουσιών, φαρμακευτικών ουσιών, φαρμακευτικών εκδόχων, πολυμερών και αερίων στο DMSO [Αναφ. 5ε, στ].
Ουσίες ασύμβατες με το DMSO. Το DMSO δεν είναι συμβατό με αρκετές ουσίες. 'Ετσι αντιδρά βίαια με ακυλοαλογονίδια και διαπιστώθηκε ότι αντιδρά έντονα με μεθυλοβρωμίδιο. Mια απόπειρα ξήρανσής του με άνυδρο υπερχλωρικό μαγνήσιο οδήγησε σε έκρηξη (σοβαρότατο χημικό σφάλμα σε ό,τι αφορά τη χρήση αυτής της ξηραντικής ουσίας, βλ. Χημική ένωση του μήνα: "Υπερχλωρικό οξύ και άλατά του") [Αναφ. 6στ].
Ιδιαίτερα προσεκτική και πάντοτε σε μικρές ποσότητες πρέπει να είναι η προσθήκη NaH για τις αντιδράσεις που αναφέρθηκαν προηγουμένως (in situ παρασκευή διαλύματος του καρβανιόντος διμσυλίου). Επίσης θα πρέπει να αποφευχθεί η θέρμανσή του με ενώσεις που μπορεί να τις οξειδώσει (π.χ. αλκοόλες). Αντίθετα, το DMSO φαίνεται να είναι "ανεκτικό" ως προς το υδρίδιο του ασβεστίου ("υδρόλιθος" CaH2), αφού έχει προταθεί ο καθαρισμός του με απόσταξή του υπό ελαττωμένη πίεση (π.χ. στους 60-65 ºC, 4 mm Hg) παρουσία μικρών ποσοτήτων αυτού του υδριδίου [Αναφ. 4στ].
Το DMSO ως διαλύτης στην οργανική σύνθεση. Το DMSO αποτελεί πολύτιμο διαλύτη για την οργανική σύνθεση καθώς σε αυτό μπορεί να πραγματοποιηθεί σχεδόν κάθε τύπος οργανικής αντίδρασης (προσθήκη, αλκυλίωση, αντικατάσταση, κυκλοποίηση, αιθεροποίηση, απόσπαση, ισομερισμός, συμπύκνωση). Στο DMSO διαλύεται εύκολα μια μεγάλη ποικιλία οργανικών ενώσεων (υδατάνθρακες, πολυμερή, πεπτίδια), σε περιεκτικότητες που μπορεί να φτάσουν το 50-60%, ενώ σε άλλους παρόμοιους διαλύτες οι αντίστοιχες περιεκτικότητες είναι 10-20%.
Τα μόρια των πολικών διαλυτών, λόγω της υψηλής διηλεκτρικής σταθεράς τους, αποτελούν καλούς "μονωτές". 'Ετσι, διαλύτες όπως το διμεθυλοφορμαμίδιο (DMF), το N,N-διμεθυλακεταμίδιο (DMAC) και ειδικά το DMSO, διαχωρίζουν αποτελεσματικά τα ανιόντα από τα κατιόντα. Επιπλέον, ο μικρός βαθμός επιδιαλύτωσης των ανιόντων από το DMSO επιταχύνει δραματικά διμοριακές αντιδράσεις πυρηνόφιλης υποκατάστασης (αντιδράσεις SN2). Ειδικά στις αντιδράσεις πυρηνόφιλης αρωματικής υποκατάστασης έχουν αναφερθεί αυξήσεις ταχύτητας κατά δέκα εκατομμύρια φορές.
'Οπως προαναφέρθηκε, το DMSO σε θερμοκρασίες μεγαλύτερες από τους 150 ºC αρχίζει να υφίσταται μια αντίδραση αυτοοξειδοαναγωγής. 'Ετσι, διαπιστώθηκε ότι διασπάται σε ποσοστό 2% κατά τον 24-ωρο βρασμό του (υπό κανονική πίεση, στους 189 ºC) με κάθετο ψυκτήρα (reflux condenser). Η αντίδραση αυτή επιταχύνεται σημαντικά παρουσία οξέων και γι αυτό ο βρασμός του πρέπει να γίνεται παρουσία ουσιών που δεσμεύουν ίχνη οξέων (π.χ. Na2CO3, ZnO).
|
|
|
Τμήμα μικροηλεκτρονικού κυκλώματος (TFT-LCD: Thin film transistor liquid crystal display), που χρησιμοποιείται στις σύγχρονες επίπεδες οθόνες υπολογιστών και τηλεόρασης, πριν (αριστερά) και μετά (δεξιά) την απομάκρυνση υπολειμμάτων καλυπτικής μάσκας novolac-photoresist με διαλυτικό που ως βάση έχει το DMSO. |
Αντίθετα, το DMSO προτιμάται σε περιπτώσεις αντιδράσεων, που απαιτούν ισχυρώς βασικό περιβάλλον. Το DMSO είναι ιδιαίτερα σταθερό παρουσία ισχυρών βάσεων (υδροξείδια, αμμωνία, αμίνες, αλκοξείδια) και ως προς αυτό το σημείο πλεονεκτεί σημαντικά έναντι άλλων υδατοδιαλυτών διαλυτών υψηλής πολικότητας (φορμαμίδιο, διμεθυλοφορμαμίδιο, Ν-μεθυλο-πυρολλιδόνη). Προϊόντα αλκαλικής υδρόλυσης αυτών των διαλυτών συνήθως οδηγούν σε ανεπιθύμητα παραπροϊόντα και χαμηλές αποδόσεις στα επιθυμητά προϊόντα [Αναφ. 5στ].
Το DMSO ως διαλύτης στη φασματοσκοπία NMR (Πυρηνικός Μαγνητικός Συντονισμός). Το δευτεριωμένο DMSO (DMSO-d6) είναι πολύτιμος διαλύτης χρήσιμος στη φασματοσκοπία NMR, δεδομένης της ικανότητάς του να διαλύει πλήθος ουσιών, του απλού φάσματος του ίδιου και της καταλληλότητάς του για μετρήσεις NMR σε σχετικά υψηλές θερμοκρασία. Στα μειονεκτήματά του περιλαμβάνονται: το υψηλό κόστος του, το σχετικά υψηλό ιξώδες του (που προκαλεί διεύρυνση των φασματικών γραμμών) και η υγροσκοπικότητά του, που ουσιαστικά αποκλείει την πλήρη εξάλειψη κορυφών Η του ύδατος στη φασματοκοπία 1Η-NMR. Συχνά χρησιμοποιείται ως μίγμα με CDCl3 και CH2Cl2 για μείωση του ιξώδους αλλά και του σημείου τήξεως.
Εφαρμογές του DMSO στη μικροηλεκτρονική. Το DMSO χρησιμοποιείται ευρύτατα ως διαλύτης στη βιομηχανία μικροηλεκτρονικών εξαρτημάτων (ολοκληρωμένα κυκλώματα). Διαλύει εύκολα τα κοινά πολυμερή (novolac και negative tone acrylic photoresist) που χρησιμοποιούνται (ως "μάσκες") κατά την κατασκευή μικροκυκλωμάτων και είναι συμβατός με τα αλκαλικά διαλύματα που χρησιμοποιούνται στη διαδικασία απομάκρυνσης των πολυμερών αυτών [Αναφ. 5ζ, η].
Το DMSO σε φαρμακευτικά σκευάσματα και άλλες σχετικές εφαρμογές
|
Ο χειρουργός Stanley W. Jacob (αριστερά) και ο χημικός Robert Herschler αλείφουν με διάλυμα χρωστικής σε DMSO το δέρμα κουνελιού για να μετρήσουν την ταχύτητα διείσδυσης του διαλύματος. Από την [Αναφ. 6γ]. |
Το 1960, ο ιατρός-χειρουργός Stanley W. Jacob, τότε επικεφαλής του προγράμματος μεταμοσχεύσεων στο νοσοκομείο της Ιατρικής Σχολής του Πανεπιστημίου του 'Ορεγκον στο Portland, διαπίστωσε την ικανότητα της διέλευσης του DMSO μέσω του δέρματος και της μεμβράνης των κυττάρων. Από τότε, ο Jacob θεωρείται ως ο "υπέρμαχος" των εφαρμογών του DMSO σε φαρμακευτικές εφαρμογές και στην ιατρική [Αναφ. 6]. Μεταξύ των φαρμακευτικών ουσιών που μπορούν να μεταφερθούν στον οργανισμό ως διαλύματα σε DMSO περιλαμβάνονται αλκαλοειδή (π.χ. μορφίνη), αντιβιοτικά (π.χ. πενικιλίνες), στεροειδή, κορτιζόνη και η ινσουλίνη.
Σήμερα πολλά φαρμακευτικά προϊόντα τα οποία περιέχουν DMSO. 'Ομως, ο ρόλος του μπορεί να διαφέρει από σκεύασμα σε σκεύασμα. Έτσι, το DMSO μπορεί να χρησιμοποιηθεί [Αναφ. 6ε]:
- Ως "συν-διαλύτης" (δηλ. σε μίγμα με άλλους διαλύτες) για να κρατά τα δραστικά συστατικά σε διάλυμα.
- Για τη μεταφορά φαρμακευτικών πολυμερών (όπως: πολυβινυλική αλκοόλη, πολυ-γαλακτικο-γλυκολικό οξύ) στο σώμα. Τα πολυμερή αυτά διαλυμένα στο DMSO, που δρα ως φορέας, εισάγονται στο σώμα, επικάθονται στα σημεία-στόχους δημιουργώντας ένα είδος πολυμερούς εμφυτεύματος, ενώ το DMSO απομακρύνεται με διάχυση.
- Σε εφαρμογές "σταθερής αποδέσμευσης" φαρμακευτικών ουσιών. Το DMSO δρα ως διαδερμικός φορέας-διαλύτης.
- Για την ενίσχυση της διαδερμικής διείσδυσης (transdermal penetration). Tο DMSO σε συγκέντρωση 70-90% έχει αποδειχθεί ότι βελτιώνει την ταχύτητα απορρόφησης φαρμακευτικών ουσιών μέσω του δέρματος. Σε μεγαλύτερες συγκεντρώσεις (ή στην περίπτωση του καθαρού DMSO) η ταχύτητα απορρόφησης είναι πολύ μικρότερη.
- Ως κρυοσυντηρητικό (cryopreservative) ή κρυοπροστατευτικό (cryoprotectant) μέσον. 'Οταν το DMSO αναμιχθεί με νερό σε αναλογία 50%, το μίγμα παραμένει υγρό και στους -80 ºC, προλαμβάνοντας την καταστροφή των κυττάρων από την κρυστάλλωση του ύδατος.
- Ως δραστικό φαρμακευτικό συστατικό. Μια από καιρό αποδεκτή φαρμακευτική χρήση του DMSO, όπου αυτό δρα ως πλέον ως δραστική φαρμακευτική ουσία είναι η θεραπεία της διάμεσης κυστίτιδας (interstitial cystitis).
Απορρόφηση από το δέρμα.
Το DMSO απορροφάται από το δέρμα με ρυθμό 176
![]() 42 g / (m2/hr) πολύ μεγαλύτερο από εκείνον του ύδατος που είναι
14,8
42 g / (m2/hr) πολύ μεγαλύτερο από εκείνον του ύδατος που είναι
14,8
![]() 0,1 g / (m2/hr). Διαπιστώθηκε ακόμη ότι ο ρυθμός απορρόφησης
εξαρτάται από το γραμμομοριακό κλάσμα του DMSO. Αν και το DMSO διεισδύει στο
δέρμα εύκολα σε συγκεντρώσεις 70-100%, σε συγκεντρώσεις μικρότερες τα μόρια
του DMSO εφυδατώνονται και η απορρόφησή τους επιβραδύνεται σημαντικά
[Αναφ. 6ε].
0,1 g / (m2/hr). Διαπιστώθηκε ακόμη ότι ο ρυθμός απορρόφησης
εξαρτάται από το γραμμομοριακό κλάσμα του DMSO. Αν και το DMSO διεισδύει στο
δέρμα εύκολα σε συγκεντρώσεις 70-100%, σε συγκεντρώσεις μικρότερες τα μόρια
του DMSO εφυδατώνονται και η απορρόφησή τους επιβραδύνεται σημαντικά
[Αναφ. 6ε].
Σε ορισμένες μελέτες αναφέρεται ότι το καθαρό DMSO δεν απορροφάται τόσο εύκολα, όσο τα διαλύματά του 70-90%. Οι DC Wood και J Wood σε άρθρο τους ανασκόπησης (1975) αναφέρονται σε πλήθος μελετών (117 αναφορές) πάνω στην απορρόφηση του DMSO από το δέρμα του ανθρώπου και πειραματόζωων, όπως και στις φαρμακολογικές ιδιότητες της ένωσης [Αναφ. 2ε].
Τοξικότητα του DMSO
Μελέτες πάνω στην οξεία τοξικότητα του DMSO έδειξαν ότι η ουσία είναι πρακτικώς μη-τοξίκη (LD50 > 5 g/kg). Για λήψη από το στόμα, οι τιμές LD50 που έχουν αναφερθεί κυμαίνονται από 17,4 έως 28,3 g/kg για αρουραίους και 16,5 έως 24,6 g/kg για ποντίκια. Για λήψη από το δέρμα οι τιμές LD50 βρέθηκαν 40 g/kg για τυφλοπόντικες, 50 g/kg για ποντίκια, >11 g/kg για σκύλους και πρωτεύοντα (πίθηκοι rhesus). Ωστόσο, μπορεί να προκαλέσει ερεθισμό στο δέρμα και στα μάτια.
Το DMSO δεν περιλαμβάνεται στη λίστα των καρκινογόνων πολλών οργανισμών υγείας (IARC, NTP, OSHA, ACGIH). Μια 18-μηνη μελέτη σε πίθηκους rhesus με ημερήσιες χορηγήσεις 3,3 g/kg έδειξε την απουσία κάποιων συμπτωμάτων. Σε ανθρώπους που λάμβαναν για τρεις μήνες (μέσω του δέρματος) ημερήσιες ποσότητες 2,8 g/kg, δεν παρουσιάσθηκαν άλλα συμπτώματα πέραν από ορισμένους περιπτωσιακούς ερεθισμούς του δέρματος και μια σκορδώδη οσμή της εκπνοής και της επιδερμίδας τους [Αναφ. 6στ].
Περιβαλλοντικά προβλήματα. Το DMSO, ως διαλύτης, δεν δημιουργεί σοβαρά περιβαλλοντικά προβλήματα. Ωστόσο, έχει εξεταστεί το ενδεχόμενο ανάπτυξης έντονης δυσοσμίας (οσμή "σάπιων λαχανικών") σε αποχετευτικά δίκτυα, όπου θα απορρίπτονταν ποσότητες DMSO και κάτω από αναερόβιες συνθήκες, λόγω βακτηριακής αναγωγής του προς το δύσοσμο διμεθυλοσουλφίδιο [Αναφ. 7].
Προσδιορισμός DMSO. Ιχνοποσότητες DMSO σε διάφορα δείγματα μπορούν να προσδιορισθούν σχετικά εύκολα με αεριοχρωματογραφία ή υγροχρωματογραφία. Ενδεικτικά, σε μια υγροχρωματογραφική μέθοδο προσδιορισμού DMSO σε απόβλητα, το αναφερόμενο όριο ανίχνευσης είναι 0,5 ppm [Αναφ. 6η]. Σε μια πιο σύγχρονη εργασία, προσδιορίζεται DMSO σε βιολογικά υγρά με συνδυασμένη αεριοχρωματογραφία/φασματοσκοπία μαζών (GC/MS) με όριο ανίχνευσης 0,04 ppm [Αναφ. 3θ].
 |
 |
 |
 |
 |
 |
|
Ορισμένα από τα προϊόντα που περιέχουν DMSO (καθαρός ή αραιωμένος με νερό διαλύτης, μίγματά του με αιθέρια έλαια, ζελέ, κρέμες, σπρέι) και διακινούνται μέσω του διαδικτύου. |
|||||
Το DMSO ως δραστική φαρμακευτική ουσία
Οι πρώτες αναφορές στη χρήση του DMSO σε διάφορες θεραπείες άρχισαν να δημοσιεύονται στις αρχές της δεκαετίας του 1960 και το ενδιαφέρον για τις φαρμακευτικές εφαρμογές της ουσίας αυτής γιγαντώθηκε μέσα στην ίδια δεκαετία. Το DMSO άρχισε να διαφημίζεται σε διάφορα έντυπα, αλλά και να διατίθεται ως έχει ή σε μίγμα με διάφορα άλλα έκδοχα ή αιθέρια έλαια ως το "θαυματουργό φάρμακο" (παυσίπονο, αντιφλεγμονώδες, για δερματικές παθήσεις, κυστίτιδες, για αρθριτικούς πόνους, για αυξημένη ενδοκρανιακή πίεση, ακόμη και ως αντικαρκινικό φάρμακο, π.χ. βλ. [Αναφ. 8α,β]).
Κατά κανόνα, όσο μια ουσία διαφημίζεται ως "θαυματουργό φάρμακο", τόσο θα πρέπει να αυξάνονται οι επιφυλάξεις και κυρίως οι προφυλάξεις. Βιβλία και φυλλάδια-ύμνοι για το DMSO άρχισαν να εκδίδονται (κυρίως στις ΗΠΑ), ενώ άρχισε να ανθεί ένα είδος παραεμπορίου σκευασμάτων του, αφού το ίδιο δεν είχε ακόμη εγκριθεί. Στο σημείο αυτό παρενέβησαν οι Κρατικές Υπηρεσίες Ελέγχου Φαρμάκων, όπως η FDA (Food and Drug Administration) στις ΗΠΑ.
To 1963, η FDA χαρακτήρισε το DMSO ως "νέο υπό εξέταση φάρμακο" (investigational new drug, IND), ωστόσο το 1965 απαγορεύτηκαν τα πειράματα στους ανθρώπους για λόγους ασφαλείας. Οι οπαδοί του DMSO κατηγόρησαν την FDA ότι σκόπιμα αντιτίθενται στη χρήση του, επειδή ήταν ένα φθηνό "φάρμακο" (ανάλογα με το H2O2 και το EDTA), το οποίο δεν θα εξασφάλιζε κέρδη στις μεγάλες φαρμακοβιομηχανίες [Αναφ. 8γ].
 Κατά τα επόμενα 15 χρόνια, η
FDA "χαλάρωσε"
σταδιακά αυτές τις απαγορεύσεις.
'Ενας από τους λόγους ανησυχίας της
FDA ήταν η γενικευμένη
και ανεξέλεγκτη χρήση του DMSO βιομηχανικής ποιότητας (μικρής σχετικά
καθαρότητας, που προορίζεται ως διαλυτικό χρωμάτων κ.α.), το οποίο εύκολα
θα μπορούσε να εισάγει στον οργανισμό τοξικές προσμίξεις. Από το 1980,
η FDA προχώρησε σε άρση κάθε απαγόρευσης
στην έρευνα των φαρμακευτικών εφαρμογών του DMSO.
Κατά τα επόμενα 15 χρόνια, η
FDA "χαλάρωσε"
σταδιακά αυτές τις απαγορεύσεις.
'Ενας από τους λόγους ανησυχίας της
FDA ήταν η γενικευμένη
και ανεξέλεγκτη χρήση του DMSO βιομηχανικής ποιότητας (μικρής σχετικά
καθαρότητας, που προορίζεται ως διαλυτικό χρωμάτων κ.α.), το οποίο εύκολα
θα μπορούσε να εισάγει στον οργανισμό τοξικές προσμίξεις. Από το 1980,
η FDA προχώρησε σε άρση κάθε απαγόρευσης
στην έρευνα των φαρμακευτικών εφαρμογών του DMSO.
Το 1987, σε κλινική του Cleveland (Οχάιο, ΗΠΑ) σε μελέτη που πραγματοποιήθηκε σε 213 ασθενείς με φλεγμονές του ουροποιητικού συστήματος δόθηκαν ημερήσιες δόσεις DMSO. Οι ερευνητές διαπίστωσαν στατιστικώς σημαντική βελτίωση της φλεγμονής και συμπέραναν ότι το DMSO, θα μπορούσε να αποτελέσει αντιφλεγμονώδη ουσία με φαρμακευτική εφαρμογή σε περιπτώσεις ασθενών που δεν θεραπεύονται με τις συνηθισμένες φαρμακευτικές αγωγές. Το 1978, η FDA αναγνωρίζει το DMSO ως φάρμακο για ασθενείς πάσχοντες από διάμεση κυστίτιδα (interstitial cystitis), μια ασθένεια της ουροδόχου κύστης.
Το 2009 εγκρίθηκε από την FDA ένα νέο αντιφλεγμονώδες φαρμακευτικό σκεύασμα (ήδη κυκλοφορεί και στην Ελλάδα) με το εμπορικό όνομα Pennsaid (Penetrating NSAID: Non-Steroidal Anti-inflammatory Drug) στο οποίο αξιοποιούνται οι "διεισδυτικές" ιδιότητες του DMSO για τη μεταφορά της δραστικής ουσίας μέσω του δέρματος. Πρόκειται για ένα διάλυμα 1,5% του μετά νατρίου άλατος της δικλοφενάκης (Diclofenac, βλ. Χημική ένωση του μήνα: Ακετυλοσαλικυλικό οξύ), ενός δραστικού αντιφλεγμονώδους μη-στεροειδούς φαρμάκου, σε διάλυμα 45,5% DMSO. Το σκεύασμα αυτό χορηγείται κυρίως για τη θεραπεία της οστεοαρθρίτιδας [Αναφ. 8ε,στ].
Κτηνιατρικές χρήσεις. Το DMSO, πέραν της χρήσης του ως διαλύτης άλλων δραστικών φαρμακευτικών ουσιών, θεωρείται απλά ως ένα ήπιο αντιφλεγμονώδες φάρμακο. Μια αποδεκτή χρήση του DMSO στην κτηνιατρική είναι ως χρίσμα (liniment), δηλ. ως υγρό για επαλείψεις, για τη θεραπεία φλεγμονών και πόνων από τραυματισμούς στα άλογα [Αναφ. 8ζ,η].
Μηχανισμός δράσης και αντιοξειδωτική δράση του DMSO. Ο μηχανισμός δράσης του DMSO δεν έχει διευκρινισθεί πλήρως. Μελέτες έχουν δείξει ότι κατά πάσα πιθανότητα οι αναλγητικές ιδιότητές του οφείλονται στο μπλοκάρισμα των ινών C των περιφερικών νεύρων. 'Εχουν προταθεί κάποιοι μηχανισμοί που ερμηνεύουν την αντιφλεγμονώδη δράση του. Φαίνεται ότι δρα ως αντιοξειδωτικό, το οποίο εξουδετερώνει τις ελεύθερες ρίζες που συσσωρεύονται στο σημείο βλάβης των ιστών. Σταθεροποιεί τις μεμβράνες των φθαρμένων κυττάρων και επιβραδύνει ή διακόπτει τη διαρροή ουσιών μέσω αυτών. Ωστόσο, η δράση αυτή δεν επεκτείνεται σε περιπτώσεις κυτταρικών βλαβών, που οφείλονται σε μολύνσεις ή σε όγκους [Αναφ. 9].
|
Τα πειράματα που απαιτούσε η FDA (απλές και διπλές τυφλές δοκιμασίες) παρουσίαζαν κάποιες πρακτικές δυσκολίες ποθ οφείλονταν στο ίδιο το DMASO. Oι ασθενείς στους οποίους γινόταν χρήση σκευάσματος με DMSO ή το εικονικό φάρμακο (placebo), ήταν αδύνατον να μην γνωρίζουν τι τους χορηγήθηκε, όπως απαιτεί το πρωτόκολλο αυτών των δοκιμασιών, αφού όσοι λάμβαναν σκεύασμα DMSO ανέπτυσσαν τη χαρακτηριστική σκορδώδη γεύση και οσμή στο στόμα. Η οσμή αυτή εμφανιζόταν και στην εκπνοή των ασθενών και γινόταν αντιληπτή και από τους ιατρούς-εξεταστές, οπότε και στην περίπτωση αυτή παραβιαζόταν το πρωτόκολλο των δοκιμασιών, που επέβαλλε να μην γνωρίζουν και οι ιατροί σε ποιους ασθενείς είχε χορηγηθεί σκεύασμα με DMSO [Αναφ. 6β]. Οι τέσσερις φάσεις (φάσεις Ι - ΙV) δοκιμών ενός νέου φαρμάκου έχουν περιγραφεί συνοπτικά αλλού (Χημική ένωση του μήνα: Ταξόλη). Στη φάση ΙΙ, διεξάγονται οι ελεγχόμενες κλινικές μελέτες κατά τις οποίες οι ασθενείς χωρίζονται σε δύο τυχαιοποιημένες ομάδες ασθενών. Στην πρώτη ("ομάδα πειραματισμού") χορηγείται το υπό δοκιμασία φάρμακο και στη δεύτερη ("ομάδα ελέγχου") χορηγείται εικονικό φάρμακο (placebo). Κατά τη φάση αυτή εκτιμάται η αποτελεσματικότητα του φαρμάκου επί ορισμένης ένδειξης (ή ενδείξεων) σε ασθενών, με την υπό εξέταση ασθένεια ή κατάσταση. Οι κλινικές δοκιμές πραγματοποιούνται με δύο τρόπους: Ως απλές ή διπλές τυφλές δοκιμασίες. Στις απλές τυφλές δοκιμασίες (single-blind tests) οι ασθενείς δεν γνωρίζουν αν ανήκουν στην ομάδα δοκιμής ή στην ομάδα ελέγχου. Αντίθετα, οι ιατροί γνωρίζουν σε ποια ομάδα ανήκει ο ασθενής. Στις δοκιμασίες αυτές υπάρχει πάντοτε το ενδεχόμενο ο ιατρός άθελά του (ή και σκόπιμα, π.χ. αν υπάρχει κάποιο οικονομικό όφελος) να εισάγει μια υποκειμενική προκατάληψη (subjective bias) στην όλη δοκιμασία. Αυτό αποφεύγεται με τον επόμενο "αυστηρότερο" τρόπο δοκιμασιών. Στις διπλές τυφλές δοκιμασίες (double-blind tests), τόσο οι ασθενείς, όσο και ιατροί δεν γνωρίζουν αν ανήκουν στην ομάδα ελέγχου ή στην ομάδα πειραματισμού, αποφεύγοντας έτσι την υποκειμενική προκατάληψη και από τις δύο πλευρές. Μόνο μετά την καταγραφή των δεδομένων και των παρατηρήσεων (ή ακόμα και μετά τη στατιστική ανάλυσή τους) οι ιατροί μαθαίνουν ποιος ανήκει πού. Η στατιστική ανάλυση εξετάζει αν υπάρχει σημαντική διαφορά ως προς ορισμένα χαρακτηριστικά, όπως κάποιο θεραπευτικό αποτέλεσμα, κάποιο αριθμητικό αποτέλεσμα (π.χ. κάποιος κλινικός δείκτης), απαντήσεις σε ερωτηματολόγια, κ.α., μεταξύ των ομάδων ή όχι. Η συχνότερα χρησιμοποιούμενη στατιστική δοκιμασία σημαντικότητας είναι η δοκιμασία t (Student's t-test). Να σημειωθεί ότι αυτοί οι τρόποι ελέγχου δεν περιορίζονται μόνο σε φαρμακευτικά προϊόντα, αλλά και σε νέα καταναλωτικά αγαθά, όπως καλλυντικά, τρόφιμα, ποτά, ευφραντικά κ.α., όπου συχνά απαιτείται η υποκειμενική γνώμη προσώπων ή ειδικευμένων δοκιμαστών για τα νέα προϊόντα. |
Το DMSO ως κρυοπροστατευτική ουσία
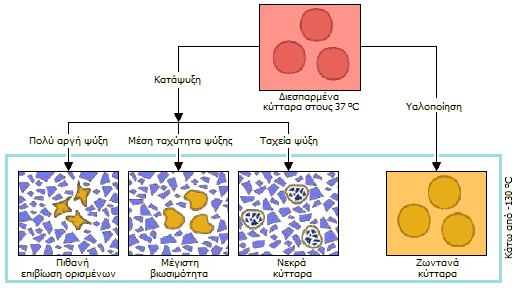
'Οταν ένας ιστός ψύχεται με αργό ρυθμό, μεταξύ των κυττάρων του αναπτύσσονται κρύσταλλοι πάγου. Καθώς η ψύξη συνεχίζεται, τα κύτταρα συντρίβονται μέσα σε θυλάκους πυκνού αλατούχου διαλύματος. Το τελευταίο είναι αποτέλεσμα της πύκνωσης του αρχικού υδατικού διαλύματος, καθώς το νερό μετατρέπεται σε πάγο και απομακρύνεται. Επομένως, η ψύξη ουσιαστικά συντρίβει τα κύτταρα και δεν προκαλεί τη ρήξη τους, όπως πίστευαν παλαιότερα. [Αναφ. 11]
Εδώ και 50 χρόνια διαπιστώθηκε ότι η καταστροφή των κυττάρων κατά την κατάψυξη ιστών θα μπορούσε να μειωθεί σε σημαντικό βαθμό ή και να αποφευχθεί με τη χρήση κρυοπροστατευτικών ουσιών (cryoprotectants). Ως κρυοπροστευτευτικές ουσίες δρουν πυκνά διαλύματα σακχάρων και πολυϋδροξυενώσεων (πολυόλες).
 |
 |
 |
||
| Αριστερά: Κατεψυγμένα κύτταρα κατεστραμμένα σε κρυσταλλωμένο υγρό. Δεξιά: Κατεψυγμένα άθικτα κύτταρα σε υαλοποιημένο κρυοπροστατευτικό μίγμα. | Αριστερά: Κατεψυγμένο - κρυσταλλοποιημένο υγρό. Δεξιά: κατεψυγμένο -υαλοποιημένο υγρό. | Αριστερά: Κατεψυγμένος νεφρός (κατεστραμμένος) σε κρυσταλλωμένο υγρό. Δεξιά: κατεψυγμένος νεφρός (άθικτος) σε υαλοποιημένο υγρό. |
Η κρυοπροστασία στη φύση. Είναι χαρακτηριστικό το ότι ο οργανισμός πολλών ζωικών οργανισμών (έντομα, ψάρια, αμφίβια και ερπετά), που ζουν στις αρκτικές περιοχές, δημιουργεί τις ουσίες αυτές για να μπορέσουν να επιβιώσουν κατά τη χειμερινή περίοδο. Κάποια είδη βατράχων περνούν ημέρες και εβδομάδες με το σώμα τους να έχει μετατραπεί σε πάγο σε ποσοστό μέχρι και 65%. Ορισμένα αμφίβια προστατεύονται χάρις στις ποσότητες γλυκερίνης (ένα γνωστό "αντιψυκτικό") που παράγονται στο συκώτι τους. 'Ενα αρκτικό είδος βατράχου διαθέτει ένα ειδικό τύπο ινσουλίνης, η οποία επιταχύνει την απελευθέρωση γλυκόζης και την προσρόφησή της στο εσωτερικό των κυττάρων του, καθώς καταψύχεται.
 Υαλοποίηση αντί
κρυστάλλωση. Τα υδατικά διαλύματα κρυοπροστατευτικών ουσιών κάνουν το νερό να
σκληρύνει κατά τη ψύξη σαν γυαλί, χωρίς να
σχηματίσει κρυστάλλους οι οποίοι θα κατέστρεφαν
τα κύτταρα. Η διαδικασία αυτή ονομάζεται
υαλοποίηση (vitrification).
Υαλοποίηση αντί
κρυστάλλωση. Τα υδατικά διαλύματα κρυοπροστατευτικών ουσιών κάνουν το νερό να
σκληρύνει κατά τη ψύξη σαν γυαλί, χωρίς να
σχηματίσει κρυστάλλους οι οποίοι θα κατέστρεφαν
τα κύτταρα. Η διαδικασία αυτή ονομάζεται
υαλοποίηση (vitrification).
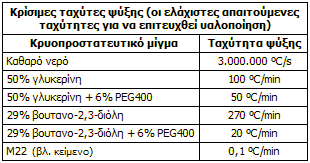
Ο κανόνας είναι ότι όταν ένα υγρό ψύχεται με αργό ρυθμό, τότε σχηματίζει κρυστάλλους. Αντίθετα, αν ψυχθεί με ταχύτατο ρυθμό υπόκειται σε υαλοποίηση. Το ζητούμενο σε μια διαδικασία κατάψυξης ενός ζωικού ιστού ή μια καλλιέργειας κυττάρων είναι η υαλοποίηση του υγρού περιβάλλοντός τους. Για να υαλοποιηθεί το καθαρό νερό θα πρέπει να καταψυχθεί με ανέφικτη ταχύτητα (cooling rate). Αντίθετα, υδατικά διαλύματα κρυοπροστατευτικών ουσιών μπορούν να καταψυχθούν με εφικτές ταχύτητες. Ενδεικτικές κρίσιμες τιμές ταχύτητας ψύξης δίνονται στον παραπλεύρως πίνακα [Αναφ. 11γ].
Κατά την κατάψυξη διαλυμάτων κρυοπροστατευτικών ουσιών, αυτά, καθώς μειώνεται η θερμοκρασία, καθίστανται σταδιακά πιο πυκνόρρευστα μέχρι πλήρους στερεοποίησης, όπως ακριβώς συχνά παρατηρείται με τα σιρόπια και το μέλι τον χειμώνα. 'Ετσι, μπορούν να καταψυχθούν σταδιακά στους π.χ. -100ºC και να στερεοποιηθούν σε μια πλήρως υαλοποιημένη κατάσταση χωρίς την εμφάνιση κρυστάλλων.
Η κατάψυξη πρέπει να είναι ταχύτατη για να επιτευχθεί υαλοποίηση, αλλά πάλι "αστραπιαίες" καταψύξεις πρέπει να αποφεύγονται. 'Οσο μικρότερος είναι ο ρυθμός ψύξης μέχρι την επίτευξη της υαλοποίησης, τόσο ελαχιστοποιούνται οι βλάβες στα ψυχόμενα κύτταρα. Αντίστοιχα, αργός θα πρέπει να είναι και ο ρυθμός επαναφοράς του καταψυχθέντος υλικού σε θερμοκρασία δωματίου. Για κάθε είδος ιστού έχουν καθορισθεί οι μέγιστοι επιτρεπτοί ρυθμοί κατάψυξης και επαναφοράς στις φυσιολογικές θερμοκρασίες.
 |
 |
 |
| Αριστερά: Επίδραση της υαλοποίηση και της κατάψυξη, όπως και της ταχύτητας κατάψυξης πάνω στη βιωσιμότητα των κυττάρων [Αναφ.11ε]. Μέσον: Γενετικό υλικό (germplasm) φυτών συντηρείται επ' αόριστον σε θερμοκρασίες υγρού αζώτου. Δεξιά: Αιμοπετάλια σε διάλυμα 6% DMSO μπορούν να καταψυχθούν στους -80 ºC και να παραμείνουν σε καλή κατάσταση για 2 χρόνια [Αναφ. 11ζ]. | ||
Κρυοπροστατευτικά μίγματα. Το DMSO, όπως και άλλες ουσίες (γλυκερίνη, αιθυλενογλυκόλη, προπυλενογλυκόλη) αποτελεί μια εξαιρετική κρυοπροστατευτική ουσία. Πρόσθετο πλεονεκτήματα του DMSO είναι η ικανότητά του να διέρχεται μέσω των κυτταρικών μεμβρανών πολύ ταχύτερα από τη γλυκερίνη και τις άλλες πολυϋδροξυενώσεις, όπως και η ουσιαστική απουσία τοξικότητας.
Το 1972, έμβρυα (οκτώ κυττάρων) ποντικιών καταψύχθηκαν με επιτυχία σε θερμοκρασίες υγρού αζώτου (σ.ζ. -196ºC) και μετά την επαναφορά τους στη θερμοκρασία δωματίου αναπτύχθηκαν και έγιναν ζωντανά ποντίκια. Αρχικά προστέθηκε γλυκερίνη, ψύχθηκαν σε μια χαμηλή θερμοκρασία και στη συνέχεια προστέθηκε DMSO για να συνεχισθεί η κατάψυξη.
'Εχουν προταθεί διάφορα μίγματα κρυοπροστατευτικών ουσιών (υαλοποιητικά διαλύματα) που διευκολύνουν την υαλοποίηση ιστών και καλλιεργειών κυττάρων. Τυπικό παράδειγμα αποτελεί το διάλυμα υαλοποίησης Μ22 η σύνθεση του οποίου είναι: 22,3% DMSO, 12,9% φορμαμίδιο, 16,8% αιθυλενογλυκόλη, 3% Ν-μεθυλοφορμαμίδιο, 4% 3-μεθοξυ-1,2-προπανοδιόλη, 2,8% πολυβινυλο-πυρρολιδόνη Κ12, Χ-1000 ice bocker 1%, 2% Z-1000 ice blocker (πολυμερείς πολυόλες, όπως η πολυβινυλική αλκοόλη και η πολυγλυκερόλη). Το μίγμα αυτό έχει προταθεί για τη διατήρηση ιστών στις Τράπεζες Ιστών (Tissue banks).
1. (α) Merck Index, 12th ed, σελ. 551. (β) Wikipedia: "Dimethyl sulfoxide". (γ) Gaylord Chemical Company, L.L.C.: "Dimethyll Sulfoxide Physical Properties" (αρχείο PDF, 1,45 MB).
2. (α) Wikipedia: "Alexander Mikhaylovich Zaytsev". (β) David AN: "The Pharmacology of Dimethyl Sulfoxide 6544", Annual Review of Pharmacology 12:353-374, 1972 (Abstract). (γ) Gavrilin MV, Sen'chukova GV, Kompantseva EV: "Structure of Chemical Compounds, Methods of Analysis and Process Control: Method for the Synthesis and Analysis of Dimethyl Sulfoxide (A Review)", Pharmaceutical Chemistry Journal 34(9):490-493, 2000 (Abstract). (δ) Epstein WW, Sweat FW: "Dimethyl Sulfoxide Oxidations", Chemical Reviews 67(3):247-260, 1967 (Abstract). (ε) Wood DC, Wood J: "Pharmacologic and biochemical considerations of dimethyl sulfoxide. Review", Ann NY Acad Sci 243:7-19, 1975 (αρχείο PDF, 821 KB).
3. (α) Wikipedia: "Lignosulfonates". (β) Environmenta Protection Agency (USA): "10.2 Chemical Wood Pulping" (αρχείο PDF, 263 KB). (γ) Gaylord Chemical Company, L.L.C.: "Profile and Capabilities" (αρχείο PDF, 1,51 MB). (δ) Toray Global: "Toray Fine Chemicals and Sinopec Asset Management Corporation to Establish DMSO Production/Sales JV in China", Toray Fine Chemicals Co.,Ltd ,June 2009.
4. (α) Wikipedia: "Trimethylsulfoxonium iodide". (β) Wikipedia: "Johnson-Corey-Chaykovsky reaction". (γ) Wikipedia: "Sodium methylsulfinylmethylide". (δ) Corey EJ, Chaykovsky M: "Μethylsulfinyl Carbanion (CH3-SO-CH2-). Formation and Application to Organic Synthesis", JACS 87(6):1345-1353, 1965 (Abstract). (ε) Corey EJ, Chaykovsky M: "Dimethyloxosulfonium Methylide ((CH3)2SOCH2) and Dimethylsulfonium Methylide ((CH3)2SCH2). Formation and Application to Organic Synthesis", JACS 87(6):1353-1364, 1965 (Abstract). (στ) Corey EJ, Chaykovsky Μ: "Methylenecyclohexane Oxide [Octane, 1-oxaspiro[2.5]-]", Organic Syntheses, Coll. Vol. 5, p.755, 1973; Vol. 49, p.78, 1969.
5. (α) Luisiana State University (Macromolecular Studies Group): "Dipole Moment". (β) Wikipedia: "Protic Solvent". (γ) Carlston RC, Schibier MM, Schnepple: "Solution growth of mercuric iodide crystals from dimethylsulfoxide-based solvent systems", Materials Research Bulletin 11(8):959-966, 1976 (Abstract). (δ) Wikipedia: "Dichlorotetrakis(dimethyl sulfoxide) ruthenium(II)". (ε) Gaylord Chemical Company, L.L.C.: "Dimethyl Sulfoxide (DMSO) solubility data", Bulletin #102B, Oct. 2007 (αρχείο PDF, 1,17 ΜB). (στ) Gaylord Chemical Company, L.L.C.: "Dimethyl Sulfoxide (DMSO), a Dipolar, Aprotic Reaction Solvent ", Bulletin #123B, Oct. 2007 (αρχείο PDF, 632 KB). (ζ) Gaylord Chemical Company, L.L.C.: "Microelectronic Applications Using DMSO (Dimethyl Sulfoxide)", Bulletin #165B, Feb. 2008 (αρχείο PDF, 1,02 MB). (η) Kvakovszky G,Artie McKim A, Moore J: "A Review of Microelectronic Manufacturing Applications Using DMSO-Based Chemistries", www.electrochem.org, (αρχείο PDF, 214 KB).
6. (α) McKim AS, Strub R: "Dimethyl Sulfoxide USP, PhEur in Approved Pharmaceutical Products and Medical Devices", Pharmaceutical Technology (pharmtech.com), 2007 (αρχείο PDF, 452 KB). (β) Muir M: "DMSO: Many Uses, Much Controversy", DMSO Background Literature. (γ) Kerr A: "DMSO, A new drug has startling effects on a wide gamut of ills and aches", Life Magazine, July 1964 (Google e-books). (δ) Walker M: "DMSO: Nature's healer", 1993 (Google e-books). (ε) Jacob SW, Herschler R: "Pharmacology of DMSO (background literature)" (DMSO.org), Cryobiology 23:14-27, 1986. (στ) Gaylord Chemical Company, L.L.C.: "Dimethyl Sulfoxide (DMSO) Health Effects Information", Bulletin #106, Oct. 2007 (αρχείο PDF, 738 KB). (ζ) Shirley SW, Stewart BH, Mirelman S: "Dimethyl sulfoxide in treatment of inflammatory genitourinary disorders", Urology 11(3):215-220, 1978. (η) Thumm W, Freitag D, Kettrup A: "Determination and quantification of dimethyl sulphoxide by HPLC", Chromatographia 32(9-10):461-462, 1991 (Abstract). (θ) Takeuchi A, Yamamoto S, Narai R, Nishida M, Yashiki M, Sakui N, Namera A: "Determination of dimethyl sulfoxide and dimethyl sulfone in urine by gas chromatography–mass spectrometry after preparation using 2,2-dimethoxypropane", Biomedical Chromatography 24(5):465-471, 2010 (Abstract).
7. (α) Glindemann D, Novak JT, Witherspoon J: "Aeration tank odour by dimethyl sulphoxide (DMSO) waste in sewage", Water Sci Technol. 55(5):319-326, 2007 (Abstract). (β) Glindemann D,Novak J,Witherspoon J: "Dimethyl Sulfoxide (DMSO) Waste Residues and Municipal Waste Water Odor by Dimethyl Sulfide(DMS): the North-East WPCP Plant of Philadelphia", Environ. Sci. Technol., 40(1):202-207, 2006 (Abstract).
8. (α) Fasting.ws: "Dimethyl Sulfoxide (DMSO) for Cancer Treatment". (β) CancerTutor.com: "DMSO - The Magic Bullet For Cancer". (γ) Kennedy R: "DMSO as a Solvent", The Doctors' Medical Library, 2002. (δ) Colucci M, Maione F, Bonito MC, Piscopo A, Di Giannuario A, Pieretti S: "New insights of dimethyl sulphoxide effects (DMSO) on experimental in vivo models of nociception and inflammation", Pharmacological Research 57:419-425, 2008 (PubMed). (ε) www.pennsaid.com: "The next generation topical NSAID with a known and effective penetration enhancer". (στ) www.drugs.com: "FDA Approves Pennsaid", Nov. 2009. (ζ) www.horses-and-horse-information.com: "Information on Dimethyl Sulfoxide (DMSO) Treatments for Horses", 2000. (η) Hillidge CJ: "The case for dimethylsulfoxide (DMSO) in equine practice", Equine Vet. J. 17:259, 1985. (θ) Santos NC, Figueira-Coelho J, Martine-Silva J, Saidanha C: "Multidisciplinary utilization of dimethyl sulfoxide: pharmacological, cellular, and molecular aspects. Review", Biochem Pharmacol 65:1036-1041, 2003 (PubMed).
9. (α) Rosenblum WI, El-Sabban F: "Dimethyl sulfoxide (DMSO) and glycerol, hydroxyl radical scavengers, impair platelet agrregation within and eliminate the accompanying vasodilation of, injured mouse pial arterioles", Stroke 13:35-39, 1982 (PubMed). (β) Kennedy AR, Symons MC: " 'Water structure' versus 'radical scavenger' theories as explanations for the suppressive effects of DMSO and related compounds on radiation-induced transformation in vitro", Carcinogenesis 8:683-688, 1987 (PubMed). (γ) Beilke MA, Collins-Lech C, Sohnie PG: "Effects of dimethyl sulfoxide on the oxidative function of human neutrofils", J Lab Clin Med 110:91-96, 1987 (PubMed). (δ) Ramoutar RR, Brumaghim JL: "Antioxidant and anticancer properties and mechanisms of inorganic selenium, oxo-sulfur, and oxo-selenium compounds. Review", Cell Biochem Biophys 58:1-23, 2010 (PubMed).
10. (α) Shuttleworth M: "Double-Blind Experiment", Experiment-resources.com, 2008. (β) Wikipedia: "Blind experiments". (γ) WikiHow: "How to Conduct a True Experiment".
11. (α) Wikipedia: "Cryoprotectant". (β) Best B (www.benbest.com): "Vitrification in Cryonics". (γ) Best B (www.benbest.com): "Physical Parameters of Cooling in Cryonics". (δ) www.alcor.org: "New Cryopreservation Technology", 2005. (ε) Martinenaite E, Tavenier J (Roskilde University): "Cryonics", Dec. 2010 (αρχείο PDF, 960 KB). (στ) Lee DH, Blajchman MA: "Platelet Substitutes and Novel Methods of Platelet Preservation", Chapter 70 in Alan D. Michelson: "Platelets", 2nd ed., p. 1297 (Google books). (ζ) Hochi S, Akiyama M, Minagawa G, Kimura K, Hanada A: "Effects of Cooling and Warming Rates during Vitrification on Fertilization of in Vitro-Matured Bovine Oocytes", Cryobiology 42(1):69-73, 2001 (Abstract).
|
Αποποίηση ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες. Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα Χημείας επικυρώνει ή καθ' οιονδήποτε τρόπο αποδέχεται το περιεχόμενό τους. |