Οι μέχρι σήμερα
Η χημική ένωση του
μήνα
[Δεκέμβριος
2009]
Επιμέλεια σελίδας:
Θανάσης Βαλαβανίδης, Καθηγητής
-
Κωνσταντίνος
Ευσταθίου, Καθηγητής
|
Φυσικoχημικές ιδιότητες
[Αναφ. 1]:
Εμφάνιση:
Κιτρινωπό αέριο ή
υποπράσινο υγρό,
με εξαιρετικά καυστική οσμή παρόμοια με εκείνη του χλωρίου, αντιληπτή σε
συγκεντρώσεις 0,02 ppm.
Μοριακός τύπος:
ClF3
Σχετική μοριακή μάζα:
92,448
Σημείο βρασμού: 11,75 ºC
Σημείο τήξης:
-76,34 ºC
Πυκνότητα:
1,77 g/cm3 (ως
υγρό στους 13 ºC)
Διαλυτότητα
στο νερό: αντιδρά βίαια
Σε οργανικούς
διαλύτες: αντιδρά βίαια
Τοξικότατη και από τις πλέον
επικίνδυνες στο χειρισμό χημικές ουσίες.
Εξαιρετικά καυστική και ερεθιστική ουσία για τα μάτια και το δέρμα.
Σε συγκεντρώσεις 50
ppm στον αέρα θεωρείται θανατηφόρο για τον
άνθρωπο, ενώ σε συγκεντρώση 1,17 ppm (εισπνοή
6 ώρες την ημέρα, 5 ημέρες την εβδομάδα, για 6 μήνες) προκαλεί σοβαρό
ερεθισμό στους πνεύμονες και πνευμονίες σε πειραματόζωα
[Αναφ. 1γ]
Ανώτερο όριο
έκθεσης:
0,1 ppm
|
 |
|
Τριφθοριούχο
χλώριο
Chlorine
trifluoride
|
"...
για την
αντιμετώπιση αυτής της κατάστασης, πάντοτε συνιστούσα ένα καλό ζευγάρι
παπουτσιών δρομέα"
(Dr. John Clark -ειδικός σε καύσιμα
πυραύλων-, αναφερόμενος στην
περίπτωση διαρροής της ουσίας αυτής)
Το τριφθοριούχο χλώριο θα μπορούσε να χαρακτηριστεί
ως το "υγρό πυρ" των νεότερων χρόνων
|

Otto Ruff (1871-1939).
Γερμανός χημικός, υπήρξε Καθηγητής της Χημείας στο
Πανεπιστήμιο του Danzig. Παρασκεύασε και
μελέτησε το 1929 το
ClF3. |
Γενικά για το τριφθοριούχο
χλώριο
Το τριφθοριούχο χλώριο (chlorine
trifluoride, ClF3) είναι
ένα ιδιαίτερα επικίνδυνο αέριο το οποίο υγροποιείται εύκολα προς ένα εξαιρετικά πτητικό
υποπράσινο υγρό (σ.ζ.
11,75 ºC), με
πνιγηρή έως καυστική οσμή, ανάλογα με τον βαθμό υδρόλυσής του από την υγρασία προς υδροφθόριο και χλώριο. Σε καθαρή κατάσταση έχει πιο ήπια οσμή,
όμως δεν είναι μια ουσία θα πρέπει κάποιος να δοκιμάσει την οσμή της. Είναι
εξαιρετικά δραστικό οξειδωτικό αντιδραστήριο και μέσο φθορίωσης.
Λόγω της ισχυρότατης οξειδωτικής δράσης του δοκιμάστηκε από τους Γερμανούς κατά
τον Β' Παγκόσμιο Πόλεμο ως συστατικό εμπρηστικών βομβών, αλλά φαίνεται πως
τελικά ποτέ δεν
χρησιμοποιήθηκε.
Το ClF3
είναι μια από τις πλέον επικίνδυνες χημικές
ενώσεις,
από εκείνες που μόνο σε ειδικώς εξοπλισμένα εργαστήρια μπορούν να
παρασκευασθούν ή να χρησιμοποιηθούν.
Προκαλεί
φοβερά εγκαύματα και πληγές στο δέρμα. Οι τοξικές του
ιδιότητες έχουν συνδυασθεί με την υδρόλυσή του σε υδροφθόριο, χλώριο και διοξείδιο του χλωρίου, ουσίες τοξικές και διαβρωτικές. Χαρακτηριστικό είναι ακόμη το
γεγονός ότι πέραν της εκρηκτικής του αντίδρασης με το νερό και με κάθε οργανικό υλικό, κατακαίει ανόργανα υλικά που θεωρούνται άκαυστα
ή πυρίμαχα,
όπως το τσιμέντο και ο αμίαντος.
Αναφέρεται βιομηχανικό ατύχημα κατά
το οποίο ποσότητα 900 kg ClF3, που
χύθηκε, "κατέκαψε" και διαπέρασε πλάκα τσιμέντου πάχους 30
cm και στρώμα χαλικιού
πάχους 90 cm.
Παρασκευή του τριφθοριούχου
χλωρίου
 |
 |
|
Αριστερά: Εξαρτήματα από κράμα Monel.
Ένα εξαιρετικά ανθεκτικό στη διάβρωση κράμα
(67% Ni - 30%
Cu - μικρές ποσότητες Fe και άλλων μετάλλων), από τα λίγα υλικά που μπορούν να αντέξουν στην
οξειδωτική δράση του φθορίου και των δραστικών ενώσεών του. Δεξιά:
Ράβδοι και πλάκα από το εξαιρετικά αδρανές υλικό
Kel-F. |
Παρασκευάστηκε για πρώτη φορά το 1928 από τον
ειδικό στη χημεία του φθορίου Γερμανό χημικό Otto
Ruff (1871-1939)
[Αναφ. 2].
Η σύνθεση του ClF3
βασίζεται στην
απ' ευθείας αντίδραση φθορίου και χλωρίου στους 280 ºC,
σε δοχείο από κράμα
Monel (κράμα Ni-Cu).
Ως δοχείο αντίδρασης μπορεί να
χρησιμοποιηθεί και ένα σχετικά ακριβό πολυμερές υλικό,
το πολυ(χλωροτριφθοροαιθυλένιο) [-CF2CFCl-]n
(PCTF), γνωστό με την εμπορική ονομασία
Kel-F. Το πολυμερές αυτό έχει
παρόμοια χημική αδράνεια με το πολυ(τετραφθοροαιθυλένιο), το γνωστό
Teflon, αλλά διαθέτει πολύ
καλύτερες μηχανικές ιδιότητες.
Cl2
+ 3F2
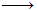 2ClF3,
ΔΗ = -159 kJ/mol (298 K)
2ClF3,
ΔΗ = -159 kJ/mol (298 K)
Παραπροϊόντα
της αντίδρασης είναι το μονοφθοριούχο χλώριο,
ClF (σ.ζ. -100,1 ºC)
και το πενταφθοριούχο χλώριο, ClF5 (σ.ζ.
-13,1 ºC),
από τα οποία απαλλάσσεται εύκολα με απόσταξη.
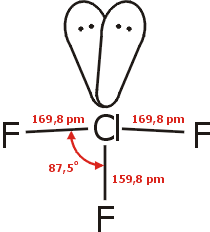
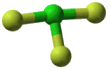
Δομή του τριφθοριούχου χλωρίου
Η δομή του μορίου του ClF3
παρουσιάζει ιδιαίτερο ενδιαφέρον. Πρόκειται για ένα τυπικό υπερσθενές μόριο, με
δέκα ηλεκτρόνια στην εξώτατη στιβάδα του [Αναφ. 4].
Το μόριο του ClF3
έχει σχήμα Τ, ένα μάλλον ασυνήθιστο σχήμα. Το
χλώριο στο ClF3
θεωρείται ότι διαθέτει πέντε ζεύγη ηλεκτρονίων στην εξωτερική στιβάδα του, η οποία
επεκτείνεται με τη χρησιμοποίηση και ενός από τα πέντε κενά 3d-τροχιακά του. Από
αυτά τα ηλεκτρονιακά ζεύγη τρία είναι δεσμικά και σχηματίζουν τους δεσμούς
Cl-F
και δύο είναι μη-δεσμικά "μονήρη" ηλεκτρονιακά ζεύγη.

Το 3s,
τα τρία τροχιακά 3p και ένα από τα 3d
τροχιακά του χλωρίου σχηματίζουν πέντε ισοδύναμα υβριδικά τροχιακά
sp3d
τα οποία
πληρούνται με 7 ηλεκτρόνια από το άτομο του χλωρίου και
3
ηλεκτρόνια από τα άτομα φθορίου (1 από το καθένα)
[Αναφ. 3α].
Τα
μονήρη ηλεκτρονιακά ζεύγη αλληλοαπωθούνται έντονα και διατηρούνται στη μεγαλύτερη δυνατή απόσταση μεταξύ
τους. Η διάταξη στην οποία σταθεροποιείται το μόριο έχει σχήμα τριγωνικής διπυραμίδας. Τα δύο μονήρη
ηλεκτρονιακά ζεύγη καταλαμβάνουν
δύο ισημερινές θέσεις με γωνία 120º
μεταξύ τους. Η διαμόρφωση αυτή προσφέρει τη χαμηλότερη ενεργειακή κατάσταση
για τα ηλεκτρονιακά ζεύγη σε χημικά μόρια. Η δομή συμφωνεί και με τη θεωρία VSPER σύμφωνα με την οποία προτιμάται η δομή που παρέχει μικρότερο αριθμό
αλληλεπιδράσεων 90º μονήρων ζευγών
- δεσμικών ζευγών. Οι αλληλεπιδράσεις των 120º και
180º
είναι πολύ ασθενέστερες των 90º.
Δεδομένου ότι οι απωστικές δυνάμεις μεταξύ των μονήρων ηλεκτρονιακών ζευγών
είναι ισχυρότερες από εκείνα που σχηματίζουν τους δεσμούς Cl-F, τα δύο άτομα F
των κορυφών της διπυραμίδας δεν βρίσκονται σε ευθεία με το άτομο Cl, αλλά
σχηματίζουν γωνία 175º. Στη δομικά παρόμοια ένωση BrF3, η απόκλιση από την
ευθεία είναι λίγο μεγαλύτερη και η αντίστοιχη γωνία είναι 172,4º
[Αναφ. 1β, 3β].
|
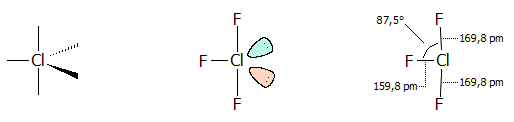
Αριστερά:
Βασική δομή της τριγωνικής διπυραμίδας. Μέσον: Η δομή
σχήματος Τ του ClF3,
όπου δείχνεται ότι δύο ισημερινές θέσεις καταλαμβάνονται από τα
μονήρη ηλεκτρονιακά ζεύγη. Δεξιά: Η πραγματική δομή του ClF3,
όπου διακρίνεται η απόκλιση από τις 90º
των δύο γωνιών F-Cl-F του ισημερινού F με τα
F των κορυφών. |
 |
 |
 |
|
Ο αμίαντος (ινώδες
πυριτικό ορυκτό), που θεωρείται ως εξαιρετικό υλικό πυροπροστασίας
"κατακαίγεται" σε ατμόσφαιρα ClF3. |
Αντιδράσεις του τριφθοριούχου χλωρίου
[Αναφ. 3β]
Το ClF3 θεωρείται ως μία από τις πιο
δραστικές γνωστές χημικές ενώσεις. Αποτελεί ισχυρότατο οξειδωτικό μέσον, όπως και
εξαιρετικό αντιδραστήριο φθορίωσης. Στην ουσία μπορεί να θεωρηθεί ως μια κάπως "πιο
εύχρηστη" μορφή στοιχειακού φθορίου. Μάλιστα, σε υγρή κατάσταση (σ.ζ. 11,75 ºC) αποδεικνύεται δραστικότερο και από το
υγρό φθόριο, αφού το τελευταίο θα πρέπει να βρίσκεται σε πολύ χαμηλότερη
θερμοκρασία
(σ.ζ.
-188,12 ºC). Κατακαίει
ακαριαία κάθε οργανικό υλικό, αλλά ακόμα και ανόργανα υλικά που
θεωρούνται χημικώς αδρανή. 'Ετσι, προκαλεί ανάφλεξη στον αμίαντο και στο
τσιμέντο.
Η δραστικότητα του ClF3 έναντι αυτών των
ανόργανων υλικών, οφείλεται στην ισχυρότατη δέσμευση
των
μεταλλικών ιόντων (π.χ. Ca, Al) προς σχηματισμό των αντίστοιχων φθοριούχων
αλάτων.
Οι αντιδράσεις αυτές διαλύουν πλήρως τον σκελετό των αργιλικών αλάτων των υλικών
αυτών, τα οποία έτσι κονιοποιούνται. Εξ αιτίας των μεγάλων ποσών της
εκλυόμενης θερμότητας, τα κονιοποιημένα φθορίδια αφίπτανται πυρακτωμένα δίνοντας
την αίσθηση πραγματικής φλόγας. Το φθόριο σχηματίζει με το πυρίτιο τη σταθερή αέρια ένωση SiF4.
Αυτό βοηθά και στην αποσύνθεση των πυριτικών αλάτων, τα οποία αποτελούν τον κρυσταλλικό
σκελετό του αμίαντου και αναπόφευκτα καθιστά την άμμο (SiO2)
ακατάλληλη για την κατάσβεση πυρκαγιών που προκαλούνται από το ClF3.
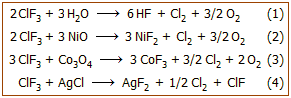
Το ClF3
αντιδρά εκρηκτικά με οργανικές ενώσεις και ο μόνος
τρόπος εισαγωγής κάποιου ελέγχου των αντιδράσεων φθορίωσης των οργανικών ενώσεων είναι η αραίωσή του ως αερίου με κάποιο αδρανές αέριο ή
ως υγρού με υγρούς υπερφθοριωμένους
υδρογονάνθρακες, τις μόνες οργανικές ενώσεις με τις οποίες αντιδρά δύσκολα.
Το
ClF3
αντιδρά εκρηκτικά με το νερό παρέχοντας κυρίως υδροφθόριο και χλώριο
(αντίδραση 1), με παράλληλο σχηματισμό -ανάλογα με τις συνθήκες- φθοριούχου
χλωρίου, υδροχλωρίου, ενώσεων φθορίου-χλωρίου-οξυγόνου και οξειδίων του χλωρίου. Από την
αντίδραση προκύπτει ότι όχι μόνο δεν εξουδετερώνεται η τοξικότητα και η
επικινδυνότητα του αερίου από το νερό, αλλά σχηματίζονται ακόμη μεγαλύτεροι
όγκοι επίσης καυστικών και τοξικών αερίων.
Αντιδρά με
κάθε μεταλλικό οξείδιο και άλας, παρέχοντας φθοριούχα άλατα των μετάλλων στην
ανώτερη δυνατή βαθμίδα οξείδωσής τους (αντιδράσεις 2-4). Αντιδρά με
δύστηκτα οξείδια (π.χ. MgO, CaO, Al2O3,
MnO2, Ta2O5,
MoO3),
ακόμη και με εκείνα τα οποία, μετά τη πυράκτωσή τους είναι εξαιρετικά
δύσκολο να διαλυθούν σε πυκνά οξέα ή βάσεις.
Αντιδρά ακαριαία με αμέταλλα (Β, P, S, As, Sb, S, Se,
Te) σχηματίζοντας πτητικά φθορίδια και χλωρίδια. Αντιδρά με μέταλλα, είτε αυτά είναι δραστικά (Na, Mg, Al, Zn), είτε μικρότερης
δραστικότητας (Fe, Sn, Ag), είτε ακόμη σχεδόν αδρανή (Mo, W) ή ευγενή (Ir,
Rh), εφόσον αυτά βρίσκονται σε μορφή σκόνης. Σε υψηλή θερμοκρασία αντιδρά με Pt και Αυ, ενώ
διαπιστώθηκε ότι μπορεί να φθοριώσει άμεσα τα ευγενή αέρια Xe και Rn.
 Το καθαρό ClF3
δεν επιδρά στην ύαλο Pyrex ή στον χαλαζία (καθαρό SiO2), παρουσία
όμως ιχνών υγρασίας σχηματίζει HF,
το οποίο προκαλεί μια αργή διάβρωση και στα υλικά αυτά.
Το καθαρό ClF3
δεν επιδρά στην ύαλο Pyrex ή στον χαλαζία (καθαρό SiO2), παρουσία
όμως ιχνών υγρασίας σχηματίζει HF,
το οποίο προκαλεί μια αργή διάβρωση και στα υλικά αυτά.
Σε θερμοκρασία δωματίου, το ClF3,
αν και ισχυρότατο οξειδωτικό,
μπορεί να έρθει σε επαφή με συμπαγή μέταλλα, εφόσον στην επιφάνειά τους έχει
προηγουμένως σχηματιστεί ένα λεπτό και συνεκτικό προστατευτικό
στρώμα φθοριούχου άλατος. Αυτό επιτρέπει την αποθήκευση του ClF3
σε δοχεία
και κυλίνδρους κατασκευασμένα από μαλακό χάλυβα, νικέλιο
ή κράμα Monel. Γενικά, η διαδικασία σχηματισμού προστατευτικού στρώματος σε
μεταλλικές επιφάνειες (εδώ από
φθορίδια, σε άλλες περιπτώσεις από οξείδια) είναι γνωστή ως παθητικοποίηση
(passivation). Ρήξη του προστατευτικού στρώματος των φθοριδίων σε δοχεία που
περιέχουν ClF3,
π.χ. από μηχανικά αίτια ή απότομες αλλαγές της θερμοκρασίας, μπορεί να οδηγήσει σε
ανεξέλεγκτη αντίδρασή του με το υλικό των δοχείων.
To ClF3
μπορεί να δράσει ως δότης ιόντων φθορίου (βάση Lewis) (αντιδράσεις 5, 6), αλλά
και ως δέκτης ιόντων φθορίου (οξύ Lewis) (αντιδράσεις 7, 8). Η μικρή αγωγιμότητά
του υποδεικνύει ότι υπόκειται σε μια ισορροπία διάστασης (αντίδραση 9).
|
Παθητικοποίση μεταλλικών επιφανειών
|

Λουτρό
ηλεκτρολυτικής παθητικοποίησης χαλύβδινων αντικειμένων |
Ως παθητικοποίηση (passivation)
ορίζεται η διεργασία που καθιστά ένα υλικό "παθητικό" ως προς ένα άλλο, πριν
έρθουν σε επαφή. Συνηθέστερη περίπτωση αποτελεί η παθητικοποίηση μετάλλων με
σχηματισμό προστατευτικού στρώματος οξειδίου, το οποίο προστατεύει το
μέταλλο από περαιτέρω οξείδωση. Σε πολλές περιπτώσεις η παθητικοποίηση
πραγματοποιείται αυθόρμητα (π.χ. το αλουμίνιο δεν απαιτεί κάποια ιδιαίτερη
επεξεργασία και πάντοτε καλύπτεται από ένα αόρατο στρώμα οξειδίου του), ενώ σε
άλλες περιπτώσεις πραγματοποιείται μέσω επίδρασης ενός οξειδωτικού οξέος (π.χ.
ΗΝΟ3)
ή με ηλεκτρολυτική επεξεργασία (ανοδίωση).
Η παθητικοποίηση χαλύβδινων φιαλών
έναντι του τριφθοριούχου χλωρίου
είναι μια ιδιαίτερα κρίσιμη διεργασία. Κάθε τετραγωνικό εκατοστό επιφάνειάς τους
πρέπει να καλυφθεί με ένα ανθεκτικό και συνεκτικό στρώμα φθοριούχου άλατος, που
θα προστατέψει το μέταλλο από τη δραστικότατη διαλογονική ένωση.
Η παθητικοποίηση πραγματοποιείται με
έκθεση των επιφανειών σε αέριο μίγμα F2 και
αδρανούς αερίου (Ν2 ή
He). Η μερική
πίεση του μίγματος σε F2 αυξάνεται σταδιακά, έως ότου το αέριο αποτελείται
κατά 100% από F2 υπό την πίεση λειτουργίας του συστήματος. Η σταδιακή αύξηση
της περιεκτικότητας σε F2 πρέπει να γίνεται με βραδύ ρυθμό, ώστε να
αποφευχθεί η θέρμανση των επιφανειών, γεγονός που θα οδηγούσε σε ελαττωματική
και ανασφαλή παθητικοποίηση.
|
Γενικά για τις διαλογονικές ενώσεις
[Αναφ. 3]
Τα αλογόνα μπορούν να ενωθούν εξώθερμα μεταξύ
τους και να σχηματίσουν διαλογονικές (interhalogen)
ενώσεις. Οι ενώσεις αυτές έχουν τους γενικούς τύπους: ΧΥ, ΧΥ3,
ΧΥ5 και ΧΥ7,
όπου Χ είναι το βαρύτερο (λιγότερο
ηλεκτραρνητικό) από τα δύο αλογόνα. Επίσης είναι γνωστές και ορισμένες τριαδικές
ενώσεις, όπως π.χ. IFCl2
και
IF2Cl.
Στον επόμενο πίνακα
αναφέρονται οι διαλογονικές ενώσεις που έχουν παρασκευασθεί μέχρι σήμερα, όπως
και λίγα πράγματα για τη σύνθεσή τους και τις ιδιότητές τους.
|
XY |
'Εχουν φυσικοχημικές ιδιότητες
ενδιάμεσες των δύο αλογόνων. Ομοιοπολικός δεσμός με ελαφρύ ιοντικό
χαρακτήρα.
Το λιγότερο ηλεκτροαρνητικό έχει μερικό θετικό φορτίο. Όλοι
οι συνδυασμοί είναι γνωστοί, δεν είναι όμως όλες οι ενώσεις σταθερές. |
 |
|
ClF |
'Αχρωμο αέριο, εξαιρετικά
σταθερό. Συμπυκνώνεται σε
ανοικτοκίτρινο υγρό κάτω από τους
-100ºC. Ισχυρό αντιδραστήριο
φθορίωσης. Υδρολύεται από το νερό: Η2Ο + 2 ClF
 2
HF + Cl2O.
Εμπορικώς διαθέσιμη ένωση σε
χαλύβδινες φιάλες των 500 g. 2
HF + Cl2O.
Εμπορικώς διαθέσιμη ένωση σε
χαλύβδινες φιάλες των 500 g. |
|
BrF |
Δεν έχει ληφθεί ποτέ καθαρό. Η παρουσία του ευνοείται σε υψηλή θερμοκρασία, ενώ σε θερμοκρασία
δωματίου
διασπάται εύκολα σύμφωνα με την αντίδραση: 3
BrF
 BrF3
+ Br2
ή 5 BrF
BrF3
+ Br2
ή 5 BrF
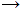 BrF5
+ 2 Br2
BrF5
+ 2 Br2 |
|
IF |
Ασταθές, διασπάται εύκολα
σύμφωνα με την αντίδραση: 5 ΙF
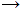 ΙF5
+ 2 Ι2.
ΙF5
+ 2 Ι2. |
|
ClBr |
Σκοτεινόχρωμο ερυθρό αέριο, σ.ζ. -5 ºC. Δεν μπορεί να
ληφθεί ποτέ καθαρό και απαλλαγμένο από Br2 και Cl2. |
|
ICl |
Ερυθροί κρύσταλλοι, σ.τ. 27,2 ºC. 'Οταν τακεί παρέχει σκοτεινόχρωμο
ερυθρό υγρό (σαν το υγρό βρώμιο), αποπνικτικής οσμής με σ.ζ.
97-100ºC. Υπόκειται σε ισορροπία
διάστασης: 2
ICl
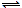 I2Cl+ + ICl2-.
I2Cl+ + ICl2-. |
|
IBr |
Σκοτεινόχρωμοι ερυθροί
κρύσταλλοι, σ.τ. 42 ºC και
σ.ζ.
116 ºC. Αν και σταθερότερο από το
ClBr, κατά τον βρασμό υπόκειται
σε μερική διάσπαση στα συστατικά του. Υπόκειται σε ισορροπία
διάστασης: 2
IBr
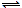 I2Br+ + IBr2-.
I2Br+ + IBr2-. |
|
XY3 |
Λαμβάνονται με απ' ευθείας ένωση των
συστατικών, αλλά σε συνθήκες που δεν ευνοούν το σχηματισμό
διαλογονικών
ενώσεων άλλων στοιχειομετριών. |
 |
|
ClF3 |
'Αχρωμο αέριο, συμπυκνούμενο προς υποπράσινο υγρό, λευκό στη στερεά κατάσταση, σ.τ.
-76,34 ºC,
σ.ζ. 11,75 ºC. Το μόριό του έχει σχήμα
ελαφρά παραμορφωμένου Τ. Μια από τις πιο δραστικές
γνωστές χημικές ενώσεις. Αντιδρά οξειδωτικά και πιο έντονα σε σχέση με
το καθαρό φθόριο. Εμπορικώς διαθέσιμη ένωση ως υγροποιημένο αέριο σε χαλύβδινους
κυλίνδρους. |
|
BrF3 |
Κιτρινοπράσινο υγρό,
σ.τ. 8,8 ºC και σ.ζ. 125,8 ºC.
Δομικά παρόμοιο με το ClF3.
Υπόκειται σε
ισορροπία διάστασης: 2 BrF3
 BrF2+
+ BrF4-
γεγονός που καθιστά το υγρό ηλεκτρικά αγώγιμο.
Εμπορικώς διαθέσιμη ένωση, χρησιμοποιείται στην οργανική σύνθεση ως
δραστικό αντιδραστήριο φθορίωσης.
BrF2+
+ BrF4-
γεγονός που καθιστά το υγρό ηλεκτρικά αγώγιμο.
Εμπορικώς διαθέσιμη ένωση, χρησιμοποιείται στην οργανική σύνθεση ως
δραστικό αντιδραστήριο φθορίωσης. |
|
IF3 |
Κίτρινο στερεό, σταθερό μόνο κάτω από τους
-28 ºC (η ασταθέστερη διαλογονική
ένωση). Σε υψηλότερες θερμοκρασίες διασπάται προς το σταθερότερο IF5.
Παρασκευάζεται με αντίδραση F2
με Ι2 διαλυμένο σε CCl3F
(freon-11) στους -45 ºC ή μέσω της
αντίδρασης I2 + XeF2
 2IF3
+ Xe,
σε χαμηλή θερμοκρασία. 2IF3
+ Xe,
σε χαμηλή θερμοκρασία.
|
|
ICl3/I2Cl6 |
Κίτρινο
στερεό, σ.τ. 101 ºC
(υπό πίεση 16 atm). Παρασκευάζεται με αντίδραση Ι2
με περίσσεια υγρού Cl2
στους -80
ºC. Σε στερεά κατάσταση υφίσταται ως διμερές Ι2Cl6
(επίπεδο μόριο). Η σχετικώς μεγάλη ηλεκτρική αγωγιμότητά του
αποτελεί ένδειξη ότι υπόκειται σε ισορροπία διάστασης:
Ι2Cl6
 ICl2+ + ICl4- ICl2+ + ICl4- |
|
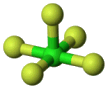
XY5 |
Οι μόνες ενώσεις που είναι
γνωστές έχουν Y = F. Εξαιρετικά δραστικά αντιδραστήρια φθορίωσης.
'Ολων τα μόρια έχουν δομή
τετραγωνικής πυραμίδας, με το Χ στο κέντρο της τετραγωνικής βάσης της. |
 |
|
ClF5 |
'Αχρωμο αέριο,
σ.τ. -103 ºC και σ.ζ. -13,1 ºC.
Παρασκευάζεται με αντίδραση Cl2
με περίσσεια F2 στους 350 ºC
και πίεση 250 atm. Αντιδρά εκρηκτικά με το νερό και τα περισσότερα
μέταλλα και αμέταλλα. |
|
BrF5 |
'Αχρωμο, ατμίζον
υγρό, σ.τ. -60,5 ºC και σ.ζ. 41,3 ºC.
Παρασκευάζεται με αντίδραση Br2
με περίσσεια F2 σε θερμοκρασίες μεγαλύτερες από 150 ºC
και πίεση 250 atm. Αντιδρά εκρηκτικά με το νερό και τα περισσότερα
μέταλλα και αμέταλλα. |
|
IF5 |
'Αχρωμο έως υποκίτρινο υγρό, σ.τ. 9,4
ºC και σ.ζ. 104,5 ºC
και πυκνότητα 3,25 g/cm3.
Η πρώτη διαλογονική ένωση αυτού του τύπου, που παρασκευάσθηκε με απ' ευθείας ένωση των
συστατικών της σε θερμοκρασία δωματίου (1871). Σε σχέση με τα
προηγούμενα, πιο ήπιο αντιδραστήριο φθορίωσης. Εμπορικώς διαθέσιμη
ένωση σε χαλύβδινους κυλίνδρους. Η μικρή ηλεκτρική αγωγιμότητά του
αποτελεί ένδειξη ότι υπόκειται σε ισορροπία διάστασης:
2 ΙF5
 IF4+ + IF6-
IF4+ + IF6- |
|
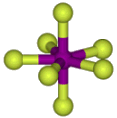
XY7 |
Η μόνη γνωστή ένωση αυτού του τύπου είναι
το IF7. |
 |
|
IF7 |
'Αχρωμο αέριο. Στερεό στους 6,5 ºC (τριπλό σημείο), εξαχνώνεται
στους 4,8 ºC (1 atm).
Παρασκευάζεται με αντίδραση του Ι2
με περίσσεια F2 στους 250-300 ºC. Θεωρείται ότι έχει
δομή πενταγωνικής διπυραμίδας και είνα η μόνη γνωστή δυαδική ένωση με
αυτήν τη δομή. |
Η σχετική δυναμικότητας φθορίωσης των διαφόρων
φθοριούχων διαλογονικών ενώσεων ακολουθεί τη σειρά: ClF3 > BrF5 > IF7 > ClF
> BrF3 > IF5 > BrF > IF3 > IF
 Παλαιότερες
χρήσεις
του τριφθοριούχου χλωρίου
Παλαιότερες
χρήσεις
του τριφθοριούχου χλωρίου
Πολεμικές εφαρμογές. Το ClF3
εντυπωσίασε τους επιστήμονες
λόγω της εξαιρετικής οξειδωτικής και φθοριωτικής του
ικανότητας. Είχαν συνθέσει μια τόσο καταστρεπτική ουσία, που μπορούσε
κυριολεκτικά να κατακάψει κάθε οικοδομικό υλικό, οργανικό (ξύλο) ή ανόργανο
(τσιμέντο, τούβλα). Η σύνθεση του ClF3
συνέβη κατά την εποχή του μεσοπολέμου, όταν η
Ναζιστική Γερμανία κρυφά ή φανερά προετοιμαζόταν για τον Δεύτερο Παγκόσμιο Πόλεμο. Επόμενο
ήταν η πρώτη εφαρμογή του να έχει πολεμικό χαρακτήρα και πράγματι δοκιμάστηκε ως
συστατικό εμπρηστικών βομβών [Αναφ. 1α].
|

Προωθητήρας RS-10 της Rocketdyne |
Στο
Kaiser Wilhelm Institute της Ναζιστικής Γερμανίας, το
ClF3
δοκιμάστηκε με την κωδική
ονομασία N-stoff (ουσία Ν), εναντίον ομοιωμάτων των οχυρών της Γραμμής Μαζινό.
Διαπιστώθηκε ότι συνδύαζε "άριστα" εμπρηστικές και τοξικές ιδιότητες.
Αποφασίστηκε η παραγωγή ClF3
με ρυθμό 50 τόνων/μήνα, σε ένα υπόγειο
εργοστάσιο κατασκευής πολεμικού υλικού (Bunker
Falkenhagen, [Αναφ. 5]).
Προς το τέλος του πολέμου
(1944), όταν το εργοστάσιο
αυτό κατελήφθη από τον
προελαύνοντα Ερυθρό Στρατό, η μέχρι τότε συνολική παραγωγή της ουσίας
ήταν μόνο 30 έως 50 τόνοι. Προφανώς οι Γερμανοί το θεώρησαν εξαιρετικά
επικίνδυνο και για τους ίδιους και φαίνεται ότι ποτέ δεν χρησιμοποιήθηκε κατά τη
διάρκεια του πολέμου.
Ως προωθητικό πυραύλων. Κατά τα τέλη της
δεκαετίας του 1950 το τριφθοριούχο χλώριο (όπως και ένα πλήθος πολλών "εξωτικών"
χημικών ενώσεων) δοκιμάστηκε ως οξειδωτικό σε
υπεργολικά προωθητικά (hypergolic propelants) πυραύλων. To
ClF3
δοκιμάστηκε σε συνδυασμό με την υδραζίνη, Ν2Η4
(και παράγωγά της)
ή και παραφίνες (κηροζίνη, κυρίως δωδεκάνιο) στους προωθητήρες RS-19 της Boing/Rocketdyne
[Αναφ. 6]. Η αντίδραση καύσης έχει ως
εξής:
Ν2Η4
+ 4/3 ClF3
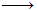 4
HF + N2
+ 2/3
Cl2
4
HF + N2
+ 2/3
Cl2
Η παραγωγή ClF3
στις ΗΠΑ ήταν τότε 12 έως 15 τόνοι ετησίως και θα μπορούσε να αυξηθεί στους 50 έως
100 τόνους, εφόσον αυτή η ουσία αποδεικνυόταν αποτελεσματική. Ωστόσο,
αν και το
ClF3
αποδείχθηκε εξαιρετικά
αποτελεσματικό ως οξειδωτικό, η διαβρωτική δράση των προϊόντων της αντίδρασης (HF,
Cl2), σε
συνδυασμό με την επικινδυνότητα του ίδιου και τη δυσκολία ασφαλούς αποθήκευσής
του, φαίνεται πως τελικά υπήρξαν αξεπέραστα εμπόδια για την εφαρμογή αυτή.
|

video
Στοo παραπάνω
βίντεο παρου-σιάζεται ένα πείραμα "αυτοανά-φλεξης" του υπεργολικού
μίγματος (Ν2Ο4
- ανιλίνης). |
Υπεργολικά προωθητικά υλικά
Ο όρος "υπεργολικό υλικό" εμφανίζεται
στη Γερμανία κατά τη δεκαετία του 1930, όταν πραγματοποιούνταν τα πρώτα
πειράματα εκτοξεύσεων πυραύλων. Η κατάληξη "-ergol" προέρχεται από τη ελληνική
λέξη "έργον" και τη λατινική "oleum"(λάδι). Ως υπεργολικά (hypergols)
χαρακτηρίζονται δυαδικά προωθητικά (οξειδωτικό - αναγωγικό), που φυλάσσονται
χωριστά και μόλις έρθουν σε επαφή αναφλέγονται, εκλύοντας μεγάλους όγκους
αερίων, χωρίς να χρειαστεί κάποια διαδικασία ανάφλεξης. Το
πλέον χρησιμοποιούμενο υπεργολικό προωθητικό στη
διαστημική τεχνολογία είναι ο συνδυασμός του οξειδωτικού N2O4
(σ.ζ. 21 ºC)
και της υδραζίνης και ειδικότερα του παραγώγου της, της ασύμμετρης διμεθυλοϋδραζίνης (unsymmetrical
dimethylhydrazine, UDMH). Τα προϊόντα της
αντίδρασης είναι πρακτικώς απαλλαγμένα από διαβρωτικά αέρια:
(CH3)2NNH2
+ 2 N2O4
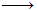 2
CO2 + 3 N2
+ 4 H2O
2
CO2 + 3 N2
+ 4 H2O
Ως μονοεργολικά (monoergols) ή
ως μονοπροωθητικά (monoprpelants) χαρακτηρίζονται μίγματα
οξειδωτικού-αναγωγικού, τα οποία μπορούν να φυλαχθούν στον ίδιο χώρο με σχετική
ασφάλεια. Για να αρχίσει η μεταξύ τους αντίδραση χρειάζεται κάποια εναρκτήρια
ανάφλεξη (π.χ. κάποιος σπινθήρας). Τυπικό παράδειγμα αποτελεί το μίγμα NH4ClO4
- Al, που χρησιμοποιείται στους αρχικούς προωθητήρες ισχύος (boosters) των
πυραύλων διαστημοπλοίων
(βλ. Χημική ένωση του μήνα:
Υπερχλωρικό οξύ και άλατά του). |
|
Τι αναφέρει ένας ειδικός στα καύσιμα
πυραύλων για το τριφθοριούχο χλώριο [Αναφ. 7]
 Ο
Dr. John Clark (1907-1999), χημικός, ειδικός σε θέματα καυσίμων πυραύλων,
στο βιβλίο του "Ignition! An Informal History of Liquid Rocket Propellants",
(Rutgers University Press, 1972), αναφέρει χαρακτηριστικά σε δύο σημεία για το
ClF3: Ο
Dr. John Clark (1907-1999), χημικός, ειδικός σε θέματα καυσίμων πυραύλων,
στο βιβλίο του "Ignition! An Informal History of Liquid Rocket Propellants",
(Rutgers University Press, 1972), αναφέρει χαρακτηριστικά σε δύο σημεία για το
ClF3:
"...Κατά την εποχή των υγρών
προωθητικών πυραύλων, συνέβη ένα σοβαρό ατύχημα, όταν για πρώτη φορά ένα δοχείο
από χάλυβα χωρητικότητας ενός τόνου συμπληρώθηε με υγρό ClF3
για μεταφορά. Το δοχείο είχε ψυχθεί με ξηρό πάγο (στερεό CO2)
για να γίνει ασφαλέστερη η
μεταφορά του υγροποιημένου αερίου, αφού η πίεση των ατμών του ClF3 είναι μόλις 0,007 kg/cm2
(0,1 psia) σε κατεψηγμένη κατάσταση. Ωστόσο, η κατάψυξη σε ξηρό πάγο κατέστησε το
χαλύβδινο δοχείο εύθραυστο και καθώς μεταφερόταν σε μια
πλατφόρμα, το δοχείο άνοιξε στα δύο. 907 κιλά ψυχρού ClF3
χύθηκαν στο δάπεδο του κτηρίου. Το δάπεδο, μια πλάκα από τσιμέντο πάχους 30 cm,
όπως και ένα στρώμα από χαλίκι
πάχους 90 cm κάτω από την τσιμεντένια πλάκα, διαλύθηκαν.
|

Συνιστώνται σε
περίπτωση διαρροής του ClF3. |
Οι ατμοί που βγήκαν (ClF3,
HF, Cl2,
HCl κ.α.) διαβρώσανε οτιδήποτε βρισκόταν στον χώρο. 'Ενας
αυτόπτης μάρτυρας περιέγραψε λακωνικά το γεγονός ως εξής: 'το
τσιμέντο είχε πάρει φωτιά!' "
"...Πράγματι, είναι εξαιρετικά τοξικό, αλλά αυτό είναι το μικρότερο πρόβλημα. Με
οποιοδήποτε καύσιμο γίνεται υπεργολικό. Ταχύτατο υπεργολικό, σε σημείο που δεν
ήταν ποτέ δυνατόν να μετρηθεί κάποια καθυστέρηση στην ανάφλεξη. Καθίσταται υπεργολικό ακόμη και σε επαφή με τα ρούχα, το ξύλο, αλλά και με τους
ίδιους τους μηχανικούς που το
δοκιμάζουν. Ας μην αναφερθώ στο ότι αντιδρά εκρηκτικά με τον αμίαντο, την άμμο
και το νερό. Μπορεί να αποθηκευτεί σε δοχεία από κάποια κοινά κατασκευαστικά
υλικά, χάλυβα, χαλκό, αλουμίνιο κ.α. επειδή σχηματίζει ένα λεπτό στρώμα
αδιάλυτου φθοριούχου άλατος, όπως ακριβώς το αόρατο οξείδιο του αργιλίου, το
οποίο δεν
επιτρέπει στο αλουμίνιο να καεί στην ατμόσφαιρα. Eάν
όμως, αυτό το "κάλυμμα"
λιώσει ή αποξεστεί και δεν του δοθεί η ευκαιρία να επανασχηματιστεί, ο χειριστής
έχει να αντιμετωπίσει πλέον πυρκαγιά φθορίου - μετάλλου. Για την αντιμετώπιση αυτής
της κατάστασης, πάντοτε συνιστούσα ένα καλό ζευγάρι
παπουτσιών δρομέα..."
|
Σύγχρονες
χρήσεις
του τριφθοριούχου χλωρίου
|

Τυπική μορφή ράβδων
πυρηνικών καυσίμων. |
Το ClF3
(όπως και το BrF3)
χρησιμοποιείται ως εναλλακτικό και ασφαλέστερο μέσο φθορίωσης αντί του ίδιου του
φθορίου. Θεωρείται καταλληλότερο σε σχέση με το καθαρό F2
επειδή υγροποιείται πολύ πιο εύκολα (σ.ζ. 11,75 ºC) και έτσι διακινείται σε υγρή
μορφή πολύ ασφαλέστερα από ό,τι το υγρό φθόριο (σ.ζ. -188,12 ºC). Πάντως, σε
κάθε περίπτωση το ClF3
(όπως και το ίδιο το φθόριο) είναι μια εξαιρετικά επικίνδυνη χημική ουσία, την
οποία μπορεί να χειριστεί ειδικά εκπαιδευμένο προσωπικό και μόνο σε κατάλληλα
εξοπλισμένους χώρους. Το ClF3,
όπως και το F2
δεν έχουν καμία θέση σε χημικό εργαστήριο, αν το εργαστήριο δεν έχει
κατασκευαστεί ειδικά για τη χρήση αυτών των ουσιών.
Επεξεργασία πυρηνικών καυσίμων. Μετά
τον Β' Παγκόσμιο Πόλεμο το ClF3
χρησιμοποιήθηκε και χρησιμοποιείται ακόμη σε ποσότητες εκατοντάδων ή και χιλιάδων τόνων ετησίως
για την επεξεργασία πυρηνικών καυσίμων και κυρίως για την παρασκευή του UF6.
Το UF6
είναι πτητική ένωση και με τη μορφή αυτή το φυσικό ουράνιο εισάγεται σε φυγοκεντρικούς
ή άλλου τύπου διαχωριστήρες για τον εμπλουτισμό του σε U-235, για την
παραγωγή πυρηνικών
καυσίμων, ή για την απομόνωση καθαρού U-235,
για πυρηνικά όπλα
(βλ. Χημική ένωση του μήνα: Εξαφθοριούχο
ουράνιο).
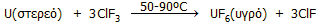
To ClF3
χρησιμοποιείται επίσης για τον διαχωρισμό του πλουτωνίου από το ουράνιο, στα
προϊόντα της πυρηνικής σχάσης (χρησιμοποιημένα πυρηνικά καύσιμα). Αντιδρά με το
U και το Pu παρέχοντας UF6
και PuF4, τα οποία διαχωρίζονται εύκολα, αφού το
πρώτο μόνο από αυτά τα φθορίδια είναι πτητικό.
|
 |
 |
|
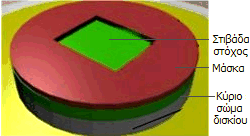
Aριστερά: Κλίβανος ελεγχόμενης
εισαγωγής προσμίξεων σε δισκία (wafers) πυριτίου με τη μέθοδο CVD.
Δεξιά:
Καθαρισμός επιφάνειας με εφαρμογή πλάσματος συνεχούς.
|
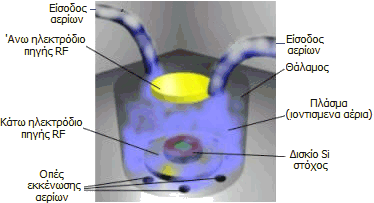
Στη βιομηχανία
ημιαγωγών υλικών.
Κατά τη βιομηχανική παρασκευή
των ημιαγωγών και ολοκληρωμένων κυκλωμάτων με τη μέθοδο απόθεσης μέσω χημικού ατμού
(Chemical Vapour
Deposition,
CVD), η απόθεση των υλικών
πάνω στο υπόστρωμα πυριτίου (δισκίο
πυριτίου, silicon wafer)
πραγματοποιείται σε κλιβάνους ελεγχόμενης (χαμηλής) πίεσης και θερμοκρασίας.
Στους θαλάμους αυτούς εισάγονται αεριώδεις ενώσεις των επιθυμητών προσμίξεων
(υδρίδια Si, P, πτητικές οργανομεταλλικές ενώσεις) οι οποίες διασπώνται ή
αντιδρούν με προηγούμενες αποθέσεις στο δισκίο πυριτίου. 'Ετσι επιτυγχάνεται η
ελεγχόμενη εισαγωγή προσμίξεων (doping) στο πυρίτιο που θα δράσουν ως n- ή
p-φορείς ηλεκτρικού ρεύματος ή ως μονωτές, όπως και τα απαραίτητα μονωτικά φιλμ.
Αναπόφευκτα η όλη
διαδικασία συνoδεύεται και από ανεπιθύμητες αποθέσεις στα τοιχώματα του
κλιβάνου, τα οποία θα πρέπει περιοδικά να απαλλάσσονται από αυτές τις αποθέσεις
[Αναφ. 8].
Για τον καθαρισμό των τοιχωμάτων, οι κλίβανοι αποσυναρμολογούνται και
εισάγονται σε χώρους που περιέχουν
αέριες χημικώς αδρανείς φθοριούχες ενώσεις όπως το NF3,
CF4
και C2F6.
Στους χώρους αυτούς, υπό την επίδραση ισχυρού ηλεκτρικού πεδίου δημιουργείται
πλάσμα, δηλαδή ένα αέριο στο
οποίο βρίσκονται σε ελεύθερη μορφή ηλεκτρικά φορτισμένα ατομικά σωματίδια (ιόντα
και ηλεκτρόνια). Στη θερμοκρασία του
πλάσματος τα προηγούμενα αέρια παρέχουν δραστικά σωματίδια φθορίου, όπως ρίζες F και CF3,
οι οποίες αντιδρούν με τις αποθέσεις-ακαθαρσίες και τις απομακρύνουν.
Τα τελευταία
χρόνια διαπιστώθηκε ότι το ClF3 μπορεί χρησιμοποιηθεί
για τον ίδιο σκοπό, χωρίς ωστόσο να χρειάζεται ενεργοποίηση μέσω σχηματισμού
πλάσματος. To ClF3 δρα ταχύτερα και
μπορεί να χρησιμοποιηθεί σε θερμοκρασίες δωματίου. 'Ενα επιπλέον πλεονέκτημα του ClF3,
σε σχέση με τις προαναφερθείσες αέριες φθοριούχες ενώσεις, είναι το ότι δεν
συμβάλλει στο φαινόμενο "θερμοκηπίου", αφού η εύκολη υδρόλυσή του δεν επιτρέπει
τη συσσώρευσή του στην
ατμόσφαιρα.
Προφυλάξεις
κατά τη χρήση του τριφθοριούχου
χλωρίου
Τοξικότητα. Το
ClF3
είναι εξαιρετικά τοξική ένωση ακόμη και σε πολύ μικρές συγκεντρώσεις στον αέρα. Ως ανώτερο όριο έκθεσης έχει καθοριστεί το 0,1 ppm (OSHA-PEL-ceiling
limit). Σε αέρια κατάσταση είναι καυστικό για το δέρμα, τους βλεννογόνους και προκαλεί επώδυνα
εγκαύματα. Ανάλογα με την έκθεση, τα εγκαύματα αυτά (στην ουσία πρόκειται για εγκαύματα υδροφθορίου) μπορεί να μην είναι άμεσα
ορατά ή αισθητά [Αναφ. 10].
Αν υπάρχει υποψία έκθεσης θα πρέπει να ακολουθηθεί η ίδια αγωγή
που παρέχεται σε περιπτώσεις έκθεσης σε ατμούς υδροφθορίου (χορήγηση αντιόξινων,
που περιέχουν ασβέστιο και γάλακτος).
Η οσμή του ClF3,
παρόμοια με του χλωρίου, μπορεί να γίνει αντιληπτή σε συγκέντρωση 0,02 ppm.
|
ΠΡΟΣΟΧΗ στο υδροφθόριο:
Τα εγκαύματα που προκαλεί
μπορεί να είναι θανάσιμα!
 |
|
|
Αριστερά:
Σωληνάρια με το ειδικό αντίδοτο για το υδροφθόριο (H-F antidote gel).
Δεξιά:
Σοβαρό έγκαυμα από πυκνό διάλυμα
υδροφθορίου [Αναφ. 11γ] |
Το υδροφθόριο ως αέριο, ως
υγροποιημένο αέριο (σ.ζ. 19,5 ºC) και ως πυκνό υδατικό διάλυμα
(υδροφθορικό οξύ) είναι μια ιδιαίτερα επικίνδυνη χημική ουσία, πολύ πιο επικίνδυνη
από τα άλλα υδραλογόνα (π.χ. το HCl) και τα αντίστοιχα πυκνά υδατικά διαλύματά τους. Οι κύριοι λόγοι
είναι:
α) Το HF είναι ασθενές οξύ (pKHF
= 3,15) γεγονός το
οποίο σημαίνει ότι βρίσκεται κυρίως στη μοριακή του μορφή και επομένως διεισδύει
ευκολότερα και βαθύτερα στο δέρμα, προκαλώντας επώδυνα βαθειά εγκαύματα, και από
εκεί εισέρχεται στην κυκλοφορία του αίματος.
β) Τα ιόντα φθορίου είναι ιδιαίτερα
τοξικά (σε αντίθεση με τα ανιόντα των άλλων αλογόνων) διότι δεσμεύουν το
ασβέστιο του οργανισμού προς δυσδιάλυτο CaF2.
Το
γεγονός αυτό οδηγεί σε υπερκαλιαιμία (τα ιόντα καλίου αυξάνονται για να συμπληρώσουν την απώλεια ιόντων
ασβεστίου). Η υπερκαλιαιμία με τη σειρά της οδηγεί σε
καρδιακή αρρυθμία και ενδεχομένως αιφνίδιο θάνατο.
Έχει εκτιμηθεί ότι αν το δέρμα ενός
ενήλικα έρθει σε επαφή με 7 mL άνυδρου HF και δεν υπάρξει κάποια θεραπευτική
αγωγή, το σύνολο του ελεύθερου ασβεστίου του οργανισμού θα δεσμευθεί. 'Ετσι το
HF δεν είναι μόνο ένα καυστικό οξύ που καταστρέφει
τοπικά τους ιστούς, αλλά και δραστικότατη τοξική ουσία που εισάγεται στον
οργανισμό από το δέρμα. Θα πρέπει να τονιστεί ότι τo HF είναι και "ύπουλο"
δηλητήριο, επειδή συχνά τα συμπτώματα δηλητηρίασης από αυτό εμφανίζονται με
καθυστέρηση ωρών.
Σε περίπτωση επαφής μεγάλης
επιφάνειας του δέρματος με διάλυμα υδροφθορίου οι πόνοι είναι αφόρητοι, λόγω
ερεθισμού των νευρικών απολήξεων από τις μεγάλες συγκεντρώσεις ιόντων καλίου. Η επέμβαση πρέπει να είναι άμεση. Στα εργαστήρια
και στους χώρους όπου γίνεται χρήση HF, πρέπει να υπάρχει οπωσδήποτε
καταιονιστήρας νερού και να είναι έτοιμα τα ειδικά αντίδοτα, όπως π.χ. ζελέ γλυκονικού ασβεστίου
(κάθε εργαζόμενος πρέπει να έχει ένα σωληνάριο αντιδότου στην τσέπη
του). Κανείς δεν πρέπει να χειρίζεται πυκνά διαλύματα HF, εάν προηγουμένως
δεν έχει ενημερωθεί για την επικινδυνότητα της ουσίας αυτής, όπως και για τις
εξειδικευμένες πρώτες βοήθειες που απαιτούνται σε περίπτωση ατυχήματος [Αναφ. 11].
|
Συμβατότητα με διάφορα
υλικά. Το ClF3
σε συμπυκνωμένη μορφή (π.χ. ως
αέριο σε υψηλές πιέσεις ή ως υγρό) προκαλεί ακαριαία ανάφλεξη σε κάθε
οργανική ένωση με την οποία θα έρθει σε επαφή, όπως και αν έρθει σε επαφή με
ύφασμα, δέρμα, μαλλιά και άσφαλτο. Οι μόνες οργανικές ενώσεις οι οποίες
είναι κάπως συμβατές με το ClF3 είναι οι υπερφθοριωμένοι υδρογονάνθρακες και το
πολυμερές Teflon.
Ωστόσο, και με τις ενώσεις αυτές μπορεί να αντιδράσει κάτω από ορισμένες
συνθήκες (υψηλές θερμοκρασίες και πιέσεις), προκαλώντας πλήρη διάσπαση του
σκελετού άνθρακα και πλήρη φθορίωσή του (άνοιγμα των δεσμών -C-C- με σχηματισμό CF4). Οι αντιδράσεις αυτές θα μπορούσαν να γραφούν ως εξής:
CnF2n+2
+ (2n-2)/3 ClF3
 n
CF4 + (n-1)/3
Cl2
[-CF2CF2-]n + 4n/3
ClF3
n
CF4 + (n-1)/3
Cl2
[-CF2CF2-]n + 4n/3
ClF3
 2n
CF4 + 2n/3
Cl2
2n
CF4 + 2n/3
Cl2
Αντιδρά
εκρηκτικά με το νερό σχηματίζοντας κυρίως υδροφθόριο και χλώριο,
αλλά και
υδροχλώριο, ποικιλία ενώσεων φθορίου-χλωρίου-οξυγόνου και
οξειδίων του χλωρίου. Η άμμος (SiO2)
δεν μπορεί να χρησιμοποιηθεί για την κατάσβεση πυρκαγιών του
προφανώς λόγω της αντίδρασης της με το
ClF3
προς σχηματισμό αερίου SiF4
[Αναφ. 12].
Η αντίδραση θα μπορούσε να είναι η ακόλουθη,
χωρίς όμως να αποκλείεται και ο σχηματισμός σειράς άλλων
προϊόντων:
3 SiO2 +
4 ClF3
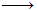 3 SiF4 +
2
Cl2
+ 3
Ο2
3 SiF4 +
2
Cl2
+ 3
Ο2
Σε θερμοκρασίες
μεγαλύτερες από 600 ºC
το ClF3 διασπάται πλήρως στα επιμέρους στοιχεία
που το αποτελούν.
Μη υπερφθοριωμένα πολυμερή δείχνουν μικρή ή
καθόλου αντοχή προς το ClF3.
Πολυμερή υλικά όπως νεοπρένιο, καουτσούκ,
πολυαιθυλένιο και PVC δείχνουν κάποια αντοχή για σύντομες
εκθέσεις, όχι όμως όταν είναι ρυπασμένα με άλλες οργανικές
ενώσεις (π.χ. ορυκτέλαια), οπότε αναφλέγονται ταχύτατα.
Οργανικές ακαθαρσίες ή υπολείμματα απορρυπαντικών, μετά από μια
διαδικασία καθαρισμού, σε επαφή με το ClF3
θα αναφλεγούν και η ανάφλεξή τους μπορεί να επεκταθεί και σε
υλικά που παρουσιάζουν κάποια αντοχή απέναντι της ένωσης αυτής
[Αναφ. 7, 12].
|

(α) |

(β) |
 (γ) (γ) |

(δ) |
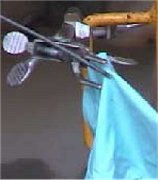 (ε) (ε) |
 (στ) (στ) |
|
(α)-(β): Ωμό κοτόπουλο
(ως προσομοίωση ανθρώπινης σάρκας) αναφλέγεται σε ατμόσφαιρα ClF3.
Κάθε σταγόνα υγροποιημένου ClF3
πάνω στη σάρκα, προκαλούσε μια μικρή έκρηξη.
(γ)-(δ): Σωλήνας πολυαιθυλενίου, παρουσία ακαθαρσιών, αναφλέγεται
μόλις διαβιβαστεί μέσω αυτού ClF3.
(ε)-(στ): Γάντι από νεοπρένιο ρυπασμένο με ορυκτέλαια αναφλέγεται
από ClF3
[Αναφ. 7]. |
Χαρακτηρισμοί επικινδυνότητας χημικών ουσιών
κατά NFPA* [Αναφ. 13]
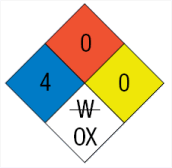
Σύμβολο επικινδυνότητας
του ClF3 |
Υγεία |
Ευφλεκτότητα |
Αστάθεια |
Ειδικό
σύμβολο |
Ειδικός κίνδυνος |
|
0 |
Κανένας κίνδυνος |
0 |
Δεν καίγεται |
0 |
Σταθερό |
 |
|
1 |
Προκαλεί ερεθισμό |
1 |
Σταθερό σε συνήθεις συνθήκες,
ασταθές σε υψηλές θερμοκρασίες |
1 |
Κανονικά σταθερό. Ασταθές σε
υψηλές θερμοκρασίες ή πιέσεις |
|
2 |
Προκαλεί παροδική ανικανότητα ή
βλάβη |
2 |
Πρέπει να θερμανθεί για να
αναφλεγεί |
2 |
Βίαιες χημικές μεταβολές σε
υψηλές θερμοκρασίες ή πιέσεις |
|
3 |
Προκαλεί μόνιμες βλάβες |
3 |
Μπορεί να αναφλεγεί σε κάθε
θερμοκρασία |
3 |
Μπορεί να εκραγεί σε υψηλές
θερμοκρασίες ή κατά την κρούση |
|
4 |
Θανατηφόρο |
4 |
Εξατμίζεται και αναφλέγεται
εύκολα σε συνήθεις θερμοκρασίες |
4 |
Μπορεί να εκραγεί σε συνήθεις
θερμοκρασίες ή πιέσεις |
|
* National Fire Protection Association:
Εθνική Εταιρεία Προστασίας από τις Πυρκαγιές. Ιδιωτικός, μη κερδοσκοπικός
οργανισμός των ΗΠΑ, που παρέχει συμβουλευτικό έργο προς το κοινό για την
προστασία από τις πυρκαγιές. Στις αρμοδιότητές του είναι ο χαρακτηρισμός των
χημικών ουσιών με σήματα σαν το παραπάνω (σύμβολο - "διαμάντι"), που κωδικοποιεί δεδομένα τοξικότητας (toxicity)
σε συνθήκες πυρκαγιάς, ευφλεκτότητας (flammability),
αστάθειας (instability)
και ειδικών κινδύνων (special hazards).
Τα τρία πρώτα χαρακτηρίζονται από έναν αριθμό από το 0 (μηδαμινός κίνδυνος) έως
το 4 (μέγιστος κίνδυνος).
Τυπικά παραδείγματα συμβόλων - "διαμαντιών":
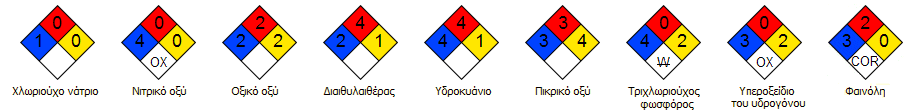
|
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1.
(α)
Wikipedia:
"Chlorine trifluoride"
(http://en.wikipedia.org/wiki/Chlorine trifluoride).
(β) Cotton S (Bristol University: The molecule of the month):
"ClF3-
The "Nasty Nick" of the Chemical World".
(γ) BOC gases (Material Safety Data Sheet): "Product name:
Chlorine trifluoride" (αρχείο
PDF, 36 KB).
2. (α)
Ruff Ο, Ascher Ε: "Über
ein neues Chlorfluorid-ClF3".
Zeitschrift für anorganische und allgemeine Chemie
176(1): 258-270, 1928.
(β) Wikipedia: "Otto
Ruff".
3. (α) Κατάκης Δ, Μεθενίτης Κ,
Μητσοπούλου Χ, Πνευματικάκης Γ: "Ανόργανη Χημεία Β': Τα στοιχεία", Εκδόσεις
Παπαζήση, 2002, σελ. 50-51. (β) Greenwood NN, Earnshaw A: "Chemistry of the
Elements", Pergamon Press, 1st ed. 1984, σελ. 968-973.
4. (α) Wikipedia: "Hypervalent
molecule". (β)
Musher JL: "The Chemistry of
Hypervalent Molecules", Angew. Chem. Int. Ed. Engl., 8:54-68, 1969 (Abstract).
(γ) Gillespie RJ, Silvi B: "The octet rule and
hypervalence: two misunderstood concepts", Coord. Chem. Rev., 233-234:53-62,
2002. (δ) Mitchell TA,
Finocchio D, Kua J: "Predicting the Stability of Hypervalent Molecules", J. Chem.
Educ., 84:629, 2007 (Abstract).
5. (α)
The Falkenhagen Complex. (β) Wikipedia: "Bunker
Falkenhagen".
6. Astronautix.com: "Propellant
Formulation: ClF3/Hydrazine",
"Propellant
Formulation: ClF3/Kerosene".
7. (α) Air Products: "Safetygram 39:
Chlorine Trifluoride" (αρχείο
PDF, 155 KB). (β) Goliath, Business Knoweledge on Demand: "Fluoride
gasses: fluorine can cause stainless steel to burn and chlorine trifluoride sets
fire to human flesh and may explode in the presence of water. The right
techniques must be used to handle these dangerous materials"
(1/5/2004).
8. Semiconductor International: "In
Situ Cleaning of CVD Chambers"
(6/1/1999). (β) Taylor AP, Fruhberger B,
Hogle R: "Interaction
of ClF3 with Metal Alloys and Polymer Gaskets",
Semiconductors International (7/1/1999)
9.
Lagouge Μ: "Microtechnology
- Dry etching".
10. United States
Department of Labor, Occupational Safety & Health Administration (OSHA): "Occupational
Safety and Health Guideline for Chlorine Trifluoride".
11. (α) Air Products: "Safetygram 29:
Treatment Protocol for Hydrofluoric Acid Burns" (αρχείο
PDF, 79 KB). (β) Portland State University: "Hydrofluoric
Acid: Occupational Health and Safety Information".
(γ) The
Νew Εngland Journal of medicine: "Images in clinical medicine:
Hydrofluoric Acid Burn" (αρχείο
PDF, 178 KB). (δ) SP Services:
"HF
Hydrofluoric Acid Antidote Gel".
(ε) Sievert WJ (Honeywell):
"Using Hydrofluoric Acid Safely" (αρχείο
PDF, 3,2 MB).
12. Derec L: "Sand
won't save you this time" (26/2/2008).
13. (α)
National Fire
Protection Association. (β)
NFPA diamond
guide.
|
Αποποίηση
ευθυνών: Έχει καταβληθεί κάθε προσπάθεια για να εξασφαλισθεί η
ορθότητα των πληροφοριών που περιλαμβάνονται σε αυτή τη σελίδα, ωστόσο ο
έχων την επιμέλεια της σελίδας αυτής και το Τμήμα Χημείας δεν αναλαμβάνουν
τη νομική ευθύνη για τυχόν σφάλματα, παραλείψεις ή ανακριβείς πληροφορίες.
Επιπλέον, το Τμήμα Χημείας δεν εγγυάται την ορθότητα των αναφερόμενων σε
εξωτερικές ιστοσελίδες, ούτε η αναφορά μέσω συνδέσμων (links) στις
ιστοσελίδες αυτές, υποδηλώνει ότι το Τμήμα Χημείας επικυρώνει ή καθ'
οιονδήποτε τρόπο αποδέχεται το περιεχόμενό
τους. |
![]() n
CF4 + (n-1)/3
Cl2
[-CF2CF2-]n + 4n/3
ClF3
n
CF4 + (n-1)/3
Cl2
[-CF2CF2-]n + 4n/3
ClF3
![]() 2n
CF4 + 2n/3
Cl2
2n
CF4 + 2n/3
Cl2![]() 3 SiF4 +
2
Cl2
+ 3
Ο2
3 SiF4 +
2
Cl2
+ 3
Ο2









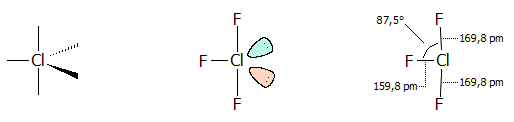



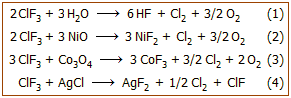
 Το καθαρό ClF3
δεν επιδρά στην ύαλο Pyrex ή στον χαλαζία (καθαρό SiO2), παρουσία
όμως ιχνών υγρασίας σχηματίζει HF,
το οποίο προκαλεί μια αργή διάβρωση και στα υλικά αυτά.
Το καθαρό ClF3
δεν επιδρά στην ύαλο Pyrex ή στον χαλαζία (καθαρό SiO2), παρουσία
όμως ιχνών υγρασίας σχηματίζει HF,
το οποίο προκαλεί μια αργή διάβρωση και στα υλικά αυτά. 







 Ο
Dr. John Clark (1907-1999), χημικός, ειδικός σε θέματα καυσίμων πυραύλων,
στο βιβλίο του "Ignition! An Informal History of Liquid Rocket Propellants",
(Rutgers University Press, 1972), αναφέρει χαρακτηριστικά σε δύο σημεία για το
ClF3:
Ο
Dr. John Clark (1907-1999), χημικός, ειδικός σε θέματα καυσίμων πυραύλων,
στο βιβλίο του "Ignition! An Informal History of Liquid Rocket Propellants",
(Rutgers University Press, 1972), αναφέρει χαρακτηριστικά σε δύο σημεία για το
ClF3:








 (γ)
(γ)
 (ε)
(ε) (στ)
(στ)