Το αιθυλένιο είναι το πρώτο σε
παραγόμενη ποσότητα προϊόν της χημικής βιομηχανίας (πετροχημικό). Σχεδόν στο
σύνολό του
χρησιμοποιείται ως πρώτη ύλη για την
παραγωγή πλήθους άλλων χημικών ουσιών.
 Γενικά
για το αιθυλένιο
Γενικά
για το αιθυλένιο
Το
αιθυλένιο
ή αιθένιο (κατά IUPAC)
(ethylene, ethene) είναι τo απλούστερo αλκένιo (ακόρεστος υδρογονάνθρακας με ένα διπλό δεσμό).
Αποτελεί την πρώτη σε ετησίως παραγόμενες ποσότητες οργανική ένωση (η ετήσια
παγκόσμια παραγωγή αιθυλενίου πλησιάζει τους περίπου 110 εκατομμύρια τόνους). Το αιθυλένιο αποτελεί το κύριο προϊόν της θερμικής διάσπασης
(πυρόλυσης) του ακάθαρτου πετρελαίου, αλλά παράγεται επίσης και με μερική οξείδωση του μεθανίου από το φυσικό αέριο.
Σχεδόν στο σύνολό του,
το αιθυλένιο χρησιμοποιείται ως πρώτη ύλη για την παραγωγή πλήθους χημικών
ενώσεων, που και αυτές με τη σειρά τους χρησιμοποιούνται ως πρώτες ύλες για
την παραγωγή τεράστιας ποικιλίας άλλων χημικών ουσιών. Στη φύση απαντά
κυρίως στα αέρια των πετρελαιοπηγών, αλλά σχηματίζεται επίσης σε πολύ μικρές
ποσότητες κατά την
ωρίμαση διαφόρων καρπών την οποία και επιταχύνει (δρα ως φυτοορμόνη). Ακόμη
παράγεται σε μικρές ποσότητες και από μικροοργανισμούς
Ιστορία του αιθυλενίου
 |
 |
|
Το
αιθυλένιο δεν ήταν γνωστό στην αρχαιότητα σαν ξεχωριστή ουσία,
ωστόσο κάποιες ιδιότητές του έβρισκαν εφαρμογή: Αρχαίοι λαοί
έκαιγαν θυμιάματα για να επιταχύνουν την ωρίμαση φρούτων, ενώ
έχει διατυπωθεί η θεωρία ότι
αέρια που περιείχαν αιθυλένιο και έβγαιναν από γεωλογικά
ρήγματα, "βοηθούσαν" την Πυθία στους Δελφούς στο να βγάλει τους
χρησμούς της. |
Χωρίς βέβαια να αναγνωρισθεί ή να απομονωθεί ως
ξεχωριστή ουσία, το αιθυλένιο ήταν γνωστό από την αρχαιότητα. Είχε
χρησιμοποιηθεί από τους αρχαίους Αιγυπτίους για
την ωρίμαση σύκων και αχλαδιών, αλλά και από τους αρχαίους Κινέζους για την
ωρίμαση αχλαδιών. Οι αρχαίοι αυτοί λαοί εγνώριζαν εμπειρικά ότι καίγοντας στις αποθήκες
φρούτων θυμίαμα μπορούσαν να
επιταχύνουν την ωρίμασή τους. Ακόμη, εικάζεται η παρουσία του αιθυλενίου σε
αέρια που εκλύονταν από σεισμογενή ρήγματα στο Μαντείο των Δελφών. Τα αέρια
αυτά ανέπνεε η
εκάστοτε ιέρεια (η Πυθία) του μαντείου και περιερχόταν σε κατάσταση ημιαναισθησίας και έκστασης [Αναφ. 2].
Το αιθυλένιο φαίνεται ότι παρασκευάσθηκε και
απομονώθηκε για πρώτη φορά από τον Γερμανό αλχημιστή
Johann
Joachim
Becher
(1635-1682), έναν από τους θεμελιωτές της
φλογιστικής θεωρίας, όταν θέρμανε αιθανόλη με θειικό οξύ. Ο
Becher ανέφερε το
αέριο αυτό στο έργο του
Physica Subterranea
(1669).
Στο αιθυλένιο αναφέρεται (χωρίς να του δώσει κάποιο
συγκεκριμένο όνομα) και ο διάσημος φυσιοδίφης και
χημικός του 18ου αιώνα
Joseph Pristley (1733-1804), ο
οποίος είχε μελετήσει και χαρακτηρίσει πλήθος αερίων χημικών ενώσεων.
Οι
ιδιότητες του αιθυλενίου εξετάστηκαν λεπτομερέστερα κατά το 1795 από τους
Ολλανδούς
Johann Rudolph Deiman
(γιατρός),
Adrien Paets van Troostwijk (έμπορος),
Anthoni Lauwerenburg
(χημικός) και
Nicolaas Bondt (βοτανολόγος),
οι οποίοι διαπίστωσαν ότι
ήταν ένα εύφλεκτο αέριο διαφορετικό από το υδρογόνο και ότι περιείχε υδρογόνο και άνθρακα.
Οι τέσσερις αυτοί Ολλανδοί
είχαν συστήσει μια εταιρεία με την επωνυμία
"Gezelschap der Hollandsche Scheikundigen"
(Εταιρεία Ολλανδών Χημικών)
για να προωθήσουν διάφορες
ενώσεις προθήκης του αιθυλενίου, που γενικά αναφέρονταν ως "έλαια", και
ειδικότερα την ένωση προσθήκης του αιθυλενίου με χλώριο, το
1,2-διχλωροαιθάνιο (ClCH2CH2Cl),
το οποίο έγινε γνωστό ως καλός διαλύτης λιπαρών υλών και αναφερόταν σε χημικά συγγράμματα εκείνης της εποχής ως
ολλανδικό έλαιο (Dutch Oil).
Η ιδιότητα του αιθυλενίου να δίνει αυτά τα "έλαια" του έδωσε από εκείνη την
εποχή την ονομασία olefiant gas, που
στα ελληνικά θα μπορούσε να αποδοθεί ως ελαιογόνο αέριο.
Η ονομασία αυτή επεκτάθηκε σε όλους τους υδρογονάνθρακες με ένα διπλό δεσμό,
οι οποίοι έτσι ονομάστηκαν συλλογικά ολεφίνες (olefins).
|
Σημείωση πάνω στην
ονοματολογία των ολεφινών [Αναφ. 3]
Η κατάληξη
-ενιο (-ene) άρχισε να χρησιμοποιείται
για την περιγραφή των ακόρεστων υδρογονανθράκων από τα μέσα του 19ου αιώνα.
Ως προέλευση αναφέρεται η αρχαία Ελληνική, όπου η κατάληξη -ενη είχε το
νόημα "θυγατέρα του". Ανάλογα, οι ολεφίνες θεωρήθηκαν "θυγατρικές" ενώσεις
των κορεσμένων υδρογονάνθρακων από τους οποίους προέρχονται με απόσπαση
υδρογόνου. 'Ετσι, το αιθυλένιο (C2H4),
προέρχεται από τη ρίζα αιθύλιο (C2H5-).
Η ονομασία αιθυλένιο εμφανίστηκε στη χημική ονοματολογία το 1852.
Το 1866,
ο Γερμανός χημικός
August
Wilhelm von Hofmann (1818-1892)
πρότεινε ένα σύστημα
ονοματολογίας των υδρογονανθράκων, το οποίο βασιζόταν στις καταλήξεις
-ane, -ene, -ine,
-one
και -une για να υποδηλώσει υδρογονάνθρακες με 0,
2, 4, 6 και 8 λιγότερα άτομα υδρογόνου στο μόριό τους σε σχέση με το μόριο
του μητρικού αλκανίου. Στο σύστημα αυτό το αιθυλένιο ονομαζόταν πλέον
αιθένιο (ethene).
Στο σύστημα ονοματολογίας
του Hofmann και ειδικότερα ως προς τις καταλήξεις:
-ane, -ene, -ine και όχι ως προς το έλλειμμα υδρογόνων, αλλά ως προς τη φύση του δεσμού
άνθρακα-άνθρακα (απλός, διπλός, τριπλός δεσμός) βασίστηκε η ονοματολογία,
η οποία έγινε
αποδεκτή κατά το Διεθνές Συνέδριο Χημικών το 1892 στη Γενεύη. Η ονοματολογία
αυτή
αποτέλεσε τον πυρήνα της σύγχρονης ονοματολογίας κατά IUPAC.
Ωστόσο, η ονομασία αιθυλένιο έμεινε βαθειά
χαραγμένη στη μνήμη των χημικών και χρησιμοποιείται ακόμη ευρύτατα σήμερα
και ιδιαίτερα στη χημική βιομηχανία.
|
|
Ηλεκτρονιακή
δομή αλκενίων
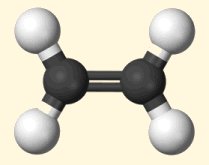
Το
αιθυλένιο
είναι η απλούστερη οργανική
ακόρεστη ένωση και αποτελεί το κλασικό παράδειγμα ένωσης που
χρησιμοποιείται στα μαθήματα χημείας για την περιγραφή της ηλεκτρονιακής
δομής του διπλού δεσμού >C=C<. Αυτό το είδος του δεσμού ερμηνεύεται με βάση
τον υβριδισμό των τροχιακών (orbital hybridization)
[Αναφ. 4].
Στο αιθυλένιο κάθε άνθρακας
διαθέτει 3 τροχιακά sp2 και ένα τροχιακό p. Τα
τροχιακά sp2 είναι αποτέλεσμα υβριδισμού (ανάμιξης) 2
ατομικών τροχιακών p και ενός ατομικού τροχιακού s. Τα τρία
αυτά τροχιακά είναι ισοδύναμα και βρίσκονται στο ίδιο επίπεδο με γωνίες
μεταξύ τους (ιδανικά) 120º.
Το τροχιακό p είναι
κάθετο στο επίπεδο των υβριδικών τροχιακών sp2. Στο σχήμα
ένα (μόνο) από τα 3 sp2 τροχιακά απεικονίζεται με καφέ
χρώμα, ενώ το τροχιακό p απεικονίζεται με ροζ χρώμα.
|
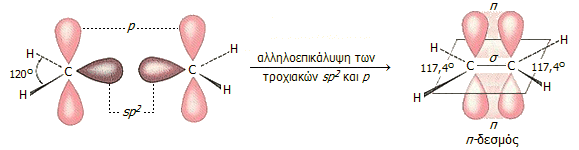
Υβριδισμός sp2 και σχηματισμός διπλού δεσμού. |
Τα δύο άτομα άνθρακα, καθώς
πλησιάζουν μεταξύ του σχηματίζουν ένα δεσμό σ από μετωπική
αλληλεπικάλυψη των τροχιακών sp2 και ένα δεσμό π από
πλευρική αλληλεπικάλυψη των τροχιακών p. Σε αντίθεση με τον δεσμό
σ, ο δεσμός π σχηματίζεται από μικρό ποσοστό αλληλεπικάλυψης και
για να διατηρηθεί αυτό το ποσοστό στη μεγαλύτερη δυνατή τιμή του, τα
τροχιακά p πρέπει να παραμένουν παράλληλα και είναι αδύνατη η
περιστροφή γύρω από τον κεντρικό δεσμό σ, όπως στην περίπτωση των απλών
δεσμών άνθρακα. Στο γεγονός αυτό οφείλεται το ότι όλα τα άτομα στο αιθυλένιο
βρίσκονται στο ίδιο επίπεδο, είναι δηλ. συνεπίπεδα (co-planar), όπως
επίσης και cis-trans ισομέρεια των
παραγώγων του αιθυλενίου.
Αυτός ο τρόπος σύνδεσης των ατόμων ανθράκων ερμηνεύει εύκολα γιατί οι διπλοί δεσμοί δεν
είναι τόσο ισχυροί, όσο οι κορεσμένοι δεσμού του άνθρακα και δίνουν εύκολα
αντιδράσεις ηλεκτρονιόφιλης προσθήκης του διπλού δεσμού. 'Ετσι, η
ισχύς του δεσμού C-C
στο αιθάνιο (σύνδεση μόνο μέσω δεσμών σ) είναι 376
kJ/mol
(ή 90 kcal/mol),
ενώ η ισχύς του δεσμού
C=C
στο αιθυλένιο (συνδέσεις μέσω δεσμών σ + π) είναι 611
kJ/mol
(ή 146
kcal/mol),
δηλαδή ναι
μεν μεγαλύτερη από εκείνη του απλού δεσμού, αλλά μικρότερη ανά δεσμό, δηλ.
είναι μικρότερη από τη διπλάσια ενέργεια σύνδεσης του απλού δεσμού. Αυτό
οφείλεται στη μικρότερη αποτελεσματικότητα του δεσμού π. Ως ενέργεια
σχηματισμού του δεσμού π μπορεί να θεωρηθεί η διαφορά: 611 - 376 = 235
kJ/mol
(ή 56 kcal/mol).
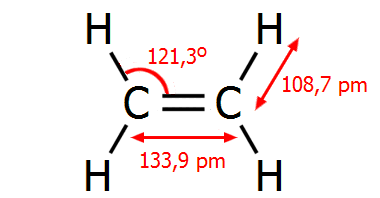
Επιπλέον, ενώ
η απόσταση μεταξύ των ανθράκων στο αιθάνιο είναι 154 pm, στο αιθάνιο είναι
μικρότερη, 134 pm, λόγω μεγιστοποίησης της αλληλοεπικάλυψης των τροχιακών
p. Οι γωνίες των ελεύθερων τροχιακών sp2 (γωνίες
H-C-H) στο αιθυλένιο είναι 117,4º
, δηλ. κατά τι μικρότερες των 120º
λόγω της απωστικής δράσης του διπλού δεσμού (στο σύνολό του) στα άτομα
υδρογόνου.
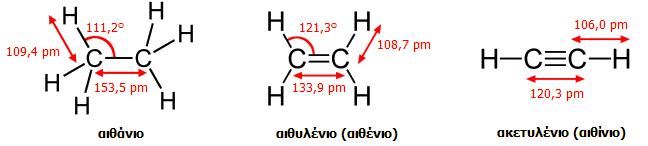
Γεωμετρικά χαρακτηριστικά των απλούστερων
ενώσεων C-C με απλό, διπλό και τριπλό δεσμό.
Παρασκευή αιθυλενίου
|
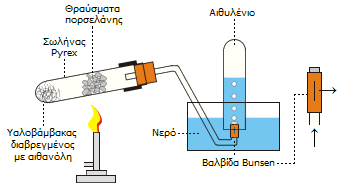
Πειραματική
διάταξη για την παρασκευή μικρών ποσοτήτων αιθυλενίου με θερμική
διάσπαση αιθανόλης. Στην άκρη του σωλήνα τοποθετείται μια
βαλβίδα Bunsen (λαστιχένιος σωλήνας
φραγμένος κατά το ένα άκρο και με μια σχισμή για την έξοδο του αερίου) για
να αποφευχθεί η αναρρόφηση νερού στον πυρακτωμένο σωλήνα
[Αναφ.5γ]
|

Τυπική φορητή
γεννήτρια αιθυλενίου που βασίζεται στην καταλυτική/θερμική διάσπαση της
αιθανόλης. |
Στο εργαστήριο: Μικρές ποσότητες αιθυλενίου μπορούν να
παρασκευασθούν εύκολα με αφυδάτωση της αιθανόλης. Στο εργαστήριο ως
αφυδατικό μέσον χρησιμοποιείται το πυκνό θειικό οξύ, ενώ μπορεί να
επιτευχθεί καταλυτική αφυδάτωση με διαβίβαση ατμών αιθανόλης υπεράνω
θερμαινόμενης αλουμίνας (Al2O3).
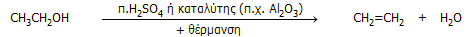
Μια απλή διάταξη παρασκευής αιθυλενίου
κατάλληλη για σχολικό εργαστήριο, που βασίζεται στη θερμική διάσπαση της
αιθανόλης δείχνεται δεξιά. Στη ίδια ουσιαστικά μέθοδο βασίζεται η λειτουργία των
ονομαζόμενων γεννητριών αιθυλενίου (ethylene generators), συσκευές που
χρησιμοποιούνται για την παραγωγή αιθυλενίου σε εγκαταστάσεις ωρίμασης
φρούτων, αν για οποιοδήποτε λόγο δεν είναι επιθυμητή ή δυνατή η χρήση εμπορικών
φιαλών αιθυλενίου.
'Αλλος τρόπος παρασκευής του αιθυλενίου μπορεί
να βασισθεί στον γενικότερο τρόπο παρασκευής αλκενίων, όπως π.χ. την
απόσπαση υδραλογόνου (αφυδραλογόνωση) από το αντίστοιχο αλκυλαλογονίδιο με
τη βοήθεια ισχυρής βάσης. 'Ετσι, αιθυλένιο μπορεί να παρασκευασθεί με την
αντίδραση (που δεν έχει όμως κάποια πρακτική αξία):
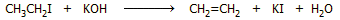
Από το πετρέλαιο: Βιομηχανικά το αιθυλένιο λαμβάνεται σε
τεράστιες ποσότητες ως χρήσιμο παραπροϊόν της ατμοπυρόλυσης (steam cracking) του αργού
πετρελαίου. Γενικά, κατά την πυρόλυση ενός αλκανίου παράγονται
υδρογονάνθρακες μικρότερου μεγέθους. Θεωρητικά ένα αλκάνιο μπορεί να
διασπαστεί σε ένα αλκάνιο
και ένα αλκένιο. 'Ετσι, μια γενική αντίδραση παραγωγής αιθυλενίου
θα μπορούσε να έχει την ακόλουθη μορφή:
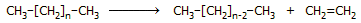
Ωστόσο, κατά την πυρόλυση δεν παράγεται αποκλειστικά
αιθυλένιο, αλλά και άλλες "χαμηλές" ολεφίνες, όπως το προπυλένιο (CH3CH=CH2)
και διάφορα βουτυλένια.
Με έλεγχο των συνθηκών πυρόλυσης (θερμοκρασία, καταλύτες -συνήθως Al2O3-) ελέγχεται η αναλογία των
διαφόρων ολεφινών (κυρίως αιθυλενίου και προπυλενίου) στα
προϊόντα πυρόλυσης.
Από το φυσικό αέριο: Μια σχετικώς νέα μέθοδος παραγωγής αιθυλενίου
από το φυσικό αέριο βασίζεται στη μερική οξείδωση του μεθανίου, με
βάση τη (συνολική) αντίδραση:
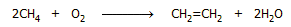
Η μέθοδος αυτή, γνωστή ως οξειδωτική σύζευξη
μεθανίου (Oxidative Coupling of Methane, OCM) άρχισε να εφαρμόζεται από τη
δεκαετία του 1980 και μετά. Η αντίδραση είναι ισχυρά εξώθερμη (ΔΗ = -67 kcal/mol), πραγματοποιείται σε υψηλή θερμοκρασία (750-950ºC) και χωρεί μέσω καταλυτικής
διάσπασης του μεθανίου σε ρίζες μεθυλίου, οι οποίες σε αέρια φάση συζεύγνυνται παρέχοντας αιθάνιο. Το αιθάνιο, στη συνέχεια υπόκειται σε
αφυδρογόνωση προς αιθυλένιο [Αναφ. 5].
|

Βιομηχανική μονάδα
πυρόλυσης για παρασκευή ολεφινών της
Selas-Linde (Gelsenkirchen, Γερμανία).
Η ετήσια παραγωγή της
μονάδας είναι 440.000 και 260.000 τόνοι αιθυλενίου και προπυλενίου.
|
Ατμοπυρόλυση
[Αναφ. 6]
Η ατμοπυρόλυση (steam
cracking) είναι μια πετροχημική διαδικασία κατά την οποία κορεσμένοι
υδρογονάνθρακες σχάζονται σε μικρότερους, συχνά ακόρεστους υδρογονάνθρακες.
Αποτελεί την κυριότερη μέθοδο παρασκευής των ελαφρύτερων αλκενίων και κυρίως
του αιθυλενίου και του προπενίου
Στην ατμοπυρόλυση η εισερχόμενη ποσότητα
αεριώδους ή υγρού υδρογονάνθρακα (νάφθα, υγραέριο, αιθάνιο) αραιώνεται με
υδρατμούς και υπόκειται σε σύντομη θέρμανση απουσία οξυγόνου. Τυπικά, η
θερμοκρασία είναι πολύ υψηλή (περίπου 850°C) και ο
χρόνος αντίδραση εξαιρετικά σύντομος (της τάξης μερικών
ms).
Κατά την ατμοπυρόλυση πραγματοποιείται πλήθος
χημικών αντιδράσεων, οι περισσότερες των οποίων χωρούν μέσω ελεύθερων ριζών.
Οι αντιδράσεις αυτές διακρίνονται στις εξής κατηγορίες:
α) Αντιδράσεις έναρξης (initiation
reactions): Σε αυτές ένα απλό μόριο υδρογονάνθρακα προσλαμβάνει
θερμική ενέργεια και διασπάται σε δύο ελεύθερες ρίζες. Μικρό ποσοστό μόνο
της συνολικής ποσότητας υδρογονανθράκων υπόκειται στις αντιδράσεις αυτές,
αλλά αυτό το μικρό ποσοστό είναι απαραίτητο για να ξεκινήσει η όλη
διαδικασία. Συνήθως η διάσπαση γίνεται σε δεσμό C-C
και όχι σε δεσμό C-H,
π.χ. CH3CH3
 2 CH3 2 CH3
β) Αντιδράσεις απόσπασης υδρογόνου (hydrogen
abstraction): Μια ελεύθερη ρίζα αποσπά υδρογόνο από ένα άλλο μόριο
υδρογονάνθρακα, μετατρέποντάς το σε ελεύθερη ρίζα, π.χ.
CH3 + CH3CH3
+ CH3CH3
 CH4
+ CH3CH2 CH4
+ CH3CH2
γ) Αντιδράσεις ριζικής αποσύνθεσης ριζών
(radical decomposition): Μια ελεύθερη ρίζα
διασπάται δίνοντας ένα αλκένιο και μια άλλη ελεύθερη ρίζα. Στις αντιδράσεις
αυτές οφείλεται η παρουσία των αλκενίων στην πυρόλυση, π.χ.
CH3CH2
 CH2=CH2
+ H CH2=CH2
+ H
δ) Αντιδράσεις ριζικής προσθήκης (radical
addition): Είναι το αντίστροφο της ριζικής αποσύνθεσης. Μια ρίζα
αντιδρά με ένα αλκένιο για να δώσει μια μεγαλύτερη ελεύθερη ρίζα. Οι
αντιδράσεις αυτού του είδους εμπλέκονται στον σχηματισμό αρωματικών
προϊόντων, όταν εισάγονται στη διαδικασία βαρείς υδρογονάνθρακες, π.χ.
CH3CH2 + CH2=CH2
+ CH2=CH2
 CH3CH2CH2CH2 CH3CH2CH2CH2
ε) Αντιδράσεις τερματισμού (termination
reactions): Είναι οι αντιδράσεις μεταξύ δύο ριζών με σχηματισμό
σταθερού προϊόντος (όχι ελεύθερης ρίζας). Υπάρχουν δύο τύποι αντιδράσεων
τερματισμού. Οι αντιδράσεις ανασυνδυασμού (recombination),
όπου δύο ρίζες αντιδρούν παρέχοντας ένα μεγαλύτερο μόριο (π.χ.
CH3 + CH3CH2
+ CH3CH2
 CH3CH2CH3)
και οι αντιδράσεις ανακατανομής (disproportionation),
όπου η μια ρίζα μεταβιβάζει ένα υδρογόνο στην άλλη παρέχοντας έτσι ένα αλκένιο
και ένα αλκάνιο: CH3CH2
CH3CH2CH3)
και οι αντιδράσεις ανακατανομής (disproportionation),
όπου η μια ρίζα μεταβιβάζει ένα υδρογόνο στην άλλη παρέχοντας έτσι ένα αλκένιο
και ένα αλκάνιο: CH3CH2 + CH3CH2
+ CH3CH2
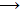 CH2=CH2
+ CH3CH3 CH2=CH2
+ CH3CH3
Η πυρόλυση υδρογονανθράκων αποτελεί τυπικό
παράδειγμα αντίδρασης, όπου επικρατεί η μεταβολή της εντροπίας (∆S°)
παρά της ενθαλπίας (∆H°) στην περιγραφή της
μεταβολής της ελεύθερης ενέργειας Gibbs (∆G°=∆H°-T∆S°).
Αν και η ενέργεια διάσπασης του απλού δεσμού C-C
είναι σχετικά μεγάλη (περίπου 375 kJ/mol),
αν
και η όλη διαδικασία είναι εξαιρετικά ενδόθερμη, η μεγάλη θετική αύξηση
μεταβολή της εντροπίας, ως αποτέλεσμα της θραυσματοποίησης ενός μεγάλου
μορίου σε αρκετά μικρότερα, σε συνδυασμό με τις υψηλές θερμοκρασίες,
καθιστούν τον όρο T∆S°
μεγαλύτερο από τον όρο ∆H°, γεγονός που οδηγεί
σε αρνητικότερες τιμές ∆G° και ευνοεί την
πυρόλυση. |
 Κυριότερες βιομηχανικές χρήσεις του
αιθυλενίου και χημικές αντιδράσεις του
Κυριότερες βιομηχανικές χρήσεις του
αιθυλενίου και χημικές αντιδράσεις του
 |
 |
|
Το αιθυλένιο
φυλάσσεται ή διακινείται σε μεγάλες ποσότητες σε κρυογόνους
δεξαμενές ή βυτία (σε φορτηγά, βαγόνια), ενώ σε
μικρότερες ποσότητες σε χαλύβδινους κυλίνδρους ως αέριο υπό
πίεση [Αναφ. 8]. |
Το αιθυλένιο, ως αλκένιο, είναι μια χημικώς
δραστική ένωση, παρέχοντας τις τυπικές αντιδράσεις προσθήκης όλων των
αλκενίων. Επίσης το αιθυλένιο δρα ως ισχυρός υποκαταστάτης και ιστορικά
ως πρώτη οργανομεταλλική ένωση θεωρείται σύμπλοκο αιθυλενίου με λευκοχρύσο(ΙΙ). Την
ένωση αυτή παρασκεύασε τυχαία
ο Δανός χημικός
William Christopher Zeise
το 1827 με βρασμό αιθανόλης με PtCl4.
Ο Zeise εξαρχής είχε αναφέρει την παρουσία αιθυλενίου στο άλας αυτό, κάτι
που ενώ αρχικά αμφισβητήθηκε, τελικά επιβεβαιώθηκε με την άμεση σύνθεση του
άλατος με διαβίβαση αιθυλενίου σε διάλυμα K2PtCl4.
Η ένωση αυτή είναι γνωστή ως
άλας
Zeise.
Η ετήσια παραγωγή αιθυλενίου προσεγγίζει περίπου τα 110 εκατομμύρια τόνους και σχεδόν στο σύνολό του χρησιμοποιείται ως πρώτη ύλη ζωτικής
σημασία για τη σύνθεση πλήθους άλλων εξίσου σημαντικών προϊόντων, που και
αυτά με τη σειρά τους αποτελούν πρώτες ύλες για τη σύνθεση άλλων ουσιών
[Αναφ. 7].
Το αιθυλένιο "ως έχει" χρησιμοποιείται σε ελάχιστες
(συγκριτικά) ποσότητες. Χρησιμοποιείται ως καύσιμο, ως αναισθητικό
αέριο (παλαιότερα, έχει πλέον αντικατασταθεί από άλλα λιγότερο εύφλεκτα
αέρια, βλ. Χημική ένωση του μήνα:
Χλωροφόρμιο). Ωστόσο, σπουδαιότερη χρήση του καθαρού αιθυλενίου είναι ως ουσία
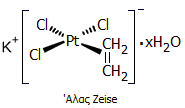
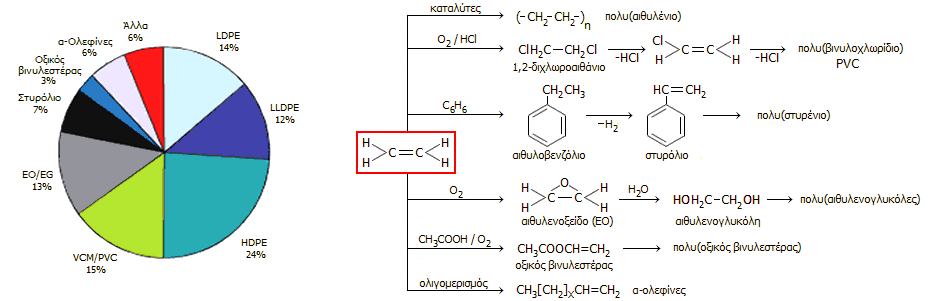
που επιταχύνει την ωρίμαση φρούτων (φυτοορμόνη). Στο διάγραμμα δείχνεται η κατανομή των κυριότερων βιομηχανικών χρήσεων του αιθυλενίου, ως
πρώτης ύλης για τη σύνθεση άλλων ουσιών.
Από το διάγραμμα είναι προφανές ότι το
αιθυλένιο χρησιμοποιείται στο συντριπτικό ποσοστό του για την παρασκευή
πολυμερών και ειδικά πολυαιθυλενίου διαφόρων τύπων (LDPE: πολυαιθυλένιο
χαμηλής πυκνότητας, LLDPE: γραμμικό πολυαιθυλένιο χαμηλής πυκνότητας, HDPE:
πολυαιθυλένιο υψηλής πυκνότητας), πολυβινυλοχλωριδίου (PVC).
Αλλά και τα προϊόντα όπως τα: στυρόλιο, οξικός
βινυλεστέρας και οι α-ολεφίνες (π.χ. 1-βουτένιο, 1-εξένιο, 1-οκτένιο)
χρησιμοποιούνται σχεδόν στο σύνολό τους για την παρασκευή πολυμερών (πολυστυρένιο,
πολυοξικός βινυλεστέρας, διάφορα συμπολυμερή του αιθυλενίου).
Σημαντικό
προϊόν του αιθυλενίου είναι το αιθυλενοξείδιο (EO), ένα αέριο, εξαιρετικά
χρήσιμο ενδιάμεσο για την παραγωγή πλήθους άλλων χημικών ουσιών. Το κύριο
παράγωγο του αιθυλενοξειδίου είναι η αιθυλενογλυκόλη (EG). Με αντίδραση
αλκοολών (ROH) ή της αιθυλενογλυκόλης με επιπλέον ποσότητες αιθυλενοξειδίου
λαμβάνεται μια μεγάλη ποικιλία
διαφόρων διαλυτών (σελοσόλβες) R-[-OCH2CH2-]χ-OH
και πολυαιθυλενοξυ-παραγώγων τα οποία χρησιμοποιούνται ευρύτατα ως μη ιοντικά απορρυπαντικά, όπως και πολυαιθυλενογλυκόλες Η-[OCH2CH2-]x-OH
που χρησιμοποιούνται ως φαρμακευτικά έκδοχα και σε καλλυντικά.
|
 |
|
Κατανομή των χρήσεων του αιθυλενίου
στις ΗΠΑ κατά το 2003 [Αναφ.
7α]. |
Αντιδράσεις σύνθεσης των κυριότερων
προϊόντων αιθυλενίου (αρχή) |
Με
αντίδραση του αιθυλενοξειδίου με αμμωνία λαμβάνονται ενώσεις όπως οι
διάφορες αιθανολαμίνες (μονο-, δι- και τρι-αιθανολαμίνη), οι οποίες
χρησιμοποιούνται ευρύτατα ως βασικοί διαλύτες, όπως επίσης και στη βιομηχανία για
την απαλλαγή των εκλυόμενων αερίων από όξινου χαρακτήρα αέρια (κυρίως SO2).
'Αλλες ουσίες που παράγονται από το αιθυλένιο
είναι: η αιθανόλη (μέσω αντίδρασης εφυδάτωσης: CH2=CH2
+ Η2Ο
 CH3CH2ΟΗ),
η ακεταλδεΰδη (με απ' ευθείας οξείδωση,
μέθοδος Wacker: CH2=CH2
+ 1/2Ο2
CH3CH2ΟΗ),
η ακεταλδεΰδη (με απ' ευθείας οξείδωση,
μέθοδος Wacker: CH2=CH2
+ 1/2Ο2
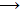 CH3CHΟ), η προπανάλη
(μέσω αντίδρασης
υδροφορμυλίωσης: CH2=CH2
+ Η2Ο
+ CO
CH3CHΟ), η προπανάλη
(μέσω αντίδρασης
υδροφορμυλίωσης: CH2=CH2
+ Η2Ο
+ CO
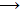 CH3CH2CHO), το αιθυλοχλωρίδιο
(μέσω αντίδρασης προσθήκης: CH2=CH2
+ ΗCl
CH3CH2CHO), το αιθυλοχλωρίδιο
(μέσω αντίδρασης προσθήκης: CH2=CH2
+ ΗCl
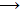 CH3CH2Cl)
και η 2-χλωροαιθανόλη (μέσω αντίδρασης προσθήκης: CH2=CH2
+ ΗOCl
CH3CH2Cl)
και η 2-χλωροαιθανόλη (μέσω αντίδρασης προσθήκης: CH2=CH2
+ ΗOCl
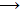 CH2ClCH2OH).
CH2ClCH2OH).
Αξίζει να σημειωθεί ότι μέχρι πριν 20-30
χρόνια, μια από τις κυριότερες χρήσεις του αιθυλενίου ήταν η παραγωγή του
1,2-διβρωμοαιθανίου (αιθυλενοδιβρωμίδιο), το οποίο παρασκευαζόταν με την
τυπική αντίδραση προσθήκης: CH2=CH2
+ Br2
 CH2BrCH2Br.
Το 1,2-διβρωμοαιθάνιο, ως πρόσθετο στη βενζίνη των αυτοκινήτων, βοηθούσε στην
απομάκρυνση του μολύβδου (στη μορφή του σχετικά πτητικού PbBr2),
του προσθέτου τετρααιθυλομολύβδου, (C2H5)4Pb,
που για περισσότερο από μισό αιώνα χρησίμευε στην αύξηση του αριθμού
οκτανίου του καυσίμου. Με την κατάργηση της χρήσης της τοξικότατης ένωσης
του μολύβδου, ουσιαστικά μηδενίσθηκε η παραγωγή του 1,2-διβρωμοαιθανίου
γεγονός που έπληξε τη βιομηχανία παραγωγής βρωμίου, σε ελάχιστο όμως βαθμό
τη βιομηχανία παραγωγής αιθυλενίου.
CH2BrCH2Br.
Το 1,2-διβρωμοαιθάνιο, ως πρόσθετο στη βενζίνη των αυτοκινήτων, βοηθούσε στην
απομάκρυνση του μολύβδου (στη μορφή του σχετικά πτητικού PbBr2),
του προσθέτου τετρααιθυλομολύβδου, (C2H5)4Pb,
που για περισσότερο από μισό αιώνα χρησίμευε στην αύξηση του αριθμού
οκτανίου του καυσίμου. Με την κατάργηση της χρήσης της τοξικότατης ένωσης
του μολύβδου, ουσιαστικά μηδενίσθηκε η παραγωγή του 1,2-διβρωμοαιθανίου
γεγονός που έπληξε τη βιομηχανία παραγωγής βρωμίου, σε ελάχιστο όμως βαθμό
τη βιομηχανία παραγωγής αιθυλενίου.
|
Λίγα πράγματα για το
κυριότερο προϊόν του αιθυλενίου: το πολυαιθυλένιο
[Αναφ. 9α]
Σύνθεση
πολυαιθυλενίου.
Το
1898 πραγματοποιήθηκε η τυχαία σύνθεση πολυαιθυλενίου από τον Γερμανό χημικό
Hans von Pechmann
(1850-1902, γνωστό για την ανακάλυψη του διαζωμεθανίου το 1894) με θέρμανση αιθερικού
διαλύματος διαζωμεθανίου (CH2N2).
Τη δομή του προϊόντος διερεύνησαν οι Eugen Bamberger
και Friedrich Tschirner , οι οποίοι
κατέδειξαν ότι περιείχε αλυσίδες -CH2-
και για τον λόγο αυτό το προϊόν αρχικά ονομάστηκε πολυμεθυλένιο.
Σύνθεση πολυαιθυλενίου με πολυμερισμό ελευθέρων
ριζών. Το 1933
αναφέρθηκε η πρώτη
βιομηχανική μέθοδος παραγωγής πολυαιθυλενίου από τους
Eric Fawcett και
Reginald Gibson στην εταιρεία ICI
(Imperial Chemical Industries) της Μ. Βρετανίας.
Σε υψηλές θερμοκρασίες και πιέσεις, μίγμα αιθυλενίου και βενζαλδεΰδης έδωσε
ένα λευκό κηρώδες υλικό στα τοιχώματα του αντιδραστήρα. Το αποτελέσμα όμως
αυτό δεν ήταν αναπαραγώγιμο. Τελικά έγινε αντιληπτό ότι ήταν απαραίτητη η
παρουσία ιχνών οξυγόνου, που εξαιτίας τεχνικού λάθους είχε εισέλθει στο
πρώτο πείραμα. 'Ετσι, σε θερμοκρασίες 200ºC
και πιέσεις μεγαλύτερες από 1000 bar
πραγματοποιείται ριζικός πολυμερισμός του αιθυλενίου με ίχνη οξυγόνου ως
εκκινητή (initiator). Το προϊόν είναι διακλαδισμένο και χαρακτηρίζεται ως
πολυαιθυλένιο χαμηλής πυκνότητας, LDPE.
Το 1939 λειτούργησε η πρώτη πιλοτική μονάδα
παραγωγής στη Μ.
Βρετανία για την παραγωγή μονωτικών επικαλύψεων σε υποθαλάσσια καλώδια
μεταφοράς ηλεκτρικού ρεύματος. Η μονάδα άρχισε να λειτουργεί την ημέρα που η Γερμανία εισέβαλε στην Πολωνία. Η
συγκεκριμένη χρήση του πολυαιθυλενίου δεν ήταν ικανοποιητική. Ωστόσο,
η εφαρμογή του πολυμερούς αυτού ως μονωτικού για την μόνωση καλωδίων εγκαταστάσεων ραντάρ ήταν απόλυτα επιτυχημένη και έδωσε στις συμμαχικές
δυνάμεις ένα τεχνικό πλεονέκτημα έναντι των αντιπάλων δυνάμεων. Εξαιτίας της
εφαρμογής αυτής η τεχνολογία παραγωγής πολυαιθυλενίου παρέμεινε άκρως
απόρρητη ως τη λήξη του Β' παγκοσμίου πολέμου.
Σύνθεση πολυαιθυλενίου με καταλύτες
Ziegler-Natta.
Η επόμενη
επανάσταση στην παραγωγή πολυολεφινών καταγράφηκε τη δεκαετία του 1950 με
την ανάπτυξη των καταλυτών Ziegler-Natta
στο εργαστήριο του Κarl Ziegler στο Ινστιτούτο
Max-Planck. Οι πρώτες
επιτυχημένες απόπειρες έγιναν το 1953 με ενώσεις τιτανίου και ζιρκονίου σε
συνδυασμό με οργανοαργιλικές ενώσεις. Τα συστήματα αυτά ονομάστηκαν
μικτοί καταλύτες (metallorganische mischkatalysatoren)
ή καταλύτες Ziegler.
Το 1954 αναφέρθηκε ο συμπολυμερισμός αιθυλενίου-προπυλενίου προς κομμιώδη προϊόντα με καταλύτες
βαναδίου, ενώ το ίδιο έτος ο Giulio
Natta ανακοίνωσε τον πολυμερισμό του προπυλενίου
με παρόμοια καταλυτικά συστήματα. Γρήγορα διαπιστώθηκε η δυνατότητα που
παρέχει η μέθοδος αυτή του καταλυτικού πολυμερισμού στον έλεγχο της
στερεοχημείας των παραγόμενων πολυμερών. Επιστέγασμα των προσπαθειών αυτών
ήταν η απονομή του βραβείου Nobel στους
Ziegler και Natta το
1963.
Καταλύτες Ziegler-Natta.
Οι καταλύτες
Ziegler-Natta
αποτελούνται από δύο συστατικά. Το πρώτο είναι χλωρίδιο, αλκοξείδιο ή άλλο
παράγωγο μετάλλου μετάπτωσης των ομάδων IV-VIII
του περιοδικού πίνακα, ενώ το δεύτερο είναι οργανομεταλλική ένωση ή υδρίδιο
στοιχείου των ομάδων I-III
του περιοδικού πίνακα. Η πρώτη χαρακτηρίζεται ως καταλύτης και η δεύτερη ως
συγκατα-λύτης. Κλασικοί καταλύτες είναι ενώσεις του τιτανίου (TiCl4,
Cp2TiCl2
κ.λπ.) (Cp: κυκλοπενταδιένιο) ή του βαναδίου (VCl4,
VOCl3
κ.λπ). Ως συγκαταλύτες χρησιμοποιούνται συνήθως ενώσεις του αργιλίου, όπως
AlEt3,
AlClEt2
κ.λπ.
Τα περισσότερο μελετημένα
συστήματα είναι τα TiCl4/AlEt3
και TiCl3/AlClEt2.
Το πρώτο σύστημα είναι αυτό που χρησιμοποίησε ο Ziegler
για τον πολυμερισμό του αιθυλενίου. Τα επιμέρους συστατικά είναι διαλυτά σε
οργανικούς διαλύτες. Ωστόσο, το προϊόν της αλληλεπίδρασής τους είναι αδιάλυτο
και συνεπώς η καταλυτική πορεία είναι ετερογενής.
|
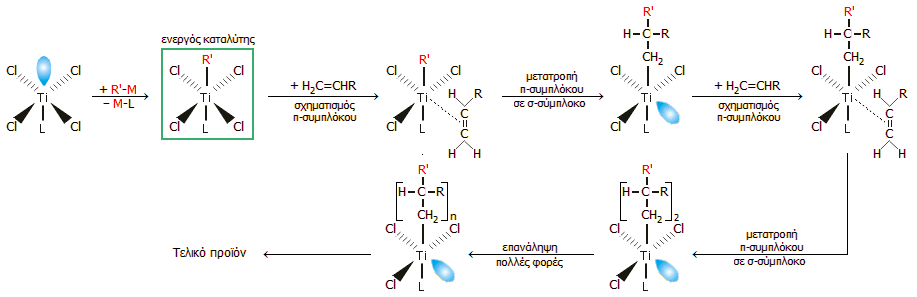
Απλοποιημένη παρουσίαση του μηχανισμού καταλυτικής δράσης ενός συστήματος καταλύτη Ziegler-Natta (
εδώ: TiCl4
- R'M, όπου Μ = Al, Li, Mg, Zn,..., L = υποκαταστάτης ) στον πολυμερισμό του βινυλοπαραγώγου H2C=CΗR
(π.χ. R: H, πολυαιθυλένιο,
R: CH3-,
πολυπρoπυλένιο, R: C6H5-,
πολυστυρένιο). Από την [Αναφ. 9β].
|
Σύνθεση πολυαιθυλενίου με τη μέθοδο
Phillips.
Η μέθοδος αυτή αναπτύχθηκε
από τους Robert Banks και
Paul Hogan και περιλαμβάνει τον πολυμερισμό
διαλύματος αιθυλενίου (συνήθως σε κυκλοεξάνιο) από καταλύτες οξείδια
μετάλλων στηριγμένα σε αδρανή υποστρώματα. Συνήθως χρησιμοποιούνται οξείδια
του χρωμίου σε ποσοστό 5% λεπτότατα διαμερισμένο σε πυριτία ή αλουμίνα. Ο
πολυμερισμός γίνεται σε μέτριες θερμοκρασίες και πιέσεις, δηλαδή 130-160ºC
και 1,4-3,5 MPa. Το παραγόμενο πολυαιθυλένιο έχει
γραμμική δομή και μεγάλη πυκνότητα (~0,96 g/cm3).
Παραλλαγή της πορείας αυτής αποτελεί η μέθοδος της
Standard Oil Company. Σύμφωνα με αυτήν χρησιμοποιούνται διαφορετικές
πειραματικές συνθήκες (θερμοκρασία 230-270ºC
και πιέσεις 40-80 atm) καθώς και οξείδια του
μολυβδαινίου ως καταλύτες.
|
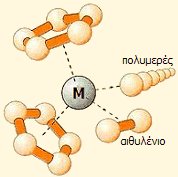
Με τους καταλύτες
Ziegler-Natta, ελέγχεται ο βαθμός πολυμερισμού των α-ολεφινών
και η στερεοχημεία του λαμβανόμενου πολυμερούς. |
Σύνθεση πολυαιθυλενίου με μεταλλοκενικούς
καταλύτες.
Tα μεταλλοκένια, ως οργανομεταλλικές ενώσεις, ήταν
από καιρό γνωστά (βλ. Χημική ένωση του μήνα:
Φερροκένιο) και είχαν χρησιμοποιηθεί ως συστατικά των καταλυτικών
συστημάτων Ziegler-Natta
στην προσπάθεια εξέλιξης των τελευταίων. Η χρήση τους σε συνδυασμό με τους
συμβατικούς αλκυλο-αργιλικούς συγκαταλύτες των συστημάτων
Ziegler-Natta (όπως για παράδειγμα τα
AlEt3
και AlEt2Cl),
οδήγησαν σε καταλυτικά συστήματα ικανά να πολυμερίσουν το αιθυλένιο, αλλά με
ασθενείς καταλυτικές δραστικότητες. Αυτός ήταν και ο κύριος λόγος για τον
οποίο καταλυτικά συστήματα βασισμένα σε μεταλλοκενικά σύμπλοκα γνώρισαν αρχικά εφαρμογή
μόνο σε εργαστηριακές μελέτες, που αφορούσαν μηχανιστικές έρευνες
πάνω στον ομογενή πολυμερισμό ολεφινικών υποστρωμάτων.
Οι κινητικές αυτές
μελέτες οδήγησαν σε ουσιαστικά συμπεράσματα για τη φύση του καταλυτικά ενεργού
είδους στο διάλυμα, για τα φαινόμενα γήρανσης του καταλυτικού συστήματος,
για τον
μηχανισμό αλληλεπίδρασης του μεταλλικού κέντρου με το ολεφινικό μονομερές,
καθώς και σε πρόσθετες ποιοτικές και ποσοτικές πληροφορίες για τα άλλα
στοιχειώδη βήματα του καταλυτικού πολυμερισμού.
Η πρώτη σημαντική πρόοδος,
όσον αφορά στην αύξηση της δραστικότητας του καταλυτικού πολυμερισμού (κατά
έναν παράγοντα 20-100), καταγράφεται από τους Reichert
και Meyer το 1973 κατά την προσθήκη
μικρής ποσότητας νερού (H2O/Αl
≈ 0,05) στο σύστημα Cp2TiCl2/EtAlCl2,
καθώς και από τους Long και Βreslow
για το αντίστοιχο σύστημα με συγκαταλύτη το Μe2AlCl.
Το βήμα που έμελλε να
αλλάξει δραματικά το ρόλο των μεταλλοκενικών συμπλόκων στον καταλυτικό
πολυμερισμό (αύξηση της δραστικότητας μέχρι και 1 εκατομμύριο φορές)
πραγματοποιήθηκε το 1975 στο Πανεπιστήμιο του Αμβούργου από την ομάδα του
καθηγητή Kaminsky, όπου αρχικά από
πειραματική αστοχία προστέθηκε νερό σε σύστημα που περιείχε
Cp2TiMe2,
Me3Al
και αιθυλένιο, οπότε πραγματοποιήθηκε ταχύς πολυμερισμός του αιθυλενίου από
ένα σύστημα, που μέχρι τότε είχε θεωρηθεί ανενεργό ως προς τον πολυμερισμό
ολεφινικών υποστρωμάτων.
 Το 1977, η ίδια ομάδα χρησιμοποιεί το
απομονωμένο προϊόν της μερικής υδρόλυσης του Me3Al,
το οποίο ονομάστηκε μεθυλοαλουμινοξάνιο, MAO, σε
συνδυασμό με μεταλλοκένια (Cp2TiMe2,
Cp2ZrMe2
και Cp2ΖrCl2)
ως καταλυτικά συστήματα για τον πολυμερισμό του αιθυλενίου. Με τον τρόπο
αυτό τα μεταλλοκενικά συστήματα γίνονται για πρώτη φορά πιο δραστικά από
τους εμπορικώς διαθέσιμους καταλύτες Ziegler-Natta. Το 1977, η ίδια ομάδα χρησιμοποιεί το
απομονωμένο προϊόν της μερικής υδρόλυσης του Me3Al,
το οποίο ονομάστηκε μεθυλοαλουμινοξάνιο, MAO, σε
συνδυασμό με μεταλλοκένια (Cp2TiMe2,
Cp2ZrMe2
και Cp2ΖrCl2)
ως καταλυτικά συστήματα για τον πολυμερισμό του αιθυλενίου. Με τον τρόπο
αυτό τα μεταλλοκενικά συστήματα γίνονται για πρώτη φορά πιο δραστικά από
τους εμπορικώς διαθέσιμους καταλύτες Ziegler-Natta.
Οι ζιρκονοκενικοί καταλύτες
σε συνδυασμό με το ΜΑΟ είναι μερικές δεκάδες ως και εκατοντάδες φορές πιο
δραστικοί από τους καταλύτες Ziegler-Natta.
'Ετσι το κλασικό σύμπλοκο Cp2ΖrCl2
παράγει περισσότερα από 60.000 kg πολυαιθυλενίου
ανά g Zr και ώρα. 'Εχει βρεθεί ότι κάθε άτομο
ζιρκονίου παράγει περίπου 46.000 αλυσίδες πολυμερούς ανά ώρα και ότι ο
χρόνος εισαγωγής ενός μορίου αιθυλενίου στην αναπτυσσόμενη μακρομοριακή
αλυσίδα είναι περίπου 30 μs.
Τα δεδομένα αυτά είναι αντίστοιχα με την ταχύτητα δράσης των ενζύμων σε
πολλές βιοχημικές πορείες.
Ρύθμιση του μοριακού βάρους.
Το μοριακό βάρος μπορεί να ρυθμιστεί σε γενικές γραμμές με κάποιον από τους
εξής τρόπους: (α) Αύξηση της θερμοκρασίας οδηγεί σε μείωση του μοριακού
βάρους. Έτσι στους 10ºC
παράγεται πολυαιθυλένιο με μοριακό βάρος 1.500.000, ενώ στους 50ºC
μειώνεται στην τιμή 180.000 και στους 90ºC
στις 90.000. (β) Αύξηση της συγκέντρωσης του καταλύτη οδηγεί σε μείωση του
μοριακού βάρους με σχεδόν γραμμική εξάρτηση. (γ) 'Ιχνη υδρογόνου αρκούν για
τη μείωση του μοριακού βάρους του παραγόμενου πολυαιθυλενίου. Έχει βρεθεί
ότι 7,5% Η2
μειώνει το μοριακό βάρος στο μισό.
Εκτός από την παραγωγή
ομοπολυμερών πολυαιθυλενίου είναι δυνατό οι μεταλλοκενικοί καταλύτες να
χρησιμοποιηθούν και σε αντιδράσεις συμπολυμερισμού αιθυλενίου με άλλες
α-ολεφίνες, όπως προπυλένιο, βουτένιο-1, πεντένιο-1, εξένιο-1 και οκτένιο-1
για την παραγωγή γραμμικού πολυαιθυλενίου χαμηλής πυκνότητας,
LLDPE. Η φύση του καταλύτη και του συν-μονομερούς
καθώς και οι συνθήκες του συμπολυμερισμού επηρεάζουν τη δομή των παραγόμενων
συμπολυμερών (σύσταση, κατανομή δομικών μονάδων κ.λπ).
 |
 |
|
Πλαστικά σταγονόμετρα
από LDPE (αριστερά) και
φιάλες από HDPE (δεξιά) |
Τύποι
πολυαιθυλενίων.
Υπάρχουν
πολλοί τύποι εμπορικά διαθέσιμων πολυαιθυλενίων, οι οποίοι διαφέρουν ανάλογα
με την πυκνότητα και την κρυσταλλικότητα του πολυμερούς. Ουσιαστικά οι
διαφορές είναι δομικές και συνίστανται στον αριθμό και το είδος των
υπαρχουσών διακλαδώσεων.
LDPE
(Low Density PolyEthylene):
Παρασκευάζεται με την τεχνική του πολυμερισμού ελευθέρων ριζών και έχει
πυκνότητα 0,910-0,940 g/cm3.
Η μακρομοριακή δομή περιλαμβάνει μεγάλο αριθμό διακλαδώσεων γεγονός που
οδηγεί σε μικρό βαθμό κρυσταλλικότητας και μικρή πυκνότητα. Κατεργάζεται
εύκολα σε μηχανές μορφοποίησης και βρίσκει εφαρμογές στην κατασκευή
πλαστικών δοχείων, αλλά και υμενίων όπως σε πλαστικές σακούλες και υμένια
περιέλιξης τροφίμων.
HDPE
(High Density PolyEthylene):
Παρασκευάζεται με καταλύτες Ziegler-Natta,
καταλύτες χρωμίου (μέθοδος Phillips) και
μεταλλοκένια. Τα προϊόντα έχουν εξαιρετικά μικρό βαθμό διακλαδώσεων και έτσι
έχουν μεγάλη πυκνότητα (μεγαλύτερη από 0,941 g/cm3) κρυσταλλικότητα και μηχανική αντοχή. Από το υλικό αυτό παρασκευάζονται
δοχεία συσκευασίας και αποθήκευσης τροφίμων, πλαστικοί σωλήνες μεταφοράς
νερού, δοχεία απορριμμάτων, πλαστικά παιχνίδια κ.λπ.
LLDPE
(Linear Low Density PolyEthylene):
Πρόκειται για γραμμικό πολυμερές που όμως φέρει συγκεκριμένο αριθμό και
μέγεθος πλευρικών ομάδων. Παρασκευάζεται από αντίδραση συμπολυμερισμού
αιθυλενίου με άλλη ανώτερη α-ολεφίνη (για παράδειγμα βουτένιο-1, εξένιο-1,
οκτένιο-1). Έχει πυκνότητα ανάμεσα στα όρια 0,915-0,925 g/cm3.
Με το υλικό αυτό παρασκευάζονται παιχνίδια, επικαλύψεις καλωδίων, σωλήνες,
δοχεία, κάδοι και υμένια με εφαρμογή στη γεωργία (π.χ. θερμοκήπια) κ.α.
UHMWPE (Ultra
High Molecular Weight PolyEthylene):
Είναι γραμμικό πολυμερές με ιδιαίτερα μεγάλο μοριακό βάρος, συνήθως μεταξύ
3,0 και 5,5x106. Παρασκευάζεται από καταλυτικές διεργασίες (Ziegler-Natta
και μεταλλοκένια). Το προϊόν χαρακτηρίζεται από τη μεγάλη μηχανική αντοχή
και τη χημική του αδράνεια. 'Ετσι χρησιμοποιείται για την κατασκευή τμημάτων
μηχανών, ιμάντων μεταφοράς, σχοινιών για ιστιοπλοϊκά σκάφη κ.λπ. |
|
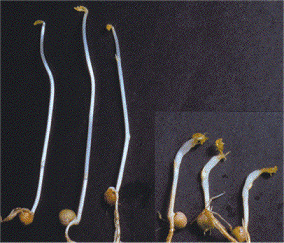
Μίσχοι μπιζελιών ανεπτυγμένων απουσία (αριστερά) και
παρουσία (δεξιά) ιχνών αιθυλενίου
[Αναφ. 10β]. |
Το
αιθυλένιο ως φυτοορμόνη
[Αναφ. 10]
Το 1858, ο
Fanestock παρατήρησε ότι φυτά καλλιεργούμενα σε ένα θερμοκήπιο
της Φιλαδέλφειας, παρουσίαζαν φαινόμενα γήρανσης και απόπτωσης φύλλων
παρουσία φωτιστικού αερίου. Ωστόσο, αν και ανίχνευσε
υδρογονάνθρακες στην ατμόσφαιρα, δεν διαπίστωσε ποιο από τα
συστατικά του φωτιστικού αερίου ήταν υπεύθυνο για αυτό το
αποτέλεσμα. Λίγα χρόνια αργότερα, το 1864, ο Girardin επαλήθευσε
ότι δέντρα που αναπτύσσονταν σε περιοχές, όπου υπήρχε διαρροή
φωτιστικού αερίου, παρουσίαζαν συμπτώματα πρόωρης γήρανσης
[Αναφ. 10α].
Το 1901, ο
Dimitry Neljubov, στο Βοτανολογικό
Ινστιτούτο της Αγίας Πετρούπολης, προσπαθώντας να καλλιεργήσει
μια ποικιλία μπιζελιών στο εργαστήριο, διαπίστωσε ένα είδος "ανώμαλης"
ανάπτυξης. Οι μίσχοι των φυτών έμεναν κοντοί, αποκτούσαν μεγάλη
διάμετρο και παρουσίαζαν μια κάμψη (διαταραχή γεωτροπισμού).
Τελικά διαπιστώθηκε ότι υπεύθυνο ήταν πάλι το φωτιστικό αέριο που χρησιμοποιούσαν
στο εργαστήριο και ειδικότερα το αιθυλένιο. Το αιθυλένιο υπήρχε σε μικρές ποσότητες στο
φωτιστικό αέριο, αλλά και στα αέρια που προέκυπταν κατά την ατελή
καύση του.
Κατά τη δεκαετία
του 1930 η φυσιολογική δράση του αιθυλενίου πάνω στα φυτά είχε
πλήρως τεκμηριωθεί και άρχισαν οι συστηματικές μελέτες της
χρήσης του αερίου πάνω στην ωρίμαση των φρούτων. Επίσης, διατυπώθηκε η
θεωρία ότι το αιθυλένιο δρούσε σαν ένας ενδογενής ρυθμιστής ανάπτυξης
των φυτών.
Το 1934, ο Gane απέδειξε πως αιθυλένιο
εκλυόταν από μήλα κατά την ωρίμασή τους. Μάλιστα έχει
διαπιστωθεί ότι η παραγωγή αιθυλενίου μπορούσε να φτάσει τα 0,5 μL
ανά g και ώρα, ενώ το αέριο αυτό είναι δραστικό σε εξαιρετικά χαμηλές συγκεντρώσεις,
στην περιοχή 10 έως 100 nL ανά λίτρο αέρα.
 |
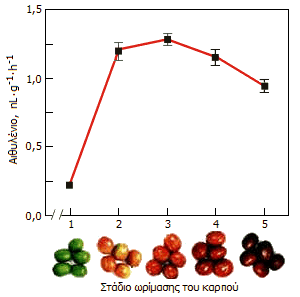 |
|
Πάνω:
Μπανάνες σε διάφορα στάδια ωρίμασης. Δεξιά:
Ρυθμός έκλυσης αιθυλενίου από καρπούς καφέ (Coffea
arabica) κατά τα διάφορα στάδια ωρίμασης
[Αναφ. 10γ]. |
Στην
απειροελάχιστη έκλυση αιθυλενίου οφείλεται το γνωστό φαινόμενο
της επιτάχυνσης της ωρίμασης άωρων φρούτων από την παρουσία
υπερώριμων φρούτων στον ίδιο κλειστό χώρο (ακόμη και στα
ψυγεία). 'Ετσι, το αιθυλένιο δρα ως
φυτοορμόνη (plant hormone),
αφού μεταφέρει το χημικό σήμα "έναρξης της ωρίμασης".
Ενεργοποιεί και
ρυθμίζει την ωρίμαση των καρπών (φρούτων), το άνοιγμα των
ανθέων και την πτώση των φύλλων. Υπάρχει πλήθος ουσιών που δρουν ως φυτοορμόνες, αλλά
το αιθυλένιο είναι η
μόνη αέρια φυτοορμόνη.
Ο σχηματισμός αιθυλένιου επάγεται σε περιπτώσεις "τραυματισμού"
των φυτών. Για παράδειγμα αν κοπεί
το άνθος από ένα φυτό, τότε αυτό αρχίζει να εκλύει
μικροποσότητες αιθυλενίου. Αν χτυπηθεί ένα φρούτο
(π.χ. ένα μήλο) στο χτυπημένο μέρος αρχίζει παράγεται
αιθυλένιο, το οποίο επιταχύνει την ωρίμασή του και η ωρίμαση
αυτή μπορεί σε κλειστούς χώρους να επεκταθεί και σε γειτονικά
φρούτα.
Γενικά, η παρουσία ιχνοποσοτήτων
αιθυλενίου στην ατμόσφαιρα (ακόμη και σε συγκεντρώσεις 0,01-0,1
ppm) κλειστών χώρων ανάπτυξης φυτών (π.χ. θερμοκήπια) ή
αποθήκευσης φυτικών καρπών μπορεί να έχει καταστρεπτικά
αποτελέσματα.
Να ληφθεί υπόψη, ότι μικρές συγκεντρώσεις
αιθυλενίου ενεργοποιούν τους μηχανισμούς ωρίμασης, με
αποτέλεσμα την παραγωγή επιπλέον ποσοτήτων αιθυλενίου, η
συγκέντρωση του οποίου έτσι αυξάνεται εκθετικά, αν δεν
πραγματοποιείται τα τακτικός αερισμός των χώρων.
Τεχνητή
ωρίμαση: Πολλά φρούτα διακινούνται
σκόπιμα στη διεθνή αγορά σε προκλιμακτηριακό στάδιο δηλ.
κόβονται πράσινα (άωρα).
Ιδιαίτερα
αυτό ισχύει για τις μπανάνες που κόβονται στον τόπο παραγωγής σε ημιώριμη μορφή
(πράσινες
μπανάνες). Στη συνέχεια, όταν
φτάσουν στον τόπο κατανάλωσής τους, υπόκεινται σε τεχνητή
ωρίμαση στα ωριμαντήρια (ripening facilities)και αμέσως μετά διατίθενται στις
τοπικές αγορές.
Στα ωριμαντήρια, η ωρίμαση (αποπρασινισμός)
των φρούτων πραγματοποιείται με ελεγχόμενη παροχή αιθυλενίου από κυλίνδρους
αερίου, που συνήθως πρέπει να συνδυάζεται με προσεκτικό έλεγχο της
θερμοκρασίας και της υγρασίας των αποθηκευτικών χώρων. Εναλλακτικά, μπορούν να χρησιμοποιηθούν οι ασφαλέστερες γεννήτριες αιθυλενίου που παρέχουν αιθυλένιο σε
ελεγχόμενες ποσότητες μέσω καταλυτικής διάσπασης αιθανόλης. Τυπικά,
τα φρούτα υπόκεινται σε επίδραση αιθυλενίου σε συγκεντρώσεις
0,05-0,2% v/v (500 έως 2000 ppm) για 24 έως 48 ώρες
στους 20ºC και τα
φρούτα.
Αν και το αιθυλένιο δεν είναι
τοξικό αέριο, η παρουσία αισθητήρων και μετρητών αιθυλενίου είναι
επιβεβλημένη αφενός μεν για τη ρύθμιση της συγκέντρωσής του στα
ωριμαντήρια, αφετέρου γιατί σε συγκεντρώσεις πάνω από 2% (20.000
ppm) μπορεί να δημιουργήσει με τον αέρα εκρηκτικό μίγμα.
Εναλλακτικά, αντί αερίου αιθυλενίου
μπορεί να χρησιμοποιηθεί η ένωση 2-χλωρο-αιθυλο-φωσφονικό οξύ,
γνωστή με την εμπορική ονομασία Ethephon.
Η ένωση αυτή μπορεί να δράσει ως "επιτόπια" πηγή
αιθυλενίου, αφού υδρολύεται ταχύτατα σε αλκαλικά διαλύματα παρέχοντας αιθυλένιο σύμφωνα με τη
συνολική
αντίδραση [Αναφ.
11]:
Cl-CH2CH2-PO(OH)2
+
4
ΟΗ-
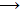 Cl-
+ CH2=CH2 + PO43-
+ 3 Η2Ο
Cl-
+ CH2=CH2 + PO43-
+ 3 Η2Ο
|
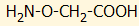 |
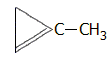 |
|
αμινο-oξυ-οξικό
οξύ
(AOA) |
1-μεθυλο-κυκλοπροπένιο
(1-MCP) |
Αναστολείς
ωρίμασης:
Το αιθυλένιο μπορεί να προκαλέσει μεγάλη οικονομική ζημιά στους
ανθοκόμους, φρουτοπαραγωγούς και στους προμηθευτές φυτικών
προϊόντων. 'Εχουν αναπτυχθεί μέθοδοι που αναστέλλουν τη
βιοσύνθεση αιθυλενίου, όπως και τη δυνατότητα δέσμευσης
(υποδοχής) του αιθυλενίου από τους
φυτικούς οργανισμούς. Τυπικός αναστολέας της βιοσύνθεσης του
αιθυλενίου είναι το αμινο-oξυ-οξικό
οξύ (aminooxyacetic
acid, AOA), που χρησιμοποιείται για την αύξηση της ζωής
των καλλωπιστικών φυτών στα ανθοδοχεία.
Εναλλακτικά, ουσίες οι οποίες
δεσμεύονται στους υποδοχείς αιθυλενίου των φυτών, μπλοκάρουν το
σήμα του αιθυλενίου και η ωρίμαση των φυτών
αναστέλλεται. Οι ουσίες αυτές δρουν ως ρυθμιστές ανάπτυξης (growth
regulators). Τυπικό παράδειγμα ουσίας-ανταγωνιστή του αιθυλενίου
είναι το 1-μεθυλο-κυκλοπροπένιο (1-MCP). H ουσία αυτή σε ιχνοποσότητες (ppb-ppm)
στην ατμόσφαιρα αναστέλλει δραστικά τη γήρανση των φυτικών
οργανισμών και χρησιμοποιείται για την αύξηση της ζωής
καλλωπιστικών φυτών, αλλά και βρώσιμων
λαχανικών (π.χ. το
σπανάκι). Στο εμπόριο διατίθεται με την εμπορική ονομασία
EthylBlock (Rohm and Haas), μια σκόνη που διαλυόμενη στο
νερό απελευθερώνει 1-MCP σε ποσοστό 0,14% του βάρους της [Αναφ. 12].
Κύκλος Yang
Η βιοσύνθεση του αιθυλενίου έχει
πλέον πλήρως διευκρινιστεί μετά τις προόδους στις τεχνικές της βιοχημικής
ανάλυσης και με τη χρήση ισοτοπικά σημασμένων (με C-14)
ενώσεων. Ο επιστήμονας ο οποίος συνέβαλε αποφασιστικά στη διευκρίνιση αυτού
του βιοσυνθετικού κύκλου ήταν ο κινεζικής (από την Ταϊβάν) καταγωγής καθηγητής
φυτοβιολογίας του Πανεπιστημίου της Καλιφόρνιας
Shang Fa Yang
(1932-2007), προς τιμήν του οποίου
ο βιοχημικός κύκλος αναφέρεται πλέον στη βιβλιογραφία ως βιοχημικός κύκλος Yang
[Αναφ. 13].
|
Δεξιά:
Ο κύκλος βιοσύνθεσης του αιθυλενίου στα φυτά (κύκλος Yang).
Βασικός είναι ο ρόλος του αμινοξέος μεθειονίνη (Met). Η έκλυση
αιθυλενίου διακόπτεται αν πάψουν να λειτουργούν τα εμπλεκόμενα ένζυμα: ACC
οξειδάση και ACC συνθετάση.
|
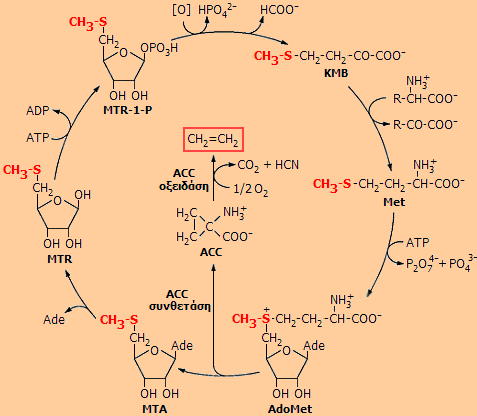 |
Ο
κύκλος Yang στην ουσία είναι κύκλος του αμινοξέος μεθειονίνη (Met). Η
μεθειονίνη μετατρέπεται σε S-αδενοσυλο-L-μεθειονίνη
(AdoMet), η οποία παρέχει την ένωση 1-αμινο-κυκλοπροπανο-1-καρβοξυλικό οξύ (ACC)
υπό την επίδραση ειδικού ενζύμου (ACC συνθετάση). Ακολουθεί η οξείδωση του ACC προς αιθυλένιο, διοξείδιο του άνθρακα και υδροκυάνιο υπό την επίδραση του ενζύμου ACC οξειδάση. Πράγματι, έχει διαπιστωθεί συσχέτιση μεταξύ της
του ρυθμού του εκλυόμενου αιθυλενίου, της συγκέντρωση του ACC και της
δραστικότητας της οξειδάσης του ACC. Ωστόσο, η ομάδα CH3S-
διατηρείται ως μεθυλο-θειο-αδενοσίνη (MTA), η οποία υδρολύεται ταχύτατα προς
μεθυλο-θειο-ριβόζη (MTR). Ακολουθεί φωσφορυλίωση και οξείδωση προς κετο-μεθυλο-θειο-βουτυρικό
οξύ (KMBT), που με τρανσαμίνωση ξαναδίνει μεθειονίνη. Το τοξικό υδροκυάνιο
δεν σωρεύεται αλλά καταστρέφεται με άλλες βιοχημικές αντιδράσεις.
 Το
συνολικό αποτέλεσμα του κύκλου Yang είναι η διατήρηση των επιπέδων
μεθειονίνης. 'Ετσι, ενώ το αιθυλένιο προέρχεται από το 3ο και 4ο άτομο
άνθρακα της μεθειονίνης, αυτά μέσω του κύκλου αναπληρώνονται από το τμήμα
ριβόζης του ATP. Δηλ. ουσιαστικά το αιθυλένιο προέρχεται από τη ριβόζη του
ATP. Το
συνολικό αποτέλεσμα του κύκλου Yang είναι η διατήρηση των επιπέδων
μεθειονίνης. 'Ετσι, ενώ το αιθυλένιο προέρχεται από το 3ο και 4ο άτομο
άνθρακα της μεθειονίνης, αυτά μέσω του κύκλου αναπληρώνονται από το τμήμα
ριβόζης του ATP. Δηλ. ουσιαστικά το αιθυλένιο προέρχεται από τη ριβόζη του
ATP.
Τα γονίδια τα οποία κωδικοποιούν
τα ένζυμα που εμπλέκονται στον σχηματισμό του ACC, όπως και στη διάσπασή του έχουν
χαρακτηρισθεί πλήρως. Έτσι, οι επιστήμονες με βιοτεχνολογικές τεχνικές πέτυχαν να
"σιγάσουν" αυτά τα γονίδια στις τομάτες και να αποτρέψουν με τον
τρόπο αυτό τον ενδογενή
σχηματισμό αιθυλενίου. Οι τομάτες που έχουν υποστεί αυτή τη γονιδιακή
τροποποίηση παραμένουν πράσινες και μπορούν να
αποθηκευθούν για μεγάλα χρονικά διαστήματα χωρίς να υποστούν ωρίμαση και να
αλλοιωθούν. Στη συνέχεια, οι τομάτες αυτές μεταφέρονται σε ωριμαντήρια και εκτίθενται σε αιθυλένιο, οπότε
αρχίζει η διαδικασία της ωρίμασης. Με τον τρόπο αυτό είναι δυνατή πλέον η
διάθεση τομάτας σε ουσιαστικά τέλεια κατάσταση σε όλη τη διάρκεια του χρόνου
[Αναφ. 10β]. |
Βιβλιογραφία - Πηγές από το
Διαδίκτυο
1.
(α) Merck Index, 12th ed, σελ. 645. (β)
Wikipedia: "Ethylene".
(γ) American Chemistry Council: "Ethylene: Product Stewardship Guidance Manual",
2004 (αρχείο
PDF, 210 KB). (δ) Gas
Encyclopedia (Air Liquid): "Ethylene".
2.
(α)
Plant-Hormones.info: "Ethylene".
(β) Erowid.org: "Oracle
at Delphi May Have Been Inhaling Ethylene Gas Fumes Theory of priestess's
trance state captures public's imagination"
(May 2007). (γ) Broad WJ (Northern Arizona
University): "For
Delphic Oracle, Fumes and Visions". (δ) Foster J, Lehoux D: "The
Delphic Oracle and the ethylene-intoxication hypothesis", Clinical
Toxicology 45:86-89, 2007 (αρχείο
PDF, 52 KB).
3. (α)
www.fact-index.com: "Ethylene".
(β) "Ethylene
focus",
Arabian Oil & Gas Staff ,
March 10th, 2009.
4. (α) www.chemguide.co.uk: "Bonding
in Ethylene". (β) Wikipedia: "Alkene".
5. (α) Wikipedia: "Oxidative
coupling of methane". (β) Lunsford
JH: "The Catalytic Oxidative Coupling of Methane", Angewandte Chemie,
34(9):970-980, 1995 (Abstract).
(γ) PracticalChemistry.org: "Dehydration
of Ethanol to form Ethene".
6. (α) Wikipedia: "Cracking
(chemistry)". (β) The Encyclopedia of Earth: "Cracking".
(γ) Zimmermann H, Walzi R (Linde AG): "Ethylene" (αρχείο
PDF, 98 KB).
7. (α) Peterson FM: "Commodity
Up-Cycle: Focus on Ethylene", ISM eDigest:
Chemicals, Vol.1(3), March 2004.
8. American Chemistry Council: "Handling
and Transportation Guide for Ethylene, Refrigerated Liquid (cryogenic
ethylene)", April 2004 (αρχείο
PDF, 5,54 ΜB).
9. (α) Πιτσικάλη Μ: "Πολυμερισμός
αιθυλενίου", Πανεπιστήμιο Αθηνών, Τμήμα Χημείας, Εργ. Βιομηχανικής Χημείας,
Αθήνα, 2011 (αρχείο
PDF, 1,22 MB). (β) Michigan State University, Chemistry Dep.: "Polymers".
(γ) Macrogalleria: "Ziegler-Natta
vinyl polymerization".
10. (α) Soare Chaves AL, de Mello-Farias
PC: "Ethylene
and fruit ripening: From illumination gas to the control of gene expression,
more than a century of discoveries (Review)", Genet. Mol. Biol.
29(3):508-515, 2006. (β) Plant Physiology Information Website (Koning
R): "Ethylene".
(γ) Pereira LFP, Galvão RM, Kobayashi AK, Cação SMB, Esteves Vieira LG: "Ethylene
production and ACC oxidase gene expression during fruit ripening of Coffea
arabica L.", Braz. J. Plant Physiol. 17(3):283-289, 2005.
11.
(α) Wikipedia: "Ethephon".
(β) Royal Society of Chemistry: "Ethephon" (αρχείο
PDF 94 KB). (γ)
Βαγιανός Μ, Λεβεντάκης Χ: "Εισροές φυτοπροστατευτικών προϊόντων στη
Βιολογική Γεωργία με βάση τον κανονισμό 2092/91", Πτυχιακή εργασία,
Εισηγητής: Παπαηλιάκης Μ (ΑΤΕΙ Κρήτης: Σχολής Τεχνολογίας Γεωπονίας,
Τμήμα Θρμοκηπιακών Καλλιεργειών @ Ανθοκομίας, 2003 (PDF
1,29 MB).


![]() Cl-
+ CH2=CH2 + PO43-
+ 3 Η2Ο
Cl-
+ CH2=CH2 + PO43-
+ 3 Η2Ο



 Γενικά
για το αιθυλένιο
Γενικά
για το αιθυλένιο



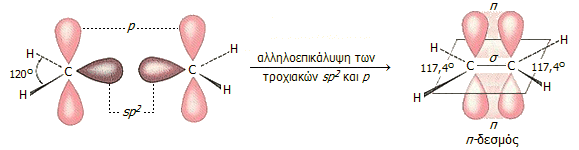




 Κυριότερες βιομηχανικές χρήσεις του
αιθυλενίου και χημικές αντιδράσεις του
Κυριότερες βιομηχανικές χρήσεις του
αιθυλενίου και χημικές αντιδράσεις του













 Το 1977, η ίδια ομάδα χρησιμοποιεί το
απομονωμένο προϊόν της μερικής υδρόλυσης του
Το 1977, η ίδια ομάδα χρησιμοποιεί το
απομονωμένο προϊόν της μερικής υδρόλυσης του 





 Το
συνολικό αποτέλεσμα του κύκλου Yang είναι η διατήρηση των επιπέδων
μεθειονίνης. 'Ετσι, ενώ το αιθυλένιο προέρχεται από το 3ο και 4ο άτομο
άνθρακα της μεθειονίνης, αυτά μέσω του κύκλου αναπληρώνονται από το τμήμα
ριβόζης του ATP. Δηλ. ουσιαστικά το αιθυλένιο προέρχεται από τη ριβόζη του
ATP.
Το
συνολικό αποτέλεσμα του κύκλου Yang είναι η διατήρηση των επιπέδων
μεθειονίνης. 'Ετσι, ενώ το αιθυλένιο προέρχεται από το 3ο και 4ο άτομο
άνθρακα της μεθειονίνης, αυτά μέσω του κύκλου αναπληρώνονται από το τμήμα
ριβόζης του ATP. Δηλ. ουσιαστικά το αιθυλένιο προέρχεται από τη ριβόζη του
ATP.