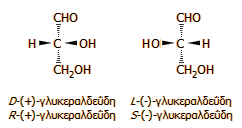Γενικά για το τρυγικό οξύ
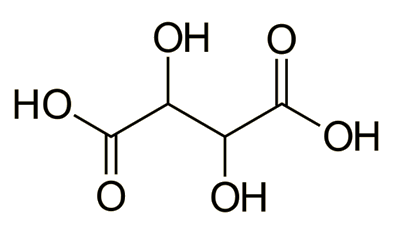
Το τρυγικό οξύ (tartaric acid) (2,3-διυδροξυ-βουτανοδιοϊκό οξύ ή 2,3-διυδροξυ-ηλεκτρικό οξύ, H2C4H4O6) είναι μια λευκή κρυσταλλική ουσία ευδιάλυτη στο νερό. Πρόκειται για ένα σχετικά ασθενές διπρωτικό οργανικό οξύ, που βρίσκεται σε πολλά φυτά και καρπούς και κυρίως στα σταφύλια. Το τρυγικό οξύ και τα άλατά του λαμβάνονται ως παραπροϊόντα κατά τη ζύμωση του γλεύκους και αποτελεί το κύριο οξύ το οποίο προσδίδει στους οίνους τη χαρακτηριστική τους οξύτητα. Η ολική οξύτητα των οίνων, εκφραζόμενη σε τρυγικό οξύ, βρίσκεται στην περιοχή 0,4-1,0%. Το όξινο τρυγικό κάλιο είναι σχετικά δυσδιάλυτο και αποτελεί τη μορφή υπό την οποία καθιζάνει το τρυγικό οξύ κατά την αλκοολική ζύμωση, καθώς η διαλυτότητά του περιορίζεται όσο αυξάνεται η περιεκτικότητα του γλεύκους (μούστου) σε αλκοόλη.Το ίζημα από όξινο τρυγικό κάλιο, μικρές ποσότητες τρυγικού ασβεστίου και διάφορες οργανικές προσμίξεις (που συνήθως του προσδίδουν κάποιο χρώμα) αποτελεί την τρυγία (tartar). Το τρυγικό οξύ έχει ελάχιστη τοξικότητα και χρησιμοποιείται ευρύτατα στη βιομηχανία τροφίμων ως παράγοντας οξύνισης (acidulant), στα οποία προσδίδει μια ευχάριστη ήπια όξινη γεύση και επιπλέον δρα ως αντιοξειδωτικό (πρόσθετο Ε334).
 |
 |
 |
 |
|
Από τα σταφύλια λαμβάνεται ο μούστος κατά τη ζύμωση του οποίου καθιζάνει σταδιακά η τρυγία, μια ακάθαρτη μορφή όξινου τρυγικού καλίου. Με ανακρυστάλλωση της τρυγίας και χρήση αποχρωματιστικών μέσων (π.χ. ενεργός άνθρακας) λαμβάνεται καθαρό όξινο τρυγικό κάλιο γνωστό ως κρεμόριο ή κρεμοτάρταρο (cream of tartar), το οποίο χρησιμοποιείται στη μαγειρική και στη ζαχαροπλαστική. Το όξινο τρυγικό κάλιο είναι η κύρια φυσική πηγή παρασκευής τρυγικού οξέος και των υπόλοιπων ενώσεών του. |
|||
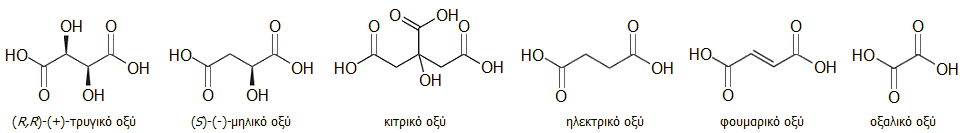
Το τρυγικό οξύ μόνο στο χυμό των σταφυλιών βρίσκεται σε σχετικά μεγάλες συγκεντρώσεις, οι οποίες μειώνονται κατά τη διαδικασία ωρίμανσής τους. Στους χυμούς των περισσότερων καρπών κυριαρχούν τα υδροξυοξέα κιτρικό οξύ (citric acid) και S-μηλικό οξύ (malic acid, λατινικά: malum = μήλο). Πλήθος άλλων οξέων συναντώνται σε μικρότερες ποσότητες. Μεταξύ αυτών των "δευτερευόντων" οξέων περιλαμβάνονται το ηλεκτρικό οξύ (succinic acid, λατινικά: succinum = ήλεκτρο, κεχριμπάρι), το φουμαρικό οξύ (fumaric acid) και το τοξικό οξαλικό οξύ (oxalic acid) [Αναφ. 1δ].
Η ιστορία του τρυγικού οξέος
Το τρυγικό οξύ υπό τη μορφή της τρυγίας είναι γνωστό στον άνθρωπο από τους νεολιθικούς χρόνους, αφού ίχνη τρυγικών αλάτων έχουν βρεθεί σε πιθάρια που χρονολογούνται από το 7.000 π.Χ. (περιοχή των ορέων Ζάγρος στο σημερινό Βόρειο Ιράν) [Αναφ. 2]. Η εμφάνιση του κρυσταλλικού ιζήματος της τρυγίας κατά τη ζύμωση του γλεύκους ήταν γνωστή στους αρχαίους πολιτισμούς (Αιγυπτίων, Ελλήνων, Ρωμαίων).
Το ~800 μ.Χ., το όξινο τρυγικό κάλιο (potassium acid tartrate, potassium bitartrate, KHC4H4O6), το κύριο συστατικό της τρυγίας, χαρακτηρίστηκε ως ξεχωριστή ουσία από τον διάσημο Πέρση αλχημιστή Jabir ibn Hayyan, ο οποίος στους αλχημιστικούς κύκλους της Ευρώπης του μεσαίωνα ήταν γνωστός ως ο "πρώτος των αλχημιστών" με το όνομα Geber. Το άλας αυτό υπήρξε μία από τις λίγες καθαρές οργανικές ουσίες που ήταν γνωστές στους αλχημιστές.
 |
 |
 |
 |
 |
 |
| Πιθάρι στο οποίο βρέθηκαν μικρές ποσότητες τρυγικών αλάτων και αποτελεί την αρχαιότερη (7.000 π.Χ.) ένδειξη παρασκευής οίνου [Αναφ. 2α]. |
Geber (Jaber Ibn Hayan, 721(;)-815, Βαγδάτη). Αναγνώρισε την τρυγία ως ξεχωριστή ουσία. |
Αλχημιστικά σύμβολα της τρυγίας |
Συλλέκτης τρυγίας. Εικόνα από βιβλίο του 1497. | Εκπληκτικά κρυσταλλικά συσσωματώματα τρυγίας. |
(1742-1786). Ο πρώτος που απομόνωσε το τρυγικό οξύ. |
Το 1769, ο Σουηδός φαρμακοποιός και χημικός Carl Wilhelm Scheele (1742-1786), μεταξύ του πλήθους των χημικών ανακαλύψεών του, απομόνωσε για πρώτη φορά το καθαρό τρυγικό οξύ από την τρυγία. Ο Scheele έβρασε τρυγία με κιμωλία (ανθρακικό ασβέστιο) και στη συνέχεια επέδρασε στο δυσδιάλυτο τρυγικό ασβέστιο με θειικό οξύ και απομάκρυνε το ίζημα από θειικό ασβέστιο. Με συμπύκνωση του υπερκείμενου διαλύματος έλαβε κρυσταλλικό τρυγικό οξύ:
![]()
Το 1819, ο Γάλλος βιομήχανος Paul Kester απομόνωσε μια δεύτερη μορφή τρυγικού οξέος (που ήταν το DL-τρυγικό οξύ) από τα μητρικά υγρά κρυστάλλωσης της τρυγίας. Το 1828, ο Joseph Louis Gay-Lussac ήταν εκείνος που το ονόμασε ρακεμικό οξύ (racemic acid) και απέδειξε ότι είχε την ίδια σύσταση με το τρυγικό οξύ. Τα ευρήματά του Gay Lussac επιβεβαίωσε και ο Berzelius, ο οποίος χαρακτήρισε τα δύο οξέα ισομερή [Αναφ. 2δ].
Κατά τα τέλη του 19ου αιώνα τρυγικό οξύ και τρυγικά άλατα παράγονταν πλέον σε ποσότητες λίγων χιλιάδων τόννων (αναφέρεται ετήσια παραγωγή της τάξης των πέντε χιλιάδων τόννων κατά το 1890). Το τρυγικό οξύ και τα άλατά χρησιμοποιούσαν τότε (όπως και σήμερα) σε μεγάλες ποσότητες στην υφαντουργία ως πρόστυμμα (mordant), όπως επίσης και ως πρόσθετο στη βιομηχανία τροφίμων και στη φαρμακοβιομηχανία ως συστατικό διαφόρων φαρμάκων (π.χ. ως τρυγικά άλατα φαρμακευτικώς δραστικών οργανικών βάσεων ή στα αναβράζοντα δισκία).
Από ιστορική
άποψη το τρυγικό οξύ
κατέχει μια ξεχωριστή θέση στη Χημεία. Το μικτό
άλας του τρυγικού οξέος με νάτριο και αμμώνιο (τρυγικό νατριοαμμώνιο,
NaNH4C4H4O6![]() 4H2O), υπήρξε η
πρώτη χημική ουσία που χωρίστηκε σε "οπτικούς αντίποδες" από τον
Louis Pasteur
(1847), γεγονός που συνέβαλε στην κατανόηση της δομής των
οργανικών ενώσεων και ειδικά της οπτικής στερεοϊσομέρειας (χειραλικότητα).
4H2O), υπήρξε η
πρώτη χημική ουσία που χωρίστηκε σε "οπτικούς αντίποδες" από τον
Louis Pasteur
(1847), γεγονός που συνέβαλε στην κατανόηση της δομής των
οργανικών ενώσεων και ειδικά της οπτικής στερεοϊσομέρειας (χειραλικότητα).
Ολική σύνθεση τρυγικού οξέος. Ο χημικός τύπος του τρυγικού οξέος διευκρινίστηκε σταδιακά κατά τη δεκαετία 1850-60. Για πρώτη φορά αναφέρθηκε ο σωστός συντακτικός τύπος του το 1858 (A. S. Couper, Phil. Mag. 16, 104 (1858)). Το L-(+)τρυγικό οξύ υπήρξε η πρώτη χειραλική φυσική ένωση της οποίας πραγματοποιήθηκε η ολική σύνθεση στο εργαστήριο (ξεκινώντας από το αιθυλένιο) από ερευνητές που απασχολήθηκαν με το φαινόμενο της χειραλικότητας (Simpson, Perkin και Duppa, Kekule και Pasteur). Η αλληλουχία των αντιδράσεων ήταν η ακόλουθη [Αναφ. 2δ]:
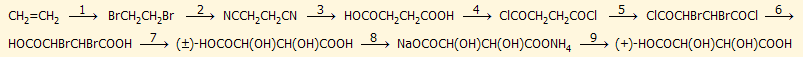
Το αιθυλένιο βρωμιώνεται παρέχοντας 1,2-διβρωμοαιθάνιο (αντίδραση 1). Το 1,2-διβρωμοαιθάνιο μετατρέπεται (π.χ. με αντίδραση με AgCN) σε 1,2-δικυανοαιθάνιο (αντίδραση 2) το οποίο υδρολύεται προς ηλεκτρικό οξύ (βουτανοδιικό οξύ) (αντίδραση 3). Το ηλεκτρικό οξύ μετατρέπεται στο αντίστοιχο διακυλοχλωρίδιο (π.χ. με αντίδραση με PCl3) (αντίδραση 4), το οποίο υπόκειται σε βρωμίωση προς το 2,3-διβρωμοπαράγωγο (αντίδραση 5). Το διβρωμιωμένο διακυλοχλωρίδιο υδρολύεται προς διβρωμοηλεκτρικό οξύ (αντίδραση 6). Υδρόλυση του άλατος με άργυρο του διβρωμοηλεκτρικού οξέος παρέχει το ρακεμικό μίγμα D(-) και L(+) τρυγικού οξέος (αντίδραση 7). Το ρακεμικό μίγμα μετατρέπεται σε μικτό άλας νατρίου-αμμωνίου (αντίδραση 8). Κατά την κρυστάλλωση του μικτού άλατος σχηματίζονται διακριτοί κρύσταλλοι των δύο στερεοϊσομερών μορφών του τρυγικού οξέος, οι οποίοι μπορούν να διαχωριστούν μεταξύ τους με το χέρι με τη βοήθεια μεγεθυντικού φακού και μιας λαβίδας (μέθοδος Pasteur, βλ. παρακάτω).
Mορφές του τρυγικού οξέος και τρόποι παρασκευής τους
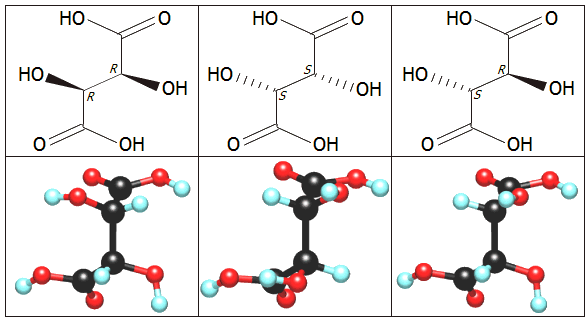
Το τρυγικό οξύ διαθέτει δύο "στερεογονικά" κέντρα, οπότε θα έπρεπε να απαντά από 22 = 4 χειραλικές μορφές τις: RR, SS, RS και SR. Ωστόσο, λόγω της συμμετρίας του μορίου του, οι RS και οι SR μορφές συμπίπτουν. 'Ετσι, υπάρχουν τρεις διαφορετικές στερεοϊσομερείς μορφές τρυγικού οξέος: το (R,R)-(+)-τρυγικό οξύ, το (S,S)-(-)-τρυγικό οξύ και το (R,S)-τρυγικό οξύ. Ακόμη υπάρχει η ρακεμική μορφή του τρυγικού οξέος, δηλαδή ισομοριακό μίγμα του (R,R)-(+)-τρυγικού οξέος και του (S,S)-(-)-τρυγικού οξέος.
Να σημειωθεί ότι τα (R,R)-(+)-τρυγικό οξύ και (S,S)-(-)-τρυγικό οξύ είναι μεταξύ τους εναντιομερή (enantiomers), αφού το ένα είναι κατοπτρικό είδωλο του άλλου, ενώ το (R,S)-τρυγικό οξύ είναι διαστερεομερές (diastereomer) ως προς τα δύο προηγούμενα. Οι απλές παραστάσεις του (προβολές Fischer) και οι κυριότερες φυσικοχημικές ιδιότητές τους δίνονται στο επόμενο πίνακα [Αναφ. 3]:

|
* Παρατίθενται οι συνηθέστεροι τρόποι ονομασίας των διάφορων μορφών του τρυγικού οξέος. Οι στερεοχημικοί προσδιορισμοί (stereochemical desciptrors) D- (dextrus: δεξιός) και L- (laevus: αριστερός περιγράφουν τα εναντιομερή με βάση τη σχετική θέση των ομάδων με αναφορά στο μόριο της γλυκεραλδεΰδης (σύστημα Fischer), ενώ οι προσδιορισμοί S- (sinister: αριστερός) και R- (rectus: δεξιός) παρέχουν την απόλυτη θέση των ομάδων με βάση τους κανόνες προτεραιότητας των Cahn, Ingold και Prelog ("προτεραιότητα CIP"). Οι "σχετικοί" προσδιορισμοί D- και L- προτιμούνται ακόμη από τους βιοχημικούς (π.χ. για τα αμινοξέα και τα σάκχαρα), ενώ οι "απόλυτοι" προσδιορισμοί S- και R- προτιμούνται από τους χημικούς λόγω της γενικότερης χρησιμότητάς τους. Τα πρόσημα (+) και (-) είναι φαινομενολογικοί προσδιορισμοί, αφού δεν παρέχουν στερεοχημικές πληροφορίες για τα μόρια, παρά μόνο το πρόσημο της ειδικής στροφικής ικανότητάς τους (δεξιόστροφα, αριστερόστροφα) και συχνά στη θέση τους (στην παλαιότερη βιβλιογραφία) χρησιμοποιούνται τα πεζά d-(dextrus: δεξιός) και l- (laevus: αριστερός). ** [Αναφ. 1γ] |
|
Διαφορετικές παραστάσεις στο χώρο (συμβολικά και τρισδιάστατα) των μορίων των (από αριστερά προς τα δεξιά): (+)-τρυγικού οξέος, (-)-τρυγικού οξέος και του μεσο-τρυγικού οξέος. |
L(+)-τρυγικό οξύ. Το φυσικό τρυγικό οξύ είναι το δεξιόστροφο τρυγικό οξύ ή (R,R)-(+)-τρυγικό οξύ ή L-τρυγικό οξύ ή απλά (+)-τρυγικό οξύ. Είναι η κυριότερη και πλέον φθηνή μορφή τρυγικού οξέος.
Αποτελεί χρήσιμο παραπροϊόν της οινοποιίας και παρασκευάζεται (απομονώνεται) σε ποσότητες δεκάδων χιλιάδων τόννων ετησίως από την οινολάσπη (argols, lees) είναι ένα είδος ακάθαρτης τρυγίας, που συλλέγεται από την υποστάθμη των οινοβαρελιών. Η οινολάσπη θερμαίνεται με αραιό υδροχλωρικό οξύ και εξουδετερώνεται με υδροξείδιο του ασβεστίου σχηματίζοντας δυσδιάλυτο τρυγικό ασβέστιο. Στο τρυγικό ασβέστιο που παράγεται, προστίθεται αραιό θειικό οξύ και με συμπύκνωση παραλαμβάνεται το ελεύθερο L-τρυγικό οξύ. Αναφέρονται και βιοτεχνολογικές μέθοδοι παρασκευής τρυγικού οξέος που βασίζονται στη ζύμωση σακχάρων.
D(-)-τρυγικό οξύ. Το αριστερόστροφο τρυγικό οξύ ή (S,S)-(-)-τρυγικό οξύ ή D-τρυγικό οξύ ή απλά (-)-τρυγικό οξύ, σε αντίθεση με το δεξιόστροφο τρυγικό οξύ, δεν δημιουργείται από βιοχημικές διαδικασίες στη φύση. Παρασκευάζεται στο εργαστήριο σε μικρές ποσότητες μόνο με διαχωρισμό του DL-τρυγικού οξέος σε οπτικούς αντίποδες. 'Αλλοι τρόποι βασίζονται στη βακτηριακή καταστροφή του (+)-τρυγικού οξέος του DL-τρυγικού οξέος. Το (-)-τρυγικό οξύ αποτελεί την πιο "δυσεύρετη" μορφή του τρυγικού οξέος.
DL-τρυγικό οξύ. Δεν αποτελεί ξεχωριστή χημική μορφή αφού πρόκειται για μίγμα. Το DL-τρυγικό οξύ ή ρακεμικό οξύ (racemic acid, από τη λατινική λέξη: racemus = τσαμπί σταφυλιών) ή rac-τρυγικό οξύ. Παλαιότερα αναφερόταν και ως παρατρυγικό οξύ (paratartaric acid). Σε παλαιά ελληνικά συγγράμματα το ρακεμικό οξύ αποδίδεται ως σταφυλικό οξύ. Είναι ισομοριακό μίγμα των δύο προηγούμενων εναντιομερών μορφών και ως εκ τούτου τα διαλύματά του δεν στρέφουν το επίπεδο πολωμένου φωτός, αφού η στροφική δράση του ενός εναντιομερούς εξουδετερώνεται επακριβώς από τη στροφική δράση του άλλου. Συναντάται σε μικρές ποσότητες στα προϊόντα της ζύμωσης του γλεύκους.
Το DL-τρυγικό οξύ μπορεί να παρασκευασθεί με θέρμανση του αλάτων του φυσικού τρυγικού οξέος (L-τρυγικό οξύ) παρουσία περίσσειας ισχυρής βάσης, οπότε επέρχεται μερική ρακεμοποίηση και συγχρόνως παράγεται μια ποσότητα μεσο-τρυγικού οξέος [Αναφ. 3ζ]. Κατά την οξύνιση και συμπύκνωση του μίγματος και λόγω μικρότερης διαλυτότητας, λαμβάνονται πρώτα κρύσταλλοι DL-τρυγικού οξέος, που διαχωρίζονται έτσι εύκολα από το αμετάβλητο L-τρυγικό οξύ και το μεσοτρυγικό οξύ.
To DL-τρυγικό οξύ αποτελεί και αυτό βιομηχανικό προϊόν και παρασκευάζεται σε μεγάλη κλίμακα μέσω οξείδωσης του μηλεϊνικού οξέος (ή του ανυδρίτη του) συνήθως με υπεροξείδιο του υδρογόνου παρουσία καταλύτη (μολυβδαινικά άλατα, βολφραμικό οξύ) [Αναφ. 1γ, 3η, 3θ], π.χ.:
![]()
'Αλλος τρόπος παρασκευής του DL-τρυγικού οξέος (F. Pollak, Monats., 1894, 15, p. 469) βασίζεται στην υδρόλυση της κυανυδρίνης της γλυοξάλης (προϊόν οξείδωσης της αιθυλενογλυκόλης):
![]()
 Μεσο-τρυγικό
οξύ. Η τρίτη μορφή τρυγικού οξέος
είναι το (R,S)-τρυγικό οξύ ή (συνηθέστερα)
μεσο-τρυγικό οξύ (meso-tartaric acid). Παλαιότερη
ονομασία του (εκ του τρόπου παρασκευής του) είναι
πυροτρυγικό οξύ (pyrotartaric acid). Αυτή η μορφή του
τρυγικού οξέος δεν απαντάται στη φύση. Παρασκευάζεται και
αυτό εύκολα, π.χ. με θέρμανση του φυσικού τρυγικού οξέος με νερό σε
αναλογία 8:1 στους 165ºC για περίπου δύο ώρες
[Αναφ. 3β].
Μεσο-τρυγικό
οξύ. Η τρίτη μορφή τρυγικού οξέος
είναι το (R,S)-τρυγικό οξύ ή (συνηθέστερα)
μεσο-τρυγικό οξύ (meso-tartaric acid). Παλαιότερη
ονομασία του (εκ του τρόπου παρασκευής του) είναι
πυροτρυγικό οξύ (pyrotartaric acid). Αυτή η μορφή του
τρυγικού οξέος δεν απαντάται στη φύση. Παρασκευάζεται και
αυτό εύκολα, π.χ. με θέρμανση του φυσικού τρυγικού οξέος με νερό σε
αναλογία 8:1 στους 165ºC για περίπου δύο ώρες
[Αναφ. 3β].
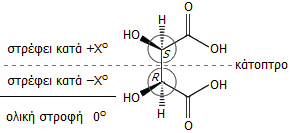
Παρ' όλο που το μεσο-τρυγικό οξύ περιέχει δύο στερεογονικά κέντρα, η στροφική ικανότητά του είναι μηδενική και αυτό οφείλεται στη συμμετρία του μορίου χάρις στην οποία η στροφική δράση του μισού τμήματος αντισταθμίζεται επακριβώς από την ίση και αντίθετη του υπόλοιπου μισού (βλ. σχήμα αριστερά).
Είναι προφανές ότι κάθε διατάραξη της συμμετρίας του μεσο-τρυγικού οξέος με την εισαγωγή κάποιας ομάδας θα οδηγούσε σε προϊόν με στροφική ικανότητα (π.χ. στις περιπτώσεις εστεροποίησης ενός μόνο καρβοξυλίου ή ακετυλίωσης ενός μόνο υδροξυλίου).
Θα πρέπει εδώ να σημειωθεί ότι το πρόθημα μεσο- είναι γενικό για τις ενώσεις που διαθέτουν στερεογονικά κέντρα, αλλά οι ίδιες δεν είναι χειραλικές λόγω εσωτερικής αντιστάθμισης.
Πού εντοπίζονται οι διαφορές. Αξίζει να σημειωθεί ότι ενώ τα D- και L-τρυγικά οξέα έχουν τα ίδια σημεία τήξεως, το DL-τρυγικό οξύ και το μεσο-τρυγικό οξύ έχουν διαφορετικά σημεία τήξεως. Οι διαφορές μεταξύ των εναντιομερών και του ρακεμικού μίγματός τους εντοπίζονται πάντοτε μόνο στις στερεές μορφές τους και οφείλονται στο διαφορετικό "πακετάρισμα" των μορίων στους κρυστάλλους τους. Οι διάφορες περιπτώσεις ρακεμικών μιγμάτων και η διαφοροποίηση του σημείου τήξεώς τους σε σχέση με τις καθαρές εναντιομερείς μορφές συζητούνται σε κάποια έκταση στην [Αναφ. 3β], όπου παρουσιάζονται και τα αντίστοιχα διαγράμματα φάσεων.
Χαρακτηριστική επίσης είναι η μεγάλη διαφορά στις διαλυτότητες των όξινων αλάτων με κάλιο. Η διαλυτότητα του άλατος του μεσο-τρυγικού οξέος είναι κατά πολύ μεγαλύτερη των αντίστοιχων αλάτων των D-, L- ή DL-τρυγικών οξέων. Επίσης το μεσο-τρυγικό οξύ είναι κατά τι ασθενέστερο οξύ σε σχέση με τα D- και L- (επομένως και του DL-) τρυγικά οξέα, λόγω της διαφορετικής στερεοχημικής διαμόρφωσης του μορίου που επαγωγικά επιδρά στην ευκολία απόσπασης των ιόντων υδρογόνου.
Γενικά, το μεσο-τρυγικό οξύ, ως διαστερεομερές έναντι των άλλων στερεοϊσομερών μορφών (D- και L-) του τρυγικού οξέος αναμένεται να διαφέρει ως προς τις τιμές φυσικών και φυσικοχημικών ιδιοτήτων, σε αντίθεση με τις εναντιομερείς μορφές, οι οποίες διαφέρουν μεταξύ τους μόνο ως προς την ειδική στροφική ικανότητα (specific rotation). Σημειώνεται ότι οι εναντιομερείς ενώσεις μπορεί να διαφέρουν σε εξαιρετικά μεγάλο βαθμό ως προς τις βιοχημικές ιδιότητές τους (βλ. ένωση του μήνα: Θαλιδομίδη).
|
Το τρυγικό οξύ και η απόλυτη στερεοαπεικόνιση των χειραλικών ενώσεων άνθρακα
Το σχετικό σύστημα στερεοαπεικόνισης με τους προσδιορισμούς D- και L- (σύστημα Fischer, 1891) παρέχει τη "σχετική" θέση των υποκαταστατών στο τετράεδρο των δεσμών του άνθρακα, εκκινώντας από μια "υποθετική" σταδιακή σύνθεση της υπό εξέταση ένωσης από ένα μόριο αναφοράς, το οποίο είναι η γλυκεραλδεΰδη και με παραδοχή μιας αυθαίρετης διευθέτησης στον χώρο των τεσσάρων ομάδων που συνδέονται με τον χειραλικό άνθρακά της. Ο Fischer ενδιαφερόταν να έχει μια δομή "αναφοράς" και όχι την πραγματική, αφού δεν υπήρχε η δυνατότητα τότε να "δει" κάποιος τις θέσεις των ομάδων στο μόριο. 'Ηξερε πολύ καλά ότι η επιλογή του είχε πιθανότητα 50% να είναι ορθή και 50% να είναι εσφαλμένη.
Σε αντίθεση με το
προηγούμενο σχετικό σύστημα, το απόλυτο σύστημα
στερεοαπεικόνισης με τους προσδιορισμούς R- και S- παρέχει την
πραγματική θέση στον χώρο και αυτό χάρις στο μικτό άλας
του τρυγικού οξέος με νάτριο και ρουβίδιο NaRb-(+)C4H4O6 Το 1951, ο Johannes Martin Bijvoet (1892-1980) με κρυσταλλογραφική μελέτη (με ακτίνες Χ) αυτού του άλατος προσδιόρισε τις πραγματικές (απόλυτες) θέσεις των τεσσάρων ομάδων στο χώρο. 'Ετσι, αποδείχθηκε τελικά πως η αυθαίρετη επιλογή του Fischer ήταν και η πραγματική (από καθαρή τύχη), οπότε οι "σχετικοί" προσδιορισμοί D- και L- συμπίπτουν με τους "απόλυτους" προσδιορισμοί R- και S-, αντιστοίχως [Αναφ. 3β, 4]. Ωστόσο, θα πρέπει να τονισθεί ότι ακόμα και αν είναι γνωστή η απόλυτη στερεοαπεικόνιση μιας χειραλικής ένωσης, δεν είναι δυνατόν να προβλεφθεί αν αυτή θα είναι αριστερόστροφη (- ή l-) ή δεξιόστροφη (+ ή d-) ως προς το επίπεδο του πολωμένου φωτός. Μάθημα πάνω στη Στερεοχημεία (Πανεπιστήμιο Yale) Μια εξαιρετικά διευκρινιστική και υποδειγματική διάλεξη ενώπιον φοιτητικού ακροατηρίου, σχετικά με τα συστήματα D/L και R/S, τα συστήματα cis/trans και Ε/Ζ, τη στερεοχημεία των διάφορων μορφών του τρυγικού οξέος, για το ιστορικό πείραμα του Pasteur και τον διαχωρισμό διαστερεομερών, από τον Καθηγητή J. M. McBride (Πανεπιστήμιο Yale) μπορεί αναζητηθεί εδώ) [Οι αγγλικοί υπότιτλοι διευκολύνουν σημαντικά την κατανόηση της παρουσίασης]. |
Χημικές ιδιότητες τρυγικού οξέος
|
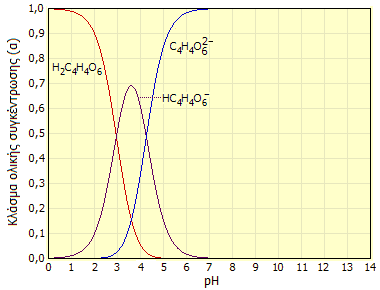
Κατανομή των σωματιδίων του τρυγικού οξέος ως προς το pH του υδατικού διαλύματος (ισχύει για τα D-, L- και DL-τρυγικά οξέα). Για το μεσο-τρυγικό οξύ οι καμπύλες κατανομής θα είναι μετατοπισμένες κατά +0,3 πεχαμετρικές μονάδες. |
Το τρυγικό οξύ ως ασθενές οξύ. Το τρυγικό οξύ δρα ως τυπικό σχετικά ασθενές διπρωτικό οξύ διιστάμενο σε δυο στάδια σύμφωνα με τις ισορροπίες:
![]()
όπου για το D-, το L- και το DL-τρυγικό οξύ είναι pK1 = 2,95 και pK2 = 4,25 και επομένως το τρυγικό οξύ είναι ασθενέστερο από το φωσφορικό οξύ, ισχυρότερο όμως από το οξικό οξύ. Το διάγραμμα κατανομής των τριών σωματιδίων του οξέος ως συνάρτηση του pH δείχνεται παραπλεύρως.
Από το διάγραμμα προκύπτει ότι για διαλύματα με pH>6,5 πρακτικώς στο σύνολό του το τρυγικό οξύ βρίσκεται υπό τη μορφή διφορτισμένου ανιόντος, ενώ δεν υπάρχει περιοχή pH όπου αποκλειστική μορφή του να είναι το μονοφορτισμένο ανιόν. Το μονοφορτισμένο ανιόν του εμφανίζεται σε μέγιστο ποσοστό (περίπου 70%) σε pH 3,5-3,7, που αποτελεί και την τυπική περιοχή του pH των διαφόρων οίνων.
Περισσότερα για τα διαγράμματα κατανομής πολυπρωτικών οξέων και για το πώς υπολογίζονται τα διαγράμματα αυτά, όπως και μια απλή μικροεφαρμογή (applet) που διευκολύνει τη σχεδίασή τους, μπορούν να αναζητηθούν στην [Αναφ. 5].
Οξείδωση και αναγωγή του τρυγικού οξέος. Το τρυγικό οξύ δρα ως ήπια αναγωγική ουσία και οξειδώνεται από ισχυρά οξειδωτικά αντιδραστήρια. 'Ετσι, οξειδώνεται από όξινα διαλύματα διχρωμικών, υπερμαγγανικών και αλάτων δημητρίου(IV) με στοιχειομετρία που εξαρτάται από τις συνθήκες, παρέχοντας ως τελικά προϊόντα μυρμηκικό οξύ και διοξείδιο του άνθρακα. Με υπεροξείδιο του υδρογόνου παρουσία αλάτων του Fe(II) (αντιδραστήριο Fenton), οξειδώνεται προς το σχετικά ασταθές δι-υδροξυμηλεϊνικό οξύ (dihydroxymaleic acid), το οποίο σε υδατικά διαλύματα διασπάται προς γλυκολαλδεΰδη (glycolaldehyde) και CO2 [Αναφ. 6α]:
![]()
Ως ένωση με γειτονικά υδροξύλια (vic-glycol) αντιδρά, το τρυγικό οξύ αντιδρά σε αραιά υδατικά διαλύματα σε θερμοκρασία δωματίου με υπεριωδικά άλατα (αντίδραση Malaprade) παρέχοντας γλυοξυλικό οξύ (glyoxylic acid). Περίσσεια υπεριωδικών ιόντων οξειδώνουν βραδέως το γλυοξυλικό οξύ προς μυρμηκικό οξύ και CO2:
![]()
Το τρυγικό οξύ κάτω από έντονα αναγωγικές συνθήκες (π.χ. με θέρμανση σε κλειστό σωλήνα με μίγμα HI και φωσφόρου) ανάγεται προς μηλεϊνικό οξύ και στη συνέχεια προς ηλεκτρικό οξύ [Αναφ. 6β]:
![]()
Τυπικές αντιδράσεις καρβοξυλομάδων και υδροξυλομάδων: Το τρυγικό οξύ, ως υδροξυοξύ παρέχει αντιδράσεις τυπικές οργανικών οξέων και αλκοολών. Ενδιαφέρον παρουσιάζει το διακετυλιωμένο τρυγικό οξύ, μορφή υπό την οποία και μόνο μπορεί να ληφθεί ο αντίστοιχος ανυδρίτης. Ο λαμβανόμενος ανυδρίτης μπορεί να αντιδράσει στη συνέχεια με αλκοόλες και αμίνες. Τυπικό παράδειγμα αποτελεί η σύνθεση εστέρων του διακετυλιωμένου τρυγικού οξέος με μονο- ή δι-γλυκερίδια ανώτερων λιπαρών οξέων. Η αλληλουχία των αντιδράσεων παρασκευής τους είναι η ακόλουθη:
![]()
Μίγμα των λαμβανόμενων εστέρων με τα μονο- ή δι-γλυκερίδια, ως έχουν ή μετά την απομάκρυνση μίας ή και των δύο ακετυλομάδων από το διακετυλο-τρυγικό οξύ, χρησιμοποιούνται ως γαλακτωματοποιητικά πρόσθετα στη βιομηχανία τροφίμων (E471, E472d-f) [Αναφ. 6γ].
Θέρμανση - συμπύκνωση του τρυγικού οξέος: Κατά τη θέρμανση του τρυγικού οξέος υπό ελεγχόμενες συνθήκες (θέρμανση στους 170ºC για περίπου 120 ώρες) λαμβάνεται ένα διμερές, μια κυκλική λακτάμη, σύμφωνα με την αντίδραση:
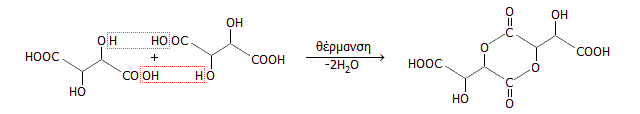
Η ουσία αυτή με προσμίξεις προϊόντων περαιτέρω συμπύκνωσης είναι γνωστή ως μετατρυγικό οξύ (metatartaric acid). Το μετατρυγικό οξύ χρησιμοποιείται στη βιομηχανία τροφίμων ως γαλακτωματοποιητής (Ε353) και στην οινοποιία ως σταθεροποιητής. Προσθήκη μετατρυγικού οξέος σε συγκεντρώσεις 50-100 mg/L, προλαμβάνει την κρυστάλλωση και την καθίζηση του όξινου τρυγικού καλίου μετά τη διαδικασία διαύγασης [Αναφ. 6δ-στ].
 |
 |
| "Εμετικό κύπελλο" του 17ου αιώνα και η δερμάτινη θήκη του | Ο χημικός τύπος του άλατος του καλίου με το ανιοντικό σύμπλοκο τρυγικών - αντιμονίου, γνωστό ως "εμετική τρυγία" |
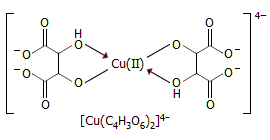
Τα τρυγικά άλατα ως συμπλεκτικά μέσα. Τα τρυγικά ανιόντα δρουν ως συμπλεκτικά μέσα, ιδιαίτερα προς μεταλλικά ιόντα τα οποία υπόκεινται εύκολα σε υδρόλυση. Παρουσία περίσσειας τρυγικών ανιόντων αποφεύγεται η υδρόλυση μεταλλικών κατιόντων όπως π.χ. των Sn(II), Sn(IV), Bi(III), Fe(III), τα οποία μόνο σε ισχυρώς όξινα διαλύματα μπορούν να παραμείνουν σε διάλυμα χωρίς να υποστούν υδρόλυση. Τα τρυγικά ανιόντα σχηματίζουν με τα μέταλλα αυτά σταθερά ανιοντικά σύμπλοκα, τα οποία είναι σταθερά σε ουδέτερα έως και αλκαλικά διαλύματα.
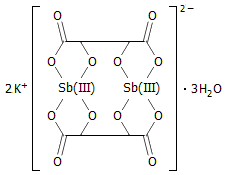
Εμπορικώς διαθέσιμο είναι το
άλας με κάλιο του ανιοντικού συμπλόκου τρυγικών με Sb(III),
το τρυγικό καλιο-αντιμονύλιο, K2[Sb2(C4H2O6)2Sb2]![]() 3H2O, το οποίο είναι γνωστό ως εμετική τρυγία (tartar
emetic) και παρασκευάζεται με θέρμανση όξινου
τρυγικού καλίου (τρυγίας) με οξείδιο του αντιμονίου(ΙΙΙ):
3H2O, το οποίο είναι γνωστό ως εμετική τρυγία (tartar
emetic) και παρασκευάζεται με θέρμανση όξινου
τρυγικού καλίου (τρυγίας) με οξείδιο του αντιμονίου(ΙΙΙ):
![]()
Πρόκειται για μια τοξική ουσία με κάπως γλυκιά γεύση και αρκετά διαλυτή στο νερό (8,3 g/100 mL). Κατά το παρελθόν είχε χρησιμοποιηθεί ως καθαρκτικό και εμετικό φάρμακο και βρίσκει ακόμη κάποιες εφαρμογές ως πρόστυμμα στη βαφή υφασμάτων, όπως και στη βυρσοδεψία [Αναφ. 7α].
Το σύμπλοκο τρυγικών - αντιμονίου έχει ένα ενδιαφέρον παρελθόν. Κατά τον 16ο έως και τον 18ο αιώνα κυκλοφορούσαν στην Ευρώπη κάποια περίεργα κύπελλα κατασκευασμένα από κράμα κασσιτέρου-αντιμονίου (7 - 15% Sb), τα οποία ήταν γνωστά ως εμετικά κύπελλα (pocula emetica, calices vomitorii, antimonial cups). Τα κύπελλα αυτά τα χρησιμοποιούσαν για φαρμακευτικούς σκοπούς και από αυτά έχουν σωθεί πολύ λίγα και βρίσκονται σε διάφορα μουσεία. Τα εμετικά κύπελλα τα γέμιζαν κρασί και τα άφηναν για ένα 24ωρο. Το τρυγικό οξύ του κρασιού αποσπούσε από τα τοιχώματα του κυπέλλου μικρές ποσότητες αντιμονίου χάρις στον εύκολο σχηματισμό του συμπλόκου τρυγικών-Sb(III). Στη συνέχεια, το μολυσμένο με αντιμόνιο κρασί χρησιμοποιούσαν ως καθαρτικό και εμετικό καταπότιο. Αναφέρεται ότι τα κύπελλα αυτά τα χρησιμοποιούσαν ενδεχομένως για να παρακάμψουν ένα νόμο που απαγόρευε την παρασκευή και διάθεση αντιμονιούχων φαρμακευτικών σκευασμάτων.
|
|
 |
 |
| Το σύμπλοκο Cu(II) - τρυγικών. Η μεγάλη περίσσεια τρυγικών ανιόντων στο αντιδραστήριο Fehling αποτρέπει την καθίζηση υδροξειδίου του χαλκού στο ισχυρώς αλκαλικό περιβάλλον δράσης του αντιδραστηρίου. | Αριστερά: Αντιδραστήριο Fehling. Δεξιά: το ίδιο μετά την αντίδραση με ένα αναγωγικό σάκχαρο (π.χ. γλυκόζη). |
Hermann von Fehling
(1812 - 1885). Ο Γερμανός χημικός που
ανέπτυξε τη μέθοδο ανίχνευσης και
προσδιορισμό αναγόντων σακχάρων με το
ομώνυμο αντιδραστήριο.
|
Τέτοιου είδους κύπελλα ή σφαιρίδια αντιμονίου φαίνεται πως χρησιμοποιούσαν ήδη κατά την αρχαιότητα οι πλούσιοι Ρωμαίοι στα συμπόσιά τους. Με αυτά μπορούσαν να παρατείνουν τη διασκέδασή τους και να ικανοποιήσουν την αδηφαγία τους, κενώνοντας το πεπτικό τους σύστημα από τα ήδη καταναλωθέντα εδέσματα για να προχωρήσουν στα επόμενα [Αναφ. 7β-γ].
Γνωστό επίσης είναι το σύμπλοκο τρυγικών ανιόντων-χαλκού(ΙΙ), το οποίο συναντάται στο αντιδραστήριο Fehling, το οποίο χρησιμοποιείται για την ανίχνευση, αλλά και τον προσδιορισμό αναγόντων σακχάρων. Σε ισχυρώς αλκαλικά διαλύματα τα ανάγοντα σάκχαρα οξειδώνονται από τον Cu(II) ανάγοντάς τον προς Cu(I), ο οποίος καθιζάνει υπό τη μορφή του κεραμέρυθρου οξειδίου Cu2O, σύμφωνα με τη συνολική αντίδραση [Αναφ. 7δ]:
![]()
Το αντιδραστήριο Fehling παρασκευάζεται λίγο πριν από τη χρήση του με ανάμιξη ίσων όγκων διαλυμάτων CuSO4 (Fehling I: 70 g CuSO4.5H2O / L) και NaOH - τρυγικού άλατος Na και Κ (Fehling ΙΙ: 350 g KNaC4H4O6.4H2O + 100 g NaOH / L). Ο ρόλος του τρυγικού άλατος είναι η συγκράτηση του Cu(II) στο διάλυμα παρά το ισχυρώς αλκαλικό περιβάλλον. Απουσία τρυγικών, ο χαλκός θα καταβυθιζόταν ως ένυδρο υδροξείδιο Cu(OH)2.
Το τρυγικό οξύ ως μέσον διαχωρισμού οπτικών αντιπόδων. Οι χημικοί διαχωρισμοί εναντιομερών ενώσεων από τα ρακεμικά μίγματά τους βασίζονται στην αντίδρασή τους με μια χειραλική ένωση προς σχηματισμό ζεύγους διαστερεομερών ενώσεων, που αναμένεται πως θα παρουσιάζουν κάποιες διαφορές στις φυσικές και φυσικοχημικές ιδιότητες. Αν οι διαφορές αυτές είναι σημαντικές (π.χ. στη διαλυτότητα) τότε είναι κατ' αρχήν εφικτός ο διαχωρισμός. Το (+)-τρυγικό οξύ (το φυσικό τρυγικό οξύ) είναι το πλέον προσιτή χειραλική ένωση από άποψη κόστους και διαθεσιμότητας, που μπορεί να χρησιμοποιηθεί για τον διαχωρισμό ρακεμικών μιγμάτων κατιοντικού χαρακτήρα (ανόργανα κατιόντα, οργανικές βάσεις) μέσω σχηματισμού διαστερεομερών αλάτων.
Οι διαχωρισμοί αυτοί (όποτε είναι εφικτοί) βασίζονται στις διαφορές διαλυτότητας των σχηματιζόμενων διαστερεομερών αλάτων [(+)-κατιόν][(+)-τρυγικό ανιόν] και [(-)-κατιόν][(+)-τρυγικό ανιόν]. Αν οι διαλυτότητες των διαστερεομερών αλάτων σε κάποιο διαλύτη διαφέρουν αρκετά, τότε είναι εφικτή η παραλαβή καθαρού του ενός ή και των δύο οπτικών αντίποδων.
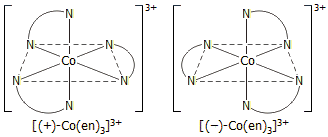 Τυπικό
παράδειγμα αποτελεί ο
διαχωρισμός των δύο οπτικών αντιπόδων του οκταεδρικού
συμπλόκου [Co(en)3]3+
[en: αιθυλενοδιαμίνη (Η2NCH2CH2NH2)]
με τη βοήθεια του (+)τρυγικού οξέος, ο οποίος αποτελεί συνηθισμένη
εργαστηριακή άσκηση στα Πανεπιστημιακά Τμήματα Χημείας. Κατά
τη σύνθεση του συμπλόκου σχηματίζεται ρακεμικό μίγμα των δύο
κατιοντικών συμπλόκων (αριστερά). Με προσθήκη
(+)-τρυγικών ιόντων παρουσία χλωριούχων καθιζάνει μόνο το
δεξιόστροφο σύμπλοκο του Co(ΙΙΙ) (ως πενταϋδρικό άλας)
σύμφωνα με την επόμενη αντίδραση, ενώ το αριστερόστροφο παραμένει
στο διάλυμα [Αναφ. 7ε]:
Τυπικό
παράδειγμα αποτελεί ο
διαχωρισμός των δύο οπτικών αντιπόδων του οκταεδρικού
συμπλόκου [Co(en)3]3+
[en: αιθυλενοδιαμίνη (Η2NCH2CH2NH2)]
με τη βοήθεια του (+)τρυγικού οξέος, ο οποίος αποτελεί συνηθισμένη
εργαστηριακή άσκηση στα Πανεπιστημιακά Τμήματα Χημείας. Κατά
τη σύνθεση του συμπλόκου σχηματίζεται ρακεμικό μίγμα των δύο
κατιοντικών συμπλόκων (αριστερά). Με προσθήκη
(+)-τρυγικών ιόντων παρουσία χλωριούχων καθιζάνει μόνο το
δεξιόστροφο σύμπλοκο του Co(ΙΙΙ) (ως πενταϋδρικό άλας)
σύμφωνα με την επόμενη αντίδραση, ενώ το αριστερόστροφο παραμένει
στο διάλυμα [Αναφ. 7ε]:
![]()
Είναι αυτονόητο ότι εάν αντί (+)-τρυγικού οξέος γινόταν χρήση του (δυσεύρετου) (-)-τρυγικού οξέος, θα καθίζανε το αριστερόστροφο σύμπλοκο του Co(III).
'Αλλο τυπικό παράδειγμα διαχωρισμού με το (+)-τρυγικό οξύ είναι ο διαχωρισμός του ρακεμικού μίγματος που προκύπτει κατά τη σύνθεση της μεθαμφεταμίνης [Αναφ. 7στ]:
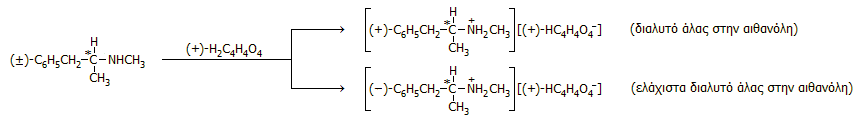
Για τον ίδιο σκοπό έχουν χρησιμοποιηθεί και παράγωγα (πλέον λιπόφιλα) παράγωγα του τρυγικού οξέος. Για παράδειγμα, το 2,3-διβενζοϋλο-(+)-τρυγικό οξύ είχε χρησιμοποιηθεί στην ιστορική σύνθεση της κινίνης από τους Woodward και Doering για την παραλαβή του επιθυμητού εναντιομερούς [Αναφ. 7ζ] (βλ. ένωση του μήνα: Κινίνη).
Το τρυγικό οξύ ως καταλύτης στις "ασύμμετρες" συνθέσεις. Το (+)-τρυγικό οξύ (ή οι εστέρες του), όπως και άλλες ενώσεις με στερεογονικά κέντρα, έχει χρησιμοποιηθεί στο πεδίο των ασύμμετρων συνθέσεων, που βασίζονται στην κινητική διαφοροποίηση των αντιδράσεων των επιμέρους εναντιομερών μορφών. Τυπικό παράδειγμα αποτελεί η παρακάτω αντίδραση του ρακεμικού μίγματος της 1-(α-αμινοβενζυλο)-2-ναφθόλης, ένωσης γνωστής ως βάση Betti, με ακετόνη παρουσία (+)-τρυγικού οξέος:
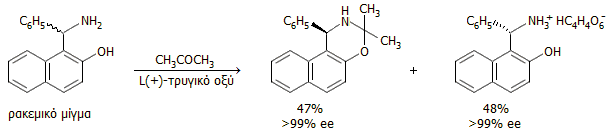
Η καταλυτική δράση του (+)-τρυγικού οξέος εκδηλώνεται σχεδόν αποκλειστικά στο R-εναντιομερές της βάσης Betti, το οποίο αντιδρά ταχύτατα παρέχοντας την N,O-κετάλη, ενώ το S-εναντιομερές παραμένει ως έχει και απομονώνεται εύκολα ως όξινο τρυγικό άλας. Η αντίδραση αυτή χωρεί με εξαιρετική στερεοεκλεκτικότητα [Αναφ 7η].
|
Στερεοεκλεκτικότητα - Εναντιοεκλεκτικότητα - Περίσσεια εναντιομερούς [Αναφ. 8] Μια αντίδραση χαρακτηρίζεται ως στερεοεκλεκτική (stereoselective) εάν παράγει το ένα στερεοϊσομερές σε μεγαλύτερη ποσότητα σε σχέση με ένα άλλο. Ο βαθμός στερεοκλεκτικότητας εκφράζεται από το ποσοστό του ενός στερεοϊσομερούς ως προς το άλλο ή τα άλλα (π.χ. 100% δηλώνει αποκλειστική παραγωγή του ενός στερεοϊσομερούς). Εάν τα στερεοϊσομερή είναι εναντιομερή, το φαινόμενο χαρακτηρίζεται ως εναντιοεκλεκτικότητα (enantioselectivity). Η εναντιοεκλεκτικότητα χαρακτηρίζεται ποσοτικά από την περίσσεια εναντιομερούς (enantiomeric excess, ee). Για ένα μίγμα (+) και (-)-εναντιομερών, με τη σύνθεσή του εκφραζόμενη σε γραμμομοριακά κλάσματα ή κλάσματα βάρους F(+) και F(-) (όπου F(+) + F(-) = 1) η περίσσεια εναντιομερούς ορίζεται ως η απόλυτη τιμή της διαφοράς F(+) - F(-) πολλαπλασιασμένη με το 100 ή (ισοδύναμα) ως
όπου [R] και [S] συγκεντρώσεις των R- και S-εναντιομερών σε διάλυμα του εξεταζόμενου δείγματος. Η περίσσεια εναντιομερούς αντικαθιστά τον παλαιότερο όρο οπτική καθαρότητα (optical purity) που ορίζεται ως ο λόγος της οπτικής στροφής μίγματος εναντιομερών προς την οπτική στροφή του καθαρού εναντιομερούς. |
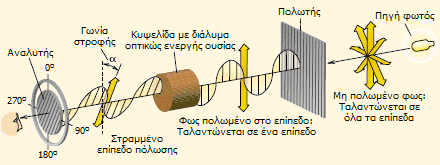
Η ανακάλυψη των οπτικώς ενεργών ουσιών - Ειδική στροφή Οι πολωτές (polarizers) είναι οπτικά μέσα τα οποία ευνοούν τη διέλευση φωτός (ηλεκτρομαγνητικό κύμα) του οποίου η ένταση του ηλεκτρικού πεδίου ταλαντώνεται σε συγκεκριμένο επίπεδο από τα άπειρα στα οποία ανήκει η ευθύγραμμη διαδρομή φωτός. Το διερχόμενο φως αναφέρεται ως πολωμένο (polarized) κατά το επίπεδο αυτό. Αν στη διαδρομή του πολωμένου φωτός παρεμβληθεί ένας επιπλέον πολωτής, που αναφέρεται ως αναλυτής (analyzer), το φως θα διέρχεται και από τον δεύτερο πολώτη, αν τα επίπεδα πόλωσης και των δύο πολωτών συμπίπτουν, ενώ αποκόπτεται (ιδανικά πλήρως), όταν τα δύο επίπεδα είναι κάθετα μεταξύ τους. Σε ενδιάμεσες γωνίες η ένταση του διερχόμενου από τους δύο πολωτές κυμαίνεται από τη μέγιστη (για διαφορά γωνίας επιπέδων πόλωσης πολωτή-αναλύτη 0°) έως μια ελάχιστη (για διαφορά γωνίας επιπέδων πόλωσης πολωτή-αναλυτής 90°).
Το 1832, ο Γάλλος επιστήμονας (μαθηματικός, φυσικός, αστρονόμος) Jean Baptiste Biot (1774-1862) εξετάζοντας τις ιδιότητες του πολωμένου στο επίπεδο φωτός, διαπίστωσε ότι εάν μεταξύ πολωτή και αναλυτή παρεμβληθεί διάλυμα ορισμένων ουσιών, ο πολωτής έπαυε πλέον να αποκόπτει το φως ακριβώς σε γωνία 90°, αλλά θα έπρεπε να στραφεί κατά τι αριστερά ή δεξιά. Το γεγονός ερμηνεύεται με την παραδοχή ότι το επίπεδο πόλωσης του φωτός στρέφεται (αριστερά ή δεξιά) κατά τη διέλευση του πολωμένου φωτός μέσω του διαλύματος της ουσίας. Η ουσία η οποία διαθέτει αυτήν την ιδιότητα χαρακτηρίζεται ως οπτικώς ενεργή (optically active). Ανάλογα με τη "στροφή" που προκαλούσε η ουσία στο επίπεδο πόλωσης του φωτός χαρακτηρίζεται ως αριστερόστροφη (levorotatory, -) ή δεξιόστροφη (dextrorotatory, +). Για παράδειγμα η σακχαρόζη είναι δεξιόστροφη, ενώ η μορφίνη είναι αριστερόστροφη. Κατά τη μελέτη του φαινομένου ο Biot διαπίστωσε ότι η "στροφή" (α), που προκαλούσε ένα διάλυμα μιας οπτικώς ενεργής ουσίας, ήταν ανάλογο προς τη συγκέντρωση της οπτικώς ενεργής ουσίας, όσο και του μήκους της οπτικής διαδρομής μέσω του διαλύματος. Επιπλέον, διαπιστώθηκε ότι η στροφή εξαρτάται σε κάποιο βαθμό από το μήκος κύματος της ακτινοβολίας και από τη θερμοκρασία του διαλύματος. 'Ετσι, μια χαρακτηριστική φυσική σταθερά για κάθε οπτικώς ενεργή ουσία είναι η ειδική στροφική ικανότητα, η οποία ορίζεται ως η στροφή (σε μοίρες) πολωμένου φωτός μονοχρωματικού φωτός μήκους κύματος 589 nm (γραμμή εκπομπής D του νατρίου, το φως που εκπέμπουν οι γνωστές "λάμπες νατρίου") τυπικά στους 20°C, διαλύματος συγκέντρωσης 1 g/mL και κυψελίδα δείγματος οπτικής διαδρομής 1 δεκατομέτρου (10 cm), οπότε είναι:
Τα όργανα με τα οποία μετρείται η στροφική ικανότητα διαλυμάτων οπτικά ενεργών ουσιών ονομάζονται πολωσίμετρα (polarimeters). Μέσω της μέτρησης της στροφής του επιπέδου πόλωσης από ένα διάλυμα μπορεί να υπολογισθεί η περιεκτικότητά τους στην οπτικώς ενεργή ουσία και η σχετική αναλυτική τεχνική ονομάζεται πολωσιμετρία (polarimetry). Ως εκ της χρήσης τους για τον προσδιορισμό σακχάρων σε διαλύματα τα όργανα αυτά ονομάζονται και σακχαρόμετρα (saccharimeters). Τυπικές τιμές ειδικής στροφής οπτικώς ενεργών ενώσεων είναι: κάμφορα +44,2°, μορφίνη -132°, σακχαρόζη +66,5°, λακτόζη +52,3°, (+)-τρυγικό οξύ +12,0°
|
 Χρήσεις του τρυγικού οξέος και των αλάτων του
Χρήσεις του τρυγικού οξέος και των αλάτων του
Το τρυγικό οξύ: Χρησιμοποιείται κυρίως ως πρόσθετο τροφίμων με αριθμό Ε334. Η κύρια χρήση του είναι ως ρυθμιστής της οξύτητας και βελτιωτικό γεύσης σε χυμούς, προϊόντα ζαχαροπλαστικής, μαρμελάδες, προϊόντα σοκολάτας. Αναμιγνύεται ιδανικά με τεχνητά και φυσικά αρωματικά ανθρακούχων ποτών και χυμών φρούτων. Αποτελεί, μαζί με το μηλικό οξύ, το κύριο οξύ του κρασιού και λειτουργεί ως ρυθμιστής του pH του.
Χρησιμοποιείται στη βυρσοδεψία, σε φωτογραφικές εκτυπώσεις και για τον καθαρισμό και το γυάλισμα μεταλλικών επιφανειών καθώς σχηματίζει εύκολα σύμπλοκα με ιόντα μετάλλων. Στη φαρμακευτική βιομηχανία χρησιμοποιείται κυρίως στα αναβράζοντα δισκία (σε στερεό μίγμα με όξινο ανθρακικό νάτριο) και υπό τη μορφή τρυγικών αλάτων φαρμακευτικώς δραστικών οργανικών ουσιών βασικού χαρακτήρα.
Σύμφωνα με μια πηγή, το 2012 οι παγκόσμιες ανάγκες σε τρυγικό οξύ αναμένεται να φτάσουν τις 58.000 τόννους [Αναφ. 9α].
 Το
όξινο τρυγικό κάλιο: Είναι το πλέον κοινό άλας
του τρυγικού οξέος και πρωτογενή πηγή του,
αφού είναι το κύριο συστατικό της τρυγίας. Είναι σχετικά
δυσδιάλυτο άλας (6 και 62,5 g/L στους 20ºC και 100ºC, αντιστοίχως)
και είναι ο κύριος
όξινος παράγοντας των οίνων, στον οποίο και συχνά οφείλεται το
θόλωμά τους κατά την ψύξη [Αναφ. 9β].
Σε καθαρή μορφή, με την ονομασία κρεμόριο ή κρεμοτάρταρο (cream
of tartar) χρησιμοποιείται στη μαγειρική και στη ζαχαροπλαστική
(αποτρέπει την κρυστάλλωση σακχαρούχων σιροπιών, σταθεροποιεί τη
μαρέγκα).
Χρησιμοποιείται ως όξινος παράγοντας σε διάφορα
διογκωτικά
ζύμης (baking powder) (μίγματα όξινου τρυγικού καλίου ή
όξινων φωσφορικών αλάτων με όξινο ανθρακικό νάτριο). Επίσης
χρησιμοποιείται σε διάφορα σκευάσματα οικιακής χρήσης για την απομάκρυνση
της σκουριάς από
μεταλλικές επιφάνειες.
Το
όξινο τρυγικό κάλιο: Είναι το πλέον κοινό άλας
του τρυγικού οξέος και πρωτογενή πηγή του,
αφού είναι το κύριο συστατικό της τρυγίας. Είναι σχετικά
δυσδιάλυτο άλας (6 και 62,5 g/L στους 20ºC και 100ºC, αντιστοίχως)
και είναι ο κύριος
όξινος παράγοντας των οίνων, στον οποίο και συχνά οφείλεται το
θόλωμά τους κατά την ψύξη [Αναφ. 9β].
Σε καθαρή μορφή, με την ονομασία κρεμόριο ή κρεμοτάρταρο (cream
of tartar) χρησιμοποιείται στη μαγειρική και στη ζαχαροπλαστική
(αποτρέπει την κρυστάλλωση σακχαρούχων σιροπιών, σταθεροποιεί τη
μαρέγκα).
Χρησιμοποιείται ως όξινος παράγοντας σε διάφορα
διογκωτικά
ζύμης (baking powder) (μίγματα όξινου τρυγικού καλίου ή
όξινων φωσφορικών αλάτων με όξινο ανθρακικό νάτριο). Επίσης
χρησιμοποιείται σε διάφορα σκευάσματα οικιακής χρήσης για την απομάκρυνση
της σκουριάς από
μεταλλικές επιφάνειες.
Συνηθισμένη εργαστηριακή άσκηση Γενικής Χημείας είναι ο προσδιορισμός του γινομένου διαλυτότητας του όξινου τρυγικού καλίου. Στην ίδια άσκηση εξετάζεται η επίδραση κοινού ιόντος, δηλαδή εξετάζεται η διαλυτότητα του όξινου τρυγικού καλίου σε διαλύματα ευδιάλυτων αλάτων του καλίου (π.χ. KNO3 και KCl). Το μικρό κόστος του τρυγικού άλατος και η όχι τόσο μικρή διαλυτότητά του, η οποία επιτρέπει τον απλό ογκομετρικό προσδιορισμό της συγκέντρωσης των όξινων τρυγικών ιόντων, είναι οι λόγοι για τους οποίους η άσκηση αυτή είναι αρκετά "δημοφιλής".
Θα πρέπει να σημειωθεί ότι το όξινο τρυγικό κάλιο μπορεί να καθαρισθεί εύκολα με ανακρυστάλλωση, δεν είναι υγροσκοπικό και μπορεί να αποτελέσει πρότυπο για τιτλοδοτήσεις διαλυμάτων βάσεων, όπως και για τη βαθμονόμηση πεχαμέτρων. Κορεσμένο υδατικό διάλυμά του στους 25ºC έχει pH 3,557 [Αναφ. 9γ-ε].
Το τρυγικό καλιονάτριο:
Το μικτό τρυγικό άλας με νάτριο και
κάλιο, γνωστότερο ως "τρυγικό καλιονάτριο" είναι το πλέον κοινό
τρυγικό άλας μετά το όξινο τρυγικό κάλιο. Παρασκευάστηκε για
πρώτη φορά περίπου το 1675 από τον φαρμακοποιό Pierre
Seignette στην πόλη La Rochelle της Γαλλίας. Για το
λόγο αυτό είναι γνωστό και ως άλας Seignette ή άλας
Rochelle. Παρασκευάζεται εύκολα με αντίδραση του όξινου
τρυγικού καλίου με σόδα (ανθρακικό νάτριο) και χρησιμοποιήθηκε
ως καθαρτικό φάρμακο. Είναι άλας εξαιρετικά διαλυτό στο νερό (630 g/L στους 20ºC) και κρυσταλλώνεται με τέσσερα μόρια
ύδατος (NaKC4H4O6![]() 4H2O) σε άχρωμους κρυστάλλους
ελαφρά υγροσκοπικούς.
Χρησιμοποιείται στη βιομηχανία τροφίμων ως συντηρητικό (Ε337),
ενώ στα χημικά εργαστήρια χρησιμοποιείται στο
αντιδραστήριο Fehling για την ποιοτική ανίχνευση και τον
ογκομετρικό προσδιορισμό αναγόντων σακχάρων (βλ. παραπάνω).
4H2O) σε άχρωμους κρυστάλλους
ελαφρά υγροσκοπικούς.
Χρησιμοποιείται στη βιομηχανία τροφίμων ως συντηρητικό (Ε337),
ενώ στα χημικά εργαστήρια χρησιμοποιείται στο
αντιδραστήριο Fehling για την ποιοτική ανίχνευση και τον
ογκομετρικό προσδιορισμό αναγόντων σακχάρων (βλ. παραπάνω).
 |
 |
 |
|
Εφαρμογές πιεζοηλεκτρικών μεταλλακτών με τρυγικό καλιονάτριο: βελόνα γραμμοφώνου, ακουστικό, μικρόφωνο. |
||
Το τρυγικό καλιονάτριο εμφανίζει ιδιαίτερα έντονο το φαινόμενο του πιεζοηλεκτρισμού. Το φαινόμενο αυτό ανακαλύφθηκε και εξετάσθηκε λεπτομερώς το 1880 από τους αδελφούς Pierre Curie (1859-1906) και Jacques Curie (1856-1941).
'Οταν κρύσταλλος τρυγικού καλιονατρίου πιεσθεί ως προς ένα κατάλληλο κρυσταλλογραφικό άξονα στις επιφάνειές του εμφανίζεται μια διαφορά δυναμικού. Ισχύει και το αντίστροφο, δηλαδή εάν επιβληθεί διαφορά δυναμικού στις ίδιες επιφάνειες ο κρύσταλλος υπόκεινται σε μικρές αυξομειώσεις του μεγέθους του.
Το φαινόμενο αυτό αξιοποιήθηκε κατά τα μέσα του 20ου αιώνα για την κατασκευή μικροφώνων, ακουστικών και βελονών γραμμοφώνου. Το μειονέκτημά τους ήταν ότι καταστρέφονταν εύκολα, εάν παρέμεναν σε υγρούς χώρους. Το τρυγικό καλιονάτριο, στις σύγχρονες πλέον συσκευές έχει αντικατασταθεί από τα περισσότερο ανθεκτικά κεραμικά πιεζοηλεκτρικά υλικά (π.χ. BaTiO3, PbTiO3, LiNbO3, KNbO3).
Το τρυγικό καλιοαντιμονύλιο:
'Ενα ακόμη εμπορικώς διαθέσιμο τρυγικό άλας είναι το
τρυγικό καλιοαντιμονύλιο, K2[Sb2(C4H2O6)2]![]() 3H2O,
γνωστό ως εμετική τρυγιά. Πληροφορίες για το άλας αυτό
και τις ιστορίες που συνδέονται με αυτό αναφέρθηκαν προηγουμένως.
3H2O,
γνωστό ως εμετική τρυγιά. Πληροφορίες για το άλας αυτό
και τις ιστορίες που συνδέονται με αυτό αναφέρθηκαν προηγουμένως.
 |
 |
 |
 |
|
Στο διαδίκτυο περιγράφεται ένα απλό πείραμα παρασκευής κρυστάλλων τρυγικού καλιονατρίου και επίδειξης των πιεζοηλεκτρικών ιδιοτήτων τους [Αναφ. 9στ]. Μια σειρά βίντεο σχετικά με τους πιεζοηλεκτρικούς κρυστάλλους και ορισμένα πειράματα με αυτούς μπορούν να αναζητηθούν εδώ. |
|||
Το περίφημο πείραμα του Pasteur
 |
 |
|
Ο Louis Pasteur (1822-1895): Αριστερά: Ως φοιτητής στην École Normale (γύρω στο 1845). Δεξιά: στο εργαστήριό του. Μια από τις πιο γνωστές απεικονίσεις του Pasteur (ζωγραφικός πίνακας του A. Edelfeldt, 1885) |
|
Αρχικά, η ανακάλυψη από τον Jean Baptiste Biot (1774-1862) της οπτικής ενεργότητας ορισμένων οργανικών ουσιών δεν είχε σημαντική επίδραση στη χημεία, πέραν της δυνατότητας που παρείχε το φαινόμενο για τον ποσοτικό προσδιορισμό των σακχάρων σε διαλύματα.
Από το 1832 και χάρις στα πειράματα του Biot ήταν ήδη γνωστό ότι το τρυγικό οξύ που λάμβαναν από την τρυγία ήταν οπτικά ενεργό (δεξιόστροφο). Επίσης ήταν γνωστό ότι από την τρυγία μπορούσε να προκύψει και ένα άλλο οξύ, το παρατρυγικό οξύ (paratartaric ή racemic acid, το DL-τρυγικό οξύ), το οποίο ήταν οπτικά ανενεργό (Eilhard Mitscherlich, 1794-1863). Ωστόσο, είχε πλέον εξακριβωθεί ότι από χημική άποψη τα δύο οξέα, το τρυγικό οξύ και το παρατρυγικό οξύ ήταν στην ουσία η ίδια ένωση.
Το 1848, ο Louis Pasteur (1822-1895), που είχε σπουδάσει φυσική και χημεία στην École Normale Supérieure, σε ηλικία μόλις 26 χρονών άρχισε να εκτελεί τα περίφημα πειράματά του στο εργαστήριο του Quartier Latin, Παρίσι), τα οποία τον κατέταξαν στην κατηγορία των πλέον δραστήριων και ευφυών επιστημόνων όλων των εποχών.
|
Σακχαρόμετρο Soleil (μοντέλο 1845), ίδιο με αυτό που χρησιμοποίησε ο Pasteur. Ως στοιχεία πόλωσης τα όργανα αυτά χρησιμοποιούσαν πρίσματα Nicol. |
'Ενα από τα ερωτήματα που απασχολούσε την κοινότητα των κρυσταλλογράφων της εποχής ήταν το κατά πόσο η στροφική ικανότητα συνδεόταν ή όχι με μια ασυμμετρία των κρυσταλλικών μορφών των ενώσεων. Για να απαντήσει ο Pasteur στο ερώτημα αυτό παρασκεύασε αρκετά άλατα του (+)-τρυγικού οξέος και του παρατρυγικού οξέος.
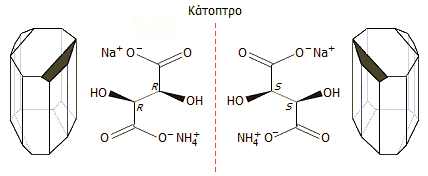
Στην περίπτωση του μικτού άλατος του παρατρυγικού οξέος με
αμμώνιο και νάτριο (NaNH4C4H4O6![]() 4H2O),
διαπίστωσε κάποιες μικρές έδρες στις γωνίες
των κρυστάλλων,
οι οποίες είχαν αγνοηθεί σε παλαιότερες παρατηρήσεις. Πιστεύοντας ότι αυτές οι έδρες
είχαν σχέση με τη στροφική ικανότητα των τρυγικών, θέλησε να
δει αν αυτές εξακολουθούν να υπάρχουν και στο αντίστοιχο
άλας του οπτικώς ανενεργού παρατρυγικού οξέος. Διαπίστωσε ότι οι
έδρες αυτές εξακολουθούσαν να υπάρχουν, αλλά επιπλέον πρόσεξε
ότι κατά την ανακρυστάλλωση προέκυπταν δύο είδη ημιεδρικών
(ασύμμετρων) κρυστάλλων, που
μεταξύ τους είχαν σχέση αντικειμένου - ειδώλου. Εξοπλισμένος με
ένα μικροσκόπιο, ένα τσιμπιδάκι και με μεγάλη υπομονή
ξεχώρισε με το χέρι αρκετά γραμμάρια από αυτά τα δύο είδη κρυστάλλων.
4H2O),
διαπίστωσε κάποιες μικρές έδρες στις γωνίες
των κρυστάλλων,
οι οποίες είχαν αγνοηθεί σε παλαιότερες παρατηρήσεις. Πιστεύοντας ότι αυτές οι έδρες
είχαν σχέση με τη στροφική ικανότητα των τρυγικών, θέλησε να
δει αν αυτές εξακολουθούν να υπάρχουν και στο αντίστοιχο
άλας του οπτικώς ανενεργού παρατρυγικού οξέος. Διαπίστωσε ότι οι
έδρες αυτές εξακολουθούσαν να υπάρχουν, αλλά επιπλέον πρόσεξε
ότι κατά την ανακρυστάλλωση προέκυπταν δύο είδη ημιεδρικών
(ασύμμετρων) κρυστάλλων, που
μεταξύ τους είχαν σχέση αντικειμένου - ειδώλου. Εξοπλισμένος με
ένα μικροσκόπιο, ένα τσιμπιδάκι και με μεγάλη υπομονή
ξεχώρισε με το χέρι αρκετά γραμμάρια από αυτά τα δύο είδη κρυστάλλων.
'Οταν ο Pasteur συνέλεξε αρκετή ποσότητα από τα δύο είδη των κρυστάλλων, παρασκεύασε διαλύματα ίδιας συγκέντρωσης των δύο διαφορετικών κρυστάλλων και με μεγάλη έκπληξη διαπίστωσε ότι και τα δύο είδη παρείχαν διαλύματα με την ίδια ακριβώς στροφική ικανότητα, αλλά με με αντίθετο πρόσημο, ενώ διάλυμα ίσων ποσοτήτων των δύο κρυστάλλων παρείχε ένα οπτικώς ανενεργό διάλυμα.
Ο Pasteur διατύπωσε ως εξής την ερμηνεία των αποτελεσμάτων "... δεν υπάρχει αμφιβολία πως [στο δεξιόστροφο τρυγικό οξύ] επικρατεί μια ασύμμετρη διάταξη, η οποία δεν συμπίπτει με το κατοπτρικό της είδωλο. Είναι επίσης βέβαιο, ότι τα άτομα του αριστερόστροφου τρυγικού οξέος, παρουσιάζουν την αντίστροφή ακριβώς ασύμμετρη διάταξη".
'Ετσι ο Pasteur υπήρξε ο πρώτος που: 1) απέδειξε ότι μπορεί να υπάρχουν χειραλικά μόρια, 2) εισήγαγε μια νέα μορφή ισομέρειας: την ισομέρεια τύπου "αντικειμένου - ειδώλου", 3) συνδύασε χημικά, φυσικά (οπτικά) και κρυσταλλογραφικά δεδομένα [Αναφ. 3β, 10α].
 |
 |
 |
|
Μορφές των χειραλικών κρυστάλλων το μικτού άλατος του παρατρυγικού οξέος (του ρακεμικού DL-τρυγικού οξέος) με αμμώνιο και νάτριο. Δεξιά τα μοντέλα από φελλό (που είχε κατασκευάσει ο ίδιος ο Pasteur) και πραγματικοί κρύσταλλοι του άλατος [Αναφ. 9α]. Στην πράξη, και ειδικά στους μικρούς κρυστάλλους του μικτού άλατος, η παρατήρηση των μικρών εδρών αυτές ειδικά υποδεικνύουν τους αντίποδες, δεν είναι εξίσου εύκολη, όπως και στα μοντέλα και στους μεγάλους κρυστάλλους. |
||
Αξίζει να σημειωθεί ότι τα αποτελέσματα του νεαρού τότε Pasteur παραξένεψαν τον σεβαστό στους επιστημονικούς κύκλους Biot (48 χρόνια μεγαλύτερος του Pasteur), ο οποίος του ζήτησε να επαναλάβει το πείραμα παρουσία του, πράγμα που ο Pasteur κατάφερε με επιτυχία. Τότε ο Biot ενθουσιασμένος τότε είπε "Mon cher enfant, j'ai tant aime les sciences dans ma vie que cela me fait battre le coeur!" (Αγαπημένο μου παιδί, αγαπώ τόσο την επιστήμη, που σε όλη μου τη ζωή με έκανε να καρδιοχτυπώ). Από τότε, και παρά τη μεγάλη διαφορά στην ηλικία τους, οι δύο επιστήμονες έμειναν θερμοί φίλοι.
|
Η προτομή του Luis Pasteur στον προαύλιο χώρο του Ερευνητικού Ινστιτούτου Pasteur της Lille. |
Η αξία της ανακάλυψης του Pasteur θα γίνει αντιληπτή αν εξετασθεί υπό το πρίσμα των γνώσεων εκείνης της εποχής. Τότε, το μόνο που γνώριζαν ήταν ότι οι ουσίες αποτελούνταν από χημικά στοιχεία σε καθορισμένη αναλογία. Ακόμη, μιλούσαν για μόρια χωρίς όμως κάποια αναφορά σε δομές και σχήματα μορίων. Ακόμη και η ατομική θεωρία ήταν υπό αμφισβήτηση. Δεν είχε ακόμη διατυπωθεί η δομική θεωρία του August Kekulé (1829-1896) για τους τέσσερις δεσμούς του άνθρακα (διατυπώθηκε το 1857) και δεν ήταν απολύτως τίποτα γνωστό για τη στερεοχημεία των ενώσεων του άνθρακα.
Αυτές οι παρατηρήσεις του Pasteur και οι συλλογισμοί του σχετικά με τη δυνατότητα ύπαρξης χειραλικών μορίων οδήγησαν το 1874 τους Jacobus Henricus van 't Hoff (1852-1911) και Joseph Achille Le Bel (1847-1930), ανεξάρτητα μεταξύ τους, στην πρόταση πως στις κορεσμένες ενώσεις του άνθρακα οι τέσσερις δεσμοί του Kekulé κατευθύνονταν προς τις γωνίες ενός κανονικού τετραέδρου και δεν βρίσκονται στο επίπεδο. Θα πρέπει να σημειωθεί ότι η επιστημονική κοινότητα της εποχής ήταν εξαιρετικά δύσκολο να δεχθεί νέες ιδέες. Είναι χαρακτηριστικό το ότι για τη θεωρία του αυτή, ο νεαρός τότε van't Hoff, ο οποίος θεωρείται σήμερα ως θεμελιωτής της Στερεοχημείας, κατηγορήθηκε σκαιότατα από γνωστό επιστημονικό όνομα της εποχής για αμάθεια και υπερβολική φαντασία.
Ο
παράγοντας ΤΥΧΗ. Η
μέθοδος την οποία χρησιμοποίησε ο Pasteur
για τον διαχωρισμό των εναντιομερών, που συνιστούν το
μικτό άλας του DL-τρυγικού
οξέος με νάτριο και αμμώνιο, δεν είναι μια μέθοδος γενικής
εφαρμογής, η
οποία
μπορεί να εφαρμοστεί σε κάθε αντίστοιχη περίπτωση. Κάθε άλλο
μάλιστα. Ο Pasteur στάθηκε τυχερός διότι
το άλας που χρησιμοποίησε, είναι μια από τις ελάχιστες ρακεμικές ουσίες, οι οποίες υπόκεινται σε αυθόρμητο
διαχωρισμό (spontaneous resolution) σε οπτικούς αντίποδες κατά την κρυστάλλωση. Επίσης
υπήρξε τυχερός διότι διεξήγαγε τα πειράματά του στο ψυχρό
Παρίσι, αφού ο διαχωρισμός του άλατος στις δύο εναντιομερείς
κρυσταλλικές μορφές ως σύμμιγμα (conglomerate) συμβαίνει σε θερμοκρασίες κάτω από τους
27,7ºC,
ενώ σε μεγαλύτερες θερμοκρασίες κρυσταλλώνεται ως ρακεμικό
άλας [Αναφ. 3β].
Αναφέρεται ακόμη ότι το πείραμα του Pasteur δύσκολα επαναλαμβάνεται
και ότι η τελευταία πειραματική λεπτομέρεια αποτελεί κρίσιμο
παράγοντα. Ωστόσο, όπως είχε πει ο ίδιος
Pasteur λίγα χρόνια αργότερα, σε
μια ομιλία του στο Πανεπιστήμιο της Lille
(Δεκέμβριος 1854):
Dans les champs de l'
Εάν θα έπρεπε κανείς να επιλέξει τους μεγαλύτερους ευεργέτες της ανθρωπότητας, ο Louis Pasteur θα ήταν σίγουρα ανάμεσά τους. 'Ηταν ο πρώτος που υπέθεσε ότι οι ζωντανοί οργανισμοί χρησιμοποιούν και παράγουν οπτικώς ενεργές οργανικές ενώσεις [Αναφ. 3β]. Κατέρριψε τον ευρύτατα διαδεδομένο μύθο της αυτόματης γένεσης (spontaneous generation), θέτοντας τα θεμέλια για τη σύγχρονη βιολογία και βιοχημεία. Περιέγραψε επιστημονικά τα φαινόμενα της ζύμωσης και της αποσύνθεσης. 'Ελυσε το μυστήριο πολλών λοιμωδών ασθενειών, αποδίδοντας τις αιτίες τους σε μικρόβια, και συνέβαλε στη δημιουργία των πρώτων εμβολίων. Το έργο του αποτέλεσε το εφαλτήριο πολλών κλάδων της επιστήμης και ο ίδιος υπήρξε ο πρωτεργάτης για μερικές από τις πιο σημαντικές θεωρητικές αρχές και πρακτικές εφαρμογές της σύγχρονης επιστήμης.
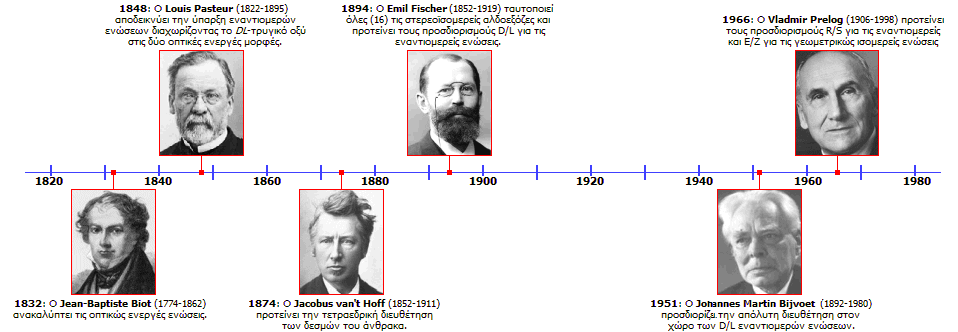
Οι σημαντικότεροι σταθμοί και οι πρωτεργάτες στην εξέλιξη της στερεοχημείας των οργανικών ενώσεων
|

Ορισμένα από τα γραμματόσημα που έχουν εκδώσει οι ταχυδρομικές υπηρεσίες πολλών χωρών προς τιμήν του Pasteur