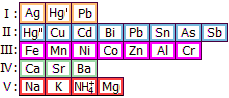 |
Βάριο (Ba)
|
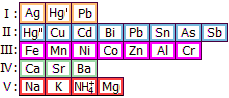 |
Βάριο (Ba)
|
|
Γενικά για το Ba
• Αργυρόλευκο, σχετικά μαλακό μέταλλο. Δραστικότατο μέταλλο, αντιδρά με το νερό με έκλυση υδρογόνου και καίγεται στον αέρα μετά από πύρωση. Στον αέρα οξειδώνεται ταχύτατα. Απομονώθηκε ως μέταλλο από τον Sir Humphry Davy (Αγγλία, 1808) με ηλεκτρολυτική μέθοδο. Η ονομασία του προέρχεται από την ελληνική λέξη "βαρύς", λόγω του σχετικά μεγάλου ειδικού βάρους των ορυκτών του. • Τα διαλυτά άλατα του βαρίου, σε αντίθεση με τα αντίστοιχα άλατα του ασβεστίου και του στροντίου είναι ιδιαιτέρως τοξικά. Ωστόσο, το θειικό βάριο, που χορηγείται σε μεγάλη ποσότητα ως σκιαστικό μέσο κατά τη λήψη ακτινογραφιών, δεν είναι επικίνδυνο λόγω της ελάχιστης διαλυτότητάς του. • Τα κυριότερα ορυκτά του είναι ο βαρύτης (ή βαρυτίνη), BaSO4 [F01] και ο βιθερίτης, BaCO3 [F02]. • Το 2021 εξορύχθηκαν παγκοσμίως 7,3 εκατομ. τόνοι BaSO4. Κυριότερες παραγωγοί χώρες: Κίνα, Ινδία, Μαρόκο, ΗΠΑ, Ιράν, Μεξικό. Στην Ελλάδα πλούσια κοιτάσματα βαρύτη υπάρχουν κυρίως στη Μήλο. • Εφαρμογές: (ως BaSO4), γεωτρήσεις για πετρέλαιο (λιπαντική λάσπη), λευκαντική επιβαρυντική ύλη, χρώματα, υαλουργία, ιατρική (ως σκιαστικό μέσο στις ακτινογραφίες του πεπτικού συστήματος). 'Αλατα του βαρίου χρησιμοποιούνται για την παρασκευή πυροτεχνημάτων πράσινου χρώματος [F03]. Ως μέταλλο, σε μικρές ποσότητες χρησιμοποιείται ως "συλλέκτης" (getter) στις ηλεκτρονικές λυχνίες για την παγίδευση ιχνοποσοτήτων οξυγόνου επαυξάνοντας σημαντικά τον χρήσιμο χρόνο ζωής τους.
Γενικές χημικές ιδιότητες των ενώσεων του BaΟξειδωτικές καταστάσεις • Η μόνη σταθερή οξειδωτική κατάσταση του Ba είναι η Ba(II).Διαλυτοποίηση του μετάλλου • Το Ba, ως δραστικό μέταλλο (δραστικότερο από το Ca και το Sr), διαλύεται σε όλα τα αραιά ισχυρά οξέα καθώς επίσης και στο οξικό οξύ με έκλυση Η2:
Ba + 2H+
• Λόγω της μεγάλης δραστικότητάς του προσβάλλεται ακόμη και από το ψυχρό ύδωρ με έκλυση H2:
Ba + 2H2Ο
Σταθερότητα των διαλυμάτων του • Τα ιόντα Ba2+ δεν υδρολύονται και έτσι δεν απαιτείται οξίνιση των διαλυμάτων τους. • Με ισχυρές βάσεις δεν παρατηρείται καθίζηση Ba(OH)2 λόγω της μεγάλης διαλυτότητάς του. Αλκαλικά διαλύματα του Ba2+ θολώνουν λόγω αντίδρασης με το CO2 της ατμόσφαιρας:
Ba2+ + 2OH− + CO2
Σχηματισμός συμπλόκων ιόντων
• Τα ιόντα
Ba2+ δεν σχηματίζουν σύμπλοκα με NH3, CN−. Τα ιόντα Ca2+, Sr2+ και Ba2+ δεν διαφέρουν σε τίποτα από άποψη χημείας. Οι μόνες διαφορές μεταξύ τους εντοπίζονται στη διαλυτότητα των επιμέρους αλάτων τους και μόνο σ' αυτές βασίζεται ο διαχωρισμός, όπως και η διάκριση μεταξύ τους. Οι διαλυτότητες των πλέον χαρακτηριστικών και σχετικά δυσδιάλυτων αλάτων τους δίνονται στους επόμενους πίνακες:
• Με χρωμικά ιόντα παρέχουν ίζημα BaCrO4 σε αντίθεση με τα ιόντα Ca2+ που δεν παρέχουν ίζημα και τα ιόντα Sr2+ που παρέχουν ίζημα αλλά σε σχετικά μικρές ποσότητες. [V03] • Με κορεσμένο διάλυμα CaSO4 παρέχουν λευκό ίζημα BaSO4 σε αντίθεση με τα ιόντα Ca2+, όχι όμως με τα ιόντα Sr2+.
• Με διάλυμα ροδιζονικού νατρίου
παρέχει ερυθρό ίζημα.
[V04]
1. Ιόντα CO32−
Ba2+ + CO32−
BaCO3 + 2H+
Video 01: Αντίδραση Ba2+ με CO32−
2. Ιόντα SO42−
Ba2+ + SO42−
Video 02: Αντίδραση Ba2+ με SO42−
3. Ιόντα CrO42−
Ba2+ +
CrO42−
Video 03: Αντίδραση Ca2+, Sr2+, Ba2+ με CrO42−
4. Ροδιζονικό Na (RodNa2 -βλέπε χημικό τύπο-)
Ba2+ + Rod2−
Video 04: Αντίδραση Ca2+, Sr2+, Ba2+ με ροδιζονικό Na
5. Πυροχημική Τα άλατα του Ba χρωματίζουν τη φλόγα του λύχνου Bunsen πράσινη. Video 05: Πυροχημική ανίχνευση Ba2+
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||