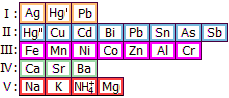 |
Νάτριο (Na)
|
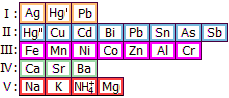 |
Νάτριο (Na)
|
|
• Αργυρόλευκο, ελαφρύ (επιπλέει στο νερό) και πολύ μαλακό μέταλλο (κόβεται εύκολα με λεπίδα). Χημικά δραστικότατο μέταλλο, αντιδρά έντονα με το νερό με έκλυση υδρογόνου το οποίο μπορεί να αναφλεγεί μαζί με το μέταλλο λόγω της εκλυόμενης θερμότητας. Στον αέρα καλύπτεται ταχύτατα από λεπτό στρώμα οξειδίου και για τον λόγο αυτό φυλάσσεται πάντοτε κάτω από παραφίνη . Παρασκευάστηκε από τον Sir Humphry Davy (Αγγλία, 1807) με ηλεκτρολυτική μέθοδο. O συμβολισμός του καθώς και η γερμανική και ελληνική ονομασία του προέρχονται από τη λατινική ονομασία του ανθρακικού νατρίου (natrium), ενώ η άλλη ονομασία του (sodium) προέρχεται από το μεσαιωνικό φάρμακο (για πονοκεφάλους) "sodanum". • Η τοξικότητα των ενώσεών του θεωρείται μηδενική (εκτός αν είναι τοξικό το ανιόν των αλάτων) και αποτελεί στοιχείο απαραίτητο για την ανάπτυξη όλων των οργανισμών. Η λήψη του σε ποσότητες μεγαλύτερες από 2-3 g ημερησίως μπορεί να διαταράξει την ισορροπία των ηλεκτρολυτών του οργανισμού και να είναι επικίνδυνη σε περιπτώσεις καρδιοπαθειών. • Υπάρχει σε αφθονία στη φύση. Κυριότερο ορυκτό του είναι ο αλίτης (ορυκτό άλας), NaCl [F01] και δευτερευόντως άλλα όπως το τρόνα, Na2CO3·NaHCO3·2H2O [F02], o βόρακας, Na2B4O7·10H2O [F03] και επίσης βρίσκεται σε πλήθος αργιλοπυριτικών και άλλων ορυκτών. Μεγάλα αλατωρυχεία (αλίτη) υπάρχουν στη Γερμανία, Πολωνία, ΗΠΑ και Μ. Βρετανία. Μεγάλες ποσότητες τρόνα υπάρχουν σε ξηρές λίμνες της Κένυας και των ΗΠΑ [F04]. Nίτρο νατρίου (soda niter) βρίσκεται στις εξαιρετικά άνυδρες περιοχές (ερήμους) της Χιλής και Περού ως κύριο συστατικό του caliche. Το caliche αποτελείται κυρίως από CaCO3, περίπου 25% NaNO3, 3% KNO3 και μικρές ποσότητες ιωδικών και βορικών αλάτων. Αποτελεί την πηγή του ονομαζόμενου "νίτρου της Χιλής" (NaNO3), όπως και την κύρια πηγή για την παραγωγή ιωδίου [F06]. • To 2021 παρήχθησαν περίπου 300 εκατομ. τόνοι NaCl, 59 εκατομ. τόνοι Na2CO3 και περίπου 100 χιλ. τόνοι μετάλλου.
• Εφαρμογές: ως μέταλλο χρησιμοποιείται ως ανταλλάκτης θερμότητας (στην
τηγμένη του μορφή) στους
πυρηνικούς αντιδραστήρες παραγωγής ηλεκτρικής ενέργειας όπως επίσης και στην
παρασκευή άλλων μετάλλων. Οι ενώσεις του χρησιμοποιούνται για την παρασκευή
πλήθους άλλων χημικών ουσιών.
Γενικές χημικές ιδιότητες των ενώσεων του
Na • Η μόνη σταθερή οξειδωτική κατάσταση του Na είναι η Na(I).
Διαλυτοποίηση του μετάλλου • Στην πράξη ποτέ δεν απαιτείται η διαλυτοποίηση του μετάλλου με τη βοήθεια οξέος. Tο Na, όπως και τα υπόλοιπα μέταλλα της ομάδας των αλκαλίων είναι τόσο δραστικά, που διαλύονται ευκολότατα στο νερό και η αντίδραση συχνά είναι εκρηκτική. 'Ετσι, το Na προσβάλλεται ακόμη και από το ψυχρό ύδωρ με έκλυση H2, πολλές φορές με ανάφλεξη του ίδιου του μετάλλου καθώς και του παραγόμενου Η2 (προφανώς η αντίδρασή του με διαλύματα οξέων θα ήταν εξαιρετικά πιο βίαιη):
2Νa + 2H2Ο
Σταθερότητα των διαλυμάτων του • Τα ιόντα Na+ είναι σταθερά, τα διαλύματα των αλάτων του δεν υδρολύονται και έτσι δεν απαιτείται οξίνισή τους. Τα διαλύματα των αλάτων του είναι άχρωμα, εκτός αν φορέας του χρώματος είναι το ανιόν του άλατος.
Σχηματισμός συμπλόκων ιόντων • Τα ιόντα Na+ δεν έχουν τάση σχηματισμού συμπλόκων με κανένα από τα συνηθισμένα συμπλεκτικά αντιδραστήρια.
Ειδικά χαρακτηριστικά
•
'Ολα τα άλατα του Na
είναι ευδιάλυτα. Λίγα άλατα του Na έχουν σχετικά περιορισμένη διαλυτότητα, όπως
το λευκό πυροαντιμονικό Na:
Τυπικές αντιδράσεις Na+ 1. Ουρανυλοξικός ψευδάργυρος
Na+ + 3UO22+ + Zn2+
+ 9CH3COO− + xH2O
Video 01: Αντίδραση Na+ με ουρανυλοξικό ψευδάργυρο
Η τελευταία αντίδραση μπορεί να πραγματοποιηθεί αποτελεσματικότερα σε επίπεδο σταγονοδοκιμασίας ως εξής: Σε ξηρό χάρτη προεμποτισμένο με το αντιδραστήριο του ουρανυλοξικού ψευδαργύρου, εάν προστεθεί σταγόνα διαλύματος Na+ (κατώτερο όριο ανίχνευσης: 0,001 Μ) και ξηρανθεί εκ νέου, τότε κάτω από υπεριώδες φως εμφανίζεται έντονος κυανοπράσινος φθορισμός. H δοκιμασία είναι τόσο ευαίσθητη που εάν ο προεμποτισμένος με το αντιδραστήριο ξηρός χάρτης πιαστεί με γυμνά δάκτυλα, τα ιόντα Na+ του ιδρώτα προκαλούν την εμφάνιση φθοριζόντων δακτυλικών αποτυπωμάτων.
2. Πυροχημική Τα άλατα του Na και σε ελάχιστες ακόμη ποσότητες χρωματίζουν τη φλόγα του λύχνου Bunsen εντόνως πορτοκαλοκίτρινη. Video 02: Πυροχημική ανίχνευση Νa+
|