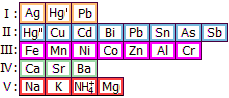 |
Νικέλιο (Ni)
|
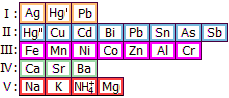 |
Νικέλιο (Ni)
|
|
• Η τοξικότητα του μετάλλου και των ανόργανων ενώσεών του είναι σημαντική. Μερικές από τις ενώσεις του θεωρούνται καρκινογόνες και τερατογόνες. Το νικέλιο σε πολλούς ανθρώπους δημιουργεί αλλεργικές αντιδράσεις.• Σπουδαιότερα ορυκτά του είναι ο νικελίτης , NiAs [F01], ο νικελιοπυρίτης (ή μιλλερίτης), NiS [F02], ο πετλανδίτης, (Ni,Fe)S [F03] κ.ά. Ελεύθερο νικέλιο ή (συνηθέστερα) ως κράμα με σίδηρο βρίσκεται σε μετεωρίτες.• Το 2021 εξορύχθηκε παγκοσμίως ποσότητα μεταλλεύματος, η οποία αντιστοιχεί σε 2,7 εκατομ. τόνους νικελίου. Κυριότερες παραγωγοί χώρες: Ρωσία, Νότια Αφρική, ΗΠΑ, Καναδάς. Στην Ελλάδα υπάρχουν πλούσια κοιτάσματα γαρνιερίτη, ενός μικτού πυριτικού άλατος νικελίου και άλλων μετάλλων (περιεκτικότητα σε Ni: 1-3%) στη Λάρυμνα (Χαλκιδική).• Τα 2/3 περίπου του παραγόμενου νικελίου διατίθενται στην παραγωγή νικελιοχάλυβα, με περιεκτικότητα μέχρι και 7% σε νικέλιο. Οι πλούσιοι σε Ni χάλυβες που περιέχουν και Cr αποτελούν τους ανοξείδωτους χάλυβες. Μεγάλες ποσότητες Ni χρησιμοποιούνται επίσης για επινικελώσεις σιδηρών σκευών, στην κατασκευή μπαταριών (μπαταρίες Ni-Cd) και ως καταλύτες υδρογονώσεων.
Γενικές χημικές ιδιότητες των ενώσεων του Ni
Οξειδωτικές καταστάσεις • Η μόνη σταθερή οξειδωτική κατάσταση του Ni σε υδατικά διαλύματα είναι η Ni(II).
Διαλυτοποίηση του μετάλλου • To Ni διαλύεται αργά σε θερμό-αραιό HCl ή Η2SO4:
Ni + 2H+
• Διαλύεται ταχύτερα σε αραιό HNO3, ενώ δεν προσβάλλεται από το π.ΗΝΟ3: 3Ni + 8H+ + 2NO3−
• Το Ni δεν προσβάλλεται από διαλύματα ισχυρών βάσεων. Video 01: Διαλυτοποίηση Ni με ΗNO3
Σταθερότητα των διαλυμάτων του • Τα διαλύματα των αλάτων του Ni2+ είναι σταθερά. Ελαφριά οξίνιση είναι απαραίτητη για να αποφευχθεί η έστω και περιορισμένη υδρόλυσή τους. Τα άλατα και τα διαλύματα του Ni2+ εμφανίζουν ένα πράσινο χρώμα.
Σχηματισμός συμπλόκων ιόντων • Τα ιόντα Ni2+ με NH3 παρέχουν δυσδιάλυτα βασικά άλατα, τα οποία διαλύονται σε περίσσεια NH3 με σχηματισμό αμμωνιοσυμπλόκων κυανού χρώματος. Σε αντίθεση με τα αντίστοιχα αμμωνιοσύμπλοκα των ιόντων Co2+ δεν οξειδώνονται από τον αέρα:
Ni2+ + NO3− + NH3 + H2O
Ni(OH)NO3 + 6NH3
• Τα ιόντα Ni2+ με ιόντα CN- παρέχουν σταθερό σύμπλοκο ανοικτού κίτρινου χρώματος: Ni+ + 4CN−
• Τα ιόντα Ni2+ δεν παρέχουν υδροξυσύμπλοκα με περίσσεια ισχυρών βάσεων. Ειδικά χαρακτηριστικά • Τα ιόντα Ni2+ με ιόντα S2- παρέχουν μαύρο ίζημα NiS (α-NiS), το οποίο εάν είναι πρόσφατο επαναδιαλύεται εύκολα σε περίσσεια ισχυρού οξέος. Για το λόγο αυτό το NiS δεν καθιζάνει από όξινα διαλύματα. 'Ιζημα NiS που έχει υποστεί παλαίωση διαλύεται πολύ δυσκολότερα λόγω μετατροπής του στην πολυμερούς χαρακτήρα β-μορφή (β-NiS). Ανάλογη συμπεριφορά παρουσιάζει και το CoS και ιδιότητα αυτή των θειούχων ενώσεών τους, μπορεί να αξιοποιηθεί για το διαχωρισμό του Co και Ni από τα άλλα κατιόντα της ΙΙΙης ομάδας:
Ni2+ + S2−
α-NiS
α-NiS + 2H+
β-NiS + 2H+
• Από τις πλέον χαρακτηριστικές αντιδράσεις των ιόντων Ni2+ είναι η αντίδρασή τους σε ελαφρά αμμωνιακό διάλυμα με διμεθυλογλυοξίμη (dmgH2), οπότε σχηματίζεται ερυθρό ίζημα συμπλόκου Ni(dmgH)2.
Ni2+ + 2dmgH2 + 2NH3
Η διμεθυλογλυοξίμη είναι ένα από τα κλασικά οργανικά αναλυτικά αντιδραστήρια με εξαιρετική εκλεκτικότητα για το Ni(II). Εκτός από την ποιοτική ανίχνευση των ιόντων Ni2+ η διμεθυλογλυοξίμη χρησιμοποιείται για τον σταθμικό προσδιορισμό του Ni, το οποίο καταβυθίζεται από αμμωνιακά διαλύματα με περίσσεια αντιδραστηρίου και ζυγίζεται στη μορφή του συμπλόκου Ni(dmgH)2. [V04]
Τυπικές αντιδράσεις Ni2+ 1. Iόντα S2−
Ni2+ + S2−
3NiS + 8H+ + 2NO3− Video 02: Αντίδραση Ni2+ με S2− και επαναδιάλυση του σχηματιζόμενου NiS με ΗNO3
2. Iόντα OH−
Ni2+ + 2 OH−
3. Αμμωνία Ni2+ + NO3− + NH3 + H2O
Ni(OH)NO3 + 6NH3
Video 03: Αντίδραση Ni2+ με ΝΗ3
4. Διμεθυλογλυοξίμη
Ni2+ + 2dmgH2 + 2NH3
Video 04: Αντίδραση Ni2+ με διμεθυλογλυοξίμη
Επιστροφή στον πίνακα επιλογών |