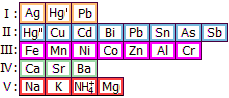 |
Αρσενικό (As)
|
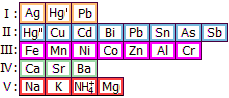 |
Αρσενικό (As)
|
|
Γενικά για το As
• Μεταλλοειδές που βρίσκεται σε πολλές αλλοτροπικές μορφές, από τις οποίες η πιο συνηθισμένη είναι η γκρίζα μεταλλική α-μορφή. Η μορφή αυτή είναι εύθρυπτη, οξειδώνεται επιφανειακά και καίγεται στον αέρα. Αν και οι ενώσεις του αρσενικού ήσαν γνωστές από την αρχαιότητα, η απομόνωσή του σε στοιχειακή μορφή αποδίδεται στον αλχημιστή Albertus Magnus κατά το 1250. Η ονομασία του προέρχεται από το "αρσενικόν" των αρχαίων Ελλήνων (κίτρινη σανδαράχη, As2S3), που χρησίμευε ως χρώμα. • Η τοξικότητα του αρσενικού και των ενώσεών του είναι πολύ μεγάλη. Το οξείδιό του (As2O3), παλαιότερα γνωστό και ως "ποντικοφάρμακο" (έχει αντικατασταθεί ως προς αυτήν την εφαρμογή προ πολλού από άλλες ουσίες), όπως και τα άλατά του, αποτελούν "ιστορικά" δηλητήρια. • Υπάρχει πλήθος αρσενικούχων ορυκτών από τα οποία τα πλέον κοινά είναι: ο αρσενοπυρίτης, FeAsS [F01], η κίτρινη σανδαράχη (orpiment), As2S3 [F02] και η σπανιότερη ερυθρά σανδαράχη (realgar), As4S4 [F03]. • Το 2020 παρήχθησαν παγκοσμίως ενώσεις αρσενικού οι οποίες αντιστοιχούν σε 32 χιλ. τόνους As2O3 ως παραπροϊόν επεξεργασίας θειούχων ορυκτών άλλων μετάλλων, όπως σιδήρου, μολύβδου και χαλκού (στοιχεία 2007). Κυριότερες παραγωγοί χώρες: Κίνα, Χιλή, Μαρόκο, Περού, Μεξικό, Ρωσία.
• Εφαρμογές: κράματα, εντομοκτόνα, μυοκτόνα, συντηρητικά ξυλείας, ημιαγωγοί και
ηλεκτρονικά εξαρτήματα (το αρσενίδιο του γαλλίου, GaAs, χρησιμοποιείται στις
διόδους εκπομπής φωτός, γνωστές ως LED), υαλουργία, κεραμικά, φαρμακευτικά
σκευάσματα (νεοσαλβαρσάνη, ατοξύλη κ.α.) τα περισσότερα των οποίων έχουν σήμερα
αντικατασταθεί με δραστικότερες και λιγότερο επικίνδυνες ουσίες.
Οξειδωτικές καταστάσεις • To As στις ενώσεις του εμφανίζεται με δύο εξίσου σταθερές οξειδωτικές καταστάσεις: ως As(III) και ως As(V). Στα διαλύματά του δεν υφίστανται κατιόντα As3+ και As5+. Αν και υπάρχει η ένωση AsCl3, αυτή είναι υγρό, έχει καθαρά ομοιοπολικό χαρακτήρα και διαλύεται σε πυκνό HCl σχηματίζοντας το ανιόν [AsCl4]−, ενώ αντιδρά με καθαρό νερό υδρολυόμενη πλήρως προς H3AsO3. • Η πλέον συνηθισμένη μορφή του As(III) είναι το ασθενέστατο αρσενικώδες οξύ H3AsO3 (Ka,1 = 6 x 10− 10)), του οποίου η ισχύς ως οξύ είναι ανάλογη εκείνου του βορικού οξέος H3BO3. Μια συνηθισμένη μορφή αρσενικώδους ανιόντος (ιδιαίτερα στα στερεά άλατά του) είναι το μεταρσενικώδες ανιόν, AsO2−:
Η2ΑsO3−
Κατανομές των σωματιδίων του αρσενικώδους (αριστερά) και του αρσενικικού οξέος (δεξιά). • Η πλέον συνηθισμένη μορφή του As(V) είναι το κατά πολύ ισχυρότερο αρσενικικό οξύ H3AsO4 (Ka,1 = 6 x 10−3), του οποίου η ισχύς είναι ανάλογη του φωσφορικού οξέος, H3PO4.• Σε όξινα διαλύματα, ευνοείται η αναγωγή του H3AsO4 προς H3AsO3, ενώ σε αλκαλικά διαλύματα ευνοείται η οξείδωση του H3AsO3 προς H3AsO4. Το σύστημα H3AsO3/H3AsO4 αποτελεί τυπικό παράδειγμα οξειδοαναγωγικού ζεύγους του οποίου η οξειδωτική/αναγωγική ισχύς εξαρτάται από την οξύτητα του διαλύματος και αυτό ερμηνεύεται από τον τρόπο με τον οποίο υπεισέρχονται τα κατιόντα Η+ στην ημιαντίδραση:
H3AsO4
+ 2H+ + 2e−
• Επειδή η καθίζηση των θειούχων αλάτων των κατιόντων της ΙΙης ομάδας πραγματοποιείται σε όξινο αναγωγικό περιβάλλον (λόγω της παρουσίας περίσσειας H2S), η πιθανότερη οξειδωτική κατάσταση, στην οποία μπορεί να βρεθεί το As κατά τη συστηματική ποιοτική ανάλυση, είναι η As(III).
Διαλυτοποίηση του στοιχείου • Το As διαλυτοποιείται μόνο σε οξειδωτικά οξέα (HNO3, πυκνό-θερμό H2SO4). Στο ΗΝΟ3, ανάλογα με την πυκνότητα του οξέος και τη θερμοκρασία, παρέχει H3AsO3, μίγμα H3AsO3 + H3AsO4 ή H3AsO4:
Σε αραιό ΗΝΟ3:
As + NO3− + H+ + H2O
Σε πυκνό ΗΝΟ3:
As + 5NO3− + 5H+
Video 01. Διαλυτοποίηση As με HΝΟ3
• Σε πυκνό-θερμό H2SO4 το As οξειδώνεται προς Αs4O6 (το οποίο συνήθως αναγράφεται ως As2O3):
4As + 6H2SO4
• Το As προσβάλλεται από πυκνά-θερμά διαλύματα ισχυρών βάσεων:
2As + 2 ΟΗ− + 2Η2Ο
• Eπίσης, διαλύεται σε διάλυμα υποχλωριώδους άλατος (π.χ. NaClO), αντίδραση που αποτελεί και χαρακτηριστική διαφορά από το Sb το οποίο δεν προσβάλλεται:
2As + 5ClO− + 6 ΟΗ− + 2Η2Ο
Σταθερότητα των διαλυμάτων του • Τα διαλύματα του H3AsO3 και των αλάτων του είναι σταθερά σε όξινα και ουδέτερα διαλύματα, ενώ σε ισχυρώς αλκαλικά διαλύματα οξειδώνονται προς αρσενικικά απορροφώντας O2 από τον αέρα:
2H2AsO3−
+ O2 + 4
ΟΗ−
• Τα διαλύματα του H3AsO4 και των αλάτων του είναι σταθερά σε οποιαδήποτε οξύτητα, αν δεν υπάρχουν αναγωγικές ουσίες.
Σχηματισμός συμπλόκων ιόντων • Τόσο το As(III), όσο και το As(V) σχηματίζουν χλωριοσύμπλοκα όπως τα [AsCl4]− και [AsCl4]+, που είναι σταθερά μόνο σε πυκνά διαλύματα HCl. • Επίσης, σχηματίζουν σειρά σχετικώς σταθερών θειοσυμπλόκων και για τον λόγο αυτό οι δυσδιάλυτες σε οξέα θειούχες ενώσεις τους διαλύονται σε αλκαλικά διαλύματα (ακόμη και αμμωνιακά διαλύματα):
As2S3 + 4 OH−
• και ακόμη πιο εύκολα διαλύονται παρουσία περίσσειας ιόντων S2−:
As2S3 + 3S2−
As2S5 + 3S2−
Ειδικά χαρακτηριστικά • Χαρακτηριστική είναι η αντίδραση As(ΙΙΙ) - I2 που ανάλογα με την οξύτητα του διαλύματος αλλάζει φορά:
ουδέτερο διάλυμα: H3AsO3 + [I3]−
+ H2O
όξινο διάλυμα: H2AsO4−
+ 2H+ + 3I−
• 'Ολες οι ενώσεις του As(III) σε όξινο ή αλκαλικό διάλυμα ανάγονται προς το αέριο AsH3 (αρσίνη) με υδρογόνο "εν τω γεννάσθαι" (όπως παραδοσιακά αναφέρεται το υδρογόνο κατά τη στιγμή που παράγεται), γεγονός που επιτρέπει την ανίχνευση του Αs στο αρχικό διάλυμα (βλ. πάνω δεξιά: Δοκιμασία Marsh). Παρόμοια αντίδραση παρέχουν και οι ενώσεις του Sb, που ανάγονται προς το αέριο SbH3 (αντιμονίνη), αλλά μόνο σε όξινο διάλυμα:
H3AsO3 + 3Zn + 6H+
H2AsO3− + 2Al
+ OH− + 4H2O
Τυπικές αντιδράσεις As(III)
και As(V) 1. Iόντα S2−
2[AsCl4]− + 3H2S
2H3AsO3 + 3H2S
2H2AsO4−
+ 5H2S
As2S5
2As2S3 + 4 ΟΗ−
As2S3 + 3S2−
Video 02. Αντίδραση As(III) με S2− / Διαλυτοποίηση As2S3 σε περίσσεια OH− και S2−
2. Ι2 - KI
H3AsO3 + [I3]− + H2O
Video 03: Αντίδραση As(III) με I2
3. Iόντα Ι−
H2AsO4− + 3H+ + 3I−
[Ι3]− (κίτρινο στο Η2Ο)
Video 0 4: Αντίδραση As(V) με I− / Εκχύλιση παραγόμενου Ι2 με CHCl3
4. Ιόντα MoO42−
H3AsO4 + 3NH4+ + 12MoO42− + 21H+
Video 05 : Αντίδραση As(V) με ΜοΟ42−
5. Αναγωγή με Zn (δοκιμασία Gutzeit)
H3AsO3 + 3Zn + 6H+
6Ag+ + AsH3
+ 3H2O
Video 06 : Δοκιμασία Gutzeit (σχηματισμός και ανίχνευση AsH3)
|